树突状细胞在人正常子宫内膜的表达及周期性变化研究
李 莉,楼寒梅,黄丽丽
(1.浙江省肿瘤医院妇瘤科,杭州 310022;2.浙江大学医学院附属妇产科医院计划生育科,杭州 310006)
树突状细胞在人正常子宫内膜的表达及周期性变化研究
李莉1,楼寒梅1,黄丽丽2△
(1.浙江省肿瘤医院妇瘤科,杭州 310022;2.浙江大学医学院附属妇产科医院计划生育科,杭州 310006)
[摘要]目的研究树突状细胞(DCs)在人正常子宫内膜的表达及周期性变化。方法免疫组织化学法分别测定CD1a、CD83 阳性细胞在40例人正常子宫内膜的表达(增生期20例,植入窗期20例),结合血清雌二醇(E2)、黄体酮(P)水平,分析DCs表达水平与E2、P的相关性。结果增生期子宫内膜CD1a+DCs阳性率为90%(18/20),植入窗期CD1a+DCs阳性率为100%(20/20),所有标本均未检测到CD83表达。DCs数量随月经周期变化而变化,植入窗期CD1a+DCs细胞密度为(18.2±5.76 )个/mm2,显著高于增生期子宫内膜CD1a+DCs细胞密度(6.5±4.05)个/mm2(P<0.05)。子宫内膜DCs数量与血清P水平具有相关性(r=0.630,P<0.01)。结论植入窗期子宫内膜CD1a+DCs数量增加可促进母胎免疫耐受。
[关键词]树突状细胞;子宫内膜;月经周期;CD1a;CD83
树突状细胞(dendritic cells,DCs)作为功能最强大的抗原提呈细胞,广泛分布于皮肤、呼吸道、胃肠道、生殖道等多种组织,不仅能够诱导抗原特异性免疫应答,还能诱导免疫耐受。DCs在免疫调节中的作用依赖于不同成熟阶段DCs的可塑性。不成熟DCs倾向于诱导免疫耐受反应,而成熟DCs诱导免疫激活,倾向于引发免疫排斥反应。
母胎免疫耐受及其机制是长期困扰免疫学研究的难题。携带50%异源遗传物质的胚胎能在“植入窗”期顺利着床,不被机体免疫系统识别及排斥。母胎界面的局部免疫应答是母胎免疫耐受建立和维持的关键[1]。既往的研究集中在子宫内膜中uNK细胞和T细胞等其他免疫细胞。最新的研究发现,DCs与母胎免疫耐受机制密切相关。由于DCs在子宫内膜中数量较少,而且不易取材,对DCs的研究主要集中在蜕膜。已有研究证实人类蜕膜存在DCs,在抵御病原体入侵及维持正常妊娠中起着重要作用[2-3]。DCs数量及功能异常与自发性流产、子痫前期等病理妊娠有关[3]。本研究采用免疫组织化学技术,观察育龄女性正常子宫内膜组织中DCs的分布及其在月经周期的不同时期表达的差异,推测血清雌二醇(E2)、黄体酮(P)对DCs数量的影响,进而探索DCs在母胎免疫耐受中的作用。
1资料与方法
1.1一般资料本研究经浙江大学医学院附属妇产科医院伦理委员会审核通过,研究对象来源于2013年1~12月浙江大学附属妇产科医院门诊及住院患者,所有研究对象均已签署知情同意书。研究对象的纳入标准如下:(1)年龄25~35岁;(2)正常规律的月经周期(月经周期26~31 d);(3)生殖系统解剖、内分泌指标均正常;(4)妇科及盆腔检查均正常;(5)近3个月内无激素类药物使用史。两组研究对象的一般临床资料见表1。
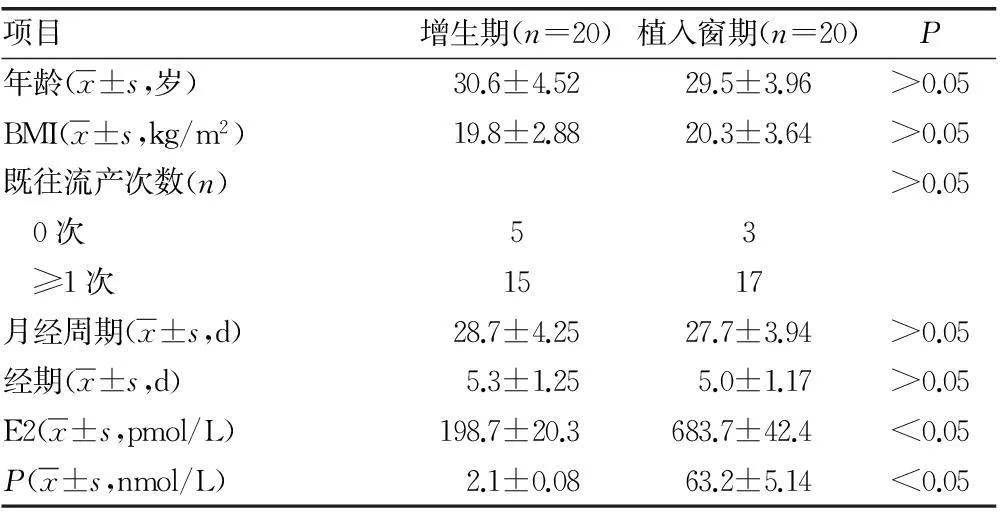
表1 两组研究对象的一般临床资料
1.2组织收集(1)植入窗期子宫内膜:收集20例因输卵管切除或丈夫不育行体外受精-胚胎移植治疗的妇女子宫内膜。于月经周期第20~24天行宫腔探查时使用一次性宫腔组织吸管吸取少量子宫内膜组织。(2)增生期子宫内膜:收集20例因管性不孕行腹腔镜检查及美蓝通液妇女的子宫内膜。于月经周期第6~10天吸取少量子宫内膜组织。收集内膜标本后,磷酸盐缓冲液(PBS)洗去标本表面血污。立即于10%中性甲醛中固定18~24 h。常规脱水、透明、浸蜡、包埋。4 μm厚连续切片。常规苏木素-伊红(HE)染色及免疫组织化学,根据组织学检查按Noyes标准确定分期。同时所有入组女性在取内膜当日进行下列检查,并根据以下标准判断研究对象的子宫内膜的期别:月经周期天数;宫颈黏液评分;基础体温;盆腔超声检测排卵前优势卵泡的直径和优势卵泡的消失;盆腔超声检测子宫内膜厚度;血清E2及P水平。
1.3免疫组织化学采用Envision两步法免疫组织化学试剂盒测定CD1a、CD83在人子宫内膜的表达。鼠抗人单克隆IgG抗体CD1a及鼠抗人单克隆IgG抗体CD83购自美国Santa Cruz公司,Envision两步法免疫组织化学试剂盒购自丹麦Dako公司。CD1a、CD83一抗工作液浓度为1∶100,染色步骤按试剂盒说明书进行。
1.4判断标准切片置于显微镜下观察,细胞质或细胞膜出现棕黄色为阳性。高倍镜下(×400)观察切片并拍照,每张切片随机选择10个不重复视野,计数阳性细胞数,结果以细胞密度表示(个/mm2)。
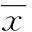
2结果
2.1CD1a、CD83在人正常月经周期子宫内膜中的表达共收集20例增生期及20例植入窗期正常子宫内膜,除2例分泌期子宫内膜染色阴性外,其余38例标本皆有CD1a阳性细胞表达。CD1a阳性细胞染色为棕黄色,定位于细胞膜,主要分布于腺体和血管周围间质,细胞形态不规则,表面可见长短不一、数目不等的树突样突起(图1)。植入窗期子宫内膜CD1a+CDs细胞密度为(18.2±5.76)个/mm2,增生期子宫内膜CD1a+CDs细胞密度为(6.5±4.05)个/mm2。CD1a+DC在植入窗期子宫内膜的表达显著高于增生期(P<0.05)。阳性对照为人正常外阴皮肤组织切片。PBS代替一抗的阴性对照内膜组织切片呈CD1a染色阴性。所有标本均未检测到CD83的表达。见表2。
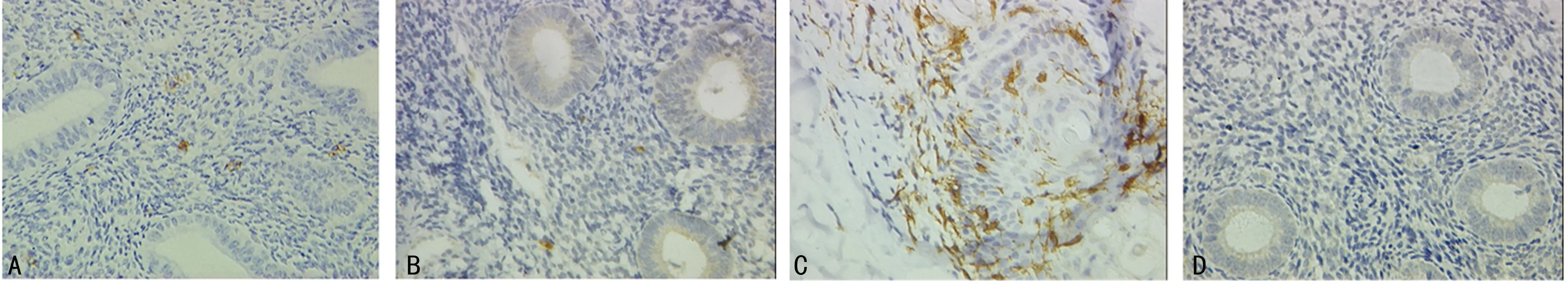
A:植入窗期子宫内膜;B:增生期子宫内膜;C:阳性对照(外阴皮肤);D:阴性对照。
图1CD1a+DCs在正常人子宫内膜的表达(免疫组织化学×400)
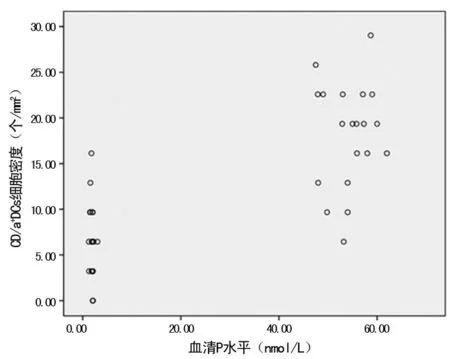
图2 子宫内膜CD1a+DCs细胞密度与血清P水平的相关性
2.2子宫内膜DCs表达与E2、P相关性分析在月经周期的不同时期,子宫内膜DCs的表达水平(平均细胞密度)与血清P水平有相关性,相关系数r=0.630,P<0.01,见图2。DCs的表达与血清E2水平无明显相关性。

表2 子宫内膜CD1a+DCs细胞密度
a:P<0.05,与增生期比较。
3讨论
人类子宫是建立和维持正常妊娠的场所,携带50%异源遗传物质的胚胎能在植入窗期顺利着床并在妊娠期间不被机体免疫系统识别及排斥。在母体免疫功能正常时,免疫系统既要保护母体和胎儿不受外来致病微生物侵犯,又要维持免疫耐受。这种母胎免疫平衡是保证正常妊娠的关键。一旦母胎界面免疫耐受出现紊乱,则会导致不孕、自然流产、子痫前期等不良妊娠结局。关于DCs在母胎免疫耐受中作用的研究目前还甚少。已有研究发现,围植入窗期小鼠子宫内膜DCs数量增加[4]。DCs缺失的转基因小鼠,植入过程受影响导致妊娠率低下,且着床位置的uNK细胞成熟受抑制[5],但目前尚未有对人子宫内膜DCs在着床过程中作用的研究。本研究发现人正常子宫内膜存在DCs,为未成熟DCs,其数量随月经周期变化而变化,受卵巢性激素调节。植入窗期未成熟DCs数量增加,推测与保证胚胎顺利着床有关,在母胎免疫耐受的建立和维持过程中起了关键调节作用。
CD1a是目前公认的DCs鉴定标记,目前一般采用CD1a阳性细胞数的多少来反映DCs数量[6]。CD83是成熟DCs所特有的膜表面分子,是DCs的成熟标记物[7]。本研究证实人正常子宫内膜组织含有CD1a+DCs,但未观察到CD83+成熟DCs的表达,推测静息状态下子宫内膜DCs表型为未成熟DCs,这与消化道黏膜、呼吸道黏膜等外周组织中的DCs为未成熟DCs相一致。机体免疫激活和免疫耐受的关键环节是DCs与T细胞的相互作用。未成熟DCs诱导免疫耐受,不仅参与中枢免疫耐受的诱导,还能在外周参与外周致耐受作用[8]。本研究证实人类子宫内膜存在未成熟DCs,推测其参与母胎免疫耐受的建立和维持。
本研究结果显示在育龄女性月经周期的不同时期(增生期和植入窗期),其子宫内膜DCs的数量有显著变化。在植入窗期, CD1a+DCs细胞数量明显增加,其细胞密度水平与增生期相比有显著性差异(P<0.05)。进一步研究发现,育龄女性正常子宫内膜的DCs数量与血清P水平具有相关性。推测,性激素(本研究主要是P)对女性子宫内膜DCs发挥了重要的调节作用。增生期P处于较低水平,子宫内膜的DCs数量较少,分泌期(植入窗期)P水平迅速增加,相应地促进子宫内膜的DCs数量也迅速增加。既往的研究发现性激素动物及人类的DCs均具有重要的免疫调节作用。不同浓度的P能使大鼠髓源性DCs表面组织相容性复合体(MHC)Ⅱ类分子和共刺激分子的表达显著下调,炎性细胞因子的产生及刺激T细胞增殖能力也显著降低[9]。E2和P能显著抑制小鼠外周血DCs的抗原提呈功能。E2、P能促进人外周血来源的DCs产生更多的Th2型细胞因子IL-10和IL-27,P还能促使DCs分泌的Th1型细胞因子IL-23减少,Th2型细胞因子IL-13增加,从而促进机体的免疫应答向Th2偏移[10]。上述研究结果表明性激素对机体的免疫应答发挥了重要的调节作用,其对生殖系统的免疫应答,尤其是子宫内膜免疫应答的结局具有重要的影响[11]。作者推测育龄女性植入窗期的子宫内膜CD1a+DCs数量增加,通过下调机体免疫应答从而促进胚胎顺利着床。这可能涉及以下多种机制的共同参与。首先,DCs可能通过调节Th1/Th2细胞因子平衡调节母胎免疫,Th1/Th2平衡是母胎免疫的关键因素。未成熟DCs不分泌或分泌极少量的Th1型细胞因子IL-12,但分泌大量的Th2型细胞因子IL-10,从而促使Th1/Th2细胞因子平衡向Th2方向偏移,促进了母体对半同种异体胚胎抗原的免疫耐受。其次,DCs通过诱导T细胞无能发挥免疫调节作用。T细胞是机体内的主要效应细胞,其活化需要MHC分子、共刺激分子和附属分子的共同刺激,而未成熟DCs表面低表达MHC分子、共刺激分子(CD80,CD86)和附属分子(CD40),T细胞不能被有效激活而处于无能或低能状态,因此,机体的免疫排斥不能被有效激发。未成熟DCs还可通过诱导具有强大免疫抑制能力的调节性T细胞产生及诱导T细胞凋亡下调机体的免疫应答[12-13]。以上是未成熟DCs参与建立母胎免疫耐受的一些可能机制。深入研究DCs在母胎免疫耐受中的作用,尤其是胚胎植入过程中的免疫学机制,有助于了解不孕、自然流产、子痫前期的免疫学原因,有助于为临床找到提高体外受精胚胎移植成功率的方法及治疗病理妊娠提供依据,也有助于开发行之有效的避孕方法。因此对DCs在母胎免疫耐受中的作用及机制有待进一步深入研究。
参考文献
[1]Erlebacher A.Immunology of the maternal-fetal interface[J].Annu Rev Immunol, 2013,31:387-411.
[2]Qian ZD,Huang LL,Zhu XM.An immunohistochemical study of CD83- and CD1a-positive dendritic cells in the decidua of women with recurrent spontaneous abortion[J].Eur J Med Res,2015,20(1):2.
[3]Laskarin G,Kämmerer U,Rukavina D,et al.Antigen-presenting cells and materno-fetal tolerance:an emerging role for dendritic cells[J].Am J Reprod Immunol,2007,58(3):255-267.
[4]Lee JY,Lee M,Lee SK.Role of endometrial immune cells in implantation[J].Clin Exp Reprod Med,2011,38(3):119-125.
[5]Krey G,Frank P,Shaikly V,et al.In vivo dendritic cell depletion reduces breeding efficiency,affecting implantation and early placental development in mice[J].J Mol Med (Berl),2008,86(9):999-1011.
[6]Cernadas M,Lu J,Watts G,et al.CD1a expression defines an interleukin-12 producing population of human dendritic cells[J].Clin Exp Immunol,2009,155(3):523-533.
[7]Larangé A,Antonios D,Pallardy M.Kerdine-Romer.glucocorticoids inhibit dendritic cell maturation induced by toll-like receptor 7 and toll-like receptor 8[J].J Leukoc Biol,2012,91(1):105-117.
[8]Dudek AM,Martin S,Garg AD.garg and P.agostinis.immature,semi-mature and fully mature dendritic cells:towards a DC-cancer cells interface that augments anticancer immunity [J].Front Immunol,2013,4:438.
[9]Butts CL,Shukair SA,Duncan KM,et al.Progesterone inhibits mature rat dendritic cells in a receptor-mediated fashion[J].Int Immunol,2007,19(3):287-296.
[10]Kyurkchiev D,Ivanova-Todorova E,Hayrabedyan S,et al.Female sex steroid hormones modify some regulatory properties of monocyte-derived dendritic cells[J].Am J Reprod Immunol,2007,58(5):425-433.
[11]Wira CR,Rodriguez-Garcia M,Patel MV.The role of sex hormones in immune protection of the female reproductive tract[J].Nat Rev Immunol,2015,15(4):217-230.
[12]Yamazaki S,Morita A.Dendritic cells in the periphery control antigen-specific natural and induced regulatory T cells[J].Front Immunol,2013,4:151.
[13]Xu X,Yi H,Guo Z,et al.Splenic stroma-educated regulatory dendritic cells induce apoptosis of activated CD4 T cells via Fas ligand-enhanced IFN-γ and nitric oxide[J].J Immunol,2012,188(3):1168-1177.
Study on the endometrial dendritic cells populations during the normal menstrual cycle*
LiLi1,LouHanmei1,HuangLili2△
(1.DepartmentofGynecologicOncology,ZhejiangCancerHospital,Hangzhou,Zhejiang310022,China;2.DepartmentofFamilyPlanning,Women′sHospitalAffiliatetoMedicalCollegeofZhejiangUniversity,Hangzhou,Zhejiang310006,China)
[Abstract]ObjectiveTo investigate the number and distribution of dendritic cells in normal endometrium of reproductive age during the normal menstrual cycle.MethodsNormal endometrial samples were collected from 40 women of reproductive age.20 endometrium samples at the proliferative phase (day 6th to 10th) and 20 endometrium samples at the "window of implantation" (day 20th to 24th) were obtained.These patients underwent intrauterine exploration before IVF and ET resulting from tubal resection or male factor infertility.Endometrial tissue was collected with a pipelle aspirator.Sections were stained with hematoxylin-eosin (HE) to identify the morphological characteristics of endometrial tissues.The Envision two-step immunohistochemical staining technique was used to detect the expression of CD1a and CD83 in the endometrium.Normal human skin and tonsil were used as positive control tissues for CD1a and CD83,respectively.The serum levels of ovarian steroid hormones were measured to analyze their relationship with the expression of CD1a and CD83.ResultsCD1a+ DCs were found in all samples of "window of implantation" and most samples of the proliferative phase (18/20,90%).DCs showed irregular shape with different processes and were buffy in cell membrane,mainly in stroma around grand and blood vessels.The density of CD1a+ DCs at the "window of implantation" were(18.2±5.76)cells/mm2,significantly higher than that at the proliferative phase [(6.5±4.05)cells/mm2,P<0.05].CD83 was considered as the marker for mature DCs.However,immunohistochemistry with specific antibody revealed no CD83+ DCs were found in human emdometrium in the present study.During the menstrual cycle,the expression of CD1a+ DCs in endometrium (the density of CD1a+DCs) correlated with serum progesterone level(r=0.630,P<0.01).Serum estradiol showed no correlation with the density of CD1a+ DCs(P>0.05).ConclusionIncreased CD1a+ immature DCs at the "window of implantation" in endometrium may play an important role in the establishment of maternal-fetal tolerance.
[Key words]dendritic cells;endometrium;menstrual cycle;CD1a;CD83
doi:·论著·10.3969/j.issn.1671-8348.2016.02.001
基金项目:国家自然科学基金资助项目(81270730)。
作者简介:李莉(1982-),主治医师,博士,主要从事妇科肿瘤的基础和临床研究。 △通讯作者, E-mail:fbhuanglili@163.com。
[中图分类号]R446.8
[文献标识码]A
[文章编号]1671-8348(2016)02-0145-03
(收稿日期:2015-08-08修回日期:2015-09-16)

