天名精内酯酮多克隆抗体的制备
何泽瑜,韩立荣,刘雪茹,冯俊涛,张 兴
(西北农林科技大学 无公害农药研究服务中心,陕西省生物农药工程技术研究中心,陕西 杨凌 712100)
天名精内酯酮多克隆抗体的制备
何泽瑜,韩立荣,刘雪茹,冯俊涛,张兴
(西北农林科技大学 无公害农药研究服务中心,陕西省生物农药工程技术研究中心,陕西 杨凌 712100)
[摘要]【目的】 合成并鉴定天名精内酯酮人工抗原,制备天名精内酯酮多克隆抗体,为天名精内酯酮作用靶标的免疫化学定位奠定基础。【方法】 通过天名精内酯酮4位羰基和盐酸氨基脲氨基的亲核加成反应制备半抗原天名精内酯酮缩氨基脲(CN),使用MS和NMR对其结构进行鉴定;采用戊二醛法将半抗原和载体蛋白牛血清蛋白(BSA)和卵清蛋白(OVA)偶联,合成天名精内酯酮免疫原(CN-BSA)和包被原(CN-OVA),采用紫外吸收扫描法、红外光谱法对免疫原及包被原进行鉴定;用制备好的免疫原免疫健康BALB/c小鼠获得天名精内酯酮多克隆抗体,通过间接非竞争ELISA法测定其效价。【结果】 成功制备了天名精内酯酮免疫原(CN-BSA)和包被原(CN-OVA),获得了效价为128 000的天名精内酯酮多克隆抗体。【结论】 成功制备了天名精内酯酮多克隆抗体。
[关键词]天名精内酯酮;半抗原;人工抗原;酶联免疫吸附分析
天名精内酯酮是卡拉布烷型倍半萜内酯类化合物,最早于1964年从天名精属植物天名精(Carpesiumabrotanoides)的果实中分离得到[1],并表现出较好的医用生物活性[2-4]。西北农林科技大学无公害农药研究服务中心前期对天名精内酯酮农用生物活性的研究工作表明,天名精内酯酮是一种优秀的广谱抑菌活性物质,对小麦全蚀病菌(Gaeumannomycesgraminisvar.tritici)、小麦纹枯病菌(Rhizoctoniacerealis)、辣椒疫霉病菌(PhytophthoracapsiciLeonian)和番茄灰霉病菌(Botrytiscinerea)等12种病原菌均具有较好的抑制活性[5];以其为先导,通过结构改造,衍生合成出酯类[6]、肟酯[7]和腙类[8]等一系列化合物,这些化合物中大部分均表现出较强的抑菌活性;对作用机理的初步探索发现,天名精内酯酮可抑制病原菌线粒体呼吸电子传递链复合酶的活性,从而影响病原菌的生物氧化过程[9],但其具体的作用靶标仍不明确,这严重阻碍了天名精内酯酮的开发利用。
免疫分析作为作用机理研究的重要手段之一,已成功应用于苏云金杆菌(Bacillusthuringiensis)伴胞晶体蛋白作用靶标的定位[10-12]。同时,农药免疫分析还应用于一些除草剂和杀菌剂作用机理的研究,如Young等[13]利用免疫荧光显微技术确定了苯酰菌胺对辣椒疫霉菌微管骨架的破坏作用,Tresch等[14]利用免疫化学定位技术证明高效麦草氟甲酯对微管组装具有抑制作用。本研究以天名精内酯酮为原料合成天名精内酯酮人工抗原,通过免疫BALB/c小鼠获得多克隆抗体,旨在为天名精内酯酮作用机理的研究提供技术手段。
1材料与方法
1.1材料
仪器:核磁共振谱仪(Bruker Avance 500 MHz)、红外光谱仪(Nicolet Avatar 330FT-IR)、紫外可见分光光度计(HITACHI U3310)、酶标仪(TECAN Sunrise)、高速冷冻离心机(MIKRO22R)、冻干机、超纯水净化仪(D8611 Branstead)、洗板机(Thermo WELLWASH PLUS)、液质联用仪(Thermo Fisher)。
试剂:天名精内酯酮(由西北农林科技大学无公害农药研究服务中心提供)、牛血清蛋白(BSA,Sigma)、卵清蛋白(OVA,Sigma)、弗氏完全佐剂(FCA,Sigma)、弗氏不完全佐剂(FICA,Sigma),四甲基联苯胺(TMB,Sigma分装进口)、辣根过氧化物酶标记羊抗鼠IgG(HRP-IgG,北京康维)、盐酸氨基脲、无水乙酸钠、无水乙醇、戊二醛、N、N-二甲基亚砜均为分析纯。试验动物为6周龄的BALB/c小鼠(购于西安交通大学实验动物中心)。
1.2方法
1.2.1天名精内酯酮半抗原的合成参照李江华[15]的方法并做适当的改动,具体合成路线见图1。
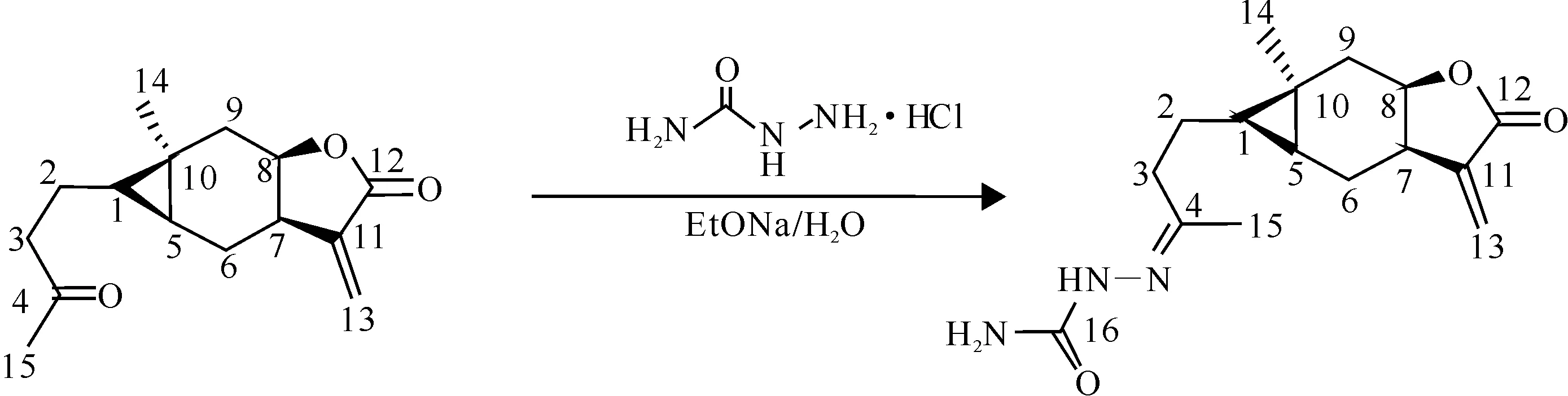
图 1 天名精内酯酮半抗原的合成路线
向1.2 mmol盐酸氨基脲水溶液中加入1.4 mmol乙酸钠,在搅拌条件下,向混合物中加入含有1 mmol天名精内酯酮的甲醇溶液,60 ℃下水浴反应。出现大量白色沉淀后(约4 h)终止反应。静置冷却,抽滤。用甲醇和水混合溶剂重结晶,得白色固体物质,并用NMR和MS进行结构鉴定。
1.2.2天名精内酯酮人工抗原的合成和鉴定采用戊二醛法将带有游离氨基的天名精内酯酮半抗原和载体蛋白BSA和OVA偶联[16-17],制备天名精内酯酮人工抗原,具体如图2所示。
将20 mg牛血清蛋白溶于2 mL pH=7.4的PBS(磷酸盐缓冲溶液)中,缓慢滴加10 mg半抗原天名精内酯酮缩氨基脲(CN)溶液和90 μL 25%戊二醛溶液。室温下搅拌反应4 h后,取出反应物,用PB(磷酸缓冲溶液)于4 ℃下透析3 d。透析完毕后,冷冻干燥,-20 ℃保存,即得免疫原CN-BSA。用同样的方法制备包被原CN-OVA。
使用红外光谱法[18]和紫外吸收扫描法[19]鉴定人工抗原。

图 2 天名精内酯酮人工抗原的合成路线
1.2.3天名精内酯酮多克隆抗体的制备参照张静[20]的方法免疫BALB/c小鼠。用生理盐水稀释免疫原至400 μg/mL,用等体积的弗氏完全佐剂(CFA,首次免疫时使用)或弗氏不完全佐剂(FICA,加强免疫时使用),采用涡旋振荡法乳化制备免疫原乳剂。选取3只健康的6周龄BALB/c小鼠,用制备好的免疫原乳剂按照表1的方法免疫小鼠。取血前3 d,冲击免疫。摘除眼球取血,并用硫酸铵/辛酸沉淀法[17]纯化抗血清,向抗血清中加入终浓度为0.01%的叠氮钠,分装, -20 ℃保存。
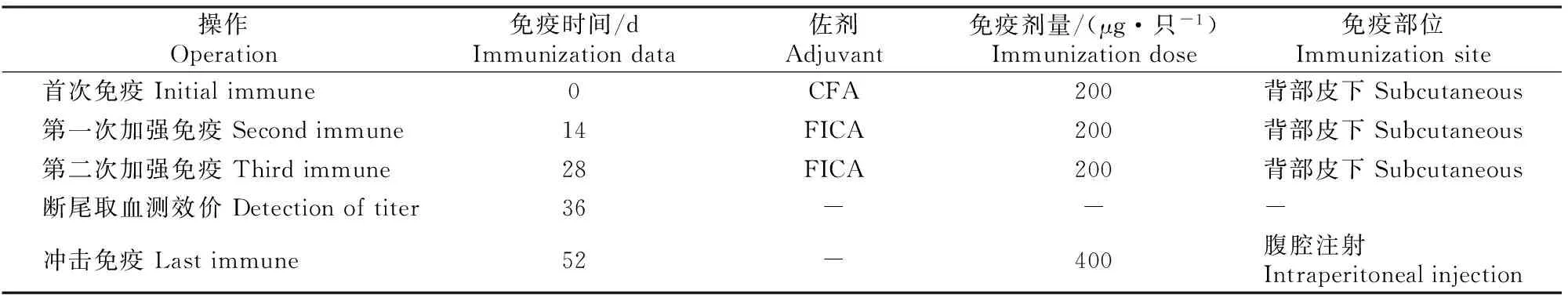
表 1 小鼠免疫方案
注:“-”表示未加佐剂或未注射免疫原。
Note:“-” means no adjuvant or no immunization.
1.2.4抗血清效价的测定使用间接非竞争ELISA法测定抗血清效价[21]。用质量浓度为5 μg/mL的包被原包被酶标板,100 μL/孔,4 ℃过夜,用PBST(含0.05% Tween-20 PBS溶液)洗板3次;加入质量分数1% OVA溶液封闭1 h,200 μL/孔,再次洗板;以4 000倍为起点,倍比稀释抗血清,加入相应酶标板孔内,100 μL/孔,每个质量浓度2个平行孔,并设置空白孔和阴性对照孔,37 ℃孵育1 h,洗板;加入辣根过氧化物酶标记羊抗鼠IgG(1∶3 000),100 μL/孔,37 ℃孵育1 h,洗板;加入TMB(四甲基联苯胺,tetramethylbenzidine)底物溶液显色10 min,100 μL/孔;加入2 mol/L的H2SO4终止反应,50 μL/孔。于450 nm下用酶标仪测定OD值。以待测孔OD值(P)/阴性对照孔OD值(N)≥ 2.1(即P/N≥ 2.1)的最大稀释倍数作为抗血清的最终效价。
2结果与分析
2.1天名精内酯酮半抗原结构的鉴定
通过MS和NMR对天名精内酯酮半抗原,即天名精内酯酮缩氨基脲(CN)的结构进行鉴定,结果如下。
1H-NMR (500 MHz,CD3Cl) δ:6.27 (1H,d,J=2.6 Hz,H-13),5.59 (1H,d,J=2.4 Hz,H-13),4.79~4.84 (1H,m,H-8),3.16~3.22(1H,m,H-7),2.32~2.37(2H,m,H-3),2.25~2.28(2H,m,H-2),1.86(3H,s,H-15),1.48~1.55(2H,m,H-9),1.12(3H,s,H-14),0.91~0.98(2H,m,H-6),0.47~0.52(1H,m,H-5),0.37~0.41(1H,m,H-1)。
13C-NMR(125 MHz,CD3Cl)δ:170.45(C-12),157.85(C-4),149.97(C-16),139.03(C-11),122.61(C-13),75.59(C-8),38.76(C-3),37.68(C-7),37.31(C-9),34.40(C-1),30.75(C-6),25.93(C-2),23.02(C-5),18.38(C-15),17.14(C-10),15.41(C-14)。
ESI-MS:m/z:306.15 C16H23O3N3([M+H]+)。
2.2天名精内酯酮人工抗原的鉴定
采用紫外吸收扫描法和红外光谱法对半抗原-载体蛋白偶联物进行鉴定,结果如图3~6所示。由图3和4可知,载体蛋白BSA和OVA的最大紫外吸收波长出现在278 nm处,半抗原在235~295 nm未发现明显的特征吸收峰,而经戊二醛法偶联合成的人工抗原CN-BSA和CN-OVA的最大吸收波长分别出现在269 nm和267 nm处。2种人工抗原CN-BSA和CN-OVA的紫外吸收光谱是半抗原天名精内酯酮缩氨基脲与载体蛋白吸收光谱的整合,表明半抗原和载体蛋白偶联成功。
国家体育场(鸟巢)是第29届夏季奥运会的主体育场。奥运会后,国家体育场公司按照“政府主导、社会参与、企业运作”的要求,充分利用奥运场馆遗产,打造鸟巢旅游新亮点,引进顶级赛事演出活动,创办青少年公益赛事,培育鸟巢自主品牌项目,打造全新的商业产业链,探索场馆多元化经营,实现了鸟巢赛后的可持续发展,获得了社会各界的广泛赞誉
由图5可以看出,CN-BSA的红外图谱中包含了载体蛋白BSA的特征吸收谱带,如1 655 cm-1处的BSA酰胺谱带Ⅰ和1 543 cm-1处的酰胺谱带Ⅱ,以及2 929 cm-1处较弱的-CH2-吸收。同时在CN-BSA的红外光谱中还存在半抗原CN和BSA偶联后的1 439 cm-1处的-CH2-的δCH吸收,以及1 720 cm-1处的半抗原分子的羰基吸收,由此可判断免疫原CN-BSA合成成功。由图6可以看出,包被原CN-OVA的红外图谱中包含了载体蛋白OVA的特征吸收谱带,如1 653 cm-1处的酰胺谱带Ⅰ和1 539 cm-1处的酰胺谱带Ⅱ,以及偶联后的1 439 cm-1处-CH2-的δCH吸收,1 724 cm-1处的半抗原分子的羰基吸收,由此表明包被原CN-OVA合成成功。
结合上述2种鉴定方法,可以确定半抗原和载体蛋白偶联成功,合成出了免疫原CN-BSA和包被原CN-OVA。
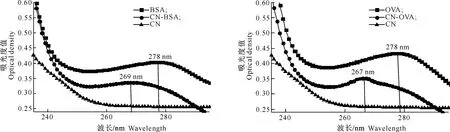
图 3 半抗原CN、免疫原CN-BSA和载体蛋白BSA的紫外光谱扫描图
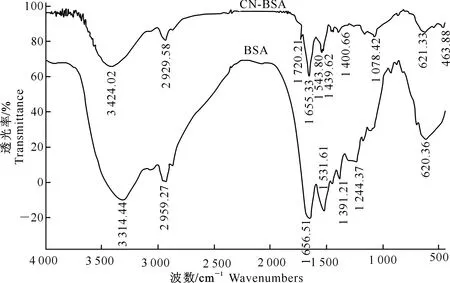
图 5 载体蛋白BSA与免疫原CN-BSA的红外光谱扫描图
2.3抗血清效价的测定
使用免疫原CN-BSA冲击免疫BALB/c小鼠后3 d,摘除眼球取血,纯化后获得抗血清,进行适当稀释后用酶标仪测定其在450 nm波长处的OD值,确定抗血清效价,结果如表2所示。由表2可知,经免疫原CN-BSA免疫后的BALB/c小鼠对半抗原CN产生了较好的免疫应答,而当抗血清稀释至 128 000 倍时,P/N值为 2.729>2.1,即获得的抗血清效价为128 000。较高效价抗血清的获得表明人工抗原的成功合成和多克隆抗体的成功制备。
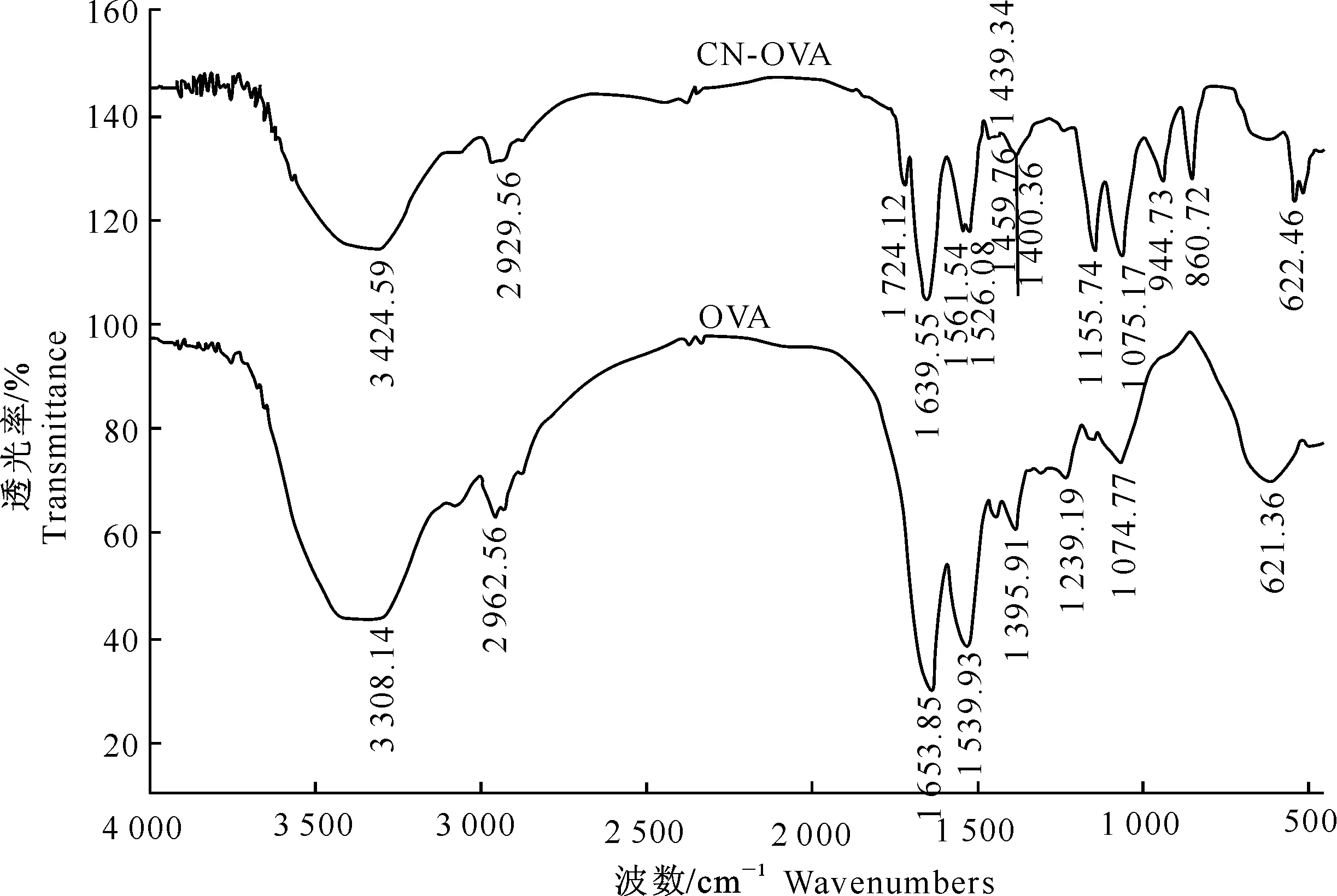
图 6 载体蛋白OVA与包被原CN-OVA的红外光谱扫描图
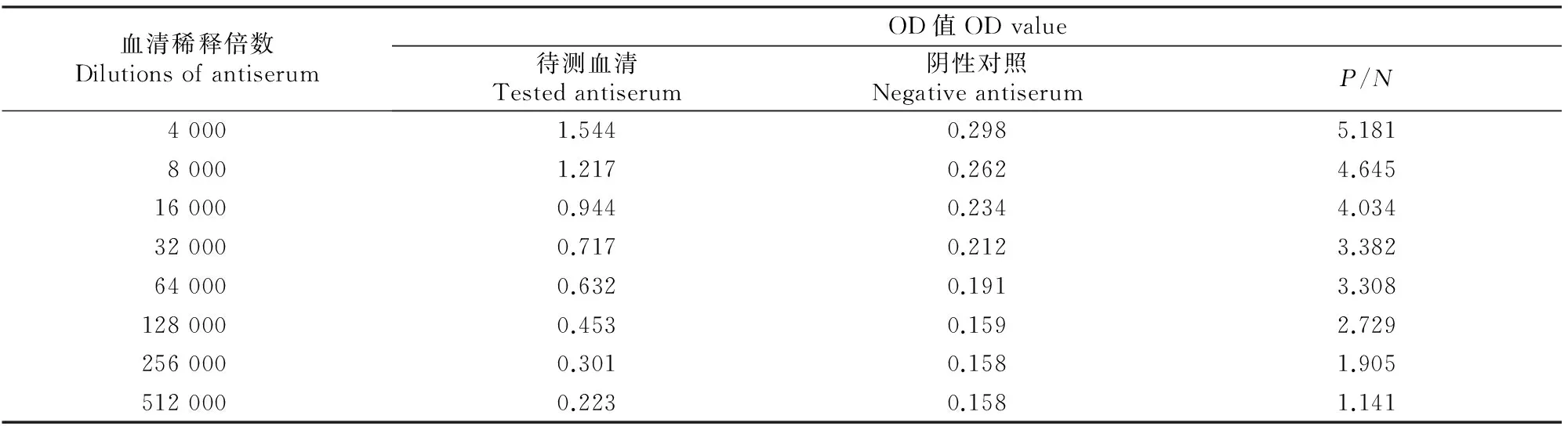
血清稀释倍数DilutionsofantiserumOD值ODvalue待测血清Testedantiserum阴性对照NegativeantiserumP/N40001.5440.2985.18180001.2170.2624.645160000.9440.2344.034320000.7170.2123.382640000.6320.1913.3081280000.4530.1592.7292560000.3010.1581.9055120000.2230.1581.141
3讨论
3.1半抗原和载体蛋白偶联位点的选择
通常小分子半抗原不具有免疫原性,必须与载体蛋白偶联形成人工抗原,借助载体蛋白的T细胞表位间接诱导B细胞激活、分化增殖,产生针对半抗原分子的特异性抗体[22]。研究表明,相同的半抗原分子,不同的偶联位点所形成的人工抗原的空间结构不同,即与载体结合后产生的人工抗原表面所暴露出的抗原决定簇不同,导致产生的抗体在效价、亲和力和特异性上均存在差异[23]。根据免疫系统通常对载体远端结构识别能力最强,而对连接位点部分特异性较弱的原则[24],要制备高效价和高特异性的抗体,半抗原分子中的偶联位点应远离半抗原分子的特征结构和官能团(如苯环或杂环等),使半抗原分子特征结构部分得以充分暴露,易于被动物免疫系统识别,同时还可避免载体蛋白对半抗原分子特征结构的屏蔽作用。在选择偶联位点时还应避免对半抗原分子的电子分布的影响[23]。本试验以半抗原天名精内酯酮缩氨基脲16位C作为偶联位点,该偶联位点的选择远离了天名精内酯酮特征结构α-亚甲基-γ-丁内酯环结构,对天名精内酯酮的电子分布影响较小,易于免疫系统对该特征结构的识别,从而产生高效价和高特异性的抗体,效价128 000抗血清的获得,证明了该设计思路的合理性。
3.2免疫分析是鉴定人工抗原的必需步骤
人工抗原的制备是为了能够引起动物的免疫反应,从而获得能识别半抗原分子的高特异性和高效价的抗体,因而人工抗原是否合格的评判标准应该为是否有特异性抗体产生。然而,通常采用的人工抗原的鉴定方法有SDS-PAGE法、红外光谱法、紫外吸收扫描法、同位素标记法等[25],但这些方法均仅能证明半抗原和载体蛋白是否成功偶联,并不能最终确定所制备的人工抗原是否能够引起动物的免疫反应从而获得满足要求的抗体。故除了要使用上述检测方法确定偶联是否成功外,还必须进一步使用免疫检测法对人工抗原的质量进行评价。本试验采用红外光谱法和紫外吸收扫描法2种方法对免疫原和包被原进行鉴定,证明半抗原和载体蛋白偶联成功,并使用间接非竞争ELISA法测定了抗血清的效价,高效价抗血清的获得证明了人工抗原的成功制备。
[参考文献]
[1]Mintao H,Nosaka S,Horibe I.Studies on sesquiterpenoids:Part Ⅷ.The structure of carabrone,a new component ofCarpesiumabrotanoidesLinn [J].Journal of Chemistry Society,1964:5503-5510.
[2]Maruyama M,Omura S.Carpesiolin fromCarpesiumabrotano-ides[J].Phytochemistry,1997,16:782-783.
[3]Yang C,Shi Y P,Jia Z J.Sesquiterpene lactone glycosides,eudesmanolides,and other constituents fromCarpesiumabrotanoides[J].Planta Medica,2002,68:626-630.
[4]Lee J,Min B,Lee S,et al.Cytotoxic sesquiterpene lactones fromCarpesiumabrotanoides[J].Planta Medica,2002,68:745-747.
[5]冯俊涛.大花金挖耳杀菌作用研究 [D].陕西杨凌:西北农林科技大学,2006.
Feng J T.Studies on the fungicidal activities ofCarpesiummacrocephalumFranch.Et Sav [D].Yangling,Shaanxi:Northwest A&F University,2006.(in Chinese)
[6]Feng J T,Wang H,Ren S X,et al.Synthesis and antifungal activities of carabrol ester derivatives [J].Journal of Argriculture and Food Chemistry,2012,60(15):3817-3823.
[7]Wang D L,Ren S X,Wang H,et al.Semisynthesis and antifungal activity of novel oxime ester derivatives of carabrone modified at C(4) againstBotrytiscinerea[J].Chemistry & Biodiversity,2014,11(6):886-903.
[8]Wang H,Ren S X,He Z Y,et al.Synthesis,antifungal activities and qualitative structure:Activity relationship of carabrone hydrazine derivatives as potential antifungal agents [J].International Journal of Molecular Science,2014,15(3):4257-4272.
[9]许丹.天名精内酯酮抑菌机理初步研究 [D].陕西杨凌:西北农林科技大学,2011.
Xu D.Preliminary study on the mode of action of carabrome [D].Yangling,Shaanxi:Northwest A&F University,2011.(in Chinese)
[10]Bravo A,Hendrickx K,Jansens S,et al.Immunocytochemical analysis of specific binding ofBacillusthuringiensisinsecticide crystal proteins of lepidopteran and coleopteran midgut membranes [J].Journal of Invertebrate Pathology,1992,60:247-253.
[11]Yasunori N,Satoshi T,Fumihide Y,et al.Identification ofBo-mbyxmorimidgut receptor forBacillusthuringiensisinsecticidal CryⅠA(a) toxin [J].Bioscience Biotechnology and Biochemistry,1998,62(4):718-726.
[12]Bravo A,Gomez I,Conde J,et al.Oligomerization triggers binding of aBacillusthuringiensisCry1Abpore-forming toxin to aminopeptidase N receptor leading toinsertion into membrane microdomains [J].Biochimicaet Biophysica Acta,2004,1667:38-46.
[13]Young D H,Slawecki R A.Mode of action of zoxamide (RH-7281),a new oomycete fungicide [J].Pesticide Biochemistry and Physiology,2001,69:100-111.
[14]Tresch S,Niggeweg R,Grossmann K.The herbicide flamprop-M-methyl has a new antimicrotubule mechanism of action [J].Pest Management Science,2008,64:1195-1203.
[15]李江华.天名精内酯酮的衍生合成及其抑菌活性研究 [D].陕西杨凌:西北农林科技大学,2006.
Li J H.Synthesis of carabrone derivatives and their antifungal activities [D].Yangling,Shaanxi:Northwest A&F University,2006.(in Chinese)
[16]Pastornavarron N,Mprails S,Maquieira A.Synthesis of hapten and development of a sensitive immunoassay for tetracycline residues [J].Analytica Chimica Acta,2007,594(2):211-218.
[17]李颖,马志卿,冯俊涛,等.苦参碱人工抗原的合成与鉴定 [J].西北农林科技大学学报:自然科学版,2012,40(9):96-102.
Li Y,Ma Z Q,Feng J T,et al.Synthesis and identification of artificial antigen of matrine [J].Journal of Northwest A&F University:Natural Science Edition,2012,40(9):96-102.(in Chinese)
[18]Goodrow M H,Harrison R O,Hammock B D.Hapten synthesis,antibody development,and competitive inhibition, enzyme immunoassay for s-Triazine herbicides [J].Journal of Agriculture and Food Chemistry,1990,38:990-996.
[19]Pauillac S,Naar J,Branaa P,et al.An improved method for the production of antibodies tolipophilic carboxylic hapten using small amount of hapten-carrier conjugate [J].Journal of Immunological Methods,1998,220(1):104-114.
[20]张静.川楝素免疫分析方法及其应用研究 [D].陕西杨凌:西北农林科技大学,2008.
Zhang J.Development and application of immunoassay for toosendanin [D].Yangling,Shaanxi:Northwest A&F University,2008.(in Chinese)
[21]Zhang J,Feng G,Luo L,et al.Development of an enzyme-lin-ked immuosorbent assay for toosendanin [J].Analytica Chimica Acta,2008,622(12):182-188.
[22]Spinks C A,Wyatt G M,Lee H A,et al.Molecular modeling of hapten structure and relevance to broad specificity immunoassay of sulfonamide antibiotics [J].Bioconjugate Chemistry,1999,10:583-588.
[23]王硕,张鸿雁,王俊平.酶联免疫吸附分析方法基本原理及其在食品化学污染检测中的应用 [M].北京:科学出版社,2011.
Wang S,Zhang H Y,Wang J P.The principle and application in decetion of food chemical contamination of ELISA [M].Beijing:Science Press,2011.(in Chinese)
[24]Kim Y J,Cho Y A,Lee H S,et al.Investigation of haptenheterology on immunoassay sensitivity and development of an enzyme-linked immunosorbent assay for organ phosphorus insecticide fenthion [J].Analytica Chimica Acta,2003,494(1/2):29-40.
[25]杨润亚,祁志军,吴文君.苦皮藤素Ⅴ人工抗原的合成和鉴定 [J].西北农林科技大学学报:自然科学版,2004,32(6):64-68.
Yang R Y,Qi Z J,Wu W J.Synthesis and identification of artificial antigen of CelangulinⅤ [J].Journal of Northwest A&F University:Natural Science Edition,2004,32(6):64-68.(in Chinese)
Preparation of polyclonal-antibody against carabrone
HE Ze-yu,HAN Li-rong,LIU Xue-ru,FENG Jun-tao,ZHANG Xing
(ResearchandDevelopmentCenterofBiorationalPesticide,TechnologyandEngineeringCenterofBiopesticide,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
Abstract:【Objective】 This study synthesized and identified artificial antigen of carabrone,and prepared polyclonal-antibody. 【Method】 Reaction of carabrone and semicarbazide hydrochloride was conducted to obtain hapten carabrone semicarbazone,which was characterized by MS and NMR spectrum.Then,the haptens were conjugated to bovine serum albumin (BSA) and ovalbumin (OVA) for generation of immunogen (CN-BSA) and coating antigen (CN-OVA),respectively.The structures of immunogen and coating antigen were identified by UV and IR spectrum.BALB/c mice were immunized with CN-BSA and polyclonal antisera were produced.The titer of antiserum was also detected by indirect non-competitive enzyme-linked immunosorbent assay.【Result】 Hapten was synthesized,and immunogen (CN-BSA) and coating antigen (CN-OVA) were obtained successfully.Polyclonal-antibody against carabrone was prepared and the titer of antiserum was 128 000.【Conclusion】 The artificial antigen and polyclonal-antibody against carabrone was prepared successfully.
Key words:carabrone;hapten;artificial antigen;ELISA
DOI:网络出版时间:2016-03-1408:4510.13207/j.cnki.jnwafu.2016.04.018
[收稿日期]2014-07-16
[基金项目]国家自然科学基金项目(31272074);陕西省自然科学研究计划项目(2012JQ3004);中央高校基本科研业务费专项(ZD2012004)
[作者简介]何泽瑜(1990-),男,云南勐腊人,在读硕士,主要从事农药毒理学研究。E-mail:skyhugh2012@gmail.com[通信作者]冯俊涛(1967-),男,河南登封人,教授,博士,主要从事生物农药及植物保护研究。E-mail:jtfeng@126.com
[中图分类号]R392.11
[文献标志码]A
[文章编号]1671-9387(2016)04-0129-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160314.0845.036.html

