巨噬细胞表型改变在先天性巨结肠相关性小肠结肠炎中的研究
陈绪勇 焦春雷 付康 冯晨钊 朱天琦 柯昌庶 冯杰雄
巨噬细胞表型改变在先天性巨结肠相关性小肠结肠炎中的研究
陈绪勇 焦春雷 付康 冯晨钊 朱天琦 柯昌庶 冯杰雄
目的 通过检测先天性巨结肠患儿结肠组织中巨噬细胞表型的改变,探讨巨噬细胞活化与巨结肠相关性肠炎发病之间的关系。方法 收集先天性巨结肠患儿(肠炎组4例,非肠炎组6例)结肠远段及近段标本,行HE染色、评估各段肠管炎症损伤程度,CD68和iNOS免疫荧光双染法评估M1型巨噬细胞活化状况,CD68和Arg-1免疫荧光双染法评估M2型巨噬细胞活化状况,RT-qPCR检测各组肠管iNOS及Arg-1的mRNA表达水平。结果 免疫荧光染色显示,肠炎组近段结肠iNOS/CD68阳性细胞的百分比(73.12±2.48)%明显高于肠炎组远段结肠(54.19±1.98)%、非肠炎组近段结肠(49.35±2.70)%及远段结肠(43.18±4.21)%;而肠炎组近段结肠Arg-1/CD68阳性细胞的百分比(33.15±4.81)%明显低于远段结肠(49.32±3.98)%;非肠炎组近段结肠Arg-1/CD68阳性细胞的百分比(45.23±1.95)%亦低于远段结肠(56.52±2.79)%,差异有统计学意义(P<0.05)。RT-qPCR结果显示,肠炎组近段结肠iNOS表达明显升高,而Arg-1表达则在肠炎组及非肠炎组的远段结肠升高(P<0.05)。结论 先天性巨结肠相关性小肠结肠炎的发生可能与巨噬细胞向M1型转化有关。
先天性巨结肠相关性小肠结肠炎; 巨噬细胞表型
先天性巨结肠(Hirschsprung’s disease,HD)是由于肠道神经嵴细胞自近段向远段发生迁移失败,导致结肠远段黏膜下层及肌间层缺乏神经节细胞,进而引起腹胀及肠梗阻等症状[1]。巨结肠相关性小肠结肠炎(Hirschsprung’s disease associated enterocolitis,HAEC)是HD最常见的并发症,HAEC在术前发生率为6%~26%,在根治术后发生率为5%~42%[2-3]。HAEC具体发病机制不明确,可能与结肠近段肠管扩张、肠壁黏膜屏障破坏、细菌移位及感染、黏蛋白改变、黏膜内神经内分泌细胞数量减少、基因表达改变等有关[4-5]。有文献报道,在HAEC患儿肠道组织中,免疫球蛋白如IgA、IgM表达升高,CD68阳性的单核巨噬细胞、CD45RO阳性的中性粒细胞及CD57阳性的NK细胞表达均升高[6]。此外,我们对EdnrB基因敲除的HD模型小鼠研究发现,在3周龄发生肠炎的小鼠中,结肠近段CD68阳性的巨噬细胞比例明显增加[7]。这些研究表明,肠道免疫细胞参与了HAEC的发生发展,但是巨噬细胞表型的改变在人类HD及其肠炎患儿的肠管中是否存在差异尚不明确,本文进一步探讨巨噬细胞在HAEC发病中的作用,现报告如下。
材料与方法
一、临床资料
收集我院2015年1月至2016年1月诊断为HD并进行手术治疗、术后病理确诊为无神经细胞症的病例,排除合并有其他先天性疾病及其他系统感染的病例。术中获取结肠标本,分为结肠近端扩张段及远端狭窄段,结肠标本一部分标本置于-80℃冰箱保存以备RT-qPCR使用;另部分标本置于4%多聚甲醛中固定、石蜡包埋、HE染色,在光镜下观察肠管组织形态学变化。采用文献报道的标准评估肠道组织的炎症损伤程度:0级,正常黏膜;Ⅰ级,隐窝扩张或隐窝存在黏蛋白;Ⅱ级,隐窝炎或每高倍镜下小于2个隐窝脓肿;Ⅲ级,每个高倍镜下多个隐窝脓肿;Ⅳ级,肠管纤维素样脓性坏死或黏膜溃疡形成;Ⅴ级,肠壁全层坏死或穿孔,每个组织标本观察5个视野,病理评分大于或等于Ⅱ级判定为HAEC[8],并用于实验。最终选取肠炎组(HAEC组)4例,非肠炎组(HD组)6例,男7例,女3例,平均月龄(10.8±2.7)个月,所有研究对象均征得患儿家属同意并签订知情同意书。
二、主要试剂仪器
巨噬细胞表面标志物CD68抗体购于Abcam公司(美国),巨噬细胞M1型标志物诱导型一氧化氮合酶(iNOS)抗体购于Santa Cruz公司(美国),巨噬细胞M2型标志物精氨酸酶1(Arg-1)抗体购于武汉三鹰公司(中国),荧光素FITC标记的二抗及荧光素Cy3标记的二抗购于碧云天生物技术公司(中国),逆转录试剂盒及qPCR试剂盒购于北京全式金生物技术有限公司(中国)。倒置荧光显微镜NIKON ECLIPSE TI SR(日本尼康),BIO-RAD C1000TM PCR仪(美国)。
三、免疫荧光双染法
肠组织石蜡切片(5 μm)使用透明脱蜡剂脱蜡、不同梯度的乙醇水化。将切片置于含0.01 mol/L枸橼酸钠修复液的修复盒中采用微波炉加热法进行抗原修复15 min。3%过氧化氢孵育10 min消除内源性过氧化物酶活性。6%BSA封闭30 min,滴加1∶200稀释的大鼠抗小鼠CD68抗体及1∶200稀释的兔抗小鼠iNOS抗体(或兔抗小鼠Arg-1抗体),4 ℃孵育过夜。滴加Cy3标记的山羊抗大鼠荧光二抗及FITC标记的山羊抗兔荧光二抗,室温下孵育1 h,DAPI染核,盖上盖玻片,在荧光显微镜下观察,绿色激发光可激发Cy3发出红色荧光,蓝色激发光可激发FITC发出绿色荧光,紫外光可激发DAPI发出蓝色荧光。使用Image-pro plus 6.0软件计数每个视野下红色荧光及绿色荧光阳性的细胞所占的比率,每个标本取5个视野,统计所有标本,取其平均值。
四、RT-qPCR检测
引物均由Invitrogen Biotechnology Co.,LTD中国公司设计合成,其中iNOS引物序列为5’-3’:TTCAGTATCACAACCTCAGCAAG;3’-5’:TGGACCTGCAAGTTAAAATCCC。Arg-1引物序列为5’-3’:GTGGAAACTTGCATGGACAAC;3’-5’:AATCCTGGCACATCGGGAATC。采用Trizol法提取各组病例结肠组织中的RNA,并使用酶标仪检测RNA的浓度,依照标本最小浓度值为标准调整各组RNA的浓度,按照逆转录试剂说明书将RNA逆转录成cDNA,再依照qPCR试剂说明书进行实时荧光定量PCR,实验结果采用ΔΔCT法计算。
五、统计学分析

结 果
一、结肠组织病理学改变
结肠标本采用HE染色(图1),镜下见HAEC组结肠近段(图1A)隐窝明显增大,并有多个隐窝脓肿,黏膜固有层可见大量炎症细胞浸润,病理评级为Ⅲ级;HAEC组结肠远段(图1B)可见隐窝炎,固有层炎症细胞浸润等,病理评级为Ⅱ级。HD组近段结肠(图1C)可见未见隐窝脓肿,病理评级为0级,HD结肠远段(图1D)未见隐窝异常,黏膜组织结构完整,病理评级为0级。所有收集病例中,HAEC组结肠近段、远段病理评级均≥Ⅱ级,病理改变符合肠炎标准;HD组结肠近段、远段病理评级<Ⅱ级,不符合肠炎标准。
二、CD68及iNOS免疫荧光双染法检测M1型巨噬细胞在结肠组织中的分布
结肠组织CD68(红色荧光)及iNOS(绿色荧光)免疫荧光双染显示(图2),HAEC组结肠近段可见大量的CD68阳性的巨噬细胞,并且iNOS阳性细胞数量增加(图2A~D);而HAEC组结肠远段CD68及iNOS阳性的细胞数量均减少(图2E~H)。HD组结肠近段及远段CD68阳性细胞及iNOS阳性的细胞均明显偏低(图2I~P)。HAEC组结肠近段、远段CD68阳性的细胞占总细胞的百分数分别为(19.61±1.78)%、(10.55±3.41)%;HD组结肠近段、远段CD68阳性细胞百分数分别为(6.03±1.17)%、(6.42±0.98)%。HAEC组结肠近段、远段iNOS阳性的细胞占CD68阳性的细胞百分数分别为(73.12±2.48)%、(54.19±1.98)%;HD组结肠近段、远段iNOS阳性的细胞占CD68阳性的细胞百分数分别为(49.35±2.70)%、(43.18±4.21)%。与HAEC组结肠远段及HD组结肠近段、远段相比,HAEC组结肠近段CD68阳性巨噬细胞数量增多,iNOS阳性的细胞百分比明显升高,差异具有统计学意义(P<0.05)。
三、CD68及Agr-1免疫荧光双染法检测M2型巨噬细胞在结肠组织中的分布
结肠组织CD68(红色荧光)及Arg-1(绿色荧光)免疫荧光双染显示(图3),HAEC组结肠近段可见明显的CD68阳性的细胞浸润,但Arg-1阳性的细胞数量偏低(图3A~D);HAEC结肠远段CD68阳性的细胞数量有所减少,而仍有一定量的Arg-1阳性的细胞(图3E~H)。HD组结肠近段CD68阳性的细胞及Arg-1阳性的细胞明显减少(图3I~L);HD组结肠远段CD68阳性的细胞较少,但仍有一定量的Arg-1阳性的细胞(图3M~P)。HAEC组结肠近段、远段Arg-1阳性的细胞占CD68阳性的细胞百分数分别为(33.15±4.81)%、(49.32±3.98)%;HD组结肠近段、远段Arg-1阳性的细胞占CD68阳性的细胞百分数分别为(45.23±1.95)%、(56.52±2.79)%。HAEC组远段Arg-1阳性的细胞数较HAEC组近段Arg-1阳性的细胞数升高;HD组远段Arg-1阳性的细胞数亦较HD组近段Arg-1阳性的细胞数升高,差异具有统计学意义(P<0.05)。
四、结肠组织iNOS及Arg-1 mRNA的相对表达量比较
采用RT-qPCR法检测HAEC及HD结肠组织iNOS(图4)、Arg-1(图5)的mRNA表达水平。结果显示,与HAEC组远段比较,iNOS的表达在HAEC组结肠近段明显升高(P=0.007);并且HAEC组近段iNOS的表达均较HD组近段(P=0.010)及HD组远段(P=0.008)升高。HAEC组结肠远段Arg-1的表达水平较HAEC组结肠近段明显升高(P<0.000 1);HD组中结肠远段Arg-1的表达量亦较HD组结肠近段升高(P=0.000 2),差异具有统计学意义。
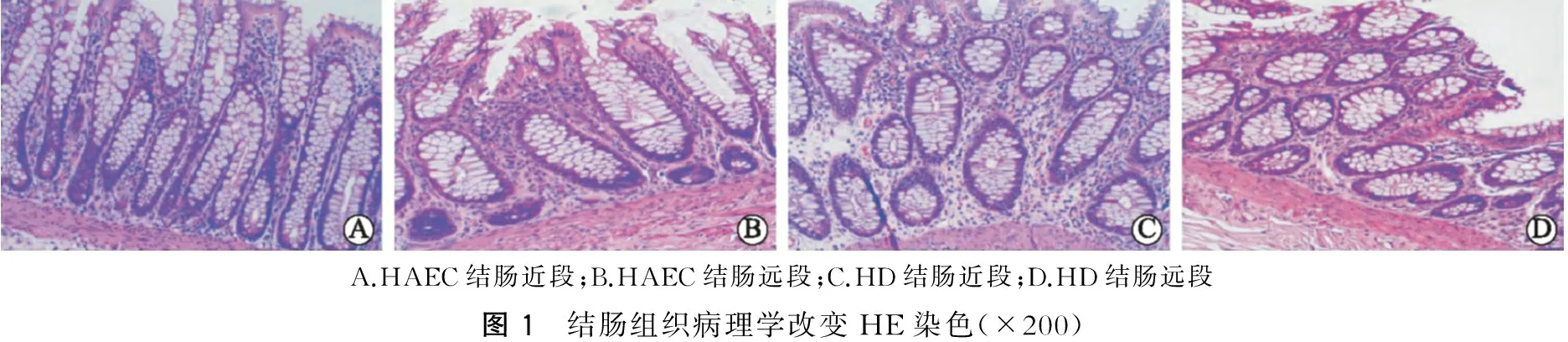
A.HAEC结肠近段;B.HAEC结肠远段;C.HD结肠近段;D.HD结肠远段图1 结肠组织病理学改变HE染色(×200)

A.HAEC结肠近段CD68染色;B.HAEC结肠近段iNOS染色;C.HAEC结肠近段细胞核染色;D.HAEC结肠近段合成图片;E.HAEC结肠远段CD68染色;F.HAEC结肠远段iNOS图;G.HAEC结肠远段细胞核染色;H.HAEC结肠远段合成图片;I.HD结肠近段CD68染色;J.HD结肠近段iNOS染色;K.HD结肠近段细胞核I染色;L.HD结肠近段合成图片;M.HD结肠远段CD68染色;N.HD结肠远段iNOS染色;O.HD结肠远段细胞核染色;P.HD结肠远段合成图片图2 CD68及iNOS免疫荧光双染(×200)

A.HAEC结肠近段CD68染色;B.HAEC结肠近段Arg-1染色;C.HAEC结肠近段细胞核染色;D.HAEC结肠近段合成图片;E.HAEC结肠远段CD68染色;F.HAEC结肠远段Arg-1图;G.HAEC结肠远段细胞核染色;H.HAEC结肠远段合成图片;I.HD结肠近段CD68染色;J.HD结肠近段Arg-1染色;K.HD结肠近段细胞核I染色;L.HD结肠近段合成图片;M.HD结肠远段CD68染色;N.HD结肠远段Arg-1染色;O.HD结肠远段细胞核染色;P.HD结肠远段合成图片图3 CD68及Arg-1免疫荧光双染(×200)

注:与其他组比较,*P<0.05图4 HAEC及HD结肠组织iNOSmRNA的相对表达量

注:与HAEC结肠近段比较,*P<0.05;与HD结肠近段比较,#P<0.05图5 HAEC及HD结肠组织Arg-1mRNA的相对表达量
讨 论
自从Harald Hirschsprung发现并报告首例HD以来,HD的发病机制已经有了很深入的研究。尤其是影响神经嵴干细胞发育的基因因素,编码序列、非编码序列的突变,转录后调节的分子机制研究,以及基因编辑技术的进步,使得进行肠道干细胞移植并促使其发育为成熟肠道神经元成为可能,但是,这些研究主要集中在动物实验方面[9-10]。目前,手术切除无神经节段肠管仍然是治疗HD最为有效的治疗手段,而术后HD患儿仍会发生小肠结肠炎等,并且术前术后HAEC发病概率无明显差异[2]。此外,有研究发现HAEC的发生与手术本身无关[11]。这些研究提示我们,HAEC的发生可能与单纯切除无神经节段肠管并无直接联系,而另有其他因素参与其中。
HAEC发病可能存在多种高危因素,包括HD家族病史、合并21-三联体综合征、Bardet-Biedl综合征、长段型HD、HD确诊时间延迟及反复发生过肠炎等[12]。肠道黏膜屏障功能、肠道微生物及肠道免疫功能在HAEC发病过程中亦起重要作用[13]。国外研究报道,HAEC病死率在1%~10%,并且大部分发生在新生儿期,但仍不清楚这部分患儿肠炎的发生是否与免疫系统不成熟相关[14]。我们前期研究表明,在HD动物模型中,发生肠炎的小鼠结肠近端扩张段巨噬细胞浸润数量明显增加并且炎症因子TNF-α表达水平明显升高[7]。巨噬细胞在维持机体功能中起重要作用,巨噬细胞活化可分为经典活化(M1型)及替代活化(M2型),M1型巨噬细胞可释放炎症因子(TNF-α,IL-1,IL-6,IL-12,IL-23)等,是机体宿主防御的有机组成成分,主要参与清除病原微生物等;M2型巨噬细胞主要参与组织的损伤修复及调节免疫功能等[15]。
本研究中,我们采用免疫荧光双染法检测人类HD结肠标本中巨噬细胞表型的变化,结果表明,在HAEC组中,CD68阳性的巨噬细胞数量在结肠近段及远段均较HD组升高,并且HAEC组近段升高更为明显。在对iNOS阳性的M1型巨噬细胞分析中发现,HAEC组近段结肠M1型巨噬细胞的百分比明显增加,而HAEC组远段及HD组近段、远段M1型巨噬细胞均无明显的差异,iNOS的mRNA表达水平亦证实上述结论。这些研究表明,HAEC发生可能与近端扩张段结肠大量巨噬细胞浸润及向M1型转化相关。为进一步研究M2型巨噬细胞在结肠的分布,我们采用CD68及Arg-1免疫荧光双染法发现,HAEC组及HD组结肠远段的M2型巨噬细胞数量均较相应组近段升高。由于M2型巨噬细胞主要参与组织的损伤修复,而且在结肠远段肠管中并无神经节细胞的存在,这些证据提示我们,结肠无神经节段肠管的病理改变可能影响免疫细胞的功能。
肠道神经系统由神经嵴细胞发育分化而来,任何破坏神经嵴细胞群数量、神经嵴细胞迁移行为及迁移速度的因素均可引起远端结肠无神经节细胞症。目前已知基因突变、调控序列的作用、microRNA及环境因素等均可引起肠道神经系统的紊乱[16]。并且在人类HD中,乙酰胆碱转移酶在无神经节段肠管明显升高而在有神经节段降低,神经元型一氧化氮合酶则在无神经节段明显降低有神经节段升高,HD动物模型亦证实这些神经递质的改变[17-18]。另有研究报道,神经递质能调控肠道免疫细胞的功能[19]。我们研究表明无论是否发生肠炎,HD远段结肠M2型细胞的比例增加,但是M2型细胞比例的增加是由无神经节段肠管微环境改变引起的结局,还是巨噬细胞产生的主动修复机制尚不清楚。
此外,在肠道特殊的微环境及肠道菌群共同进化作用下,肠道巨噬细胞在定居成熟过程中低表达多种先天性免疫反应相关分子,如LPS识别受体CD14,Fcα识别受体CD89,Fcγ识别受体CD64、CD32、CD16,CR3识别受体CD11b/CD18,CR4识别受体CD11c/CD18,共刺激因子CD40、CD80、CD86,髓样细胞1触发受体(TREM1)等,因此肠道巨噬细胞保持较弱炎症反应性,但仍保留吞噬功能[20-21]。我们在对HAEC近段结肠研究中发现,巨噬细胞比例明显增多,并且大部分巨噬细胞向M1型转化,即表现为强炎症反应性,而没有发生肠炎时,巨噬细胞数量则偏低;并且HAEC小鼠结肠近段炎症因子如TNF-α等高表达[7],这些研究表明HAEC中巨噬细胞的表型及功能存在改变。另有研究发现,炎症性肠病中CD14阳性的巨噬细胞明显增多,并且有可能来源于外周血中的单核细胞[22]。但是,HAEC近段结肠中升高的巨噬细胞是来源于血液,还是巨噬细胞在迁移过程中发育不成熟,亦或是肠道微环境改变从而影响巨噬细胞的表型变化,尚不清楚。因此后续实验有必要对HAEC结肠组织中巨噬细胞表面分子的表达差异及肠道微环境对巨噬细胞的影响等作进一步研究。
总之,HAEC发病过程中可能有多种机制的参与,包括黏膜屏障、肠道微生物及免疫功能的变化等。在本研究我们分析了巨噬细胞在HD中的分布,发现在HAEC近段结肠巨噬细胞明显浸润,并且大部分向M1型活化,这一发现为后续逆转巨噬细胞表型变化及HAEC的治疗提供了新的思路。
1 Haricharan RN,Georgeson KE.Hirschsprung disease.Semin Pediatr Surg,2008,17:266-275.DOI:10.1053/j.sempedsurg.2008.07.005.
2 Demehri FR,Halaweish IF,Coran AG,et al.Hirschsprung- associated enterocolitis: pathogenesis,treatment and prevention.Pediatr Surg Int,2013,29:873-881.DOI:10.1007/s00383-013-3353-1.
3 Wu X,Feng J,Wei M,et al.Patterns of postoperative enterocolitis in children with Hirschsprung’s disease combined with hypoganglionosis.J Pediatr Surg,2009,44:1401-1404.DOI:10.1016/j.jpedsurg.2008.11.004.
4 Austin KM.The pathogenesis of Hirschsprung’s disease-associated enterocolitis.Semin Pediatr Surg,2012,21:319-327.DOI:10.1053/j.sempedsurg.2012.07.006.
5 熊晓峰,冯杰雄.巨结肠相关性小肠结肠炎诊治进展.中华小儿外科杂志,2014,35:540-543.DOI:10.3760/cma.j.issn.0253-3006.2014.07.014.
6 Imamura A,Puri P,O’Briain DS,et al.Mucosal immune defence mechanisms in enterocolitis complicating Hirschsprung’s disease.Gut,1992,33:801-806.
7 陈绪勇,夏雪,韦佳,等.巨噬细胞活化在先天性巨结肠相关性小肠结肠炎发病中的作用.中华小儿外科杂志,2015,36:661-665.DOI:10.3760/cma.j.issn.0253-3006.2015.09.005.
8 Elhalaby EA,Teitelbaum DH,Coran AG,et al.Enterocolitis associated with Hirschsprung’s disease:a clinical histopathological correlative study.J Pediatr Surg,1995,30:1023-1027.
9 Fattahi F,Steinbeck JA,Kriks S,et al.Deriving human ENS lineages for cell therapy and drug discovery in Hirschsprung disease.Nature,2016,531:105-109.DOI:10.1038/nature16951.
10Bondurand N,Southard-Smith EM.Mouse models of hirschsprung disease and other developmental disorders of the enteric nervous system:Old and new players.Dev Biol,2016,417:139-157.DOI:10.1016/j.ydbio.2016.06.042.
11Estevao-Costa J,Carvalho JL,Soares-Oliveira M.Risk factors for the development of enterocolitis after pull-through for Hirschsprung’s disease.J Pediatr Surg,1999,34:1581-1582.
12Pontarelli EM,Ford HR,Gayer CP.Recent developments in Hirschsprung’s-associated enterocolitis.Curr Gastroenterol Rep,2013,15:340.DOI:10.1007/s11894-013-0340-6.
13Jiao CL,Chen XY,Feng JX.Novel Insights into the Pathogenesis of Hirschsprung’s-associated Enterocolitis.Chin Med J (Engl),2016,129:1491-1497.DOI:10.4103/ 0366-6999.183433.
14Gosain A.Established and emerging concepts in Hirschsprung’s-associated enterocolitis.Pediatr Surg Int,2016,32:313-320.DOI:10.1007/s00383-016-3862-9.
15Wynn TA,Chawla A,Pollard JW.Macrophage biology in development,homeostasis and disease.Nature,2013,496:445-455.DOI:10.1038/nature12034.
16Torroglosa A,Alves MM,Fernandez RM,et al.Epigenetics in ENS development and Hirschsprung disease.Dev Biol,2016,417:209-216.DOI:10.1016/j.ydbio.2016.06.017.
17Coyle D,O’Donnell AM,Gillick J,et al.Altered neurotransmitter expression profile in the ganglionic bowel in Hirschsprung’s disease.J Pediatr Surg,2016,51:762-769.DOI: 10.1016/j.jpedsurg.2016.02.018.
18Zaitoun I,Erickson CS,Barlow AJ,et al.Altered neuronal density and neurotransmitter expression in the ganglionated region of Ednrb null mice: implications for Hirschsprung’s disease.Neurogastroenterol Motil,2013,25:e233-e244.DOI:10.1111/nmo.12083.
19Gabanyi I,Muller PA,Feighery L,et al.Neuro-immune Interactions Drive Tissue Programming in Intestinal Macrophages.Cell,2016,164:378-391.DOI:10.1016/j.cell.2015.12.023.
20Weber B,Saurer L,Mueller C.Intestinal macrophages: differentiation and involvement in intestinal immunopathologies.Semin Immunopathol,2009,31:171-184.DOI:10.1007/s00281-009-0156-5.
21Smith PD,Smythies LE,Shen R,et al.Intestinal macrophages and response to microbial encroachment.Mucosal Immunol,2011,4:31-42.DOI:10.1038/mi.2010.66.
22Smith PD,Ochsenbauer-Jambor C,Smythies LE.Intestinal macrophages: unique effector cells of the innate immune system.Immunol Rev,2005,206:149-159.
Phenotypic changes of macrophages in Hirschsprung’s disease associated enterocolitis
ChenXuyong,JiaoChunlei,FuKang,FengChenzhao,ZhuTianqi,KeChangshu,FengJiexiong.
DepartmentofPediatricSurgery,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China
Correspondingauthor:FengJiexiong,Email:fengjiexiong@126.com
Objective To investigate the phenotypic changes of macrophages in patients with Hirschsprung disease,and to explore the role of macrophage activation in Hirschsprung’s associated entercolitis.Methods The distal segment of colon and proximal segments of the colon specimens in 10 patients with Hirschsprung’s disease (Entercolitis group: 4 cases; non-entercolitis group: 6 cases) were collected.HE staining was used to assess the degree of bowel inflammation injury.CD68 and iNOS immunofluorescence double staining was used to assess M1 macrophages,and CD68 and Arg-1 immunofluorescence double staining was used to assess M2 macrophages.The mRNA expression levels of iNOS and Arg-1 were detected by RT-qPCR.Results Immunofluorescence staining showed that the percentage of iNOS/CD68 positive cells in proximal segments of HAEC group [(73.12±2.48)%] was higher than that of distal segments of HAEC group [(54.19±1.98)%],proximal segments of HD group [(49.35±2.70)%] and distal segments of HD group [(43.18±4.21)%].But the percentage of Arg-1/CD68 positive cells in proximal segment colon of HAEC group [(33.15±4.81)%] was lower than in distal segment of HAEC group [(49.32±3.98)%],and percentage of Arg-1/CD68 positive cells in proximal segment colon of HD group [(45.23±1.95)%] was also lower than in distal segment of HD group [(56.52±2.79)%] (P<0.05).RT-qPCR results showed that the expression of iNOS was significantly increased in proximal segments of colon in HAEC group,but that of Arg-1 was higher in distal segment of HAEC group (P<0.05).Conclusions The occurrence of Hirschsprung’s associated entercolitis may be associated with the activation of M1 macrophages.
Hirschsprung’s associated entercolitis; Microphage phenotype
·论 著·(实验研究)
国家自然科学基金(81270441)
430030 武汉,华中科技大学同济医学院附属同济医院小儿外科(陈绪勇、焦春雷、付康、朱天琦、冯杰雄),病理科(柯昌庶);武汉外国语学校(冯晨钊)
冯杰雄,Email:fengjiexiong@126.com
R656.9
A
10.3969/j.issn.1003-5591.2016.06.018
2016-07-26)

