盐芥GRP7基因的克隆和逆境表达分析
李景艳,高 飞,周宜君,王 荣
(1 安徽大学 生命科学学院,安徽 合肥 230601;2 阜阳师范学院 生物与食品工程学院,安徽 阜阳 236037;3 中央民族大学 生命与环境科学学院,北京 100081)
盐芥GRP7基因的克隆和逆境表达分析
李景艳1,2,高飞3,周宜君3,王荣2
(1 安徽大学 生命科学学院,安徽 合肥 230601;2 阜阳师范学院 生物与食品工程学院,安徽 阜阳 236037;3 中央民族大学 生命与环境科学学院,北京 100081)
[摘要]【目的】 从抗逆植物盐芥中分离GRP7(glycine-rich RNA-binding protein7,GRP7)基因,为进一步揭示GRPs基因在盐芥逆境应答中的作用机制及生物学功能奠定基础。【方法】 利用盐芥GRP7基因的EST序列设计特异引物,克隆GRP7基因的全长序列,对其保守结构域和系统进化树进行分析,并对TsGRP7基因的启动子区进行预测;利用qRT-PCR技术,检测GRP7基因在不同逆境胁迫、不同组织中的表达情况。【结果】 TsGRP7基因编码区全长522 bp,编码173个氨基酸;TsGRP7蛋白的N端第9~82位氨基酸之间有1个RNA识别基序(RRM),RRM中含有保守的RNP-1和RNP-2亚结构域;多重序列比对和系统进化树分析表明,盐芥和拟南芥亲缘关系较近;启动子序列分析表明,盐芥GRP7启动子区含有HSE热激响应元件、LTR低温应答元件等多个逆境相关的顺式作用元件,表明盐芥GRP7基因参与逆境响应。qRT-PCR分析表明,盐芥GRP7基因在不同逆境胁迫条件及不同组织中表达不同。【结论】 盐芥GRP7基因参与低温、高盐、PEG等逆境响应。
[关键词]盐芥;GRP7;qRT-PCR;逆境胁迫
真核生物中,基因的表达在转录和翻译水平上均受到严格的调控。基因表达调控的第一步,即转录调控曾被认为是基因表达调控的主要环节,通过对基因表达调控机制越来越深入的了解,现在逐渐认识到转录后和翻译水平上的调控对基因表达同样起着重要的作用。有研究表明,转录后和翻译后的调控对真核生物适应生物及非生物胁迫有一定的帮助[1],这个过程主要通过不同的RNA结合蛋白来进行,尤其在调控涉及RNA的以下几个过程,如mRNA的转运、mRNA稳定性的维持、mRNA的翻译控制等[1-5]。典型的RNA结合蛋白(RBPs)含有1个或2个RNA识别基序(RNA-recognition motif),主要位于其N-末端和各种辅助基序或区域的C-末端,例如富含谷氨酸的区域、富含精氨酸的基序、RGG box、锌指结构基序及SR或RD重复区域等[6]。最新研究表明,RBPs在不同的植物基因组序列中被发现,包括拟南芥、水稻(Oryzasativa)、小麦(Triticumaestivum)、烟草、油菜和亚麻[6],这表明RBPs参与植物的生长发育、抗逆性等代谢过程[3,7-8]。
现已在许多植物中鉴定出富含甘氨酸的RNA结合蛋白(GRPs),其N端含有1个或多个RNA识别基序(RRM),在C端有1个富含甘氨酸的区域[9-10]。尽管对GRPs的功能研究还不是特别深入,但已有研究表明,GRPs的表达受一系列的外部刺激调控,包括寒冷、水分、植物激素胁迫、损伤、病毒感染等[10]。
近年来,一种新的抗非生物逆境研究模式植物,即盐芥(Thellungiellasalsugineum)越来越受到人们的关注。盐芥是拟南芥的近缘植物,表达序列标签(EST)分析表明,盐芥和拟南芥cDNA和氨基酸序列的同源性高达90%~95%[11],盐芥在植物抗非生物逆境方面有广阔的应用前景,能耐受较高程度的高盐、低温和干旱胁迫[12]。有研究发现,拟南芥8个GRP家族中的AtGRP2和AtGRP7[13]在寒冷胁迫中起作用[14-16],推测盐芥中的TsGRP7基因可能也参与逆境响应。本研究拟从盐芥中克隆GRP7基因,用生物信息学方法分析其结构特征进而推测其蛋白序列特征,对其8种同源蛋白进行多重序列比对并构建系统进化树,利用qRT-PCR分析TsGRP7基因在高盐、低温、干旱条件下的基因表达模式,以期为GRPs的功能研究提供科学依据。
1材料与方法
1.1试验材料
Trizol试剂,购于invitrogen公司;反转录试剂盒、Taq酶及qRT-PCR试剂盒,均购于天根生化科技(北京)有限公司;胶回收试剂盒,购自百泰克生物技术有限公司;T4DNA连接酶及pGEM®-T载体,购自Promega公司。引物合成及片段测序由华大科技有限公司完成。
1.2试验材料的处理
盐芥种子播种在培养基质为营养土、蛭石、珍珠岩 (质量比质量比为2∶1∶1)的混合土中,每3 d浇1次水。生长条件为:温度23 ℃(光)/18 ℃(暗),光照周期16 h(光)/8 h(暗),相对湿度60%(光)/80%(暗)。待其生长4周后移栽至新的培养基质中(m(蛭石)∶m(珍珠岩)=1∶1),期间每3 d浇1次Hoagland营养液。待其生长至6周后,取少量叶片迅速冻于液氮中,用于基因克隆。用Hoagland营养液配制300 mmol/L NaCl溶液和质量分数20%PEG6000溶液,然后将盐芥在配制好的NaCl溶液、PEG6000溶液及4 ℃低温条件下分别处理0,1,3,6和24 h,分别模拟高盐、干旱和低温胁迫处理,同时以正常培养盐芥为对照,之后取各处理盐芥的适当叶片和根迅速冻于液氮中,用于基因的组织特异性表达分析。
1.3TsGRP7基因的克隆
用Trizol法提取盐芥的总RNA,并用1%琼脂糖电泳检测其完整性,用NanoDrop 2000测定DNA浓度和OD260/280。以RNA为模板,根据天根FastQuant cDNA第一链合成试剂盒说明书操作得到cDNA后,低温保存用于后续试验。
利用拟南芥AtGRP7序列(序列注册号为AT4G13850)进行Blast分析,找到与AtGRP7序列同源性最高的盐芥GRP7的EST序列,根据TsGRP7的CDS序列,用Primer3.0软件(http://primer3.ut.ee/)在线设计基因克隆引物,所得引物序列见表1。PCR反应条件:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,36个循环;72 ℃ 5 min;4 ℃保存。PCR反应体系50 μL:cDNA模板2 μL,上、下游引物各2 μL,2×TaqPCR MasterMix 25 μL,ddH2O 19 μL。将PCR产物经1%琼脂糖电泳分离后进行胶回收,回收产物与pGEM®-T载体在T4DNA连接酶作用下4 ℃连接过夜。连接产物转化大肠杆菌DH5α,通过蓝白斑筛选得到阳性克隆,挑取单菌落进行菌落PCR验证,将得到的单一条带所对应的菌落挑出送华大科技有限公司测序。
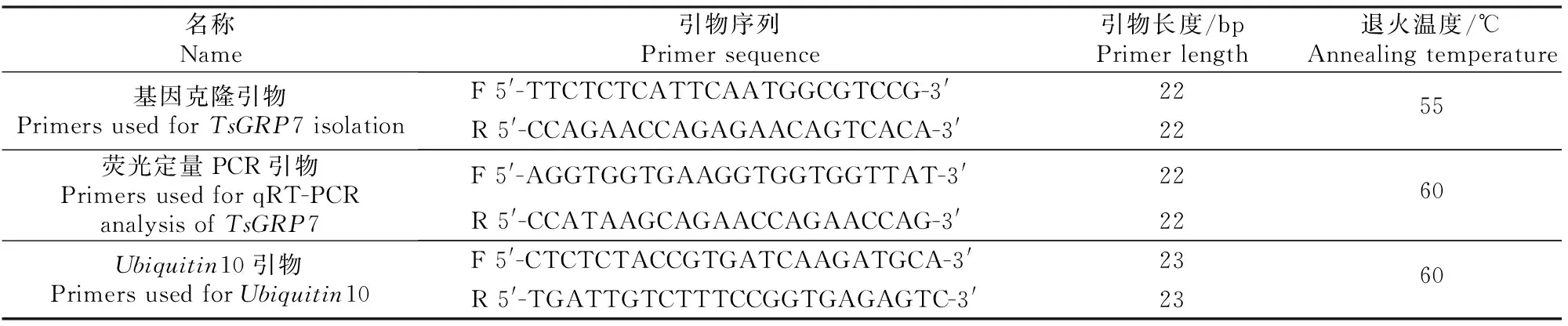
表 1 TsGRP7基因克隆和荧光定量PCR相关的引物序列
1.4生物信息学分析
运用生物信息学软件DNAMAN7.0查找TsGRP7基因全长序列的开放阅读框(ORF),翻译成氨基酸序列并分析等电点、氨基酸数目、相对分子质量等理化性质。利用在线工具NetPhos2.0 Server(http://www.cbs.dtu.dk/services/NetPhos)分析其氨基酸序列潜在的磷酸化位点;用在线工具TMHMM2.0 Server(http://www.cbs.dtu.dk/services/TMHMM/)预测蛋白质跨膜区结构;用在线工具SignaIP3.0 Server(http://www.cbs.dtu.dk/services/SignalP-3.0/)分析其信号肽;用在线工具WoLF PSORT(http://wolfpsort.org)进行亚细胞定位;用在线程序SMART进行保守结构域分析;利用NCBI的BlastP功能获得与TsGRP7氨基酸序列同源性较高的其他植物的氨基酸序列,用DNAMAN和MEGA5.0软件进行蛋白多序列比对并构建系统进化树。
用Phytozome网站和TsGRP7 CDS序列找到TsGRP7基因的启动子序列,运用在线工具PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析TsGRP7基因编码序列上游1 000 bp启动子区域内存在的顺式作用元件。
1.5表达模式分析
从低温、高盐、PEG6000胁迫处理的盐芥中提取RNA,电泳检测其完整性,根据天根FastQuant cDNA第一链合成试剂盒说明转录成cDNA,用NanoDrop 2000测定cDNA浓度,稀释成统一浓度后用于荧光定量PCR。利用在线工具Primer 3.0软件(http://primer3.ut.ee/)设计荧光定量PCR引物,并以盐芥的Ubiquitin10基因为内参基因,所用引物序列如表1所示。按照天根FastFire qPCR PreMix试剂盒说明书进行实时荧光定量PCR,用2-ΔΔCt法对荧光定量PCR的结果进行计算和统计分析。
2结果与分析
2.1TsGRP7基因的克隆
Trizol法提取盐芥的总RNA,用1%琼脂糖电泳检测其完整性,结果得到28S、18S、5S共3条清晰条带,且28S条带亮度约是18S的2倍。用NanoDrop 2000检测提取的RNA浓度,OD260/280为 2.10,说明提取的RNA完整性较好、纯度较高,可用于后续试验。
以反转录获得的cDNA为模板,使用克隆引物进行PCR扩增,将扩增产物用1%琼脂糖凝胶进行电泳检测,结果(图1)表明,PCR产物为单一、明亮的条带,大小为500~600 bp。PCR产物胶回收后,与T载体连接转化大肠杆菌DH5α细胞。取5个阳性菌落培养后测序,测序得到的序列与TsGRP7 EST序列中的相应区域完全相同,确认该片段为盐芥TsGRP7基因序列。
2.2TsGRP7基因的序列分析
TsGRP7基因编码区全长522 bp,编码173个氨基酸(图2),其中19个为酸性氨基酸,18个为碱性氨基酸。DNAMAN7.0软件分析表明,预测的蛋白分子质量为16.62 ku,等电点为5.54。
NetPhos 2.0 Server分析表明,TsGRP7蛋白有13个潜在的磷酸化位点,包括8个Ser、3个Thr和2个Tyr位点;TMHMM 2.0 Server在线预测表明,该蛋白不存在跨膜结构,不是跨膜蛋白;在线工具SignaIP3.0 Server分析表明,TsGRP7蛋白无信号肽,不是分泌蛋白;使用WoLF PSORT进行亚细胞定位分析,预测该蛋白定位于细胞核中;用在线工具SMART对其保守结构域的分析表明,TsGRP7蛋白的N端第9~82位氨基酸之间有1个RNA识别基序(RRM);由氨基酸序列可知,其C端有富含甘氨酸的区域。RRM中含有保守的RNP-1 (GFGFVTF,50~56位氨基酸)和RNP-2(CFVGGL, 10~15位氨基酸)亚结构域,在C端有1个arginine-glycine-rich (RGG)位点,这是核定位GRP蛋白的特征位点。以上分析结果表明,TsGRP7蛋白是一个典型的富含甘氨酸的RNA结合蛋白。
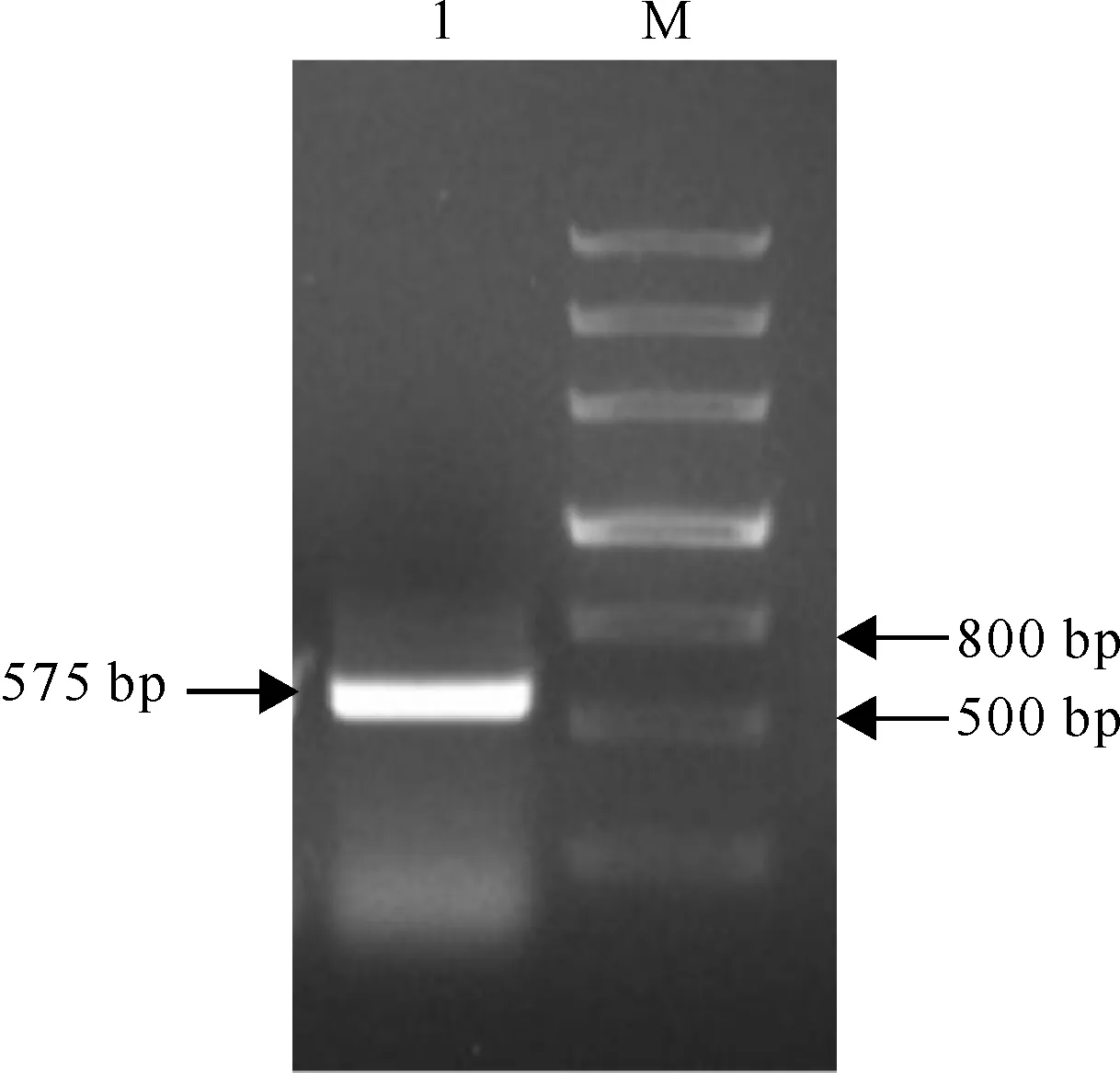
图 1 盐芥TsGRP7基因PCR产物的电泳检测
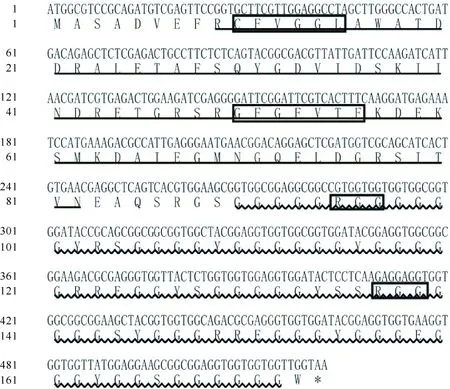
图 2 TsGRP7基因的ORF序列及编码的氨基酸序列
2.3TsGRP7氨基酸序列同源性及进化树分析
将TsGRP7氨基酸序列在NCBI中进行BlastP比对,找到其在拟南芥(Arabidopsisthaliana)、油菜(Brassicacampestris)、毛果杨(Populustrichocarpa)、高山离子芥(Chorisporabungeana)、水稻(Oryzasativa)、大豆(Glycinemax)、烟草(Nicotianatabacum)、二穗短柄草(Brachypodiumdistachyon)中的同源蛋白。对这9种蛋白的氨基酸序列进行比对,结果如图3所示。再进一步构建TsGRP7蛋白和其他8种同源蛋白的系统进化树见图4。结果表明,盐芥的GRP7蛋白与油菜中同源蛋白的同源性最高,其次是高山离子芥、拟南芥,与水稻中同源蛋白的同源性最低,说明盐芥与芸苔属、拟南芥属亲缘关系较近。

图 3 TsGRP7与其他8同源性蛋白氨基酸序列的多重比较
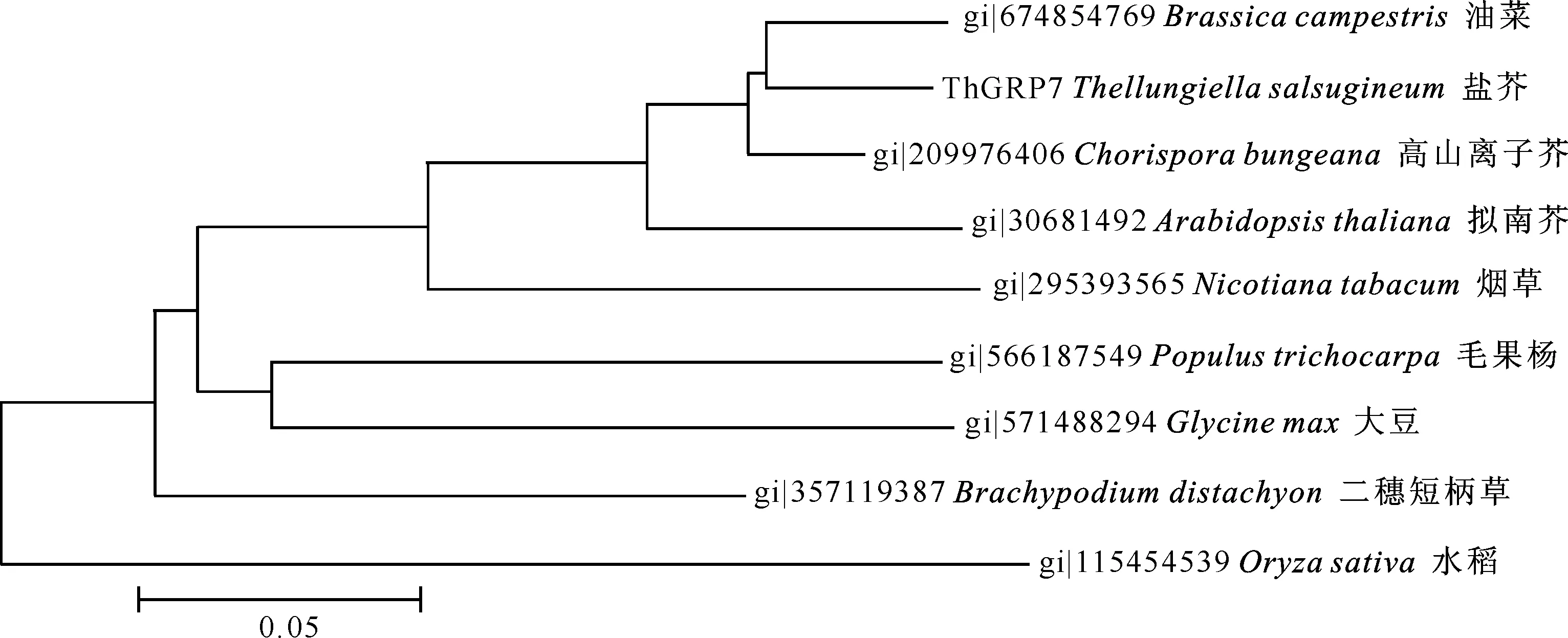
图 4 TsGRP7与其他8种同源性蛋白的系统进化树分析
2.4TsGRP7基因启动子序列分析
顺式作用元件(cis-acting element)是启动子区域中序列特异性转录因子的结合位点,通过与转录因子结合调控基因转录的精确起始和转录效率,从而在基因表达调控过程中起着重要的作用。使用plantCARE软件预测TsGRP7基因启动子区的顺式作用元件的种类和作用,有助于揭示TsGRP7基因的表达调控机制。分析结果(表2)表明,TsGRP7基因启动子区含有多种与植物非生物胁迫、生物胁迫和激素应答有关的顺式作用元件,表明TsGRP7参与了盐芥的非生物胁迫和生物胁迫应答。
2.5TsGRP7的逆境表达模式分析
为进一步揭示TsGRP7应答逆境的表达模式,以盐芥Ubiquitin10为内参基因,利用qRT-PCR方法分析高盐、干旱、低温逆境条件下TsGRP7基因在盐芥根和叶中的表达情况,结果如图5所示。
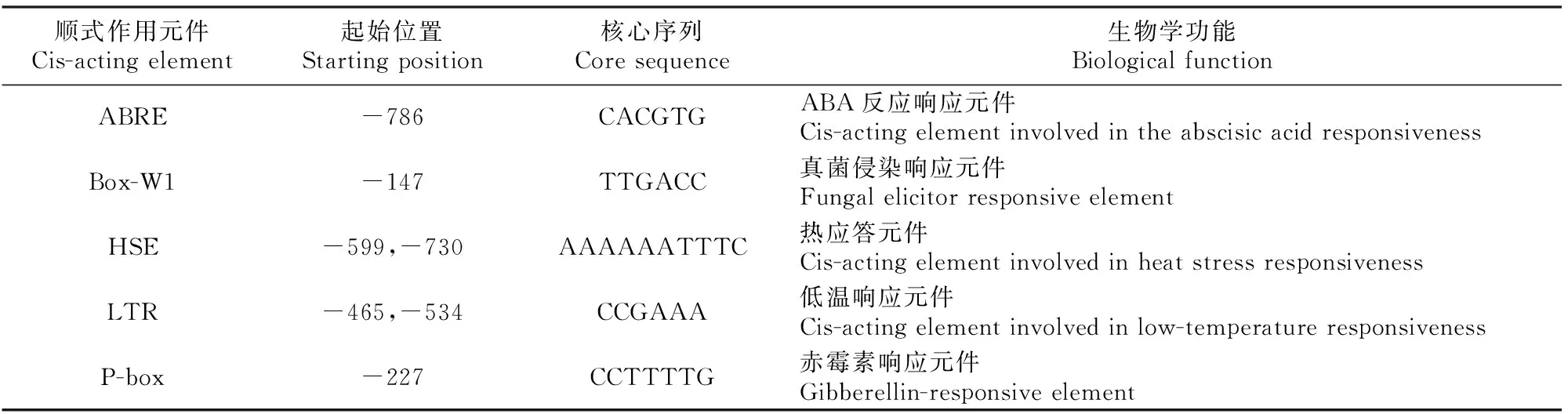
表 2 TsGRP7基因启动子区中可能参与逆境胁迫的顺式作用元件
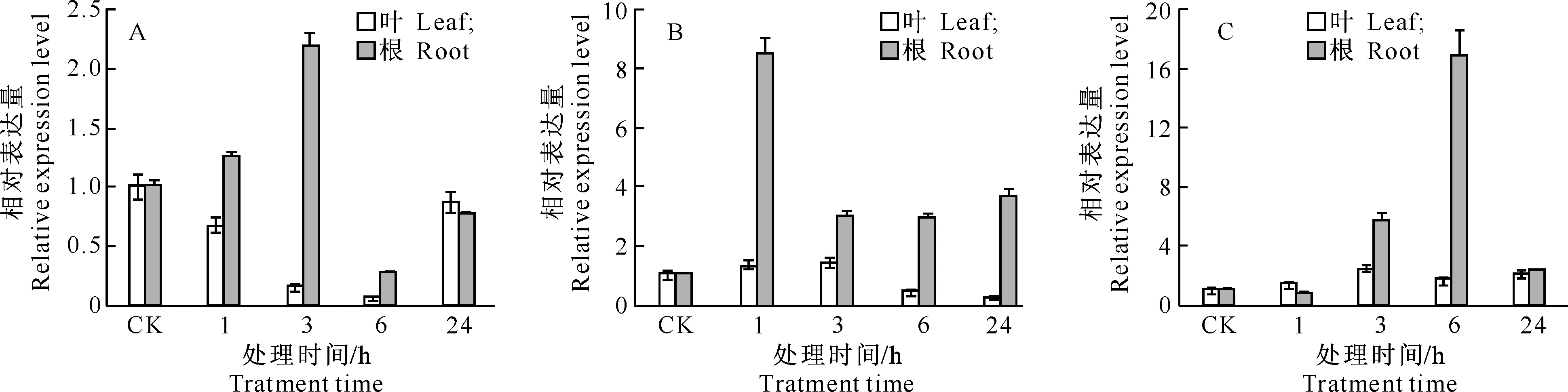
图 53种逆境胁迫下盐芥叶和根中TsGRP7基因的表达分析
A.20% PEG6000模拟干旱处理;B.300 mmol/L NaCl处理;C.4 ℃低温处理
Fig.5Expression patterns ofTsGRP7 in response to three stresses
A.20% PEG treatment;B.300 mmol/L NaCl treatment;C.4 ℃ cold treatment
从图5-A可知,在20%PEG6000模拟干旱处理盐芥的24 h中,盐芥叶片中的TsGRP7表达量总体呈下调趋势,干旱处理6 h时表达量最低,为对照的0.06倍;24 h时表达量有所提高,为对照的0.86倍。盐芥根中的TsGRP7表达量整体表现为下调趋势,与叶中不同,干旱处理1,3 h时的TsGRP7表达量分别为对照的1.24,2.02倍,6 h时下调为对照的0.26倍,24 h时为对照的0.74倍。
图5-B显示,在300 mmol/L NaCl处理盐芥过程中,盐芥叶中的TsGRP7表达量下调,高盐处理24 h时表达量达到最低,为对照的0.23倍;与叶相反,盐芥根中的TsGRP7表达量上调,高盐处理1 h时表达量最高,为对照的8.5倍,24 h时仍为对照的3.67倍。
图5-C表明,在4 ℃低温胁迫处理过程中,盐芥叶中的TsGRP7表达量于处理3 h时达到最高水平,为对照的2.45倍,处理24 h时表达量又有所下降,但仍为对照的2.14倍;盐芥根中的TsGRP7表达量上调,6 h时表达量达到最高,为对照的16.86倍。上述结果表明,在不同逆境胁迫下TsGRP7的表达趋势不同,而在同一胁迫条件下,不同组织中TsGRP7的表达趋势也不相同。
3讨论
植物中存在两大类GRP蛋白:一类在N端具有典型的真核生物信号肽序列,信号肽序列引导合成的蛋白质进入内质网并最终经细胞分泌系统定位于质膜外的细胞壁中;另一类在N端含有90~100个氨基酸组成的RNA结合功能域保守序列(RRM),其中包括2个保守结构域RNP-1和RNP-2,它们定位于细胞核中,可与新生mRNA前体分子结合,参与形成异源核糖核蛋白复合体[17]。本研究从盐芥中克隆了富含甘氨酸的RNA结合蛋白(TsGRP7),运用生物信息学软件对其氨基酸序列特征进行了分析,结果表明:TsGRP7蛋白无信号肽,不是分泌蛋白;TsGRP7蛋白N端有1个典型的RNA识别基序(RRM),RRM中含有保守的RNP-1(GFGFVTF,50~56位氨基酸)和RNP-2(CFVGGL,10~15位氨基酸)亚结构域,在C-端有arginine-glycine-rich (RGG)位点,这是核定位GRP蛋白的特征位点。缺失分析表明,RNP-1、RNP-2和富含甘氨酸结构域的氨基酸残基是RNA结合活性所必需的[17]。许多逆境因子,包括冷害、致伤、干旱、脱落酸(ABA)处理等均能有效诱导GRPs基因家族的RNA表达水平显著提高[14,18]。盐芥与拟南芥近缘,盐芥具有很强的抗低温、抗干旱和耐盐的能力。本研究通过盐芥TsGRP7和其他8种同源蛋白进行多序列比对,发现盐芥GRP7与拟南芥同源蛋白的一致性高达94%;系统进化树分析也表明,盐芥与拟南芥有较近的亲缘关系。
有研究表明,AtGRP7影响拟南芥的生长及其在高盐、干旱、低温下的耐受性,尤其于低温时通过调控mRNA在细胞中的输出增加拟南芥的耐受性[19]。GRP7的表达受到不同胁迫因素的调节,低温胁迫会显著提高GRP7的表达水平[14,20],而高盐和干旱胁迫则会下调拟南芥中GRP7的表达[21]。本研究用生物信息学方法对TsGRP7基因启动子序列进行预测,发现启动子区含有多个响应逆境胁迫的顺式作用元件,说明这些顺式作用元件可能与相应的转录因子结合进而调节非生物胁迫下盐芥TsGRP7基因的表达。RT-PCR分析结果表明,在24 h 20% PEG6000模拟干旱处理盐芥的过程中,其叶和根中的TsGRP7表达量下调;在300 mmol/L NaCl处理盐芥的24 h中,其叶中的TsGRP7表达量下调,而根中的TsGRP7表达量上调,说明盐芥根和叶对逆境胁迫的耐受程度不同;在24 h 4 ℃低温胁迫盐芥的过程中,其叶和根中的TsGRP7表达量均上调。TsGRP7基因的表达也受到不同胁迫因素的调节,TsGRP7基因启动子预测得到的顺式作用元件在基因表达调控过程中起着重要作用,尤其是在逆境胁迫中。
有研究表明,大肠杆菌在受到低温胁迫时其GRP7蛋白发挥着RNA分子伴侣的作用[21]。对拟南芥GRP7蛋白细胞定位和功能的研究表明,在高盐、干旱胁迫下,拟南芥GRP7蛋白表达会抑制种子的萌发、幼苗的生长并增强植物的逆境耐受性,尤其可通过调节mRNA在保卫细胞的输送,以增强拟南芥的低温耐受能力[19]。对高山离子芥低温条件下基因转录水平和蛋白质组的研究表明,CbGRP在低温条件下表达量上调[10]。CbGRP是RNA的分子伴侣,在基因转录后调节中发挥作用。更有蛋白质组学研究表明,TsGRP7蛋白通过在低温胁迫下表达量上调来增强RNA的代谢,进而赋予盐芥低温耐受能力[22]。本研究对TsGRP7表达模式的分析表明,盐芥TsGRP7基因在4 ℃低温条件下表达量上调,推测TsGRP7蛋白可能通过参与mRNA从细胞核到细胞质的输送,来增强盐芥的低温耐受性。
总之,本研究为进一步了解盐芥GRP7基因参与高盐、干旱、低温等逆境反应的分子机制奠定了基础,并且本研究从盐芥中克隆了GRP7基因,为下一步构建表达载体及进行转基因试验的验证提供了条件。
[参考文献]
[1]Mata J,Marguerat S,Bähler J.Post-transcriptional control of gene expression:a genome-wide perspective [J].Trends in Biochemical Sciences,2005,30(9):506-514.
[2]Kim J Y,Kim W Y,Kwak K J,et al.Zinc finger-containing glycine-rich RNA-binding protein inOryzasativahas an RNA chaperone activity under cold stress conditions [J].Plant Cell & Environment,2010,33(5):759-768.
[4]Moore M J.From birth to death:the complex lives of eukaryotic mRNAs [J].Science,2005,309(5740):1514-1518.
[5]Huh S U,Paek K H.Plant RNA binding proteins for control of RNA virus infection [J].Frontiers in Physiology,2013,4:397.
[6]Xu T,Gu L,Choi M J,et al.Comparative functional analysis of wheat (Triticumaestivum) zinc finger-containing glycine-rich RNA-binding proteins in response to abiotic stresses [J].PLoS One,2014,99(5):e96877.
[7]Jung H J,Park S J,Kang H.Regulation of RNA metabolism in plant development and stress responses [J].Journal of Plant Biology,2013,56(3):123-129.
[8]Kang H,Park S J,Kwak K J.Plant RNA chaperones in stress response [J].Trends in Plant Science,2013,18(2):100-106.
[9]Alba M M,Pages M.Plant proteins containing the RNA-recognition motif [J].Trends in Plant Science,1998,3(1):15-21.
[10]Sachetto-Martins G,Franco L O,Oliveira D E D.Plant glycine-rich proteins:a family or just proteins with a common motif? [J].Biochimica et Biophysica Acta,2000,1492(1):1-14.
[11]Amtmann A,Bohnert H J,Bressan R A.Abiotic stress and plant genome evolution:search for new models [J].Plant Physiol,2005,138(1):127-130.
[12]Amtmann A.Learning form evolution:Thellungiellagenerates new knowledge on essential and critical components of abiotic stress tolerance in plants [J].Mol Plant,2009,2(1):3-12.
[14]Carpenter C D,Kreps J A,Simon A E.Genes encoding glycine-richArabidopsisthalianaproteins with RNA-binding motifs are influenced by cold treatment and an endogenous circadian rhythm [J].Plant Physiology,1994,104(3):1015-1025.
[15]Vermel M,Guermann B,Delage L,et al.A family of RRM-type RNA-binding proteins specific to plant mitochondria [J].Proceedings of the National Academy of Sciences,2002,99(9):5866-5871.
[16]陈万利,刘宗旨,李文华.植物富含甘氨酸蛋白质(GRP)及其基因研究进展 [J].东北农业大学学报,2005,36(4):512-519.
Chen W L,Liu Z Z,Li W H.Plant RNA binding proteins and its genetic research progress [J].Journal of Northeast Agricultural University,2005,36(4):512-519.(in Chinese)
[17]Hanano S,Sugita M,Sugiura M.Isolation of a novel RNA-binding protein and its association with a large ribonucleoprotein particle present in the nucleoplasm of tobacco cells [J].Plant Molecular Biology,1996,31(1):57-68.
[18]Van Nocker S,Vierstra R D.Two cDNA fromArabidopsisthalianaencode putative RNA-binding proteins containing glycine-rich domains [J].Plant Molecular Biology,1993,21(4):695-699.
[19]Kim J S,Jung H J,Lee H J,et al.Glycine-rich RNA-binding protein 7 affects abiotic stress responses by regulating stomata opening and closing inArabidopsisthaliana[J].The Plant Journal,2008,55(3):455-466.
[20]Kwak K J,Kim Y O,Kang H.Characterization of transgenicArabidopsisplants overexpressing GR-RBP4 under high salinity,dehydration,or cold stress [J].Journal of Experimental Botany,2005,56(421):3007-3016.
[21]Kim J S,Park S,Kwak K J,et al.Cold shock domain proteins and glycine-rich RNA-binding proteins fromArabidopsisthalianacan promote the cold adaptation process inE.coli[J].Nucleic Acids Research,2006,35(2):506-516.
[22]Gao F,Zhou Y J,Zhu W P,et al.Proteomic analysis of cold stress-responsive proteins inThellungiellarosette leaves [J].Planta,2009,230(5):1033-1046.
Cloning and stress expression ofGRP7 inThellungiellasalsugineum
LI Jing-yan1,2,GAO Fei3,ZHOU Yi-jun3,WANG Rong2
(1SchoolofLifeScience,AnhuiUniversity,Hefei,Anhui230601,China;2CollegeofLifeScience,FuyangNormalCollege,Fuyang,Anhui236037,China;3CollegeofLifeandEnvironmentalScience,MinzuUniversityofChina,Beijing100081,China)
Abstract:【Objective】 The glycine-rich RNA-binding protein7 (GRP7) gene was isolated from Thellungiella salsugineum to understand the role of GRPs and lay the foundation for further function analysis of GRPs in stress response.【Method】 In this experiment,specific primers of TsGRP7 were designed based on EST sequence and full-length cDNA of TsGRP7 gene was isolated.The conserved domain and potential cis-element in promoter region were analyzed and phylogenetic analysis was performed.Quantitative real-time PCR analysis was carried out under different stresses in different tissues.【Result】 The 522 bp coding region of TsGRP7 encoded 173 amino acid residues.The region between residues 9 and 82 was a typical RNA-recognition motif,containing conserved RNP-1 and RNP-2 subdomains.Multiple sequence alignment and system evolution analysis of TsGRP7 protein reveled that Thellungiella salsugineum had higher identity with homologous protein in Arabidopsis.Promoter sequence analysis by PlantCARE showed that multiple cis-elements were associated with abiotic and biotic stress localized in promoters,such as HSE,LTR,ABRE,Box-W1 and P-box,indicating that the TsGRP7 gene involved in stree response.Quantitative real-time PCR analysis revealed that the expression of TsGRP7 gene was specific under different stresses and in different tissues.【Conclusion】 The TsGRP7 gene involved in responses to low temperature,high salt and drought stress.
Key words:Thellungiella salsugineum;GRP7;qRT-PCR;stress
DOI:网络出版时间:2016-05-0314:0510.13207/j.cnki.jnwafu.2016.06.021
[收稿日期]2015-12-25
[基金项目]国家自然科学基金项目(31070361);安徽省自然科学基金项目(1408085MC44);中央高校基本科研业务费专项(1112KYQN31,0910KYZY43);国家985工程项目(MUC98507-08);高等学校学科创新引智计划项目(B08044);国家民委科研项目(10ZY01)
[作者简介]李景艳(1988―),女,河南项城人,在读硕士,主要从事生化与分子生物学研究。E-mail:602419592@qq.com E-mail:wangrbnu@aliyun.com
[通信作者]王荣(1968―),女,河北石家庄人,教授,硕士,硕士生导师,主要从事植物分子遗传学研究。
[中图分类号]Q945.78;Q943.2
[文献标志码]A
[文章编号]1671-9387(2016)06-0150-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160503.1405.042.html

