鱼腥藻PCC 7120 基因alr0267敲除及其功能的初步研究
曹必溥,傅雪琳,蔡晓丹,何 平
(华南农业大学 a 生命科学学院 广东省农业生物蛋白质功能与调控重点实验室,b 农学院,广东 广州 510642)
鱼腥藻PCC 7120 基因alr0267敲除及其功能的初步研究
曹必溥a,傅雪琳b,蔡晓丹a,何平a
(华南农业大学 a 生命科学学院 广东省农业生物蛋白质功能与调控重点实验室,b 农学院,广东 广州 510642)
[摘要]【目的】 敲除鱼腥藻PCC 7120的alr0267基因,并对其功能进行初步研究。【方法】 克隆获得鱼腥藻PCC 7120 alr0267基因部分片段,通过构建敲除载体,使其与目的基因发生单交换同源重组,从而将鱼腥藻PCC 7120中的alr0267基因敲除,并对敲除体进行纯化和PCR鉴定,然后对alr0267敲除体和野生型固氮异形胞进行形态观察和统计,同时采用实时荧光定量PCR,在培养不同时间(0,3,8,24 h和10 d)检测野生型和alr0267基因敲除体中与异形胞功能相关基因all0813、all2736、alr2887的相对表达量。【结果】 鱼腥藻PCC 7120 alr0267基因被成功敲除;在缺氮条件下培养6~12 d,敲除体异形胞营养细胞数的均值明显少于野生型;实时定量PCR分析表明,野生型中all0813、all2736、alr2887基因表达量均在培养24 h达到最大,敲除体中这3个基因最大相对表达量的出现时间均有所延迟。【结论】 alr0267基因敲除导致异形胞分化频率增加,同时影响异形胞的正常发育。
[关键词]鱼腥藻PCC 7120;alr0267基因;异形胞;单交换同源重组;实时荧光定量PCR
鱼腥藻PCC 7120(Anabaenasp.PCC 7120)是一种能固氮的丝状蓝藻,其在缺氮环境下,沿着丝体每隔一定数量的营养细胞即可分化出一个固氮细胞,此固氮细胞被称作异形胞。当鱼腥藻PCC 7120被置于缺氮环境中时,细胞内的α-酮戊二酸开始积累[1-2],即使在加氮环境下,人为地增加蓝藻细胞内的α-酮戊二酸也能诱导异形胞的形成[1]。NtcA和HetR是异形胞形成的主要调节因子, NtcA能诱导ntcA表达,也能诱导hetR的表达[3];当α-酮戊二酸大量存在时,NtcA结合DNA的能力明显增强[4]。HetR是一种带有DNA结合位点的自我降解蛋白酶[5-6],其主要功能是促进NtcA的进一步富集,对hetR进行敲除后,蓝藻细胞不能形成异形胞,但当其过量表达时,异形胞出现的频率明显升高[7-8]。
异形胞的糖脂层具有阻止氧气渗入的作用,其对异形胞行使固氮功能具有重要作用[9]。虽然对糖脂层和多糖层合成有关的酶[10-12]已有了解,但对糖脂被转运到外膜的过程和机制却并不清楚。研究者一致认为,ABC型转运蛋白是异形胞糖脂层形成过程中所必需的一种转运蛋白[13-14]。大肠杆菌中的TolC是一个贯穿细胞周质空间而连接内外膜的通道蛋白,参与着毒素分泌和药物的外排[15]。Moslavac等[16]曾在异形胞的外膜中鉴定出与大肠杆菌TolC相似的异形胞糖脂沉淀蛋白D(HgdD),将hgdD敲除后,异形胞不能形成糖脂层[17]。Moslavac[18]推测鱼腥藻PCC 7120 TolC(Alr2887)的膜外结合底物可能为All2736和Alr0267,但其在鱼腥藻PCC 7120外膜蛋白中检测到了All2736与Alr2887(HgdD)组成的复合蛋白,且All2736是Alr2887膜外结合底物的可能性更大[19]。Black等[20]通过化学诱变发现基因hglK(all0813)与异形胞糖脂层形成相关,但并不参与糖脂的合成,其主要功能是将糖脂定位在膜外。Staron等[21]将devBCA操纵子或tolC(hgdD)敲除后,发现异形胞都不能形成糖脂层,经过蛋白质的相互作用,发现DevBCA和TolC组合成了一种由ATP驱动的外排泵,负责将糖脂运输到膜外。本实验室曾对鱼腥藻PCC 7120的胞外蛋白进行了研究,对比加氮和缺氮条件下胞外蛋白的差异,发现Alr0267是缺氮条件下所独有的高丰度蛋白。本研究采用单交换同源重组方法敲除alr0267基因,观察鱼腥藻PCC 7120野生型和alr0267基因敲除体细胞形态及异形胞数量的变化,并对异形胞形成相关基因all0813(hglK)、all2736、alr2887(hgdD)进行荧光定量PCR检测,以期为深入了解alr0267基因的功能提供参考。
1材料与方法
1.1材料
1.1.1菌株鱼腥藻PCC 7120(Anabaenasp. PCC 7120)、EscherichiacoliNEB 10β、EscherichiacoliHB 101[pRL623+pRL443]、EscherichiacoliNEB 10β[pZR606 (GenBank: KJ500179.1)]菌株,均由美国南达科他州立大学周阮宝教授惠赠。
1.1.2主要试剂DNA凝胶回收试剂盒,购自生工生物工程有限公司;NotⅠ、SmaⅠ限制性内切酶、高保真PCR酶(PrimeSTAR HS DNA Polymerase)、pMD18-T载体试剂盒(以下简写为“T载体”)、T4 DNA连接酶,均购自TaKaRa公司;2×TaqPCR Master Mix,购自北京康为世纪生物科技有限公司;质粒提取试剂盒、SuperReal PreMix Plus(SYBR Green)试剂盒、FastQuant RT Kit(With gDNase)试剂盒,均购自天根生化科技有限公司;柱式细菌RNAout试剂盒,购自北京天恩泽基因科技有限公司。
1.2方法
1.2.1鱼腥藻PCC 7120的培养条件使用的基础培养基为Allen-Arnon培养基[22](以下简写为AA培养基),三角瓶所装液体培养基占其注明体积的30%(如250 mL的三角瓶装75 mL培养液),培养温度(30±2) ℃,光照强度5 600 lx(连续光照),摇床转速110 r/min。后续试验的培养条件如无特殊说明,均与此条件相同。
1.2.2引物设计从蓝藻数据库(http://genome.microbedb.jp/cyanobase/Anabaena)中下载rnpB、alr0267、all0813、all2736、alr2887基因序列,采用Oligo7软件进行引物的设计,具体引物序列见表1。
1.2.3alr0267基因片段的克隆取10 μL 洗涤后的鱼腥藻PCC 7120菌液,于PCR仪中95 ℃裂解10 min。取裂解菌液8 μL,加入5×TaqBuffer 5 μL, dNTPs(2.5 mmol/L)2 μL,上、下游引物(20 μmol/L)各1 μL,无菌水8 μL,最后加入高保真Taq酶(2.5 U/μL)0.2 μL,混匀。PCR反应程序为:95 ℃ 5 min;98 ℃ 10 s,55 ℃ 5 s,72 ℃ 1 min,30个循环;72 ℃延伸15 min;10 ℃保温。用1%琼脂糖凝胶电泳检测扩增产物,并按DNA凝胶回收试剂盒说明进行目的条带的纯化回收。

表 1 研究所用PCR引物及其序列和用途
注:“gcggccgc”为NotⅠ酶切位点,“cccggg”为SmaⅠ酶切位点。
Note:“gcggccgc” isNotⅠ cutting site,“cccggg” isSmaⅠ cutting site.
1.2.4PCR扩增产物的克隆和鉴定将经纯化回收的目的条带连接到T载体上:目的条带 4.7 μL、T载体0.3 μL、Solution Ⅰ 5 μL,16 ℃连接1 h。连接产物转化至E.coliNEB 10β 感受态细胞中,取200 μL转化后的感受态细胞液涂布在含100 μg/mL 氨苄西林(Amp)的LB固体培养基上,37 ℃过夜培养。挑选单菌落于40 μL无菌水中,充分混匀,取10 μL菌液于PCR仪中95 ℃裂解10 min。取裂解菌液8 μL,加入2×TaqPCR Master Mix 12.5 μL,上、下游引物(20 μmol/L)各1 μL,无菌水2.5 μL,总体积为25 μL,混匀。PCR反应程序为:95 ℃ 5 min;95 ℃ 30 s,50 ℃ 30 s,72 ℃ 55 s,30个循环;72 ℃延伸15 min;10 ℃保温。用1%琼脂糖凝胶电泳检测扩增产物,将能够扩增出预期条带的单菌落接种于4 mL LB液体培养基(含100 μg/mL Amp)中,37 ℃、200 r/min摇菌过夜。选取2个单菌落的菌液送至测序公司进行序列测定,将测序结果与alr0267基因完全匹配的质粒命名为pHEP20,将含有pHEP20的菌株命名为E.coliNEB 10β[pHEP20]。
1.2.5敲除载体的构建和鉴定使用质粒提取试剂盒提取pZR606和pHEP20,然后用NotⅠ和SmaⅠ分别双酶切,将目的片段连接到酶切后的pZR606片段上,构建过程见图1。双酶切体系为:SmaⅠ 0.2 μL,NotⅠ 0.2 μL,10×T Buffer 1 μL,体积分数0.1% BSA 2 μL,质粒 16.5 μL,混匀,37 ℃保温3 h。1%琼脂糖凝胶电泳检测扩增产物,并按DNA凝胶回收试剂盒说明进行目的条带的纯化回收。取酶切后的alr0267片段 16.5 μL、pZR606片段 5 μL、10×T4 Ligase Buffer 2.5 μL、T4 DNA 连接酶 1 μL,16 ℃连接4 h。鉴定步骤同1.2.4,但所用的抗生素为卡那霉素(Km,50 μg/mL)。选取2个单菌落的菌液进行测序,将测序结果与alr0267基因完全匹配的质粒命名为pHEP24,将含有pHEP24的菌株命名为E.coliNEB 10β[pHEP24]。

图 1 alr0267基因敲除载体的构建
1.2.6alr0267基因的敲除将E.coliNEB 10β[pHEP24]和E.coliHB 101[pRL623+pRL443]等体积混合,37 ℃下静置培养30 min。取混合菌液3 μL点在灭过菌的硝酸纤维膜上,待晾干后,在同一位置加上2.5 μL经超声处理成单个细胞的鱼腥藻PCC 7120菌液,晾干后,再将硝酸纤维膜转移到含体积分数5% LB、无抗生素且添加氮源的AA固体培养基中,倒置,28 ℃弱光培养24 h。第2天将膜转移到含有200 μg/mL硫酸新霉素(Nm)且添加氮源的AA固体培养基中,正置,在4 800~5 600 lx(连续光照)光照强度下,28 ℃培养10 d左右。以E.coliHB 101[pRL623+pRL443]的菌液代替混合菌液作为对照,其他步骤不变。
1.2.7alr0267敲除体的纯化及PCR鉴定敲除载体进入蓝藻细胞后,与目的基因进行单交换同源重组(图2)。
光照培养10 d左右,挑出生长良好的菌落,转移到AA/8N(AA/8N培养基表示在AA培养基中添加氮源,其他成分均稀释8倍)液体培养基(含100 μg/mL Nm)中培养7 d。再用超声波打断菌丝,使其成为单个细胞,于添加氮源的AA固体培养基(含200 μg/mL Nm)中划线培养。挑出生长良好的单个菌落,通过PCR鉴定基因是否敲除完全,如不完全,继续重复上述纯化步骤直至敲除完全。PCR鉴定原理如图3所示。

图 2 敲除载体与alr0267基因的单交换同源重组
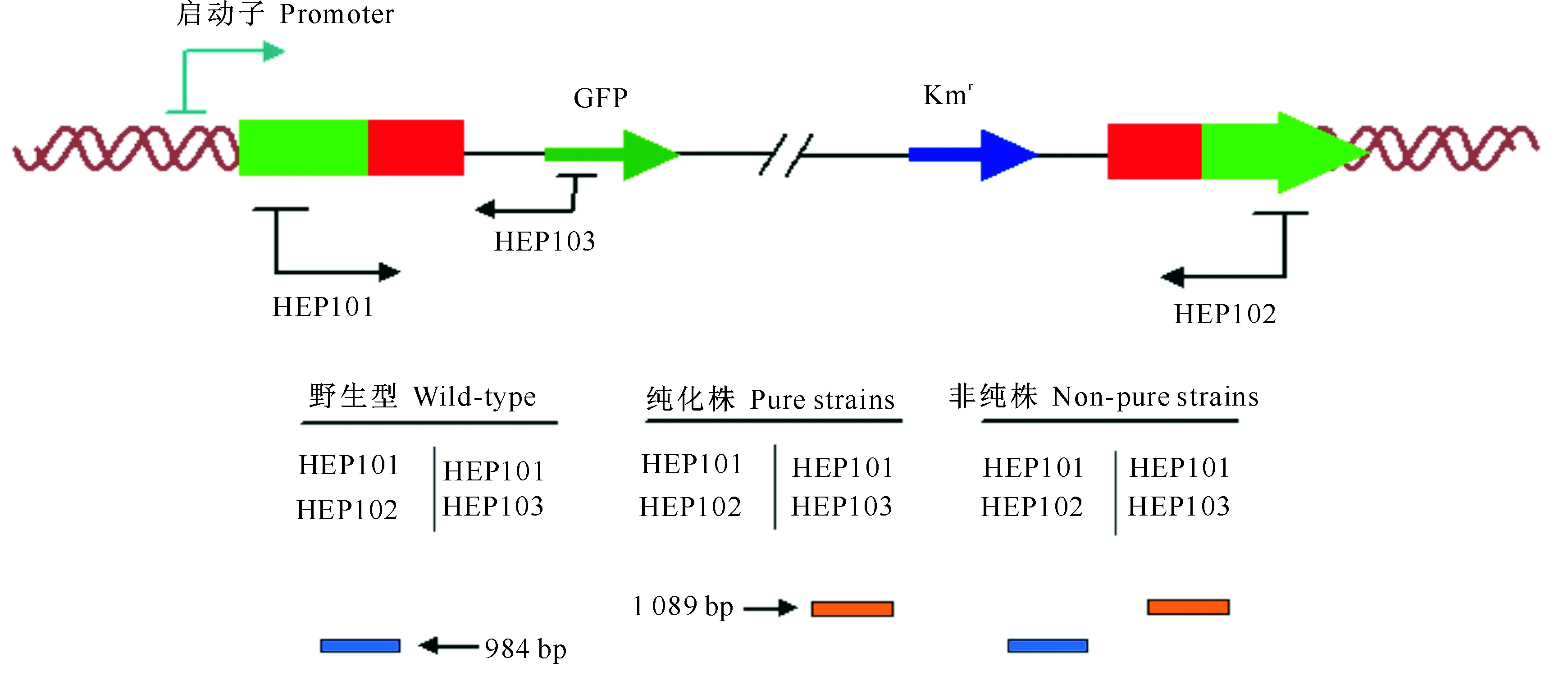
图 3鱼腥藻PCC7120alr0267基因敲除体的PCR鉴定原理示意图
引物HEP101/102 预期扩增条带大小为984 bp;引物HEP101/103 预期扩增条带大小为1 089 bp
Fig.3PCR verification ofAnabaenasp.7120alr0267 gene mutant
Expected size of the product of primer HEP101/102 is 984 bp;the product of primer HEP101/103 is 1 089 bp
在原基因非同源区重新设计PCR引物,即引物对HEP101/102,以设计好的HEP101为上游引物,在pZR606中设计对应的下游引物(HEP103),组成新的引物对HEP101/103。使用引物对HEP101/102进行PCR时,野生型和非纯株(存在一些单细胞目的基因未被敲除的蓝藻菌株)能扩增出特异性条带,而纯化株(所有单细胞的目的基因均被敲除的蓝藻菌株)却无相应条带;使用引物对HEP101/103进行PCR时,纯化株和非纯株都能扩增出特异性条带,而野生型却无相应条带。当采用2对引物同时PCR时,如果是纯化株,那么只有引物对HEP101/103能扩增出条带,如果是非纯株则2个引物对都能扩增出条带。PCR反应体系同1.2.4,PCR反应程序为:95 ℃ 5 min;95 ℃ 30 s,50 ℃ 30 s,72 ℃ 65 s,30个循环;72 ℃延伸15 min;10 ℃保温。
1.2.8alr0267基因敲除体与野生型细胞形态的观察将鱼腥藻PCC7120alr0267敲除体(以Δalr0267表示)与野生型一同置于AA/8培养基(在AA培养基不添加氮源,其他成分均稀释8倍)中培养,一共培养12 d,每隔24 h于超净台中取1 mL菌液,低速离心,去上清,用去离子水悬浮沉淀,然后用荧光显微镜观察异形胞的分化和发育,统计异形胞之间营养细胞的个数。
1.2.9基因表达的Real-time PCR检测将鱼腥藻PCC 7120野生型与Δalr0267分别置于加氮与缺氮培养基中培养,培养时间为0,3,8,24 h和10 d。使用柱式细菌RNAout试剂盒提取蓝藻RNA,用FastQuant RT Kit(With gDNase)试剂盒进行cDNA的合成,SuperReal PreMix Plus(SYBR Green)试剂盒进行all0813、all2736、alr2887基因实时荧光定量分析,每个样品均重复检测3次。取已稀释10倍的cDNA模板1 μL,加入RNase-free ddH2O 9 μL,正、反向引物(20 μmol/L)各0.3 μL,2×Supper Real PreMix Plus 10 μL,混匀。PCR反应程序为:95 ℃ 15 min;95 ℃ 10 s,55 ℃ 20 s,72 ℃ 15 s,50个循环;溶解曲线分析条件:起始温度62 ℃,终止温度95 ℃, 升温率为0.5 ℃/5 s。本研究以rnpB[23]为内参基因,采用2-ΔΔCt法分析缺氮培养
条件下样品中的目的基因相对于加氮条件下的表达量。
1.3数据处理
使用SPSS软件对试验数据进行t检验。
2结果与分析
2.1alr0267基因部分片段的克隆
采用引物HEP43/44进行PCR扩增,扩增出的条带大小为750~1 000 bp,与预期大小(834 bp)相符(图4)。

图 4 鱼腥藻PCC 7120 alr0267基因
2.2alr0267克隆片段及其敲除载体的鉴定
将连接到T载体的转化子进行菌落PCR检测,结果(图5)显示,所挑取的10个单菌落都扩增出了预期条带(834 bp);选取2个扩增出预期条带的转化子进行测序,发现测序结果与alr0267基因的比对结果完全匹配(文中未列出)。将连接到pZR606的转化子进行菌落PCR检测,结果(图6)显示,所挑取的6个单菌落都扩增出了预期条带(834 bp);选取2个扩增出预期条带的转化子进行测序,发现测序结果与alr0267基因的比对结果也完全匹配(文中未列出)。
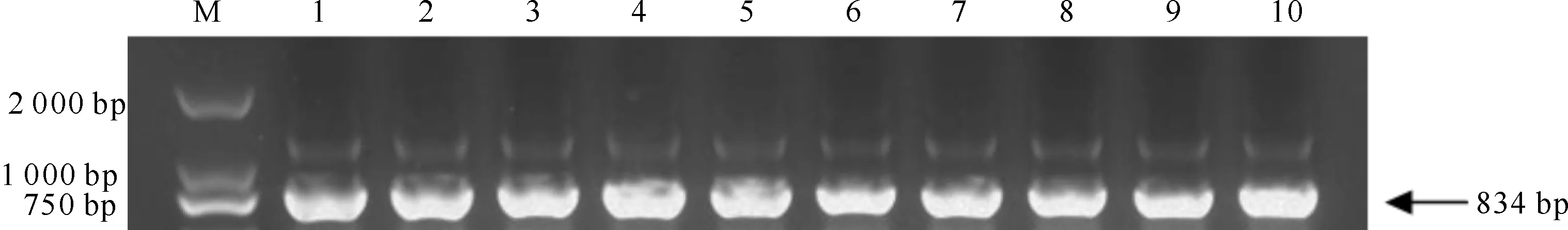
图 5鱼腥藻PCC 7120alr0267基因连接T载体后的PCR检测
M.DNA Marker;1~10.连接到T载体后的转化子, 预期条带大小为834 bp
Fig.5PCR detection of T vector clone ofAnabaenasp.7120alr0267 gene
M.DNA Marker;1-10.Transformants,the product of PCR was 834 bp
2.3alr0267敲除体的纯化及PCR鉴定
将经转化处理的鱼腥藻PCC 7120置于添加氮源的AA固体培养基(含100 μg/mL Nm)中培养15 d后,对照组未见蓝藻菌斑,而试验组有蓝藻菌斑形成,表明敲除载体已整合到蓝藻细胞的基因组中,使其获得了抗性(图7)。纯化3次后,经PCR鉴定(图8)发现,野生型采用引物HEP101/102能扩增出预期的条带,而采用引物HEP101/103却不能扩增出预期的条带;敲除体采用引物HEP101/102不能扩增出预期的条带,而采用引物HEP101/103却能扩增出预期的条带。综上可知,alr0267基因已被敲除且敲除体已纯化。
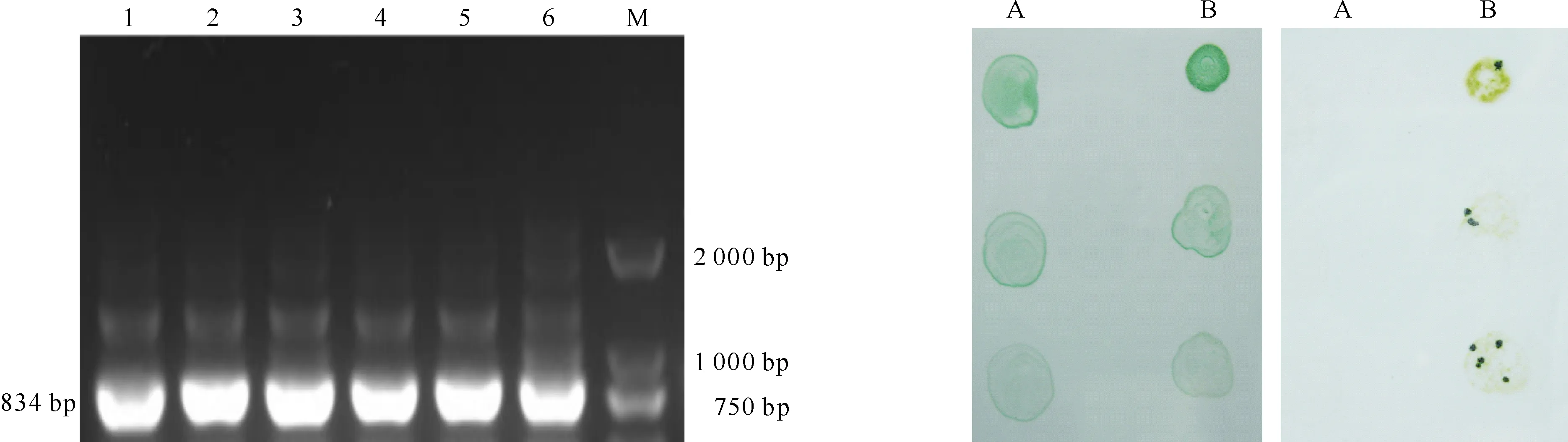
图 6鱼腥藻PCC 7120alr0267基因
敲除载体的PCR检测
M.DNA Marker;1~6.连接pZR606的转化子,
预期条带大小为834 bp
Fig.6PCR detection of knockout vector of
Anabaenasp.7120alr0267 gene
M.DNA Marker;1-6.Transformants,
the product of PCR was 834 bp
图 7alr0267基因的敲除
A为对照组,B为试验组;左图为培养起始阶段,
右图为培养15 d后;从上至下顶部为稀释2倍的蓝藻菌液,
中部为稀释4倍的蓝藻菌液,底部为稀释8倍的蓝藻菌液
Fig.7Inactivation ofalr0267 gene
A.Control,B.Experiment group;Left.Initial training phase,Right.
After 15 days;The top of picture was diluted by two times,the
middle of picture was diluted by four times,and the bottom of
picture was diluted by eight times
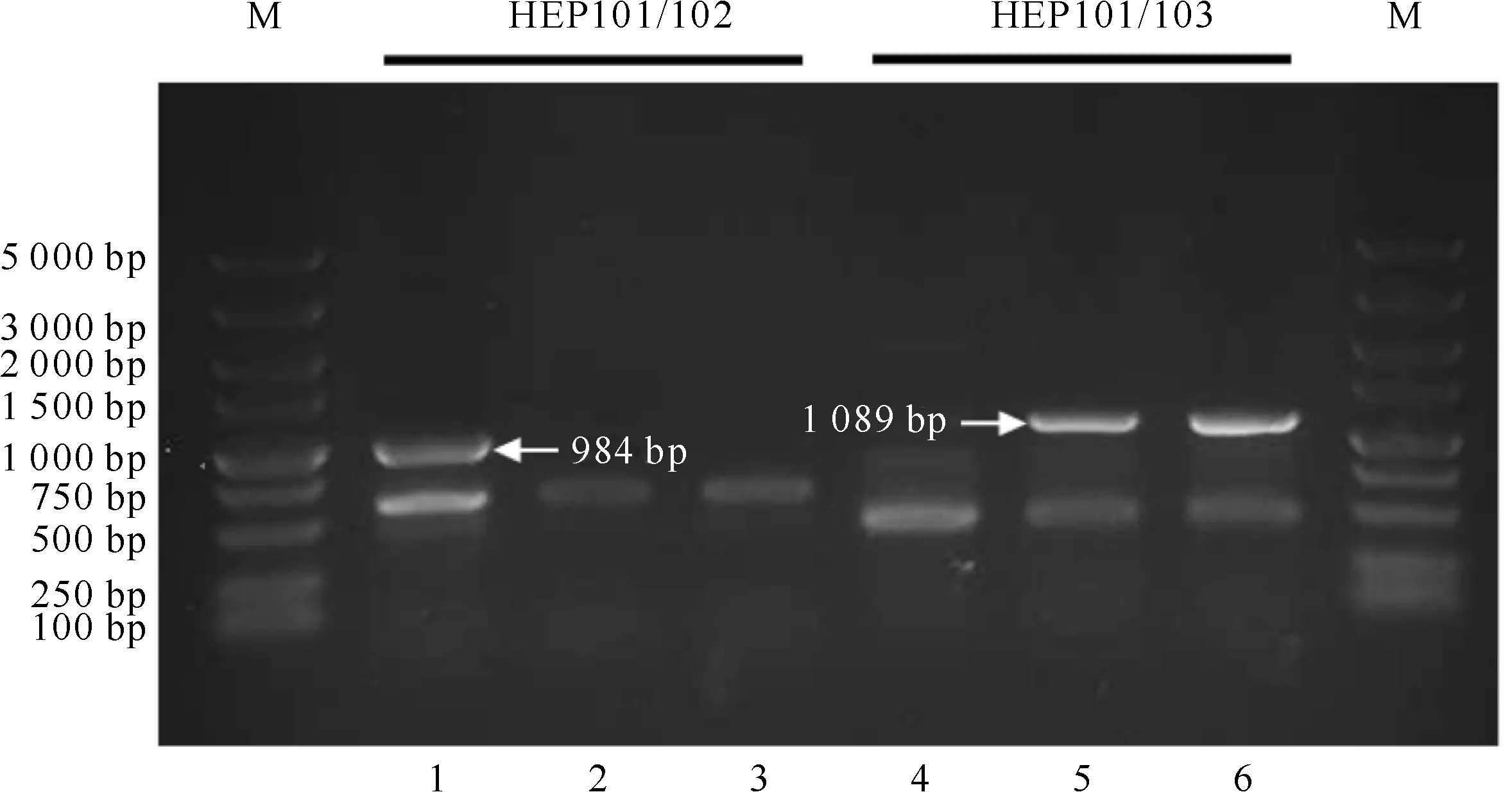
图 8鱼腥藻PCC 7120 Δalr0267的PCR鉴定
M.DNA Marker;1、4.野生型;2、5.敲除体Ⅰ;3、6.敲除体Ⅱ
Fig.8PCR verification of mutant of Δalr0267
M.DNA Marker;1,4.Wild-type;2,5.MutantⅠ; 3,6.Mutant Ⅱ
2.4alr0267基因敲除体与野生型异形胞的观测
鱼腥藻PCC 7120的营养细胞需要进行光合作用,而藻胆蛋白在蓝藻中主要承担着光的吸收,在蓝色激发光下能发出红色荧光[9]。成熟异形胞的主要功能是固氮,而氧气能抑制固氮酶的活性[9],故在成熟的异形胞中藻胆蛋白的量很少,成熟异形胞在蓝色激发光下所发出的红色荧光很弱甚至观察不到。在缺氮条件下,蓝藻细胞会降解已有的藻胆蛋白来补充氮源[9],这会导致营养细胞藻胆蛋白含量下降,所发的红色荧光将会减弱。从图9可见,在缺氮条件下培养24 h后,野生型鱼腥藻PCC 7120的异形胞开始成熟;野生型与Δalr0267的营养细胞所发的红色荧光有弱有强,很不均匀,且野生型的异形胞为椭圆形,而Δalr0267的则近似为圆形;野生型的营养细胞比Δalr0267的大,Δalr0267的营养细胞较为短小。缺氮培养48 h后,野生型和Δalr0267异形胞的形态趋于相同。

图 9鱼腥藻PCC 7120野生型与Δalr0267缺氮培养后的细胞形态观察
a、b为野生型;c、d为Δalr0267;a、c在缺氮条件下培养;b、d在蓝光下激发;
字母后的数字表示培养时间(d);箭头所指为异形胞;标尺为10 μm
Fig.9Cell morphology of wild-type and Δalr0267 in nitrogen-absent medium
a and b are wild type,c and d are Δalr0267;a and c are cultured in nitrogen-absent medium,b and d emit red fluorescence under blue
excitation light;The numbers after the letters indicate the culturing days;Arrows indicate heterocyst;The scale bar is 10 μm
对鱼腥藻PCC 7120野生型和Δalr0267异形胞之间营养细胞数的均值进行t检验,结果表明,在培养的1~4 d,二者的差异达极显著水平(P<0.001);5 d时P=0.136,差异不显著;6~12 d时二者具有极显著差异(P<0.001)。由表2可知,鱼腥藻PCC 7120野生型和Δalr0267在缺氮条件下培养1~4 d,两者异形胞之间营养细胞数的均值差异虽然达到极显著水平,但均值不稳定;5 d后,营养细胞数均值的差异越来越明显且很稳定,野生型的均值始终大于Δalr0267。且培养5 d后,Δalr0267异形胞之间营养细胞数的均值增加缓慢,而野生型却还在不断增加。
上述结果表明,alr0267基因的敲除影响了异形胞的正常发育。
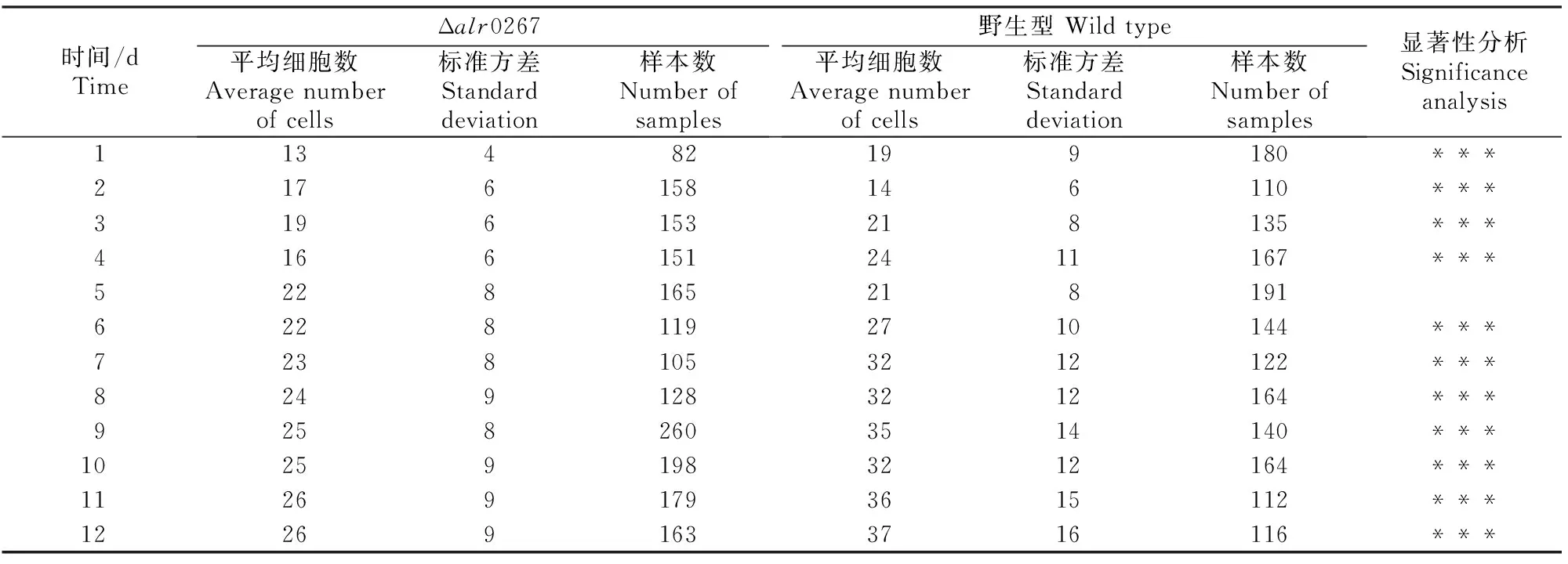
表 2 鱼腥藻PCC 7120野生型与Δalr0267异形胞之间营养细胞数的比较
注:表中标准方差为平均细胞数的标准方差, 样本数为以异形胞为端点的蓝藻菌丝段数;***表示P<0.001。
Note:The standard deviation refers to the average number of cells.The number of samples are the number of cyanobacteria segments between the heterocysts;*** meansP<0.001.
2.5all0813、all2736、alr2887基因表达的检测
鱼腥藻PCC 7120野生型和Δalr0267在培养0,3,8,24 h和10 d时,all0813、all2736、alr2887基因mRNA表达的Real-time PCR检测结果见图10。
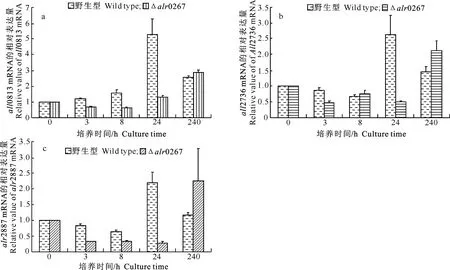
图 10鱼腥藻PCC 7120野生型与Δalr0267中all0813、all2736、alr2887基因表达的实时定量分析
Fig.10 Real-time quantitative analysis of geneall0813,all2736,andalr2887 of
wild-type and Δalr0267 ofAnabaenasp.PCC 7120
由图10-a可见,鱼腥藻PCC 7120野生型的all0813基因相对表达量于培养3 h开始上升,24 h达到最大;Δalr0267在培养3,8和24 h的相对表达量逐步上升,但均维持在较低水平,于培养10 d时达到最大值;24 h时二者all0813基因相对表达量的差值达到最大,且Δalr0267的相对表达量极显著低于野生型(P<0.01)。
鱼腥藻PCC 7120all2736基因和alr2887基因的相对表达量变化相似(图10-b,c),在野生型中均以培养3,8 h时相对表达量较低,于培养24 h达到最大值。在Δalr0267中,培养3,8和24 h的相对表达量基本没有变化,且均维持在较低水平,于培养10 d达到最大值;但二者培养24 h时相对表达量的差值最大,且Δalr0267的相对表达量极显著低于野生型(P<0.01)。
综上所述,all0813、all2736、alr2887在PCC 7120野生型中的最大相对表达量都出现在培养24 h,而此时Δalr0267中的相对表达量均维持在较低水平,最大相对表达量出现时间明显推后,表明alr0267的敲除影响了all0813、all2736、alr2887的正常表达。
3讨论与结论
Ehira等[11]分析了缺氮条件下鱼腥藻PCC 7120基因组的表达情况,将缺氮培养24 h内基因的表达分为三大类,即3,8 和24 h表达簇,他发现在缺氮条件下培养24 h时,与异形胞糖脂层形成有关的基因hglE、hglD、hglC出现高表达。all0813、all2736、alr2887基因与异形胞糖脂层形成相关[17-20],其中alr2887(HgdD)作为一种外排泵,参与次生代谢产物的外排以及蓝藻抗药性的形成[24],并参与alr0267的分泌[25]。在缺氮培养条件下,鱼腥藻PCC 7120野生型的all0813、all2736、alr2887基因均在培养24 h时达到最大值,表明其均属于24 h表达簇。而在Δalr0267中,由于alr0267被敲除,all0813、all2736和alr2887最大相对表达量出现时间明显延迟。Paulo等[26]发现,alr0267的突变体不能形成正常的糖脂层,故当alr0267被敲除时,糖脂层的构建受阻,从而阻遏了与糖脂层形成相关基因all0813(hglK)、all2736和alr2887(hgdD)的正常转录与翻译。
本研究结果表明,缺氮培养6~12 d,异形胞在敲除体中出现的频率明显高于野生型。对alr0267基因序列进行分析发现,在alr0267起始密码子上游58位点处存在与NtcA结合的位点TGTN9ACA[27],而NtcA是异形胞形成的主要调节因子[3]。alr0267基因的敲除可能增强了NtcA的调节能力,使异形胞出现频率增加。可见alr0267能影响鱼腥藻PCC 7120异形胞的形成频率,且将其敲除后会影响异形胞的正常发育。
[参考文献]
[1]Li J H,Laurent S,Konde V,et al.An increase in the level of 2-oxoglutarate promotes heterocyst development in the cyanobacteriumAnabaenasp.strain PCC 7120 [J].Microbiology,2003,149(11):3257-3263.
[2]Laurent S,Chen H,Bédu S,et al.Non metabolizable analogue of 2-oxoglutarate elicits heterocyst differentiation under repressive conditions inAnabaenasp.PCC 7120 [J].Proceedings of the National Academy of Sciences,2005,102(28):9907-9912.
[3]Herrero A,Muro-Pastor A M,Flores E.Nitrogen control in cyanobacteria [J].Journal of Bacteriology,2001,183(2):411-425.
[4]Vázquez-Bermúdez M F,Herrero A,Flores E.2-Oxoglutarate increases the binding affinity of the NtcA (nitrogen control) transcription factor for theSynechococcusglnA promoter [J].FEBS Letters,2002,512(1):71-74.
[5]Zhou R,Wei X,Jiang N,et al.Evidence that HetR protein is an unusual serine-type protease [J].Proceedings of the National Academy of Sciences,1998,95(9):4959-4963.
[6]Huang X,Dong Y,Zhao J.HetR homodimer is a DNA-binding protein required for heterocyst differentiation,and the DNA-binding activity is inhibited by PatS [J].Proceedings of the National Academy of Sciences,2004,101(14):4848-4853.
[7]Buikema W J,Haselkorn R.Characterization of a gene controlling heterocyst differentiation in the cyanobacteriumAnabaena7120 [J].Genes & Development,1991,5(2):321-330.
[8]Buikema W J,Haselkorn R.Expression of theAnabaenahetRgene from a copper-regulated promoter leads to heterocyst differentiation under repressing conditions [J].Proceedings of the National Academy of Sciences,2001,98(5):2729-2734.
[9]Bryant D A.The molecular biology of cyanobacteria [M].Dordrecht:Kluwer Academic Publishers,1994:139-216,769-823.
[10]Bauer C C,Ramaswamy K S,Endley S,et al.Suppression of heterocyst differentiation inAnabaenaPCC 7120 by a cosmid carrying wild-type genes encoding enzymes for fatty acid synthesis [J].FEMS Microbiology Letters,1997,151(1):23-30.
[11]Ehira S,Ohmori M,Sato N.Genome-wide expression analysis of the responses to nitrogen deprivation in the heterocyst-forming cyanobacteriumAnabaenasp.strain PCC 7120 [J].DNA Research,2003,10(3):97-113.
[12]Fan Q,Huang G,Lechno Yossef S,et al.Clustered genes required for synthesis and deposition of envelope glycolipids inAnabaenasp.strain PCC 7120 [J].Molecular Microbiology,2005,58(1):227-243.
[13]Fiedler G,Arnold M,Hannus S,et al.The DevBCA exporter is essential for envelope formation in heterocysts of the cyanobacteriumAnabaenasp.strain PCC 7120 [J].Molecular Microbiology,1998,27(6):1193-1202.
[14]Genevrois S,Steeghs L,Roholl P,et al.The Omp85 protein ofNeisseriameningitidisis required for lipid export to the outer membrane [J].The EMBO Journal,2003,22(8):1780-1789.
[15]Andersen C,Hughes C,Koronakis V.Chunnel vision [J].EMBO Reports,2000,1(4):313-318.
[16]Moslavac S,Bredemeier R,Mirus O,et al.Proteomic analysis of the outer membrane ofAnabaenasp.strain PCC 7120 [J].Journal of Proteome Research,2005,4(4):1330-1338.
[17]Moslavac S,Nicolaisen K,Mirus O,et al.A TolC-like protein is required for heterocyst development inAnabaenasp.strain PCC 7120 [J].Journal of Bacteriology,2007,189(21):7887-7895.
[18]Moslavac S.Outer membrane proteins ofAnabaenasp.strain PCC 7120 [D].München:Ludwig-Maximilians-Universität,2007.
[19]Moslavac S,Reisinger V,Berg M,et al.The proteome of the heterocyst cell wall inAnabaenasp.PCC 7120 [J].Biological Chemistry,2007,388(8):823-830.
[20]Black K,Buikema W J,Haselkorn R.ThehglKgene is required for localization of heterocyst-specific glycolipids in the cyanobacteriumAnabaenasp.strain PCC 7120 [J].Journal of Bacteriology,1995,177(22):6440-6448.
[21]Staron P,Forchhammer K,Maldener I.Novel ATP-driven pat-hway of glycolipid export involving TolC protein [J].Journal of Biological Chemistry,2011,286(44):38202-38210.
[22]Allen M B,Arnon D I.Studies on nitrogen-fixing blue-green algae:Ⅱ.The sodium requirement ofAnabaenacylindrical [J].Physiologia Plantarum,1955,8(3):653-660.
[23]Nicolaisen K,Moslavac S,Samborski A,et al.Valdebenito M Alr0397 is an outer membrane transporter for the siderophore schizokinen inAnabaenasp.strain PCC 7120 [J].Journal of Bacteriology,2008,190(22):7500-7507.
[24]Hahn A,Stevanovic M,Mirus O,et al.The TolC-like protein HgdD of the cyanobacteriumAnabaenasp.PCC 7120 is involved in secondary metabolite export and antibiotic resistance [J].J Biol Chem,2012,287:41126-41138.
[25]Hahn A,Stevanovic M,Brouwer E,et al.Secretome analysis ofAnabaenasp.PCC 7120 and the involvement of the TolC-homologue HgdD in protein secretion [J].Environmental Microbiology,2015,17(3):767-780.
[26]Paulo O,Filipe P,Catarina C,et al.HesF,an exoprotein required for filament adhesion and aggregation inAnabaenasp.PCC 7120 [J].Environmental Microbiology,2015,17(5):1631-1648.
[27]Jiang F,Wisén S,Widersten M,et al.Examination of the transcription factor NtcA-binding motif byinvitroselection of DNA sequences from a random library [J].Journal of Molecular Biology,2000,301(4):783-793.
Inactivation and functions of genealr0267 in cyanobacteriumAnabaenasp.PCC 7120
CAO Bi-pua,FU Xue-linb,CAI Xiao-dana,HE Pinga
(aGuangdongProvincialKeyLaboratoryofProteinFunctionandRegulationinAgriculturalOrganisms,CollegeofLifeSciences,bCollegeofAgriculture,SouthChinaAgriculturalUniversity,Guangzhou,Guangdong510642,China)
Abstract:【Objective】 The gene alr0267 was knocked out in Anabaena sp.PCC 7120 and its function was studied preliminarily.【Method】 The fragment of alr0267 gene of Anabaena sp.PCC 7120 was cloned and knock-out vector was constructed.The alr0267 gene was inactivated by single-crossover homologous integration.The mutant of alr0267 gene was purified and identified by PCR.Then,the morphology of nitrogen-fixing heterocyst from both the mutant and wild-type was observed and counted.The relative expression of related genes all0813,all2736 and alr2887 in wild-type and the mutant were measured at different incubation times (0,3,8,24 h and 10 d) using real-time PCR.【Result】 The alr0267 gene of Anabaena sp.PCC 7120 was inactivated successfully.After 6-12 days nitrogen-absent culturing,the average number of vegetative cells in heterocysts of mutant was significantly less than that in wild-type.The maximum relative expressions of all0813,all2736,and alr2887 in the wild-type were detected by real-time PCR 24 h after nitrogen-absent culturing while the time was delayed in the mutant.【Conclusion】 The inactivation of alr0267 gene increased the frequency of heterocyst and affected the development of heterocyst.
Key words:Anabaena sp.PCC 7120;alr0267 gene;heterocyst;single-crossover homologus integration;real-time PCR
DOI:网络出版时间:2016-05-0314:0510.13207/j.cnki.jnwafu.2016.06.022
[收稿日期]2014-10-24
[基金项目]广东省自然科学基金项目(S2013010013184);公益性行业(农业)科研专项(201003021);国家自然科学基金项目 (50977041)
[作者简介]曹必溥(1988-),男,湖南泸溪人,硕士,主要从事蛋白质、酶学与酶工程研究。E-mail:caobipu@163.com E-mail:phe@scau.edu.cn
[通信作者]何平(1967-),男,安徽枞阳人,副教授,博士,硕士生导师,主要从事蛋白质、酶学与酶工程研究。
[中图分类号]Q943.2
[文献标志码]A
[文章编号]1671-9387(2016)06-0157-10
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160503.1405.044.html

