文蛤早期发育阶段生长性状遗传参数的估计
梁冰冰,王鸿霞
Received: Feb.25,2015Key words: Meretrix meretrix; growth traits; animal model; genetic parameterAbstract: This study investigates the genetic parameters affecting the growth traits of Meretrix meretrix in the early stages of life-history.Twenty three full-sib families were produced using the part factorial design,and effects were estimated using the single trait and two trait animal models.The results showed that,regarding the shell length heritabilities and shell height heritabilities,there were no significant differences between metamorphosis and juvenile stages.The estimated heritabilities were arranged from 0.11 to 0.41,at a medium level.However,the common environment effects increased as the age of Meretrix meretrix increased(from 0.02 to 0.38),and the common environment effects at the juvenile stage were significantly higher than those observed at the settlement and metamorphosis stages(P<0.01).From the metamorphosis stage to the juvenile stage,significantly positive phenotypic and genetic correlations were shown between the shell length and shell height,the correlation coefficients were 0.84~0.95 and 0.84~0.99,respectively.While the genetic correlations of the shell length between different development periods were positive,they were not significant and the correlation coefficients were different between each developmental period(0.34~0.71).
文蛤早期发育阶段生长性状遗传参数的估计
梁冰冰1,2,王鸿霞1
(1.中国科学院 海洋研究所 实验海洋生物学重点实验室,山东 青岛 266071; 2.中国科学院大学,北京100049)
摘要:采用部分因子设计构建了 23个全同胞家系,应用单性状及两性状动物模型对文蛤(Meretrix meretrix)早期不同生长发育时期的生长性状进行遗传力和相关性估计。结果表明,文蛤附着变态期以及稚贝期生长性状的遗传力并无显著差别,在0.11~0.41范围内变化,属于中等遗传力。非遗传的共同环境效应随着年龄的增长而呈现上升趋势,由附着变态期的0.02逐渐增加到稚贝期的 0.38,且稚贝期的共同环境效应显著大于其附着变态期(P<0.01)。壳长与壳高表型相关和遗传相关的分析结果显示,从附着变态期到稚贝期,壳长与壳高之间的表型相关及遗传相关都存在极显著的正相关性,相关系数的范围分别为0.84~0.95、0.93~0.99。早期发育连续时间段生长性状之间的遗传相关均为正相关,但并不显著,且不同时期的遗传相关也不尽相同(0.34~0.71)。
关键词:文蛤(Meretrix meretrix); 生长性状; 动物模型; 遗传参数
[Foundation: the National High Technology Research and Development Program(863 program)of China,No.2012AA10A410; the Zhejiang science and technology project of agricultural breeding,No.2012C12907-4]
经济物种重要经济性状的数量遗传学研究无论在发育生态学还是在实际育种领域都有重要的意义。文蛤(Meretrix meretrix)是我国重要的滩涂经济贝类之一[1],多年来对其重要的经济性状已经开展了一系列的遗传选育工作[1-5],但对其早期不同生长阶段的遗传效应还缺乏系统的研究。
对于文蛤等滩涂贝类来说,它们在幼虫期经历了一系列复杂的形态学变化: 受精之后,在26~28℃海水中胚胎经历快速发育,12 h后形成具有游泳能力但无法进食的担轮幼虫。随后12 h逐渐形成进食器官、壳腺,进而发育成具有进食能力、可自由游泳的面盘幼虫。面盘幼虫期持续4~8 d后进入变态阶段,包括面盘退化,鳃、足及双水管的形成等一系列复杂的形态变化。变态过程持续 10~15 d,发育成稚贝,建立终生底栖的生活方式。
在幼虫附着变态这一形态建成的过程中涉及大量基因表达调控的变化,且不同时期基因的表达在质量和数量上有显著的不同[6],因而有可能导致不同时期的遗传变异存在差异。Bonar等[7]从生态和生理水平探讨了牡蛎幼虫附着变态机理,认为外界适宜环境刺激幼虫后,会引起多巴胺或肾上腺素等激素的上调,从而激活变态过程的发生。Wang等[8]对文蛤组织蛋白酶 B蛋白水平的分析表明,组织蛋白酶 B在胚胎发育及变态早期均有显著的上调,认为其不仅参与幼虫能量来源的途径,而且在胚胎发育以及变态早期过程中具有一定的功能。附着变态过程是从幼虫向成体转变的一个重要发育阶段。附着变态的成功与否将决定苗种生产的成败。因此,开展文蛤幼虫附着变态期间的生长遗传效应的研究无论对幼虫生长发育的基础理论还是苗种繁育的应用实践都具有重要的意义。
在双壳贝类中,对于不同时期生长性状遗传参数的估计已有诸多报道,如 Ernande等[9]对长牡蛎(Crassostrea gigas)早期生长、变态发育及存活等不同性状进行研究,发现浮游幼虫期的存活率、变态率以及附着时的壳长都有很大程度的遗传效应,其中幼虫期生长率的遗传力属于中等水平(0.24),而稚贝期生长率的遗传力则较低(0.05)。但Strömgren等[10]对紫贻贝(Mytilus edulis)幼虫期(14 d,28 d)及稚贝期(4.5个月及13个月)壳长的遗传力进行分析,均得出较高的遗传力。对于文蛤,仅有Wang等[2]采用了贝叶斯抽样的方法估计了6月龄及12月龄文蛤生长性状的遗传参数,而对于浮游幼虫期、附着变态期的遗传参数估计尚未见报道。因此,本研究对部分因子设计产生的23个全同胞家系的生长数据进行跟踪测量,并采用两种个体动物模型对发育不同时期的文蛤进行遗传参数的估计,探究早期不同发育阶段的遗传变异,旨在从遗传的角度揭示文蛤附着变态和稚贝期的生长发育规律。
1 材料与方法
1.1家系的建立与培育
2014年7月8日,在浙江省水产养殖海洋研究所清江基地采用部分因子设计(Berg and Henryon design,BH设计)[11],利用11个父本与11个母本,构建了 23个全同胞家系。每个父本与两个母本交配:父本1#与母本1#和2#交配; 父本2#与母本2#和3#交配,以此类推。用于构建家系的亲贝来源于选育群体,分别从细纹、黑色、红色三种壳色的品系中选择。亲贝阴干放置 4~8 h后,清洗体表并单独放置于含800 mL海水的烧杯中催产采集精卵。精卵按适当比例受精后,放置于70 L的培养桶中孵化。受精和养殖过程中家系之间避免交叉污染,并确保家系间的环境一致,如水温、盐度及饵料投喂量等。受精第3天,浮游幼虫出现眼点和足,此时桶底铺沙,幼苗进入附着变态期。当幼虫出现双水管时,开始进入稚贝生长阶段,对稚贝进行分苗,每个家系密度一致,分别放置于 23 个400 cm×100 cm×50 cm的小池内,并将23个小池同放于大水泥池中(7 m×4 m),以减小环境差异。
1.2数据收集和整理
受精卵孵化3 d后进入变态期。附着变态期间(受精后第4天至受精后第17天)依次间隔1、2、5 d取样,样品用碘液固定后置于显微镜下测量壳长(shell length,SL)和壳高(shell height,SH)(精确度0.01 µm),每个家系测量30个个体; 稚贝期(受精后第22天至受精后第140天)大约每1个月采样1次,对每个家系 30~50个个体的壳长和壳高生长数据进行测量。测量的数据及系谱信息在Excel中整理,并对异常值进行检查。
1.3数据统计分析
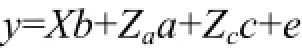
壳长和壳高两个性状遗传参数的估计采用ASReml(3.0)软件的单性状和两性状个体动物模型进行估计:其中,y表示不同性状的观测值,b表示固定效应的向量,a表示个体动物加性遗传效应向量,c表示不同家系的共同环境效应向量。X,Za以及Zc表示相应向量的关系矩阵,e表示残差方差。
生长性状遗传力的估计采用单性状动物模型,遗传力计算公式为:; 两个性状间的表型相关及遗传相关的估计采用两性状动物模
特定生长率(SGR)=100×(ln(S2)-ln(S1))/(Δt)其中S1和S2分别表示在时间1和时间2文蛤生长性状的测量值,Δt表示时间1和时间2之间的天数之差。
2 结果
2.1文蛤早期发育阶段生长性状的变化趋势
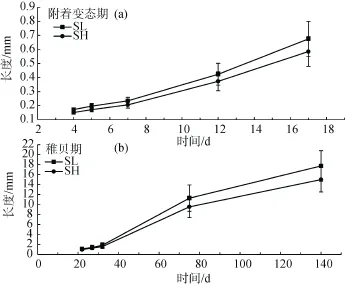
文蛤早期发育阶段生长性状整体呈现稳步增长的趋势(图1)。在附着变态期间,23个家系壳长与壳高的平均值分别由164.22 µm±10.00 µm和141.92 µm± 9.38 µm增长到675.12 µm±10.00 µm和585.36 µm± 10.58 µm,壳长与壳高的特定生长率分别为 10.48%/d,10.41%/d。经过123 d稚贝期的生长,壳长和壳高分别达到17.73 mm±3.07 mm和15.00 mm± 2.48 mm,特定生长率分别为(2.32±0.09)%/d,(2.29± 0.09)%/d。以上数据表明,文蛤幼体在稚贝期进入了一个快速生长的阶段,同时个体生长性状的变异系数(CV)逐渐增大,以壳长为例,受精后第4天的CV值为7.14%,而到了受精后第75天 CV值达到了23.49%,意味着个体间生长差异逐渐增大。
对不同家系间生长性状的差异比较,发现在每个测量时间点,壳长和壳高在不同家系之间均存在显著差异(P<0.01)。附着变态初期(受精后第4天)家系间生长性状已经表现出一定的差异显著性,例如58号家系所在的集群生长性状表型值显著大于47、41、63、46和50号家系。而个体生长性状平均值最高的58号家系比生长性状平均值最小的 47号家系在壳长和壳高上分别大15.24%和16.01%。生长至稚贝初期(受精后第22天)家系间生长状态进一步分化,49号家系成为壳长和壳高的平均值最高的家系,它除了与56、51、47、50号家系的生长性状无显著差异外,生长表型明显高于其他家系。对受精后140 d不同家系间生长性状的差异比较发现,前期生长表型处于中等水平的45、52号家系此时与之前生长表现较优的49、50、56家系处于同一集群,表现出较好的生长性能。
2.2早期生长性状遗传参数的估计
文蛤早期发育阶段不同时期各生长性状的遗传力和共同环境效应(c2)如图2所示。从图中可以看出,附着变态期和稚贝期生长性状的遗传力变化平缓,并没有出现升高或降低的趋势,统计表明各时间点之间的遗传力并无显著差异(P>0.2)。附着变态期间壳长的遗传力在 0.11±0.19(受精后第 5天)和0.33±0.38(受精后第 17天)之间波动,而稚贝期壳长遗传力则在 0.23±0.33~0.41±0.42之间变化。壳高与壳长遗传力的结果相似,变态期及稚贝期壳高的遗传力分别在(0.11±0.08)~(0.34±0.14)和(0.26±0.06)~(0.41± 0.34)之间波动。与遗传力在各阶段表现稳定的趋势不同,在变态期第 1天共同环境效应的值较低,仅0.02左右,但随着时间的推移,环境效应逐渐增大至0.38。统计分析表明,壳长与壳高在稚贝期的共同环境效应显著大于其附着变态期(P<0.01)。
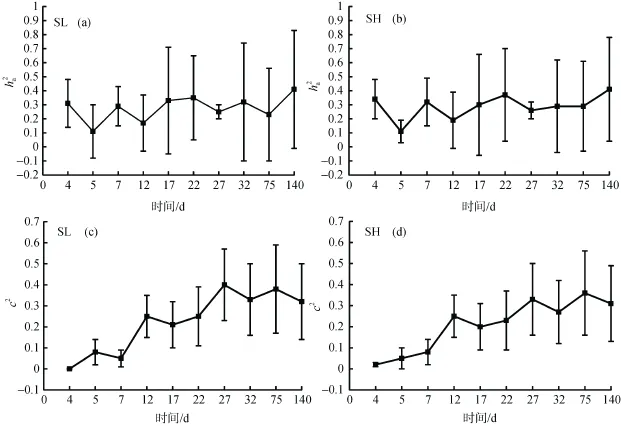
图2 文蛤早期生长不同时期壳长和壳高的遗传力(ha2)和共同环境效应(c2)的变化Fig.2 Heritabilities(ha2)and common environment effect sizes(c2)of shell length and shell height at different stages in the early life-history of Meretrix meretrix
2.3早期生长性状相关性分析
对文蛤早期生长性状壳长与壳高之间的表型相关和遗传相关进行分析,结果显示,从附着变态期到稚贝期,壳长与壳高间的表型相关及遗传相关都存在极显著的正相关性(表1)。附着变态期壳长与壳高的表型相关性略高于稚贝期,而随着时间的增加,二者的表型相关有降低的趋势,由受精后第 4天(DPF4)的 0.94降低到受精后第 140天(DPF140)的0.84。而遗传相关从变态期到稚贝期则一直呈现出强烈的正相关性,维持在 0.93以上。对文蛤在早期发育阶段连续时间生长性状的遗传相关进行分析,结果表明,在附着变态期及稚贝期连续发育时期内,壳长的生长连续性具有遗传相关性,但相关性并不显著。附着变态期壳长在相邻时间点的相关系数为0.51~0.67,而稚贝期壳长相邻时间点的相关系数则从0.71降低到0.34(表2)。

表1 文蛤早期生长不同时间壳长与壳高的表型相关(rP)及遗传相关性(rG)Tab.1 Phenotypic(rP)and genetic correlations(rG)between shell length and shell height at different stages in the early life-history of Meretrix meretrix
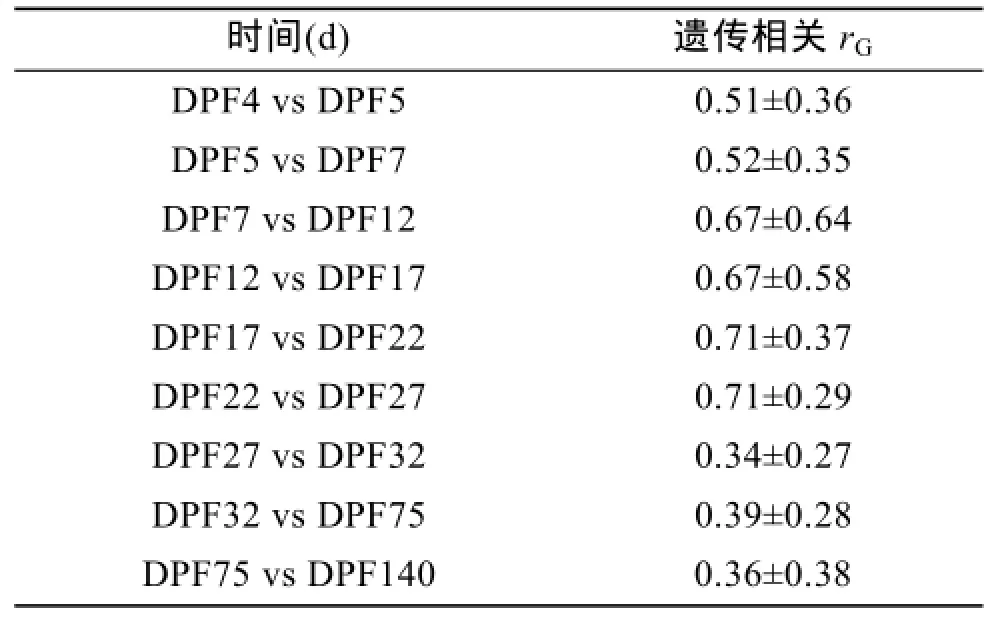
表2 文蛤壳长在连续发育时期之间的遗传相关性(rG)Tab.2 Genetic correlations(rG)of shell length between sequential development stages of Meretrix meretrix
3 讨论
本研究对部分因子设计(BH设计)产生的 23个文蛤全同胞家系早期发育生长性状的遗传参数进行了估计。由于目前用于水产贝类遗传参数估计的家系材料多采用巢式设计,与因子设计相比,巢式设计提供的信息量较少,很难将非遗传效应如母性效应、显性效应等部分效应与加性效应区分开,容易造成加性效应方法组分的过高估计[11-12]。本研究采用的部分因子设计不仅可以对非加性遗传效应进行分析,且在育种实践中可实现遗传多样性的最大化[11]。本研究分析结果表明,文蛤附着变态期以及稚贝期生长性状的遗传力无显著差别,在附着变态期壳长和壳高的遗传力为 0.11~0.34; 稚贝期的遗传力为0.23~0.41,均处于中等遗传力的水平,说明早期幼虫个体间的生长差异仍有一部分受环境因子的作用。在其他双壳贝类中,对于不同时期的遗传力的研究也有诸多报道。例如,Yan等[13]通过巢式设计,对菲律宾蛤仔(Ruditapes philippinarum)的33个全同胞和11个半同胞的壳长进行遗传力的估计,其自然群体中幼虫期和稚贝期壳长遗传力分别为0.22±0.11和0.39±0.14,养殖群体中同期性状的遗传力分别为0.17±0.09和0.87±0.24。Toro等[14]在实验室的条件下构建了95个全同家系和19半同胞家系,分别对紫贻贝(Mytilus edulis)幼虫期第10、25和40天壳高的遗传力进行估计,遗传力估计值范围为 0.38~0.84。Mallet等[15]估算了紫贻贝(Mytilus edulis)受精后第11d(幼虫期)壳长的遗传力为0.11。
对于人工养殖的水产经济动物来说,全同胞半同胞之间的共同环境效应对生长性状有显著的影响[16],这种影响可能与交配策略、养殖环境、数据结构有关[17]。大多数双壳经济贝类很难实现个体标记,尤其是幼虫阶段,因此只能将同一家系的个体共同养殖,而这种养殖池效应则有可能造成家系间生长的差异,引起参数估计的偏差。本研究将不同家系的养殖环境当做共同环境效应来分析,结果显示共同环境效应随着年龄的增长而逐渐增大,且稚贝期生长性状的共同环境效应显著大于附着变态期。若模型中不考虑共同环境效应,这种非遗传的效应会混在加性遗传效应中,导致遗传力的过高估计。共同环境效应在水产动物中有着广泛的研究,Angélica等[18]对三个不同群体不同日龄的的贻贝(Mytilus chilensis)进行遗传力的分析,发现非遗传的环境效应对贻贝的生长性状有重要的影响。对鱼类的研究中发现共同环境效应对大西洋鳕鱼(Gadus morhua)稚鱼期体重的影响为3%~12%[19],而对露斯塔野鲮(Labeo rohita)成鱼期体重的影响为32%[20]。Herbinger等[21]为探究环境池效应对大西洋鲑(Salmo salar)早期生长的影响,对在单个家系池养殖的大西洋鲑与混合池养殖的个体进行分析,结果表明存在较高的环境池效应。
本研究结果表明,从附着变态期到稚贝期,壳长与壳高之间的遗传相关都存在极显著的正相关性,说明两者生长相互影响,共同生长。而表型相关则由附着变态期的0.95降低到稚贝期的0.84,表明经变态之后,环境对生长性状的影响有所增大,而遗传相关则几乎不受影响,依旧呈现高度正相关,这一现象与环境效应的变化趋势相一致。本研究较高的表型及遗传正相关与 Wang等[2]对文蛤(Meretrix meretrix)、Jin等[22]对三角帆蚌(Hyriopsis Cumingii)的研究结果相类似,意味着选育过程中无论选择壳长还是壳高,都会带来间接的选育效果。
除了对文蛤不同时间的壳长和壳高的表型相关及遗传相关进行分析之外,我们还对早期连续时间段生长性状的遗传相关进行分析。由于遗传协方差是描述同一个个体性状之间的关系,而在本研究中应用的破坏性抽样法导致无法在同一个个体上实现不同发育阶段的壳长数据的跟踪测量,而是在同一个家系的不同个体上测量,因此无法估计壳长在不同发育时期的表型协方差,只能对遗传协方差进行估计。早期连续时间段生长性状的遗传相关分析结果表明,在附着变态期及稚贝期连续的发育时期内,壳长的生长连续性具有遗传相关性,但相关性并不显著。Hilbish等[6]对硬壳蛤(Mercenaria mercenaria)幼虫期和稚贝期生长性状的遗传变异进行研究,结果表明胚壳I期和第2天的壳长呈现显著的较高遗传正相关,而第2天到第10以及第10天到 9个月之间壳长则并不相关,作者认为不同发育时期之间缺少关联很可能与基因-环境互作有关。在本研究中,可能是由于浮游幼虫期、附着变态期及稚贝期的养殖环境有所不同,削弱了遗传的变异,造成估算出的遗传相关不显著。而本研究结果也反映在发育过程中壳长的生长连续性是具有遗传相关性的,但这种相关并不稳定,受环境影响很大,因此在生长早期对文蛤个体进行选育并不可靠。
本研究对文蛤部分因子设计产生的 23个家系不同发育阶段的生长性状进行遗传参数的估计,发现文蛤附着变态期和稚贝期生长性状的遗传力并无显著差别,均属于中等遗传力。但共同环境效应随着年龄的增长而逐渐增大,稚贝期的共同环境效应显著大于附着变态期。不同时期壳长和壳高的表型相关和遗传相关都呈现出高度显著的正相关,壳长不同发育时期之间的遗传相关为正相关,但并不显著。这些结果为文蛤不同时期的生长性状提供基本的遗传评估,为后续的人工选育计划提供数据支持和理论指导。
参考文献:
[1]Liu B Z,Dong B,Tang B J,et al.Effect of stocking density on growth,settlement and survival of clam larvae,Meretrix meretrix[J].Aquaculture,2006,258(1-4):344-349.
[2]Wang H X,Chai X L,Liu B Z.Estimation of genetic parameters for growth traits in cultured clam Meretrix meretrix(Bivalvia: Veneridae)using the Bayesian method based on Gibbs sampling[J].Aquaculture Research,2011,42(2): 240-247.
[3]Wang C,Chai X L,Wang H X.Growth performance of the clam,Meretrix meretrix,breeding selection populations cultured in different conditions[J].Heart Vessels,2004,19(1): 19-22.
[4]Wang C,Wang H X,Li Y,et al.Identification of a fructose-1,6-bisphosphate aldolase gene and association of the single nucleotide polymorphisms with growth traits in the clam Meretrix meretrix[J].Mol Biol Rep,2012,39(4): 5017-5024.
[5]Lu X,Wang H X,Liu B Z,et al.Three EST-SSR markers associated with QTL for the growth of the clam Meretrix meretrix revealed by selective genotyping[J].Mar Biotechnol(NY),2013,15(1): 16-25.
[6]Hilbish T J,Winn E P,Rawson P D.Genetic variation and covariation during larval and juvenile growthin Mercenaria mercenaria[J].Marine Biolog,1993,115: 97-104.
[7]Bonar D B,Coon S L,Walch M,et al.Control of oyster settlement and metamorphosis by endogenous and exogenous chemical cues[J].Bulletin of marine science,1990,46(2): 484-498.
[8]Wang X M,Liu B Z,Tang B J,et al.Potential role of cathepsin B in the embryonic and larval development ofclam Meretrix meretrix[J].J Exp Zool B Mol Dev Evol,2011,316(4): 306-312.
[9]Ernande B,Clobert J,McCombie H,et al.Genetic polymorphism and trade-offs in the early life-history strategy of the Pacific oyster,Crassostrea gigas(Thunberg,1795): a quantitative genetic study[J].J Evol Biol,2003,16(3): 399-414.
[10]Strömgren T,Nielsen M V.Heritability of Growth in Larvae and Juveniles of Mytilus edulis[J].Aquaculture,1989,80: 1-6.
[11]Dupont-Nivet M,Vandeputte M,Chevassus B.Optimization of factorial mating designs for inference on heritability in fish species[J].Aquaculture,2002,204(3-4): 361-370.
[12]Blanc J M.Comparison of experimental designs for estimating quantitative genetic parameters in fish[J].Aquaculture Research,2003,34(12): 1099-1105.
[13]Yan X W,Huo Z M,Yang F,et al.Heritability of larval and juvenile growth for two stocks of Manila clam Ruditapes philippinarum[J].Aquaculture Research,2014,45(3): 484-490.
[14]Toro J E,Alcapán A C,Vergara A M,et al.Heritability estimates of larval and spat shell height in the Chilean blue mussel(Mytilus chilensis Hupe 1854)produced under controlled laboratory conditions[J].Aquaculture Research,2004,35: 56-61.
[15]Mallet A L,Freeman K R,Dickie L M.The genetics of production characters in the blue mussel Mytilus edulis.I.A preliminary analysis[J].Aquaculture,1986,57(1-4): 133-140.
[16]Winkelman A M,Peterson R G.Genetic parameters(heritabilities,dominance ratios and genetic correlations)for body weight and length of chinook salmon after 9 and 22 months of saltwater rearing[J].Aquaculture,1994,125(1-2): 31-36.
[17]Whatmore P,Nguyen N H,Miller A,et al.Genetic parameters for economically important traits in yellowtail kingfish Seriola lalandi[J].Aquaculture,2013,400-401: 77-84.
[18]Alcapán A C,Nespolo R F,Toro J E.Heritability of body size in the Chilean blue mussel(Mytilus chilensis Hupé 1854): effects of environment and ageing[J].Aquaculture Research,2007,38(3): 313-320.
[19]Gjerde B,Terjesen B F,Barr Y,et al.Genetic variation for juvenile growth and survival in Atlantic cod(Gadus morhua)[J].Aquaculture,2004,236(1-4): 167-177.
[20]Gitterle T,Rye M,Salte R,et al.Genetic(co)variation in harvest body weight and survival in Penaeus(Litopenaeus)vannamei under standard commercial conditions[J].Aquaculture,2005,243(1-4): 83-92.
[21]Herbinger C M,O'Reilly P T,Doyle R W,et al.Early growth performance of Atlantic salmon full-sib families reared in single family tanks versus in mixed family tanks[J].Aquaculture,1999,173(1-4): 105-116.
[22]Jin W,Bai Z Y,Fu L L,et al.Genetic analysis of early growth traits of the triangle shell mussel,Hyriopsis Cumingii,as an insight for potential genetic improvement to pearl quality and yield[J].Aquaculture International,2012,20(5): 927-933.
Received: Feb.25,2015
Key words: Meretrix meretrix; growth traits; animal model; genetic parameter
Abstract: This study investigates the genetic parameters affecting the growth traits of Meretrix meretrix in the early stages of life-history.Twenty three full-sib families were produced using the part factorial design,and effects were estimated using the single trait and two trait animal models.The results showed that,regarding the shell length heritabilities and shell height heritabilities,there were no significant differences between metamorphosis and juvenile stages.The estimated heritabilities were arranged from 0.11 to 0.41,at a medium level.However,the common environment effects increased as the age of Meretrix meretrix increased(from 0.02 to 0.38),and the common environment effects at the juvenile stage were significantly higher than those observed at the settlement and metamorphosis stages(P<0.01).From the metamorphosis stage to the juvenile stage,significantly positive phenotypic and genetic correlations were shown between the shell length and shell height,the correlation coefficients were 0.84~0.95 and 0.84~0.99,respectively.While the genetic correlations of the shell length between different development periods were positive,they were not significant and the correlation coefficients were different between each developmental period(0.34~0.71).
(本文编辑: 康亦兼)
Genetic parameter estimation for growth traits in the early life history of Meretrix meretrix
LIANG Bing-bing1,2,WANG Hong-xia1
(1.Key Laboratory of Experimental Marine Biology,Institute of Oceanology,Chinese Academy of Sciences,Qingdao 266071,China; 2.University of Chinese Academy of Sciences,Beijing 100049,China)
中图分类号:Q38
文献标识码:A
文章编号:1000-3096(2016)03-0047-06
doi:10.11759/hykx20150215001
收稿日期:2015-02-15; 修回日期: 2016-01-21
基金项目:国家 863计划项目(2012AA10A410); 浙江省科技计划项目(2012C12907-4 )
作者简介:梁冰冰(1989-),女(满族),辽宁本溪人,硕士研究生,从事贝类遗传育种学研究,E-mail: bing11061203@163.com; 王鸿霞,通信作者,博士,副研究员,电话: 0532-82898863,E-mail: hxwang@qdio.ac.cn

