2011~2012年度大亚湾海域浮游植物群落的季节变化
王朝晖,梁伟标,邵 娟
2011~2012年度大亚湾海域浮游植物群落的季节变化
王朝晖,梁伟标,邵娟
(暨南大学 生命科学技术学院生态学系 水体富营养化与赤潮防治广东普通高校重点实验室,广东 广州 510632)
摘要:于2011年12月至2012年11月采集了大亚湾海域9个站位表层水样,对大亚湾海域的浮游植物群落结构进行了周年调查。本次调查共鉴定出浮游植物93种,其中硅藻门40属55种,甲藻14属33种。秋季浮游植物种类较为丰富,春季和夏季较低。浮游植物细胞密度为41~396个/mL,年平均值为72.5个/mL。浮游植物细胞密度夏季较高,春季较低。硅藻是浮游植物优势类群,年均占浮游植物总细胞密度的 83.6%,优势硅藻主要有拟菱形藻(Pseudo-nitzschia spp.)、丹麦细柱藻(Leptocylindrus danicus)、中肋骨条藻(Skeletonema costatum)等。甲藻细胞密度一般较低,各季节甲藻的百分比含量为1.5%~32.6%,春季血红哈卡藻(Akashiwo sanguinea)大量出现,最大细胞密度高达82.3个/mL。浮游植物种类多样性指数(H′)和均匀度(J)在冬季和秋季较高,夏季较低; 远岸站点较高,近岸站点较低。研究结果说明虽然大亚湾浮游植物群落结构仍以硅藻占据优势,但甲藻种类与数量及百分比具有明显上升的趋势,同时近岸海域的富营养化导致了浮游植物种类多样性的下降。
关键词:浮游植物; 群落结构; 多样性; 大亚湾
[Foundation: National Natural Science Foundation of China,No.41276154,No.41476132]
浮游植物是海洋生态系统中的初级生产者,浮游植物的光合作用占海洋生产力总量的 95%左右,浮游植物的兴衰过程直接或间接地影响着整个海洋生态系统的生产力[1]。浮游植物的群落结构和种类组成受到海洋环境的影响,能够指示环境的变化,海洋浮游植物的群落结构及其动态变化因而也成为海洋环境调查的重要内容[2-4]。
大亚湾是南海东北部一个半封闭的海湾,是广东省的重要养殖基地,也是惠州港以及大亚湾和岭澳两座核电站所在地。关于大亚湾浮游植物的研究已经有诸多报道,研究结果显示大亚湾海域环境变化显著,核电站运行以来冬季水温升高,富营养化趋势日益加剧[5]; 浮游生物群落结构也发生了一定程度的改变,小型化趋势明显,甲藻、针胞藻、蓝细菌等有毒有害赤潮藻数量和种类增加,有害赤潮也时常发生[6-7],海洋生态系统有进一步恶化的趋势。虽然已有的研究报道较为全面揭示了近20年来大亚湾浮游植物状况和变化趋势,但是浮游植物监测需要得到长期和持续的数据,以建立浮游植物数据库,揭示浮游植物对环境变化的响应规律,了解浮游植物群落结构的变化历程。本研究于 2011年 12月~2012年11月在大亚湾海域设置了9个采样点,对浮游植物进行了定性定量研究,同时对浮游植物 DNA指纹图谱进行了研究,本文系统分析了浮游植物种类组成、数量分布的季节变化,为大亚湾海域浮游植物群落和生态环境的变化提供背景资料,并为大亚湾赤潮监测与预防提供科学依据。
1 材料与方法
1.1样品的采集
在广东省大亚湾海域设置了9个采样点(S1-S9),采样点的地理位置见图1。于2011年12月15日(冬季)、2012年3月15日(春季)、2012年6月8日(夏季)、2012年11月2日(秋季)采集上述9个站点的表层水样1L,加入4%的中性福尔马林溶液固定。
1.2浮游植物观察
将固定后的浮游植物样品,迅速带回实验室静置,静置48h后小心去除上清液,经过逐步浓缩,使浮游植物样品最终浓缩定量至20mL。观察时将样品摇匀,并取 0.1mL于浮游植物计数板中,然后在NIKON(TE-2000U)显微镜下观察鉴定,并记录样品中浮游植物的种类与数量[8-9],每个样品至少计数400 个,有的样品观察到的细胞数量超过 1000 个,使计数误差控制在10%以内[10]。
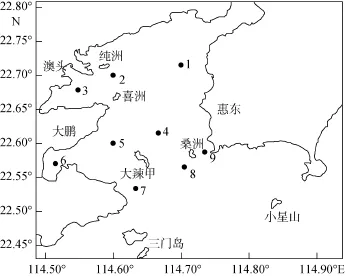
图1 大亚湾采样站点Fig.1 Sampling stations in DayaBay
1.3数据处理与分析
浮游植物的多样性指数与均匀度采用以下公式计算:
均匀度(J)= H′/ log2S(Pielous,1969)其中 Ni为第 i种的个体数,N为样品中的总个体数,Pi=Ni/N为第i种在样品中的数量比例,S为总种类数。
2 结果与分析
2.1浮游植物的种类组成
大亚湾浮游植物种类比较丰富,以硅藻为主要类群,其次为甲藻,还有少量黄藻和绿藻。本次调查共鉴定出浮游植物93种(含变种、变形),其中硅藻门40属55种,占总种数的59.1%; 甲藻门,共14 属33种,占总种数的35.5%; 黄藻门3属4种; 绿藻门1属1种。秋、冬两季浮游植物种类较为丰富,春季和夏季较低; 各站位间浮游植物种类数相差不大,相对来说,S2、S3和S9浮游植物种类数较为丰富(图2)。
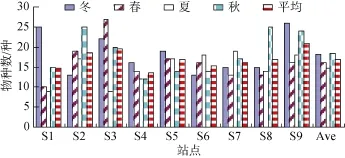
图2 大亚湾海域各站位浮游植物种类数Fig.2 Species richness of phytoplankton in each station in Daya Bay
各个季节观察到的浮游植物种类数相近,冬季、春季、夏季、秋季观察到浮游植物种类数分别为48、43、42和 49种,硅藻是主要类别,占总种类数的51.2%~77.1%,冬季硅藻种类较为丰富; 甲藻种类数为 7~18种,占总种类数的14.6%~41.9%; 其余类别的浮游植物较少出现。冬季硅藻优势种为斯氏几内亚藻(Guinardia striata)、中肋骨条藻(Skeletonema costatum)等,甲藻优势种为斯氏藻(Scrippsiella spinifera); 春季硅藻优势种为角毛藻(Chaetocerosspp.)、中肋骨条藻等,甲藻优势种为血红哈卡藻(Akashiwo sanguinea); 夏季硅藻优势种为角毛藻、丹麦细柱藻(Leptocylindrus danicus)、拟菱形藻(Pseudonitzschia spp.)等,甲藻优势种为锥状斯氏藻(Scrippsiella trochoidea); 秋季硅藻优势种为拟菱形藻、中肋骨条藻、菱形海线藻(Thalassionemanitzschioides)等,甲藻优势种为锥状斯氏藻(Scrippsiella trochoidea)。
2.2浮游植物数量的季节变化
浮游植物细胞密度的变化范围为41~396个/mL,年平均值为72.5个/mL。浮游植物细胞密度的季节波动较明显,春季浮游植物密度相对较低,夏季较高,秋冬两季节也有一些站位浮游植物密度较高(图3)。

图3 大亚湾海域浮游植物总细胞密度的季节变化Fig.3 Seasonal variation of total cell number of phytoplankton in Daya Bay
冬季浮游植物细胞密度的变化范围为 4.4~262.6个/mL,平均值为40.9个/mL。冬季调查中硅藻占据绝对优势,其细胞密度为总细胞密度的95.0%,甲藻细胞密度占总细胞密度的2.4%,而以等刺硅鞭藻为主的其他类别浮游植物也占了 2.6%(图4a)。春季浮游植物细胞密度为全年最低,变化范围为4.1~98.4个/mL,平均值为31.8个/mL。春季调查中硅藻仍然为主要门类,其细胞密度为总细胞密度的 66.7%; 值得注意的是春季甲藻的相对含量迅速增加,达到总细胞密度的32.6%(图4b),期间优势甲藻种类为血红哈卡藻。夏季浮游植物细胞密度是全年最高的季节,变化范围为 4.4~396.1个/mL,平均值为 141.0个/mL。夏季调查中硅藻占据绝对优势,其细胞密度为总细胞密度的 93.3%,甲藻细胞密度仅占总细胞密度的 1.5%,以等刺硅鞭藻为主的其他浮游植物的相对含量明显较其他季节高,为5.2%(图4c)。秋季的浮游植物细胞密度仅次于夏季位居第二,细胞密度变化范围为 10.8~265.6个/mL,平均值为76.3个/mL。秋季调查中硅藻的百分比含量最高,其细胞密度为总细胞密度的 95.9%,甲藻细胞密度仅占总细胞密度的2.8%(图4d)。
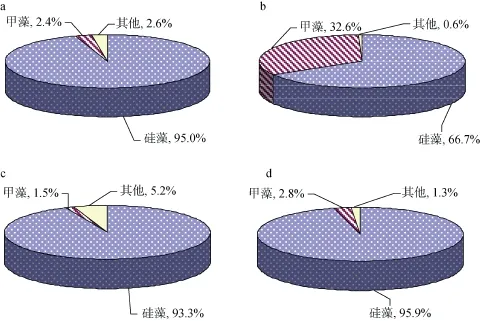
图4 大亚湾海域各类别浮游植物数量百分比组成Fig.4 Quantitative percentages of different groups of phytoplankton in DayaBay
a.冬季: b.春季: c.夏季: d.秋季
a.winter: b.spring: c.summer: d.autumn
整个调查期间各站位的硅藻细胞密度的变化范围为3.7~395.4个/mL,平均值为60.6个/mL,年均占浮游植物细胞总密度的83.6%。3种优势硅藻拟菱形藻、丹麦细柱藻和中肋骨条藻平均占浮游植物总密度的65%。硅藻细胞密度的季节波动比较明显,夏季硅藻细胞密度达到一年中的最高值,秋季次之,春季、冬季硅藻密度相对较低(图5a)。但从各个季节硅藻的百分比含量来看(图 4),秋冬两个季节硅藻百分比含量较高,达到 95%左右,而夏季也达到 93.5%,春季最低,为66.7%。
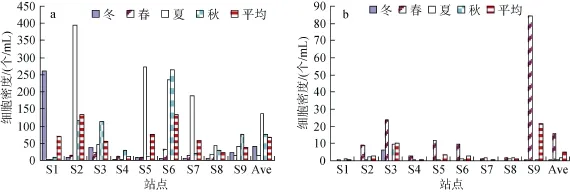
图5 大亚湾海域硅藻(a)和甲藻(b)细胞密度的季节变化Fig.5 Seasonal variation in cell number of diatoms(a)and dinoflagellates(b)in Daya Bay
甲藻细胞密度明显低于硅藻,变化范围为 0~84.2个/mL,年平均值为4.8个/mL。春季甲藻细胞密度明显高于其他3个季节(图5b),主要是因为春季大亚湾海域血红哈卡藻的密度较高。而秋冬两个季节也有一些站位有一定细胞密度的甲藻出现,夏季甲藻几乎不出现。甲藻的最高细胞密度出现在春季的S9站位,优势种为血红哈卡藻,该藻细胞密度达到82.3个/mL,占甲藻总数的97.7%以及浮游植物总数的83.6%; 而其时其他站位如S3、S5、S2、S6血红哈卡藻细胞密度也较高,达到8.6~22个/mL。
调查期间还观察到了针胞藻、绿藻、黄藻等其他藻类,其他藻类细胞密度较低,变化范围为 0~11.8个/mL,年平均值仅为1.1个/mL。
2.3浮游植物多样性分析
浮游植物种类多样性指数(H′)偏低,为 0.64~3.76,年平均值为2.50。最高值出现在秋季的S8,为3.76; 最低值出现在夏季的S2(图6a)。整体来看,冬季和秋季H′值较高,夏季H′值较低。H′值也具有一定空间差异,其中远岸站点如 S9、S1的 H′值较高,离岸站点 S4、S8、S5、S7次之,近岸站点 S6、S2 和 S3最低。虽然秋冬季节浮游植物细胞密度较低,但由于浮游植物数量分布较为均匀,物种多样性较高; 而夏季浮游植物数量较高,但样品中常常以某一种浮游植物占据优势,如H′值较低的S2和S6夏季样品中拟菱形藻和丹麦细柱藻就分别占据了浮游植物的绝对优势; 而春季样品中,由于血红哈卡藻在一些样品中优势度较高,导致春季浮游植物多样性下降。
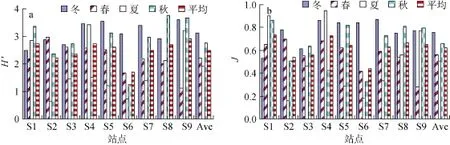
图6 大亚湾海域浮游植物物种多样性指数(a)和均匀度(b)的变化Fig.6 The Shannon-Weaver species diversity index(a)and Pielous evenness(b)of phytoplankton in Daya Bay
浮游植物均匀度(J)变化范围为 0.16~0.95,周年平均值为0.60。均匀度与多样性变化趋势一致,同样也是冬秋季节较高,春夏季节较低; 远岸站点较高、近岸站点较低(图6b)。
3 讨论
与众多亚热带海域浮游植物的一样,大亚湾海域也具备以下特点: 种类繁多,以暖水性、广布种类为主,优势种交替频繁。该海域的浮游植物群落完全是一个由硅藻为主导型的浮游植物群落,在硅藻中,又以拟菱形藻、丹麦细柱藻、中肋骨条藻等小型链状硅藻占据优势,这3种硅藻就占了浮游植物总量的65%左右。大亚湾浮游植物结构是对养殖环境的生态响应,作为一个典型养殖海域,一些个体小、生长速度快的小型硅藻成为该海区的优势种,这些适应能力较广的广温、广盐种类,在环境条件合适时,能迅速增殖成为优势物种。
浮游植物的群落结构特征是对周围环境的一个生态响应。营养盐含量和组成的改变会导致浮游植物群落结构的改变,并对海洋生态系统产生长期的影响[1-4]。在胶州湾海域,由于氮磷浓度的上升以及硅酸盐含量的下降,导致营养盐结构发生变化[11],浮游植物群落结构也发生了显著变化,硅藻趋于小型化,而且硅藻种类及相对数量下降,有毒有害甲藻及其他鞭毛藻类出现频率和数量急剧增加,有毒有害赤潮发生频率也明显上升[12-13]。在长江口海域,由于氮输入量的不断增加,也导致浮游植物群落结构的变化,硅藻优势度降低,20世纪 90年代以来东海原甲藻(Prorocentrum donghaiense)、亚历山大藻(Alexandrium spp.)以及米氏凯伦藻(Karenia mikimotoi)等甲藻赤潮频繁发生[14-15]。
由于经济的发展和人口的增加以及海水养殖的自身污染,近 20多年来大亚湾海域营养结构发生了巨大变化[5-7,16-17],从20世纪90年代中后期以来,可溶性无机氮浓度上升了4倍,与此同时可溶性无机磷浓度却下降,致使氮磷比急剧上升,而浮游植物的生长也有氮限制转变为磷限制[16-17]。大量的氮污染使浮游植物出现小型化趋势,原来个体较大的优势种逐渐被个体较小的种类所代替,而且甲藻、针胞藻、蓝细菌等非硅藻类出现频率和数量明显增加[6-7]。在本研究中浮游植物虽然优势种仍以小型硅藻为主,但甲藻种类、数量及百分比明显高于前期调查[6-7],春季甲藻的数量百分比可高达32.6%,此现象值得进一步关注。
浮游植物群落结构特征变化可在一定程度上反映环境变化的影响[2]。在水质较好、营养水平较低的海域,浮游植物的种类数较多且比例均匀,浮游植物群落的多样性指数和均匀度较高。反之,则群落多样性指数和均匀度较低。夏季浮游植物细胞密度较高,种类多样性指数和均匀度均较低。夏季是大亚湾的丰水期,地表径流带来了丰富的营养物质,同时由于水温较高,适合浮游植物快速增长,造成浮游植物群落的丰度上升,而多样性和均匀度则相应下降。
另外一个值得注意的问题是,在春季样品中血红哈卡藻的大量出现。血红哈卡藻属于裸甲藻目,已在我国福建、浙江以及山东沿海发生了多起赤潮[18-20]。而2009年 10月底在广东省珠海海域发生的双胞旋沟藻(Cochlodinium geminatum)赤潮中,血红哈卡藻是第 2优势种[21],说明该藻也能在亚热带的广东沿海大量出现。目前尚未有血红哈卡藻产生毒素的报道,其造成养殖动物死亡一般是由于赤潮消亡期消耗大量溶解氧,致使养殖动物缺氧而死。在本研究中,血红哈卡藻最大细胞密度高达82.3个/mL,已经接近赤潮密度,而且也是浮游植物群落中的绝对优势种,这是在大亚湾海域首次发现如此高密度的血红哈卡藻。由此可见,该藻赤潮有在大亚湾海域发生趋势,需要防范于未然。
4 结论
大亚湾浮游植物种类丰富,硅藻为浮游植物主要类群; 秋季浮游植物种类最为丰富,其次为冬季,春季和夏季较低; 春季样品中出现大量血红哈卡藻,需要防范该藻赤潮的发生。
浮游植物细胞密度较高,季节波动明显,夏季较高,春季较低,秋冬季节细胞密度也较高。
浮游植物种类多样性指数(H′)和均匀度(J)偏低,其中冬季和秋季较高,夏季较低; 远岸站点较高,近岸站点较低。
参考文献:
[1]Brown C W,Uz S S,Corliss B H.Seasonality of oceanic primary production and its interannual variability from 1998 to 2007[J].Deep-Sea Research Part I,2014,90: 166-175.
[2]Hernandez-Farinas T,Soudant D,Barille L,et al.Temporal changes in the phytoplankton community along the French coast of the eastern English Channel and the southern Bight of the North Sea[J].ICES Journal of Marine Science,2014,71: 821-833.
[3]Machado RCD,Feitosa FAD,Koening ML,et al.Phytoplankton productivity and hydrology of Porto de Galinhas reef ecosystem(Pernambuco,Brazil)[J].Journal of Coastal Research,2014,30: 371-378.
[4]Vadrucci M R,Sabetta L,Fiocca A,et al.Statistical evaluation of differences in phytoplankton richness and abundance as constrained by environmental drivers in transitional waters of the Mediterranean basin[J].Aquatic Conservation-Marine and Freshwater Ecosystems,2008,18: S88-S104.
[5]Wang Y S,Lou Z P,Sun C C,et al.Ecological environment changes in Daya Bay,China,from 1982 to 2004[J].Marine Pollution Bulletin,2008,56(11): 1871- 1879.
[6]Wang Z,Zhao J,Zhang Y,et al.2009.Phytoplankton community structure and environmental parameters in aquaculture areas of Daya Bay,South China Sea[J].Journal of Environmental Science China,21: 1268-1275.
[7]Wang Z H,Song S H,Qi Y Z.A comparative study of phytoneuston and the phytoplankton community structure in DayaBay,South China Sea[J].Journal of Sea Research,2014,85: 474-482.
[8]郭玉洁,钱树本.中国海藻志 第五卷 硅藻门 第一册 中心纲[M].北京: 科学出版社,2003.Guo Yujie,Qian Shuben.Flora Algarum Marinarum Sinicarum,Tomus V.Bacillariophyta,No.I.Centricae[M].Beijing: Science Press,2003.
[9]Fukuyo F,Takano H,Chihara M,Matsuoka K.Red tide organisms in Japan[M].Tokyo: Uchia Rokakuho Co.Ltd.,1990.
[10]Anderson P,Throndsen J.Estimating cell numbers[A].Hallegraeff G M,Anderson D M,Cembella A D.Manual on Harmful Marine Microalgae[C]//Paris: UNESCO Publishing.2003.99-130.
[11]沈志良.胶州湾营养盐结构的长期变化及其对生态环境的影响[J].海洋与湖沼,2002,33(3): 322-331.Shen Zhiliang.Long-term changes in nutrient structure and its influences on ecology and environment in Jiaozhou-Bay[J].Oceanologia et Limnologia Sinica,2002,33(3):322-331.
[12]韩笑天,邹景忠,张永山.胶州湾赤潮生物种类及其生态分布特征[J].海洋科学,2004,28(2): 49-54.Han Xiaotian,Zou Jiangzhong,Zhang Yongshan.Harmful algae bloom species in JiaozhouBay and the features of distribution[J].Marine Science,2004,28(2): 49-54.
[13]刘东艳,孙军,张利永.胶州湾浮游植物水华期群落结构特征[J].应用生态学报,2003,14(11): 1963-1966.Liu Dongyan,Sun Jun,Zhang Liyong.Structural characteristics of phytoplankton community during harmful algae bloom in JiaozhouBay[J].Chinese Journal of Applied Ecology,2003,14(11): 1963-1966.
[14]周名江,颜天,邹景忠.长江口邻近海域赤潮发生区基本特征初探[J].应用生态学报,2003,14(7): 1031-1038.Zhou Mingjiang,Yan Tian,Zou Jingzhong.Preliminary analysis of the characteristics of red tide areas in ChangjiangRiver estuary and its adjacent sea[J].Chinese Journal of Applied Ecology,2003,14(7): 1031-1038.
[15]周名江,朱明远.“我国近海有害赤潮发生的生态学、海洋学机制及预防预测”研究进展[J].地球科学进展,2006,21(7): 673-679.Zhou Mingjiang,Zhu Mingyuan.Progress of the Project “Ecology and Oceanography of Harmful Algal Blooms in China”[J].Advances in Earth Science,2006,21(7): 673-679.
[16]彭云辉,孙丽华,陈浩如,等.大亚湾海区营养盐的变化及富营养化研究[J].海洋通报,2002,21(3): 44-49.Peng Yunhui,Sun Lihua,Chen Haoru,et al.Study on Eutrophication and Change of Nutrients in the Daya-Bay[J].Marine Science Bulletin,2002,21(3): 44−49.
[17]王朝晖,齐雨藻,李锦蓉,等.大亚湾养殖区营养盐状况分析与评价[J].海洋环境科学,2004,23(2): 25-28.Wang Zhaohui,Qi Yuzao,Li Jingrong,et al.Analysis and evaluation trophic status in aquaculture areas of Daya Bay[J].Marine Environmental Science,2004,23(2): 25-28.
[18]刘义豪,宋秀凯,靳洋,等.一次陆源降雨污水引起血红哈卡藻赤潮的成因[J].生态学报,2012,(15): 4836-4843.Liu Yihao,Song Xiukai,Jin Yang,et al.Occurrence characteristics of Akashiwo sanguinea bloom caused by land source rainwater[J].Acta Ecologica Sinica,2012,(15): 4836-4843.
[19]喻龙,马兆虎,郝彦菊,等.四十里湾2012年一次血红哈卡藻赤潮的调查分析[J].海洋科学进展,2014,32(1): 84-91.Yu Long,Mao Zhaohu,Hao Yanju,et al.Analysis of the red tide caused by Akashiwo sanguinea in Sishili Bay,2012[J].Advances in Marine Science,2014,32(1): 84-91.
[20]Yang C,Li Y,Zhou Y,et al.Bacterial community dynamics during a bloom caused by Akashiwo sanguinea in the Xiamen sea area,China[J].Harmful Algae,2012,20: 132-141.
[21]王朝晖,姜珊,谷阳光,等.珠海旋沟藻赤潮水样对其他微藻生长的影响[J].深圳大学学报理工版,2011,28(6): 553-558.Wang Zhaohui,Jiang Shan,Gu Yangguang,et al.Effects of Cochlodinium bloom in Pearl River Estuary in China on the growth of other harmful algal bloom species[J].Journal of ShenzhenUniversity Science and Engineering,2011,28(6): 553-558.
Seasonal changes of phytoplamkton community in Daya Bay,South China Sea,between 2011 and 2012
WANG Zhao-hui,LIANG Wei-biao,SHAO Juan
(College of Life Science and Technology,Key Laboratory of Eutrophication and Red Tide Prevention of Guangdong Higher Education Institutes,Jinan University,Guangzhou 510632,China)
Received: Jun.28,2015
Key words:phytoplankton; community structure; diversity; Daya Bay
Abstract:An annual survey of the phytoplankton community was conducted at nine stations in Daya Bay in the South China Sea between December 2011 and November 2012.A total of 93 taxa were identified in this survey,in which 55 taxa of 40 genera were diatoms and 33 taxa of 14 genera were dinoflagellates.Species numbers were higher in autumn and lower in spring and summer.Cell densities ranged between 41 and 396 cells/mL,with the annual mean being 72.5 cells/mL.Cell densities were higher in summer and lower in spring.Diatioms dominated the phytoplankton community,which contributed 83.6% to the total phytoplankton average.The predominant diatoms included Pseudo-nitzschia spp.,Leptocylindrus danicus,and Skeletonema costatum ect.Dinoflagellates generally occurred in low numbers,with seasonal average proportions of approximately 1.5% to 32.6%.However,high densities of Akashiwo sanguinea were recorded in spring samples,with amaximum cell number of 82.3 cells/mL.The Shannon-Weaver species diversity index(H′)and Pielou's evenness(J)were higher in winter and autumn and lower in summer.H′ and J values were higher in the offshore stations and lower in the inshore stations.These results suggest that both species and cell numbers of dinoflagellates have been clearly increased in Daya Bay,though the phytoplankton community is dominated by diatoms up till now.The high nutrient levels in the inshore areas resulted in a decrease of the species diversity of phytoplankton.(本文编辑: 梁德海)
中图分类号:Q178.53
文献标识码:A
文章编号:1000-3096(2016)03-0053-07
doi:10.11759/hykx20141206002
收稿日期:2015-06-28; 修回日期: 2015-09-10
基金项目:国家自然科学基金项目(41276154,41476132)
作者简介:王朝晖(1968-),女,湖南长沙人,教授,博士,研究方向为藻类生态学,电话: 020-85225100,E-mail: twzh@jnu.edu.cn

