秦皇岛近海褐潮高发区浮游植物的碱性磷酸酶活性分析
刘晓红,覃仙玲,蔡阳扬,欧林坚,吕颂辉
秦皇岛近海褐潮高发区浮游植物的碱性磷酸酶活性分析
刘晓红,覃仙玲,蔡阳扬,欧林坚,吕颂辉
(暨南大学赤潮与海洋生物学研究中心,水体富营养化与赤潮防治广东普通高校重点实验室,广东 广州510632)
摘要:碱性磷酸酶(Alkaline phosphatase,AP)是浮游植物在磷胁迫状态下表达的一种水解有机磷源的胞外酶,可用于指示海区浮游植物的磷胁迫状态。本研究于 2013年 7月,对秦皇岛近海抑食金球藻(Aureococcus anophagefferens)褐潮发生期间浮游植物的碱性磷酸酶活性(AP activity,APA)进行研究,结合其他理化参数,分析藻华发生时浮游植物的磷营养状态及其对海水中磷源的水解与利用情况。结果表明,褐潮发生时,抑食金球藻细胞密度高达108个/L,溶解有机磷(Dissolved organic phosphorus,DOP)成为浮游植物生长利用的主要磷源。抑食金球藻的细胞密度受到海水中 NO3-、DOP、溶解无机磷(Dissolved inorganic phosphorus,DIP)浓度等的显著影响。浮游植物大量表达AP水解DOP,平均APA高达217.72 nmol/(µg·h)±90.86 nmol/(µg·h)(350.44 nmol/(L·h)±130.57 nmol/(L·h)),且APA随浮游植物生物量增大而显著增加。该结果表明抑食金球藻褐潮发生时,海区遭受严峻的磷胁迫甚至限制。磷源,尤其是有机磷源的可利用性可能在秦皇岛海区抑食金球藻褐潮的发生和维持中起关键作用。
关键词:碱性磷酸酶; 抑食金球藻; 溶解有机磷; 秦皇岛; 磷胁迫
[Foundation: Public science and technology research funds projects of ocean(201305003-2); China NSF(U1301235; 41176087)]
2009年以来,在渤海湾的秦皇岛近岸海域连续发生了抑食金球藻(Aureococcus anophagefferens)“褐潮”[1-2]。褐潮是继赤潮和绿潮之后,我国出现的又一藻华新类型。秦皇岛海域是中国扇贝养殖规模最大的区域之一,每当褐潮发生时,近海的养殖经济和滨海旅游业都遭受重创[3-7]。
美国是最早发生抑食金球藻褐潮的国家[8-9]。有学者认为,海水中溶解有机氮浓度的升高是美国株抑食金球藻褐潮发生的关键因子之一[10-11]。褐潮主要在无机氮浓度较低有机氮浓度较高的条件下发生[12-14]。而近几十年来,渤海海域的营养盐结构已经由潜在的氮限制逐渐演变为现今的磷限制[15-16]。秦皇岛抑食金球藻褐潮发生时,海区可能处于磷限制的环境中。在磷缺乏时,浮游植物可以通过表达碱性磷酸酶(alkaline phosphatase,AP)来利用溶解态有机磷(dissolved organic phosphorus,DOP)[17-18]。这种特性使碱性磷酸酶活性(AP activity,APA)可以作为浮游植物磷胁迫水平的指标[19-20]。因此,研究海区浮游植物的APA可以指示该海域浮游植物的磷营养生理状态,并揭示其对DOP的水解利用能力。
本研究于2013年7月23~25日对秦皇岛近海进行海上调查,重点研究抑食金球藻褐潮发生期间海区 APA水平,同时结合其他理化因子数据,分析褐潮发生期间浮游植物的磷营养生理状态,揭示 DOP的生物可利用性,以期为秦皇岛褐潮的暴发机制从营养生理学角度提供理论依据。
1 材料和方法
1.1采样时间与站位
自2009年以来,秦皇岛近海几乎每年都暴发抑食金球藻褐潮,褐潮持续数十天至数月不等[3-7]。其中2013年发生的抑食金球藻藻华,为当年我国持续时间最长和单次过程影响面积最大的藻华,分别为98 d(5月25日~8月31日)和1 450 km2[6]。本次调查于2013年7月23~25日褐潮的高发持续期内,在秦皇岛海域(119.44°~119.74°E; 39.71°~39.90°N)进行采样,共采集4个断面,每个断面5个站位(图1)。

图1 秦皇岛海域采样站位图Fig.1 Sampling stations in the Qinhuangdao coastal waters
1.2采样与参数检测
秦皇岛近海海域水深较浅(<25 m),表底层海水混合较为均匀,故只采集表层海水进行实验。海水使用有机玻璃采水器进行采集。水温和盐度由美国YSI 6600V2现场检测,使用前用标准溶液对仪器的盐度和温度参数进行校正。采集的海水用150 µm孔径筛绢去除大型浮游动物后,经GF/F滤膜过滤用于测定营养盐。溶解态无机氮(dissolved inorganic nitrogen,DIN)、溶解态无机磷(dissolved inorganic phosphorus,DIP)、活性硅酸盐(SiO32-)和溶解态有机磷(dissolved organic phosphorus,DOP)检测按照国家《海洋调查规范》(GB/T12763-2007)[21]进行,其中 DIN=NO3-+ NO2-+ NH4+。抑食金球藻的密度采用流式细胞仪(BD,FACSCALIBUR)进行检测,叶绿素a(Chl a)是将水样过滤于 GF/F膜上,由叶绿素荧光仪(TURNER,Trilogy)测定。
APA的采样是将水样过滤于0.22 µm的醋酸纤维膜上并立即保存于液氮中,回到实验室后,参考Hoppe[22]及Pettersson等[23]的方法进行测定。APA的表达单位采用单位水体 APA(单位: nmol/(L·h))与单位叶绿素 APA(单位: nmol/(µg·h))及单位细胞 APA(fmol/(个·h))表示。
1.3数据处理与分析
文中的数据分析均在统计学软件 SPSS 13.0中进行,分布图使用 Surfer 11软件完成,主成分分析的软件为Canoco 4.5。
2 结果
2.1理化环境因子
调查期间,秦皇岛海域的温度由北向南递增,由近岸向外海递减; 盐度的分布趋势刚好相反,近岸盐度低,外海盐度高。DIN、DIP、SiO32-均呈现出由近岸向外海减小的趋势,平均值分别为 42.06 µmol/L± 22.39 µmol/L、0.15 µmol/L ± 0.11 µmol/L和34.3 µmol/L± 4.0 µmol/L(表 1)。无机态 DIN/DIP平均比值高达347.5±179.8,表明海区浮游植物处于磷胁迫甚至磷限制状态。DOP浓度是DIP浓度的32.1±21.5倍,DOP是海区浮游植物可利用的主要磷源。

表1 秦皇岛海域各理化环境因子的变化范围与平均值Tab.1 Ranges and average values of different environmental parameters in the coastal waters of Qinhuangdao
2.2浮游植物丰度变化
Chl a在整个海域中变化范围为0.88~3.09 µg/L,平均值为1.71 µg/L ± 0.57 µg/L(图2)。靠北的两个断面Chl a浓度显著高于南面的两个断面(P<0.05)。 抑食金球藻在整个研究海域的浮游植物群落中占绝对优势,其密度分布趋势为外海高于近岸,平均细胞密度高达10.64 个/L ± 5.59×107个/L。Chl a与抑食金球藻密度显著正相关(P<0.05)。
2.3碱性磷酸酶活性
单位水体APA与单位Chl a APA(APAChl a)以及单位细胞 APA(APAcell)变化趋势相似,均在最北的断面具有最大平均值,且由近岸向外海逐渐增大,表明北部靠外海域的浮游植物遭受磷胁迫甚至限制较为严重(图 3)。单位水体的 APA的平均值为350.44 nmol/(L·h)±130.57 nmol/(L·h),最高值出现在北部最靠外的站位,最大值为 534.01 nmol/(L·h);APAChl a变化范围为58.2~389.8 nmol/(μg·h),在最南部和最北部的两条断面出现高值。APAcell平均值为3.86 fmol/(个·h)± 2.06 fmol/(个·h)。
海域浮游植物的APA(包括单位水体APA与APAChl a以及 APAcell)与各理化环境因子之间相关性分析结果表明,单位水体 APA随温度的升高而显著降低(P<0.01);APAChl a随DIP浓度的下降而显著上升(P<0.05)。

图2 秦皇岛海域的叶绿素a与抑食金球藻密度分布Fig.2 The distribution of Chl a and cell densities of Aureococcus anophagefferens in the Qinhuangdao coastal waters

图3 秦皇岛海域的单位水体APA与单位叶绿素APA及单位细胞APA分布Fig.3 The distribution of APA and APAChl aand APAcellin the Qinhuangdao coastal waters
2.4抑食金球藻的密度与各理化环境因子的关系分析
对抑食金球藻的密度与海区各理化环境因子进行 PCA分析,结果表明,秦皇岛海域抑食金球藻的细胞密度与温度、盐度、NO3-、DOP和DIP等因子呈正相关关系,与APAChl a、SiO32-和NH4+呈负相关(图4)。
3 讨论
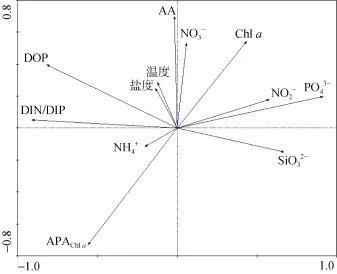
图4 抑食金球藻丰度(图中AA表示)与理化环境因子的PCA二维排序图Fig.4 Two-dimensional graph of PCA plot with Aureococcus anophagefferens richness(AA)and environmental factors
海水中的无机 N/P比常被用于指示水体可能存在的营养限制的情况,一般正常的N/P比值为 16︰1[24],而当该比值大于20~30的时候,即意味着浮游植物处于磷限制状态[25]。作者的研究结果表明2013 年 7月份,在秦皇岛海域抑食金球藻褐潮暴发期间,海区DIP的平均浓度为0.15 μmol/L,DIN/DIP的比值平均为347.5,最高达769.7,远远超出了海水中正常的无机氮磷比值,说明海区浮游植物遭受严重的磷胁迫甚至磷限制。这与蒋红等[15]对渤海近20年的营养盐变化趋势分析得出的结论是一致的; 他们提出了20世纪90年代与80年代相比,氮磷比值升高,渤海水域由氮限制逐步向磷限制方向演化。曹宇峰等[16]也进一步证明,渤海海域的N/P比已经由20世纪80年代初的2︰1~3︰1逐步上升到了2008年的67︰1,局部高达200︰1。2009年以来,秦皇岛褐潮的暴发几乎都是始于5月底6月初,7月份藻华密度持续升高,直至8月份才开始衰亡。在磷限制的条件下,抑食金球藻维持了长时间的藻华,除了具有细胞内部磷库的支撑,还有可能通过表达AP水解DOP而获得 PO43-。Wurch等[17]用蛋白质组学方法研究发现,抑食金球藻在磷缺乏条件下,AP的表达量会大量增长。而 Wurch等[18]认为在磷缺乏的条件下,抑食金球藻可以通过以下 4种途径增强其对磷的利用或保存能力:(1)对5′-核苷酸酶及AP的正调控;(2)通过表达更多的磷转运蛋白或者切换到更有效的磷转运蛋白以增强其转运磷的能力;(3)通过将磷脂质转化成硫脂质以降低细胞的磷需求;(4)调整它的糖酵解途径。这些研究都表明,抑食金球藻在磷限制条件下,具有表达AP以利用DOP的能力。
APAChl a与 PO43-浓度之间显著负相关,APA的高值区主要集中在PO43-浓度小于0.20 µmol/L的站位,表明浮游植物在低磷下诱导表达AP,随着褐潮生物量的增加,海区遭受的磷胁迫甚至磷限制加剧。调查过程中APAcell的平均值为3.86 fmol/(个·h)±2.06 fmol/(个·h),假设抑食金球藻的1天生长速率高达1,其单位细胞的最小颗粒磷含量为3.41 fmol/个(根据室内实验结果假设),因此抑食金球藻细胞倍增的磷需求为0.14 fmol/(个·h)。由此可见,秦皇岛褐潮发生期间,其 APA的水解速率远远大于磷需求。该海域中DOP占总磷的10.5%~98.6%,所以DOP在秦皇岛褐潮发生期间,对浮游植物的磷补给上起重要的作用。
在秦皇岛褐潮发生期间的单位APA与APAChl a水平约为同年4~5月东海调查海域的APA的5.70和1.85倍。经研究,东海海区也是一个磷限制海区,磷营养盐含量和结构的变化可能在东海原甲藻藻华的发生中起重要作用[26-27]。而本次调查中由于实验条件的限制,作者采集的秦皇岛海域褐潮发生期的APA样品是过滤到膜(孔径 0.22 µm)上的生物样品,因而检测的主要是颗粒态的 APA,并不包含游离态APA。因此,作者推论,该海区褐潮发生时,整个水体中的APA水平可能还要更高。目前,对于抑食金球藻在中国得以发生褐潮的营养发生机理的研究基本处于空白。而美国株抑食金球藻褐潮的发生,则更多的强调氮源,尤其是有机氮源在褐潮发生中的作用。鉴于本文的研究结果,作者认为,磷源可能在中国株抑食金球藻褐潮的发生中发挥重要作用,研究有待深入开展。
4 结论
2013年7月,秦皇岛抑食金球藻褐潮发生期间,海区的浮游植物处于严重的磷胁迫甚至限制状态,随藻华生物量的升高,浮游植物磷胁迫加剧。抑食金球藻的细胞密度与海水中NO3-、DIP和DOP正相关。DOP是海水中的主要可利用的磷源,抑食金球藻大量表达APA,迅速水解利用DOP。浮游植物对DOP的水解利用可能是褐潮得以发生和长时间维持的重要原因之一。
参考文献:
[1]Zhang Q C,Qiu L M,Yu R C,et al.Emergence of brown tides caused by Aureococcus anophagefferens Hargraves et Sieburth in China[J].Harmful Algae,2012,19: 117-124.

State Oceanic Administration People's Republic of China.Bulletin of Marine Environmental Status of
[2]国家海洋局.2014国家海洋环境状况公报[R].北京:国家海洋局,2015.China for the Year of 2014[R].Beijing: State Oceanic Administration People's Republic of China,2015.
[3]国家海洋局.2010中国海洋灾害公报[R].北京: 国家海洋局,2011.State Oceanic Administration People's Republic of China.Bulletin of Marine Disaster of China for the Year of 2010[R].Beijing: State Oceanic Administration People's Republic of China,2011.
[4]国家海洋局.2011中国海洋灾害公报[R].北京: 国家海洋局,2012.State Oceanic Administration People's Republic of China.Bulletin of Marine Disaster of China for the Year of 2011[R].State Oceanic Administration People's Republic of China,2012.
[5]国家海洋局.2012中国海洋灾害公报[R].北京: 国家海洋局,2013.State Oceanic Administration People's Republic of China.Bulletin of Marine Disaster of China for the Year of 2012[R].State Oceanic Administration People's Republic of China,2013.
[6]国家海洋局.2013中国海洋灾害公报[R].北京: 国家海洋局,2014.State Oceanic Administration People's Republic of China.Bulletin of Marine Disaster of China for the Year of 2013[R].State Oceanic Administration People's Republic of China,2014.
[7]国家海洋局.2014中国海洋灾害公报[R].北京: 国家海洋局,2015.State Oceanic Administration People's Republic of China.Bulletin of Marine Disaster of China for the Year of 2014[R].State Oceanic Administration People's Republic of China,2015.
[8]Gobler C J,Berry D L,Dyhrman S T,et al.Niche of harmful alga Aureococcus anophagefferens revealed through ecogenomics[J].Proceedings of the National Academy of Sciences of the United States of America,2011,108: 4352-4357.
[9]Koch F,Sañudo-Wilhelmy S A,Fisher N S,et al.Effect of vitamins B1 and B12 on bloom dynamics of harmful brown tide alga,Aureococcus anophagefferens(Pelagophyceae)[J].Limnology and Oceanography,2013,58(5):1761-1774.
[10]Mulholland M R,Boneillo G E,Bernhardt P W,et al.Comparison of nutrient and microbial dynamics over a seasonal cycle in a mid-Atlantic coastal lagoon prone to Aureococcus anophagefferens(brown tide)blooms[J].Estuaries Coasts,2009,32: 1176-1194.
[11]Gobler C J,Sunda WG.Ecosystem disruptive algal blooms of the brown tide species,Aureocuccus anophagefferens and Aureoumbra lagunensis[J].Harmful Algae,2012,14: 36-45.
[12]Nixon S W,Granger S L,Taylor D I,et al.Subtidal volume fluxes,nutrient inputs and the brown tide—an alternate hypothesis[J].Estuarine,Coastal and Shelf Science,1994,39: 303-312.
[13]Probyn T A,Bernard S,Pitcher G C,et al.Ecophysiological studies on Aureococcus anophagefferens blooms in Saldanha Bay,South Africa[J].Harmful Algae,2010,9: 123-133.
[14]Taylor G T,Gobler C J,Sañudo-Wilhelmy S A.Speciation and concentrations of dissolved nitrogen as determinants of brown tide Aureococcus anophagefferens bloom initiation[J].Marine Ecology Progress Series,2006,312: 67-83.
[15]蒋红,崔毅,陈碧鹃,等.渤海近20年来营养盐变化趋势研究[J].海洋水产研究,2005,6(26): 61-67.Jiang hong,Cui yi,Chen bijuan,et al.The variation trend of nutrientsalts in the Bohai Sea[J].Marine Fisheries Research,2005,6(26): 61-67.
[16]曹宇峰,孙霞,于灏,等.浅谈渤海海洋环境污染治理与保护对策[J].海洋开发与管理,2014,31(1): 104-108.Cao yufeng,Sun xia,Yu hao,et al.The marine pollution control and environmental protection measures in Bohai sea[J].Ocean Development and Management,2014,31(1): 104-108.
[17]Wurch L L,Bertrand E M,Saito M A,et al.Proteome vhanges driven by phosphorus deficiency and recovery in the brown tide-forming alga Aureococcus anophagefferens[J].PLoS one,2011,1-11.
[18]Wurch L L,Haley S T,Orchard E D,et al.Nutrient-regulated transcriptional responses in the brown tide-forming alga Aureococcus anophagefferens[J].Environmental Microbiology,2011,13(2): 468-481.
[19]Dyhrman S T,Ruttenberg K C.Presence and regulation of alkaline phosphatase activity in eukaryotic phytoplankton from the coastal ocean: Implications for dissolved organic phosphorus remineralization[J].Limnology and Oceanography,2006,51: 1381-1390.
[20]Huang B Q,Ou L J,Wang X L,et al.Alkaline phosphatase activity of phytoplankton in East China Sea coastal waters with frequent harmful algal bloom occurrences[J].Aquatic Microbial Ecology,2007,49:195-206.
[21]中华人民共和国国家质量监督检验检疫总局、中国国家标准化管理委员会.GB/T12763-2007,海洋调查规范[S].北京: 中国标准出版社,2007.General Administration of Quality Supervision,Inspection and Quarantine of the People′s Republic of China,Standardization Administration of the People′s Republic of China.GB/T12763-2007,Specifications for Oceanographic Survey[S].Beijing: China Standard Press,2007.
[22]Hoppe H G.Significance of exoenzymatic activities in the ecology of brackish water: Measurements by means of methylumbelliferyl-substrates[J].Marine Ecology Progress Series,1983,11: 299-308.
[23]Pettersson K.Alkaline phosphatase activity and algal surplus phosphorus as phosphorus-deficiency indicators in Lake Erken[J].Archives of Hydrobiology,1980,89:54-87.
[24]陈敏.化学海洋学[M].北京: 海洋出版社,2009.Chen min.Chemical Oceanography[M].Beijing: China Ocean Press,2009.
[25]Healey F P,Hendzel L L.Physiological indicators of nutrient deficiency in lake phytoplankton[J].Canadian Journal of Fisheries and Aquatic Sciences,1980,(37):442-453.
[26]张传松,王江涛,朱德弟,等.2005年春夏季东海赤潮过程中营养盐作用初探[J].海洋学报,2008,30(2):153-159.Zhang chuansong,Wang jiangtao,Zhu dedi et al.The preliminary analysis of nutrients in harmful algal blooms in the East China Sea in the spring and summer of 2005[J].Acta Oceanologica Sinica,2008,30(2):153-159.
[27]Ou L,Huang X,Huang B,et al.Growth and competition for different forms of organic phosphorus by the dinoflagellate Prorocentrum donghaiense with the dinoflagellate Alexandrium catenella and the diatom Skeletonema costatum sl [J].Hydrobiologia,2015:1-13.
(本文编辑: 张培新)
Alkaline phosphatase activity of phytoplankton in Qinhuangdao coastal waters with frequent brown tide occurrences
LIU Xiao-hong,QIN Xian-ling,CAI Yang-yang,OU Lin-jian,LÜ Song-hui
(Research Center for Harmful Algae and Marine Biology/Key Laboratory of Eutrophication and Red Tide Prevention of Guangdong Higher Education Institutes,Jinan University,Guangzhou 510632,China)
Received: Sept.25,2015
Key words:alkaline phosphatase; Aureococcus anophagefferens; dissolved organic phosphate; Qinhuangdao; phosphorus stress
Abstract:Alkaline phosphatase(AP)is a type of ectoenzyme that is expressed by phytoplankton under phosphorus(P)stress states and can hydrolyze dissolved organic P(DOP).AP has been widely used to indicate the P stress status of phytoplankton in the sea.In this study,the AP activity(APA)of phytoplankton during the brown tide of Aureococcus anophagefferens that occurred near the coastal waters of Qinghuangdao was investigated in July 2013.The P status of phytoplankton and the capability of phytoplankton in using DOP during the bloom were analyzed.The results show that the density of A.anophagefferens was as high as 108cells/L when the bloom occurred in the coastal area of Qinhuangdao.DOP was the main P source for phytoplankton growth.The densities of A.anophagefferens showed positive correlations with NO3−,DOP,dissolved inorganic P,and so forth.Phytoplankton expressed abundant AP,and the average APA in water reached as high as 217.72 nmol/(µg·h)chla± 90.86 nmol/(µg·h)chla(350.44 nmol/(L·h)± 130.57 nmol/(L·h)).APA increased significantly with phytoplankton biomass.Our results suggest that A.anophagefferens experienced severe P stress or even P limitation when the brown tide occurred.The bioavailability of P,particularly DOP,may play a key role in the occurrence and persistence of the brown tide of A.anophagefferens in the coastal waters of Qinhuangdao.
中图分类号:P735
文献标识码:A
文章编号:1000-3096(2016)03-0095-06
doi:10.11759/hykx20150925001
收稿日期:2015-09-25; 修回日期: 2015-12-09
基金项目:海洋公益性行业科研专项经费资助项目(201305003-2); 国家自然科学基金项目(U1301235; 41176087)
作者简介:刘晓红(1990-),女,山东临沂人,硕士研究生,主要从事海洋微藻的生理生态学研究,E-mail: yueer2596@163.com,电话:020-85221562; 欧林坚,通信作者,E-mail: torangeou@jnu.edu.cn

