3个棘孢木霉菌株对山新杨组培移栽苗生长和光合特性的影响
姜传英,朱国栋,姚志红,杨兴堂,刘志华,张荣沭
(1.东北林业大学园林学院,黑龙江 哈尔滨 150040; 2.东北林业大学林学院,黑龙江 哈尔滨 150040)
3个棘孢木霉菌株对山新杨组培移栽苗生长和光合特性的影响
姜传英1,朱国栋1,姚志红1,杨兴堂1,刘志华2,张荣沭1
(1.东北林业大学园林学院,黑龙江 哈尔滨 150040; 2.东北林业大学林学院,黑龙江 哈尔滨 150040)
摘要:为了收集具有促进林木生长作用的棘孢木霉(Trichoderma asperellum)功能菌株,本研究采用盆栽方法,以1年龄山新杨(Populus davidiana×P. alba var. pyramidalis)组培移栽苗为试材,分析了根施5×103 cfu·cm-3土的3个棘孢木霉菌株Ta492、Ta536和Ta4分生孢子对山新杨幼苗生长状况、叶绿素含量、光合日变化及光响应曲线特征参数的影响。结果发现,经3个棘孢木霉菌株诱导后,杨树苗苗高、地径及生物量均不同程度地高于对照组(CK);杨树苗叶绿素含量和叶绿素a/b在多数时间点均显著高于CK(P<0.05),为光合速率的提高奠定了物质基础。同时,试验组杨树苗叶片的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)的日变化均高于CK,但变化趋势均与CK相同;并且,最大净光合速率(Pn max)、光饱和点(LSP)、表观量子效率(AQY)等光响应曲线特征参数也在不同程度上高于CK。说明这3个棘孢木霉菌株均能有效提高山新杨的光合能力,促进其生长。并且,Ta536菌株对山新杨幼苗的诱导效果最好。
关键词:棘孢木霉;山新杨;促生长;光合日变化;光响应曲线
木霉菌(Trichoderma)是自然界中普遍存在的生防真菌,是土壤微生物群落的重要组成部分,常见于土壤、植物残体、植物根围和叶围等环境中[1-2]。木霉菌及其相应产品不仅能增强植物抗病能力,而且可以促进植物对养分的吸收,增加作物产量[3-4]。目前,对于木霉菌促生长作用的研究较多,如,哈茨木霉T-17可有效促进甜瓜(Cucumismelo)幼苗期的生长,其机制之一为木霉菌可通过调控激素水平来促进植物生长[5]。田间条件下用深绿木霉诱导番茄(Lycopersiconesculentum),根、茎和叶的干重较对照组增加了3倍,明显提高了作物产量[6]。目前,已经有许多商品化木霉制剂问世,其应用日渐广泛[7-9]。
光合作用是植物体内最重要的生理过程,作物产量的90%直接来源于光合作用产生的有机物[10],光合作用效率是植物生产力和作物产量高低的决定性因素[11]。有研究认为,木霉菌之所以能促进植物生长与其提高叶片叶绿素含量,促进光合作用有很大的关系[12]。为了收集具有促进林木生长作用的棘孢木霉功能菌株,本研究分别采用生防相关的3个棘孢木霉菌株分生孢子诱导1年龄山新杨(Populusdavidiana×P.albavar.pyramidalis)组培移栽苗,观测棘孢木霉对山新杨树苗生长状况及光合特性的影响,结果将为阐明木霉菌通过提高木本植物光合能力来促生长的机制提供依据。同时,验证能促生长的棘孢木霉功能菌株,可为研制生防棘孢木霉菌肥提供物质基础。
1材料与方法
1.1材料
供试菌株:T.asperellumACCC32492(Ta492)、T.asperellumACCC30536(Ta536)购于中国农业微生物菌种保藏管理中心(Agricultural Culture Collection of China, ACCC),T.asperellumT4(Ta4)由东北林业大学林学院森保学科提供。
供试植物:1年龄山新杨组培移栽苗。山新杨组培苗由东北林业大学林学院森保学科提供,采用WPM+6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1培养基继代,采用WPM+IBA 0.4 mg·L-1培养基生根,经扩繁获得大量山新杨组培苗。2013年4月下旬,选取高度10~12 cm,地径1.5~2.5 mm,叶片数为8~12的山新杨组培苗,采用刘志华等[13]的方法对山新杨组培苗进行驯化移栽。将移栽成活的山新杨幼苗放置于温度22 ℃/18 ℃(昼夜温度),自然光照的温室条件下生长。
供试土壤源自哈尔滨市郊的农田地表土。
1.2木霉分生孢子悬液制备
无菌条件下将活化了的棘孢木霉菌种接种在PDA(potato dextrose agar)试管(30 mm×300 mm)斜面培养基上,28 ℃恒温培养5 d,获得大量木霉分生孢子。将分生孢子收集后,用自来水稀释至3×105cfu·mL-1,备用。
1.3试验设计
2013年6月10日将温室驯化的山新杨组培苗栽入21 cm×21 cm的营养钵(盛土量约为6 dm3)并移到东北林业大学园林学院花卉研究所苗圃自然条件下生长。选取长势一致的120株山新杨幼苗,按照随机区组设计,设定4组处理,每个处理为10株苗,3个重复。于7月11日分别取棘孢木霉菌株Ta492(T1)、Ta536(T2)和Ta4(T3)分生孢子悬浮液100 mL浇灌山新杨幼苗根部,使土壤中棘孢木霉分生孢子浓度达到5×103cfu·cm-3,以浇灌同等体积自来水的山新杨幼苗为对照组(CK)。所有山新杨树苗的田间管理方法一致。
1.4指标的测定
1.4.1生长及生物量测定根施木霉当天开始测量山新杨的苗高和地径,之后每隔10 d测量一次,共测量7次。9月10日测量杨树苗生物量。将每株树苗按照根、茎和叶进行组织分类,称量鲜重。其中根组织用自来水洗净泥土,用吸水纸擦干后进行测量。然后,采用Cornelissen等[14]的方法,将根、茎和叶组织进行干燥,称量,获得山新杨不同组织的生物量干重。
1.4.2山新杨叶片中叶绿素含量的测定于木霉诱导0(当天)、3、6、9、12和15 d时,分别采集对照组和试验组无病虫害、无机械损伤、顶生的成熟展开叶,采用分光光度法测定叶绿素含量[15]。
1.4.3山新杨光合日变化和光响应曲线的特征参数测定光合日变化测定:于2013年9月上旬,采用LI-6400XT便携式光合仪,在试验组和对照组中各随机选取3株长势一致的山新杨幼苗,每株苗选择3片成熟健康的顶生叶片,在晴朗无风、光照充足的天气进行测定。在08:00-16:00,每隔2 h检测净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)等光合指标。
光响应曲线测定:于9月上旬3个晴天09:00-12:30,利用LI-6400XT内置6400-02LED红蓝光源和6400-01CO2注入系统测量光合-光强响应曲线。选取朝向一致,健壮顶生且无病虫害的叶片。光合有效辐射设定为2 000、1 800、1 600、1 400、1 200、1 000、800、600、400、200、150、100、50、20、0 μmol·(m2·s)-1,CO2浓度为350 μL·L-1,叶面温度控制在(30±1) ℃,记录不同光照强度所对应的净光合速率,每一光照梯度读取数据3次,该试验重复3次。
采用Farquhar模型[16]进行光响应曲线拟合,计算最大净光合速率(Pn max)、表观量子效率(AQY)以及暗呼吸速率(Rd)等参数。模型的理论公式见(1)。
Pn={EQ+Pn max-sqrt[(QE+Pn max)2-4QPn maxEk]}/(2k)-Rd
(1)
式中:E为光照强度,Pn为净光合速率,Pn max为最大净光合速率,Q为表观量子效率(AQY),k为曲角,Rd为暗呼吸速率。
将0~200 μmol·(m2·s)-1低光强下的光响应曲线进行线性回归分析,计算光饱和点(LSP)、光补偿点(LCP)等参数。
1.5数据分析
测得的数据采用Microsoft Office Excel 2007软件包及Minitab 16统计软件包进行统计分析。对同一时间点处理与对照间的差异显著性进行ANOVA分析,在P=0.05水平下比较差异显著性。
2结果与分析
2.1木霉菌对山新杨生长的影响
2.1.1苗高的生长动态3个棘孢木霉菌株分生孢子均可有效促进山新杨幼苗苗高的增长(图1)。木霉菌诱导后30 d内,对山新杨苗高增长影响不显著(P>0.05)。但是,根施木霉30 d后,试验组幼苗与CK相比差异逐渐增大,在木霉诱导40 d时,T1和T2组山新杨苗高显著高于CK(P<0.05)。木霉菌诱导50 d时,试验组山新杨苗高均显著高于CK。当木霉诱导60 d时,山新杨苗高的大小顺序为T2>T1>T3>CK,此时,试验组T1、T2、T3苗高分别比CK增加9.53%、11.90%和9.04%(图1)。
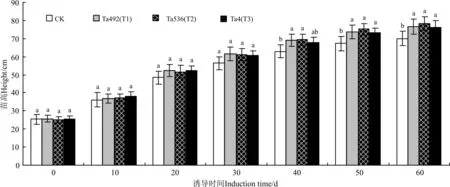
图1 3株棘孢木霉菌诱导后山新杨幼苗苗高的生长动态
注:不同小写字母表示在相同诱导时间不同木霉菌诱导处理间差异显著(P<0.05)。下同。
Notes:Different lower case letters within the same induction time represent significant difference among different treatments of Ta492, Ta536 and Ta4 at 0.05 level. The same below.
2.1.2地径的生长动态棘孢木霉对山新杨幼苗地径的生长具有促进作用(图2)。在木霉菌诱导20 d时,开始出现显著差异,此时T3组山新杨地径显著大于CK(P<0.05);木霉菌诱导50 d时,T2和T3组山新杨地径均显著大于CK;木霉菌诱导60 d时,T1、T2和T3组幼苗地径分别较CK增加了3.73%、5.24%和4.89%(图2)。
2.1.3生物量产量比较经棘孢木霉诱导60 d后山新杨各组织干重发现,棘孢木霉对山新杨根的干重影响较大,T1、T2和T3根组织的干重均显著高于CK(P<0.05),且较CK分别增加了11.42%、16.43%和13.61%(图3);对茎组织干重的影响,只有T2组显著高于CK,而T1和T3组茎的干重仅分别为对照的1.083和1.096倍(P>0.05);对叶组织干重的影响为T2和T3组均显著高于CK,分别较CK增加14.81%和14.69%(图3)。对比不同菌株诱导对山新杨干重的影响发现,3个棘孢木霉菌株都能促进杨树苗生物产量的增加,并且,棘孢木霉Ta536(T2)诱导下树苗生物量的增加效果最好。

图2 3株棘孢木霉菌诱导后山新杨幼苗地径的生长动态

图3 3株棘孢木霉诱导60 d后单株山新杨
2.2根施木霉菌对山新杨叶绿素含量的影响
棘孢木霉分生孢子诱导山新杨15 d内,叶片中叶绿素含量呈上升趋势,在不同时间点,3个菌株对叶绿素含量的影响程度不同,并且试验组叶绿素含量均高于CK(图4A)。在木霉诱导6和15 d,试验组叶绿素含量均显著高于CK(P<0.05);此外,诱导3-15 d,T2组叶绿素含量一直显著高于CK组(P<0.05)。
另一方面,叶绿素a/b的变化也呈上升趋势,在不同时间点,3个菌株对叶绿素a/b的影响程度不同,并且试验组叶绿素a/b均高于CK(图4B)。在木霉菌诱导3和6 d时,试验组叶绿素a/b均显著高于CK(P<0.05);并且诱导3-15 d时,T2组叶绿素a/b一直显著高于CK组(P<0.05)。结果表明,根施棘孢木霉提高山新杨的叶绿素总量,能很大程度地增大叶绿素a/b,而叶绿素a/b在一定程度上可以反映植物对光能的利用能力。此外,对比3个棘孢木霉菌株对山新杨叶绿素含量及叶绿素a/b的影响发现,棘孢木霉Ta536的诱导效果最好。

图4 3株棘孢木霉菌诱导后山新杨幼苗叶片中叶绿素含量及叶绿素a/b的变化
2.3山新杨光合日变化因子动态分析
2.3.1净光合速率日变化试验组与CK组山新杨幼苗的净光合速率变化趋势一致,均为“单峰型”曲线,并且都在12:00出现峰值(图5)。在08:00,4组山新杨幼苗净光合速率差异不显著(P>0.05);在10:00,随着光照的增强及叶面温度的升高,净光合速率逐渐增加,且试验组山新杨叶片净光合速率增加幅度显著大于CK组(P<0.05)。T1、T2和T3净光合速率比08:00时分别增加了20.06%、31.76%和30.60%,而CK仅增加了11.24%。12:00之后,山新杨叶片净光合速率逐渐下降。在14:00,CK组的净光合速率迅速下降,而试验组的净光合速率仍保持较高水平,T1、T2和T3净光合速率分别为20.94、22.11和22.18 μmol·(m2·s)-1,而CK仅为16.38 μmol·(m2·s)-1。通过对比4组山新杨净光合速率的日变化动态发现,在10:00-14:00,经棘孢木霉分生孢子诱导后的山新杨叶片净光合速率显著高于CK组,且能维持较高的净光合速率,这说明根施棘孢木霉能够有效增加叶片的净光合速率,而且可以延长高水平净光合速率的时间,有利于有机物质积累。
2.3.2气孔导度日变化试验组和CK组山新杨气孔导度(Gs)日变化趋势均为“双峰型”(图6)。从08:00-10:00,Gs逐渐增大;在10:00出现第1个峰值,此时,T1、T2和T3组山新杨叶片Gs分别是CK的1.087、1.178和1.177倍(P<0.05);在12:00出现谷点,试验组Gs显著高于CK组;在14:00,Gs出现第2个峰值,此时T1、T2和T3组Gs分别是CK的1.203、1.316和1.320倍。对比试验组和CK组山新杨叶片Gs日变化发现,试验组山新杨Gs在整个测定过程中均显著高于CK组(P<0.05)。说明根施棘孢木霉能有效促进叶片气孔的开放,而气孔是植物叶片与外界进行气体交换的主要通道[17],气孔的开闭在调控光合速率和蒸腾速率中具有重要的作用。

图5 3株棘孢木霉菌诱导后山新杨幼苗净光合速率日变化

图6 3株棘孢木霉菌诱导后山新杨幼苗气孔导度日变化
2.3.3胞间CO2浓度的日变化试验组和CK组山新杨叶片的胞间CO2浓度(Ci)日变化趋势均为先下降后上升,在12:00为最低点(图7),这与净光合速率日变化趋势正好相反(图5)。在08:00-12:00时,Ci逐渐下降,这可能是净光合速率增强,消耗的CO2逐渐增多所致;在12:00,净光合速率最大,消耗的CO2最多,而此时气孔导度最低,不能及时补给CO2,致使Ci处于最低点;之后气孔逐渐开放,而净光合速率也逐渐下降,消耗的CO2的量逐渐减少。因此,Ci会逐渐上升。在10:00-14:00时,由于试验组山新杨净光合速率显著高于CK(P<0.05),消耗的CO2的量也要高于CK,可能导致4组处理间Ci差异不显著(P>0.05)。在08:00时,4组山新杨叶片净光合速率差异不显著(P>0.05),而试验组气孔导度显著高于CK组(P<0.05),使得Ci高于CK组。因此,试验组山新杨Ci在5个检测时刻中只有在08:00时显著高于CK组(P<0.05),在12:00时,只有T2组显著高于CK(P<0.05),在其它时刻的虽然高于CK,并没有出现显著差异(P>0.05)。
2.3.4蒸腾速率的日变化试验组和CK组山新杨的蒸腾速率(Tr)日变化趋势均呈现“双峰型”曲线。在08:00时Tr最低,在10:00和14:00,Tr出现峰值,这与气孔导度日变化趋势一致(图8)。除08:00和10:00时T1处理外,试验组山新杨叶片Tr均显著高于CK(P<0.05),并在14:00达到最大值,此时T1、T2和T3的Tr分别是CK的1.21、1.30和1.25倍。这可能是由于棘孢木霉增大了山新杨的气孔导度,而气孔的开放程度增大必会导致蒸腾速率增大。
2.4山新杨叶片的光合-光强响应曲线及其参数分析
对山新杨光合-光强响应曲线进行拟合的结果表明,山新杨叶片光响应拟合值与观测值相关度都较高,相关系数(R2)在0.95~0.99。试验组T1、T2和T3组山新杨叶片Pn max均高于CK组,表现为T2>T3>T1>CK,且T2组显著高于CK组(P<0.05),这有利于促进光合产物的积累。
在低光强PAR≤200 μmol·(m2·s)-1下,对Pn-PAR进行直线回归,获得线性方程及其相关系数,并计算LSP和LCP(表1)。结果表明,试验组山新杨LSP明显高于CK,T1、T2和T3的LSP分别是CK的1.04、1.13和1.07倍;而且,T2和T3组的AQY也高于CK(虽然T1与CK的AQY差异不大)。LSP反映了植物对强光的适应能力[18],而AQY是光合作用中光能转化效率的重要指标[19],能够反映植物对弱光的利用效率。结合本研究结果分析,3个棘孢木霉菌株增大了山新杨对高光强的适应范围,Ta536(T2)、Ta4(T3)提高了山新杨对弱光的利用效率。此外,Rd反映了植物消耗光合产物的速率,LCP反映了植物对弱光的适应能力[18],LCP越小,植物对弱光的适应能力越强。而本研究中,试验组山新杨的Rd与LCP高于CK组,这说明棘孢木霉分生孢子提高了山新杨的暗呼吸速率,但并没有提高对弱光的适应能力。

图7 3株棘孢木霉菌诱导后山新杨幼苗胞间CO2浓度日变化

图8 3株棘孢木霉菌诱导后山新杨幼苗蒸腾速率日变化

处理Treatment最大净光合速率Pnmax/μmolCO2·(m2·s)-1光饱和点LSP/μmol·(m2·s)-1光补偿点LCP/μmol·(m2·s)-1表观量子效率AQY/μmol·mol-1暗呼吸速率Rd/μmol·(m2·s)-1CK26.786±1.82b589.776±13.05b43.123±0.42b0.062±0.002ab2.366±0.05bT127.970±1.07ab615.061±17.64b44.245±0.62ab0.062±0.003b2.407±0.03abT231.221±1.45a667.920±22.46a43.500±0.43b0.066±0.001ab2.434±0.05abT329.353±1.21ab632.000±10.39ab44.940±0.54a0.066±0.002a2.543±0.06a
3讨论与结论
木霉是一类重要的生防真菌,不仅对土传病原菌具有拮抗作用,而且能通过提高植物免疫机制来促进植物生长[6,20]。前期研究发现,根施棘孢木霉Ta650分生孢子对山新杨生长和光合作用都具有积极的影响[21]。为更多地收集具有促进林木生长的棘孢木霉功能菌株,本研究用3个棘孢木霉菌株Ta492、Ta536、Ta4分生孢子诱导山新杨组培移栽苗,结果发现,经3个棘孢木霉菌株诱导后,杨树苗苗高、地径及生物量均在不同程度上高于CK,并Ta536的促生长效果最好。说明这3个棘孢木霉菌株均能有效促进山新杨幼苗生长,这为研制促进林木生长的复方棘孢木霉生物菌肥提供了理论依据和物质基础。
光合作用是植物体内重要的反应,为植物的生长发育和物质代谢提供基础和能量,它的强弱对植物生长具有重要影响,所以光合作用参数可以作为评价植物生长状况的指标[22-23]。本研究检测了3个棘孢木霉菌株分生孢子诱导山新杨幼苗15 d内叶绿素含量和叶绿素a/b的变化,这15 d正是杨树苗营养生长旺盛期,也是大量施入的木霉菌对杨树苗生长的土壤环境影响最大的时期。研究认为,木霉菌在土壤中能快速传播、强势定殖,能通过穿透植物根表皮和皮下的部分细胞长期存活在根系表面[24],对土壤微生物环境产生较大影响。本研究发现,在木霉菌诱导后3 d,山新杨叶绿素及叶绿素a/b迅速增加,说明棘孢木霉菌对杨树苗叶绿素合成的影响作用快,影响大;而且,对叶绿素a的合成影响大于叶绿素b。叶绿素a是光合作用中最主要的捕光色素之一[25],叶片叶绿素a含量的提高为光合速率的提高提供了物质基础,而较高的光合速率则是作物高产的前提[26]。叶绿素含量和叶绿素a/b在不同时间点的波动或许是由于土壤中固有的和外施的木霉菌与生态环境、其它微生物进行菌群平衡调节的结果,具体机制有待进一步研究。
植物光合作用日变化是植物生产生物产量的基本单元,同时也是分析外界环境因素对植物生理代谢影响的重要指标[27]。植物的净光合速率日变化一般为“单峰型”曲线或“双峰型”曲线。杨树作为一种阔叶树种,在烈日夏季经常出现“午休”现象,如,在攀西干旱河谷的旱季和雨季四季杨(Populusdeltoides×P.nigra)和南抗杨(P.delteidescv. nankang)叶片的净光合速率日变化呈“双峰型”曲线,均表现出明显的光合“午休”现象[28];在辽宁锦州,中辽1号(Populus×canadensis ‘Zhongliao1’)的净光合速率日变化呈“双峰型”曲线,而辽宁杨(Populus×liaoningensis)、DM-9-18(P.deltoides×P.maximowiczii)、小青杨(P.pseudo-simonii)和小叶杨(P.simonii),均为“单峰型”[29]。本研究中,山新杨幼苗净光合速率日变化为“单峰型”曲线,并没有出现光合“午休”现象,并且在12:00时净光合速率达到峰值。众多研究发现,净光合速率一般与气孔导度呈正相关[30-33]。而本研究中,气孔导度日变化却为“双峰型”曲线,在12:00时,气孔导度达到谷点,说明此时山新杨叶片气孔关闭程度达到最大,但净光合速率并没有受到气孔关闭的影响,净光合速率达到峰值,说明此时光照强度可能是影响净光合速率的最重要因素。由于山新杨在中午时净光合速率最高,消耗大量的CO2,同时气孔大程度关闭,造成不能及时补给CO2,致使胞间CO2浓度下降至最低点。采用喷雾法向番茄植株接种哈茨木霉,可以有效增加番茄光合有效面积,同时,木霉菌诱导了卡尔文循环关键基因的表达,从而提高净光合速率,提高作物产量[34]。本研究中,经不同棘孢木霉菌株分生孢子诱导后,山新杨幼苗的净光合速率显著提高,在10:00-14:00,试验组山新杨幼苗净光合速率一直处于高水平状态,而对照组在10:00与14:00时间点,净光合速率仅为T2组净光合速率的81.12%和74.09%。其次,试验组棘孢木霉显著(P<0.05)增大了山新杨叶片气孔导度。而气孔的开张程度对植物光合作用发挥着重要作用,气孔可以根据环境条件的变化来调节开度的大小,使植物在损失水分较少的条件下获取最多的CO2,供植物进行光合作用[17]。因此,棘孢木霉增大了山新杨的气孔导度,从而提高了净光合速率,增加生物量产量。棘孢木霉促进光合作用的进行,是否激发光合作用相关基因表达,需要进一步研究。
光补偿点(LCP)和光饱和点(LSP)是植物光合能力的重要体现。本研究中,对山新杨光合作用光响应曲线进行拟合,并以此为基础计算了LSP、LCP、AQY、Pn max、Rd,经分析可知,棘孢木霉增强了山新杨叶片在高光强下的光合能力,增大了对高光强的利用范围,有利于有机物质的积累。此外,T2和T3组的AQY高于CK,T1组与CK组差异不明显,说明棘孢木霉Ta536、Ta4增强了山新杨叶片对弱光的利用能力,而Ta492效果不明显。此外,试验组的LCP和Rd高于CK,原因可能是在弱光条件下,棘孢木霉使得山新杨幼苗暗呼吸增强,消耗有机物的量高于CK,导致光补偿点增大,但具体原因还有待进一步研究。
综合分析根施棘孢木霉分生孢子后山新杨生长及光合特性的变化可知,棘孢木霉Ta492、Ta536、Ta4对山新杨幼苗的生长和光合作用都有积极的影响,并且棘孢木霉Ta536诱导效果最好。
参考文献References:
[1]Harman G E,Howell C R,Viterbo A,Chet I,Lorito M.Trichodermaspecies-opportunistic,avirulent plant symbionts.Nature Reviews Microbiology,2004,2:43-56.
[2]张茹,李金华,柴兆祥,王蒂.甘肃河西马铃薯根际生防木霉菌对接骨木镰刀菌的拮抗筛选及鉴定.草业学报,2009,18(2):138-145.
Zhang R,Li J H,Chai Z X,Wang D.Screening of biocontrolTrichodermafrom potato rhizosphere of Western Gansu againstFusariumsambucinumand their identification.Acta Prataculturae Sinica,2009,18(2):138-145.(in Chinese)
[3]Lorito M,Woo S L,Harman G E,Monte E.Translational research onTrichoderma:From omics to the field.Annual Review of Phytopathology,2010,48:395-418.
[4]Yedidia I,Benhamou N,Chet I.Induction of defense responses in cucumber plants (CucumissativusL.) by the biocontrol agentTrichodermaharzianum.Applied and Environmental Microbiology,1999,65:1061-1070.
[5]Martínez-Medina A,Del Mar Alguacil M,Pascual J A,van Wees S C.Phytohormone profiles induced byTrichodermaisolates correspond with their biocontrol and plant growth-promoting activity on Melon plants.Journal of Chemical Ecology,2014,40:804-815.
[6]Gravel V,Antoun H,Tweddell R J.Growth stimulation and fruit yield improvement of greenhouse tomato plants by inoculation withPseudomonasputidaorTrichodermaatroviride:Possibile role of indole acetic acid(IAA).Soil Biology and Biochemistry,2007,39:1968-1977.
[7]Vinale F,Sivasithamparam K,Ghisalberti E L,Marra R,Woo S L,Lorito M.Trichodermaplant-pathogen interactions.Soil Biology and Biochemistry,2008,40(1):1-10.
[8]Bhuya S A.Antagonistic effect ofT.viride,T.harzianumandAsperigillusterreusonRhizoctoniasolanicausing sheath blight of rice.Journal of Agricultural Science Society of North East India,1994,7(1):125-128.
[9]龚明波.木霉厚垣抱子制剂的防病促生机制研究.北京:中国农业科学院硕士学位论文,2004.
Gong M B.Mechanism of biocontrol and plant-growth-promoting of a kind of preparation ofTrichodermaspp. chlamydospores.Master Thesis.Beijing:Chinese Academy of Agricultural Sciences,2004.(in Chinese)
[10]Lian L,Wang X W,Zhu Y S,He W,Cai Q H,Xie H A,Zhang M Q,Zhang J F.Physiological and photosynthetic characteristics of indica Hang2 expressing the sugarcanePEPCgene.Molecular Biology Reports,2014,41:2189-2197.
[11]许大全.光合作用效率.上海:上海科学技术出版社,2002:163-167.
Xu D Q.Efficiency of Photosynthesis.Shanghai:Shanghai Scientific and Technical Publishers,2002:163-167.(in Chinese)
[12]陈伯清,屈海泳,刘连姝.木霉HT-03对番茄幼苗叶绿素和保护酶的影响.江苏农业科学,2007(3):112-114.
Chen B Q,Qu H Y,Liu L S.Effects ofTrichodermaharziarumstrain HT-03 on chlorophyl content and antioxidases activity of tomato seedling.Jiangsu Journal of Agricultural Sciences,2007(3):112-114.(in Chinese)
[13]刘志华,王志英,王玉成,张荣沭,刁桂萍,古丽吉米拉·米吉提,王娜,窦恺.一种杨树组培苗的生根移栽方法.中国专利:201210074323.6,2012-07-11.
Liu Z H,Wang Z Y,Wang Y C,Zhang R S,Diao G P,Gulijimila·Mijiti,Wang N,Dou K.A kind of rooting and transplanting method of poplar tissue culture seedlings.China Patent:201210074323.6,2012-07-11.(in Chinese)
[14]Cornelissen J H C,Lavorel S,Garnaier E,Díaz S,Buchmann N,Gurvich D E,Reich P B,Steege H,Morgan H D,Heijden M G A,Pausas J G,Poorter H.A handbook of protocols for standardized and easy measurement of plant functional traits worldwide.Australian Journal of Botany,2003,51:335-380.
[15]王学奎.植物生理生化实验原理与技术.北京:高等教育出版社,2006:278-279.
Wang X K.Principles and Techniques of Plant Physiological Biochemical Experiment.Beijing:Higher Education Press,2006:278-279.(in Chinese)
[16]Farquhar G D,Von Caemmerers S,Berry J A.A biochemical model of photosynthetic CO2assimilation in leaves of C3species.Planta,1980,149:78-90.
[17]莫凌,黄玉清,桂堂辉,黎彦余.5个热带禾本科牧草品种的光合-光响应特性研究.草业科学,2010,27(9):64-68.
Mo L,Huang Y Q,Gui T H,Li Y Y.Photosynthesis-light response characteristics of five tropical forage cultivars.Pratacultural Science,2010,27(9):64-68.(in Chinese)
[18]刘玲,刘淑明,孙丙寅.不同产地花椒幼苗光合特性研究.西北农业学报,2009,18(3):160-165.
Liu L,Liu S M,Sun B Y.Research of the photosynthetic characteristics ofZanthoxylumbungeanumseedlings in different producing areas.Acta Agriculturae Boreali-Occidentalis Sinica,2009,18(3):160-165.(in Chinese)
[19]王爱民,祖元刚.大兴安岭不同演替阶段白桦种群光合生理生态特征.吉林农业大学学报,2005,27(2):190-193.
Wang A M,Zu Y G.Photosynthetic characteristics of birch during different succession stage in Great Xing’an Mountain.Journal of Jilin Agricultural Univemity,2005,27(2):190-193.(in Chinese)
[20]Harman G E.Multifunctional fungal plant symbionts:New tools to enhance plant growth and productivity.New Phytologist,2011,189:647-649.
[21]朱国栋,吕曼曼,杨兴堂,王慧,刘志华,张荣沭.木霉Ta650对杨树移栽苗生长及光合特性的影响.中国农学通报,2015,31(10):7-12.
Zhu G D,Lyu M M,Yang X T,Wang H,Liu Z H,Zhang R S.Effects ofTrichodermaasperellum650 on the growth and leaf photosynthetic characteristics of transplanted poplar seedlings (Populusdavidiana×P.albavar.pyramidlis).Chinese Agricultural Science Bulletin,2015,31(10):7-12.(in Chinese)
[22]吕鹏,张吉旺,刘伟,杨今胜,董树亭,刘鹏,李登海.施氮时期对高产夏玉米光合特性的影响.生态学报,2013,33(2):576-585.
Lyu P,Zhang J W,Liu W,Yang J S,Dong S T,Liu P,Li D H.Effects of nitrogen application stages on photosynthetic characteristics of summer maize in high yield conditions.Acta Ecologica Sinica,2013,33(2):0576-0585.(in Chinese)
[23]庞立东,李卫军,朱进忠.追施氮肥对苏丹草光合特性及种子产量的影响.草业科学,2014,31(12):2286-2292.
Pang L D,Li W J,Zhu J Z.Effects of topdressing nitrogen fertilizer on photosynthetic characteristics and seed yields of Sudangrass.Pratacultural Science,2014,31(1):102-107.(in Chinese)
[24]陈为京,李润芳,杨焕明,陈建爱.黄绿木霉T1010对日光温室番茄功能叶光合色素含量及光系统Ⅱ光化学效率的影响.中国农学通报,2010,26(9):178-183.
Chen W J,Li R F,Yang H M,Chen J A.Effect ofTrichodermaaureoviride1010 on chlorophyⅡ and carotenoid content and Fv/Fmof tomato functional leaves in solar-greenhouse.Chinese Agricultural Science Bulletin,2010,26(9):178-183.(in Chinese)
[25]曹翠玲,李生秀.供氮水平对小麦生殖生长时期叶片光合速率、NR活性和核酸含量及产量的影响.植物学通报,2003,20(3):319-324.
Cao C L,Li S X.Effect of nitrogen level on the photosynthetic rate,NR activity and the contents of nucleic acid of wheat leaf in the stage of reproduction.Chinese Bulletin of Botany,2003,20(3):319-324.(in Chinese)
[26]Gorai T,Katayama T,Obata M,Murata A,Taguchi S.Low blue light enhances growth rate,light absorption,andphotosynthetic characteristics of four marine phytoplankton species.Journal of Experimental Marine Biology and Ecology,2014,459(5):87-95.
[27]李小平,王景燕,王东,胡庭兴,陈宏志,龚伟.施肥水平对巨桉幼树叶片气体交换日变化的影响.应用生态学报,2010,21(11):2734-2741.
Li X P,Wang J Y,Wang D,Hu T X,Chen H Z,Gong W.Effects of fertilization level on diurnal variation of gas exchange of youngEucalyptusgrandisleaf.Chinese Journal of Applied Ecology,2010,21(11):2734-2741.(in Chinese)
[28]杨再强,谢以萍,王立新.四季杨和南抗杨光合特性的研究.华中农业大学学报,2008,27(5):654-658.
Yang Z Q,Xie Y P,Wang L X.Photosynthetic characteristics of evergreen poplar and nankang poplar.Journal of Huazhong Agricultural University,2008,27(5):654-658.(in Chinese)
[29]刘巍,蔄胜军,丁勇,纪纯阳.5种不同杨树光合指标日变化分析.西南林业大学学报,2015,35(6):19-25.
Liu W,Man S J,Ding Y,Ji C Y.Studies diurnal variation of photosynthesis on five species of poplars.Journal of Southwest Forestry University,2015,35(6):19-25.(in Chinese)
[30]祁娟,师尚礼,徐长林,闫伟红,张小娇.4种披碱草属植物光合作用光响应特性的比较.草业学报,2013,22(6):100-107.
Qi J,Shi S L,Xu C L,Yan W H,Zhang X J.A comparison of photosynthesis responses to light of fourElymusspecies.Acta Prataculturae Sinica,2013,22(6):100-107.(in Chinese)
[31]宗建伟,杨雨华,杨风岭,梁亚红,刘杜玲,朱海兰.4个核桃品种光合特性的日变化.草业科学,2013,30(3):397-401.
Zong J W,Yang Y H,Yang F L,Liang Y H,Liu D L,Zhu H L.Diurnal changes of photosynthetic characters of fourJuglansregiacultivars.Pratacultural Science,2013,30(3):397-401.(in Chinese)
[32]谌晓芳.鸡桑叶片光合速率与气孔导度及微气象因子的相关性研究.中国农学通报,2008,24(11):197-201.
Chen X F.On the correlativity between the photosynthetic rate ofMorusaustralisPoir and the leads degree of air hole as well as tiny meteorological phemomena factors.Chinese Agricultural Science Bulletin,2008,24(11):197-201.(in Chinese)
[33]杨学军,武菊英,滕文军,袁小环.青绿苔草光合作用日变化及季节动态.草业科学,2014,31(1):102-107.
Yang X J,Wu J Y,Teng W J,Yuan X H.Daily and seasonal variation of photosynthetic characteristics ofCarexleucochlora.Pratacultural Science,2014,31(1):102-107.(in Chinese)
[34]陈双臣,姬德刚,李聪,刘爱荣,王洪涛,林晓民.哈茨木霉诱导番茄叶片光合生理变化的研究.园艺学报,2014,41(3):489-497.Chen S C,Ji D G,Li C,Liu A R,Wang H T,Lin X M.Effects ofTrichodermaharzianumon photosynthetic characteristics in tomato leaves infected withFulviafulva.Acta Horticulturae Sinica,2014,41(3):489-497.(in Chinese)
(责任编辑武艳培)
Effects of three Trichoderm aasperellum strains on the growth and photosynthetic characteristics of tissue-culturedPopulusdavidiana×P.albavar.pyramidalisseedlings
Jiang Chuan-ying1, Zhu Guo-dong1, Yao Zhi-hong1, Yang Xing-tang1, Liu Zhi-hua2, Zhang Rong-shu1
(1.College of Landscape Architecture, Northeast Forestry University, Harbin 150040, China;2.School of Forestry, Northeast Forestry University, Harbin 150040, China)
Abstract:In order to collect Trichoderma asperellum strains which could promote the growth of woody plants, pot experiment was carried out with one-year-old tissue-cultured seedlings of Populus davidiana×P. alba var. pyramidalis to study the effects of three strains of T. aspereullm: ACCC32492 (Ta492), ACCC30536 (Ta536) and T4(Ta4) on the growth, the chlorophyll contents, diurnal variation of photosynthesis and light response curve characteristic parameters. The results showed that the height, basal stems diameter and biomass yields of the poplar seedlings inoculated with these T. asperellum strains were higher than those of the control (CK) at different levels. At most of the time points, the chlorophyll contents and chlorophyll a/b ratios in the leaves of the inoculated poplars were significantly higher (P<0.05) than those of CK which laid material foundation for the improvement of photosynthetic rate. The net photosynthetic rate (Pn), stomatal conductance (Gs) and transpiration rate (Tr) of the poplars inoculated with these T. asperellum strains increased compared with those of CK, but their respective time-course changing trends were the same as CK. The maximum net photosynthetic rate (Pn max), the light saturation point (LSP) and the apparent quantum efficiency (AQY) of the poplars inoculated with T. asperellum strains were higher than those of the CK. All the above results indicated that inoculation of the three T. asperellum strains could significantly improve the photosynthetic efficiency and growth of poplar seedlings. T. asperellum ACCC30536 strain had the best effects on the growth of poplar seedlings.
Key words:Trichoderma asperellum; Populus davidiana×P. alba var. pyramidlis; growth promotion; diurnal variation of photosynthesis; light response curve
DOI:10.11829/j.issn.1001-0629.2015-0625
*收稿日期:2015-11-10接受日期:2016-02-24
基金项目:中央高校基本科研业务费专项资金(2572015EY01);国家自然科学基金资助项目(31370642);林木遗传育种国家重点实验室(东北林业大学)开放基金(201202)
通信作者:张荣沭(1965-),女,黑龙江哈尔滨人,副教授,博士,主要从事园林植物种质资源研究及植物病害生物防治。E-mail:zrs6504@sina.com
中图分类号:Q945.11
文献标志码:A
文章编号:1001-0629(2016)6-1189-11*
Corresponding author:Zhang Rong-shuE-mail:zrs6504@sina.com
姜传英,朱国栋,姚志红,杨兴堂,刘志华,张荣沭.3个棘孢木霉菌株对山新杨组培移栽苗生长和光合特性的影响.草业科学,2016,33(6):1189-1199.
Jiang C Y,Zhu G D,Yao Z H,Yang X T,Liu Z H,Zhang R S.Effects of threeTrichodermaasperellumstrains on the growth and photosynthetic characteristics of tissue-culturedPopulusdavidiana×P.albavar.pyramidalisseedlings.Pratacultural Science,2016,33(6):1189-1199.
第一作者:姜传英(1990-),女,山东章丘人,在读硕士生,主要从事园林植物种质资源研究及植物病害生物防治。E-mail:1392206572@qq.com

