阿勒泰羊CFD基因的克隆及其在不同营养状态阿勒泰羊尾脂中的表达分析
李星艳,王世银,许瑞霞,王新华,刘守仁,张伟,唐红
(1.新疆农垦科学院畜牧兽医研究所,新疆石河子 832000;2.新疆石河子工程技术学校,新疆石河子 832000;3.新疆农业职业技术学院,新疆昌吉 831100)
阿勒泰羊CFD基因的克隆及其在不同营养状态阿勒泰羊尾脂中的表达分析
李星艳1,2,王世银3,许瑞霞1,王新华1,刘守仁1,张伟3,唐红1
(1.新疆农垦科学院畜牧兽医研究所,新疆石河子832000;2.新疆石河子工程技术学校,新疆石河子832000;3.新疆农业职业技术学院,新疆昌吉831100)
摘要:【目的】获取阿勒泰羊CFD基因序列,研究CFD基因在阿勒泰羊不同组织中的表达情况,及其在不同营养状态阿勒泰羊尾脂中表达量的变化,为深入研究CFD基因对阿勒泰羊尾脂沉积的调控作用奠定基础,并最终用于低脂肪绵羊品种的培育。【方法】以阿勒泰羊尾脂cDNA为模板,进行CFD基因克隆及序列分析,采用RT-PCR技术研究CFD基因在阿勒泰羊不同组织中的表达情况,采用qRT-PCR技术分析CFD基因在不同营养状态阿勒泰羊尾脂中表达量的变化。【结果】克隆了阿勒泰羊CFD基因,CFD基因在阿勒泰羊心脏、肝脏、脾脏、肺脏、肌肉、尾脂组织中均有表达,其中在尾脂组织中表达水平最高。CFD基因在阿勒泰羊正常饲喂阶段尾脂组织中的表达量极显著低于饥饿饲养阶段尾脂组织中的表达(P<0.01)。【结论】CFD基因主要是通过促进脂肪分解而对阿勒泰羊尾脂沉积进行调控。
关键词:阿勒泰羊;CFD基因;尾脂
0前 言
【研究意义】近年来,随着生活水平的不断提高,以及高脂肪食物对心脑血管健康的影响,人们对低脂肪羊肉的需求量越来越大。新疆很多地方绵羊品种由于适应性强、耐粗饲的优良特点曾在当地养羊业中占据重要地位,但是随着人们饮食结构的变化,这些绵羊品种由于瘦肉率较低已不能适应市场发展的需求,所以研究绵羊脂肪沉积相关基因及其调控机制,培育低脂肪绵羊品种对当前绵羊育种有重要意义。已有的研究结果表明,CFD(Complement Factor D)基因在动物脂肪代谢调控中发挥着重要作用。研究以脂尾型绵羊品种阿勒泰羊为研究对象,研究其在不同代谢状态阿勒泰羊中的表达情况,为进一步阐明其在阿勒泰羊脂肪沉积中的调控机理进而用于培育低脂肪绵羊品种奠定基础。【前人研究进展】1985年学者Cook等在研究小鼠3T3-F442A脂肪细胞时发现了CFD(Complement Factor D)基因及其所编码的28 kDa的蛋白,其基因定位于小鼠的第10号染色体43.0 cM上。CFD基因大小为1 748 bp,包含5个外显子和4个内含子,外显子大小分别为74、157、148、258和230 bp,内含子大小分别为475、90、141和175 bp。CFD基因保留了丝氨酸蛋白酶基因家族的基本外显子结构特征,但CFD基因中有两个外显子是熔接的,而这2个外显子在其他的丝氨酸蛋白酶基因中是分离的[1,2]。CFD是一种丝氨酸蛋白激酶,是酰化刺激蛋白acylation stimulating protein (ASP)合成所必需的。它主要由脂肪组织分泌并释放入血。研究表明,在瘦素缺陷型小鼠模型“ob/ob”、瘦素受体缺陷型小鼠模型“db/db”以及谷氨酸钠(monosodium glutamate, MSG)处理的糖尿病小鼠模型的脂肪组织中,CFDmRNA及蛋白质水平均显著减少[3]。在不同物种中CFD基因的表达似乎有组织差异,已有的研究结果表明小鼠CFD基因几乎是脂肪组织特异性表达,而人类CFD却主要是由单核/巨噬细胞系统合成的[4-7]。目前,关于小鼠CFD基因的研究主要集中在肥胖以及血脂代谢等方面。Zhu等关于大鼠肺动脉高压模型的研究结果显示,CFD基因在肺组织中的表达水平显著增强[8,9],具体的机制尚不清楚;王晓蕾(2005) 等[10]发现,CFD基因的表达变化可能与糖尿病的发病有关,可以作为深入研究和治疗糖尿病的候选基因。Lo JC等研究报道,由脂肪细胞生成的一种细胞信号蛋白CFD在刺激胰岛素分泌、控制血糖中发挥了一种从前未预料到的、至关重要的作用,CFD有可能是长期以来寻找的、将脂肪组织代谢和胰腺β细胞功能联系到一起的分子[11,12]。【本研究切入点】CFD基因在脂肪组织生理功能和能量代谢中非常主要。通过文献检索未见相关的研究报道。阿勒泰羊是新疆一种优良的地方绵羊品种,由于其脂肪沉积能力很强,可以很好地适应北疆寒冷而漫长的冬季。所以阿勒泰羊是研究脂肪沉积的理想试验动物,前期研究已发现一些与阿勒泰羊尾脂沉积密切相关的基因[13-15],在脂肪沉积研究方面有一定的基础。研究其在绵羊中的组织表达,以及在绵羊脂肪沉积中功能。【拟解决的关键问题】以阿勒泰羊为研究对象,研究CFD基因在阿勒泰羊中的组织表达情况,以及不同营养状态阿勒泰羊尾脂中表达量的变化,分析其与阿勒泰羊脂肪沉积之间的关系,为深入研究其对脂肪沉积的调控机理进而用于低脂肪绵羊品种的培育奠定基础。
1 材料与方法
1.1 材 料
选择6只健康状况良好的成年阿勒泰羊,分为2组每组3只分别作为对照组和试验组。对照组正常饲喂,试验组的饲喂分为两个阶段:第一个阶段采用正常饲喂的方式,4周后手术采集左臀部脂肪组织,迅速置于液氮保存备用;手术结束后进行3周的恢复饲养,待其恢复正常后进入第二个饲养阶段,此阶段采用自由饮水,但逐渐降低饲喂量并最终停止饲喂。4周后屠宰,对照组也同时屠宰并采集心脏、肝脏、脾脏、肺脏、肌肉和尾脂,迅速置于液氮保存备用。
1.2方 法
1.2.1引物设计
检索NCBI数据库,获得牛CFD基因序列(登录号:NM_001034255),采用oligo6软件分别设计克隆引物CFD-L和qRT-PCR引物CFD-Ex,选择GAPDH(登录号:NM_001190390)为内参基因。引物由上海生工生物工程有限公司合成,列出引物序列。表1
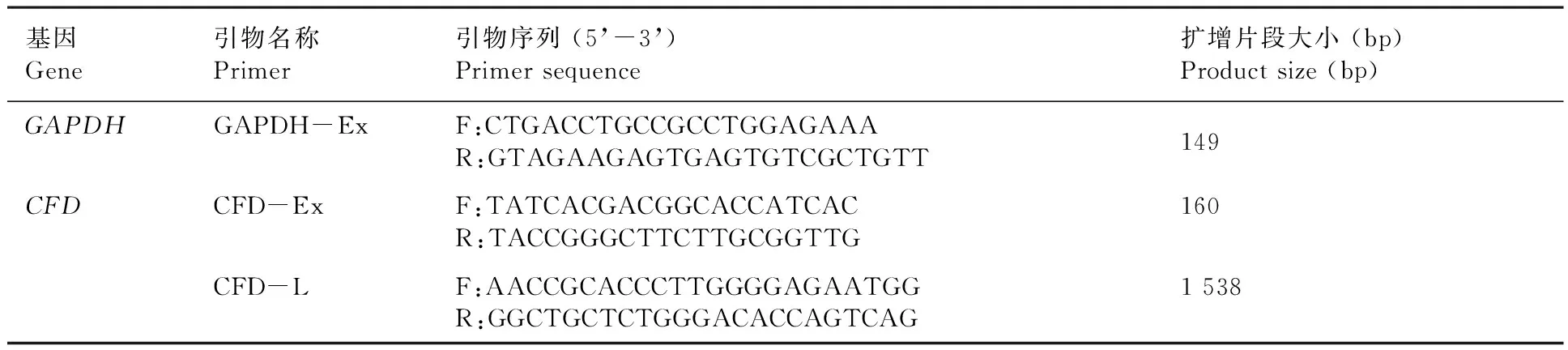
表1 引物序列和PCR产物长度
1.2.2总RNA的提取及cDNA合成
使用TRizol Reagent (Invitrogen)分别提取心脏、肝脏、脾脏、肺脏、肌肉和尾脂总RNA,采用0.7%琼脂糖凝胶电泳检测及ND2000超微量分光光度计(Thermo)分析,确定总RNA提取质量并测定浓度。采用可去除基因组的反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser (TaKaRa)合成cDNA。
1.2.3CFD基因的克隆、测序及序列分析
以尾脂cDNA为模板,用克隆引物CFD-L进行PCR扩增,扩增条件:95 ℃预变性1 min,然后95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1.5 min,40个循环后72 ℃延伸10 min。获得阿勒泰羊CFD基因扩增片段经1%琼脂糖凝胶电泳检测后连接T载体 (Promega),转化感受态细胞,进行菌落PCR鉴定,并选择阳性克隆摇菌、提取质粒送华大基因测序。测序序列拼接后与牛CFD基因序列比对,以确定扩增序列的正确性,并采用DNAMAN软件和UCSC数据库在线分析克隆的绵羊CFD基因序列,采用ExPASy-ProtParam tool软件分析其蛋白结构。
1.2.4阿勒泰羊不同组织CFD基因表达情况检测
以对照组阿勒泰羊心脏、肝脏、脾脏、肺脏、肌肉和尾脂cDNA为模板,以绵羊GAPDH基因为内参照,采用引物CFD-Ex和GAPDH-Ex进行半定量PCR扩增,扩增条件:95 ℃预变性1 min,然后95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,25个循环后72 ℃延伸5 min,扩增产物使用1.5%琼脂糖凝胶电泳检测。
1.2.5不同营养状态阿勒泰羊尾脂中CFD基因表达情况检测
分别以试验组第一阶段和第二阶段采集的尾脂cDNA为模板,以绵羊GAPDH基因为内参照,采用引物CFD-Ex和GAPDH-Ex对CFD基因进行qRT-PCR分析,扩增条件:95 ℃热激活5 min,然后95 ℃变性 1 s,60 ℃复性/延伸 30 s,共40个循环,并绘制溶解曲线已检测PCR反应的特异性。
1.3数据统计
CFD基因在不同营养状态阿勒泰羊尾脂中的表达量通过Ct(Qr=2-△△Ct)计算,即CFD基因和GAPDH基因每个样品分别做三个重复并取其平均数,然后计算其的Ct差值。以第一阶段尾脂样品中CFD基因表达量为对照,第二阶段尾脂样品中CFD基因表达量的Ct差值减去一阶段尾脂样品中CFD基因表达量的Ct差值即为△△Ct,然后通过2-△△Ct计算不同营养状态阿勒泰羊尾脂中CFD基因的相对表达量,并使用SPSS13.0进行单因素方差分析进行差异显著检验。
2结果与分析
2.1基因的克隆测序
以阿勒泰羊尾脂组织cDNA为模板,利用CFD基因特异性引物CFD-L进行PCR扩增,获得了一条与预期大小相符的片段,经回收、测序及序列拼接后,与GenBank中登录的绵羊CFD基因序列进行比对,同源性高达96%,确定为绵羊CFD基因。
2.2CFD基因生物信息学
通过DNAMAN软件和UCSC数据库在线分析,试验克隆获得的绵羊CFD基因序列的编码区(CDS序列)大小为786 bp,包含5个外显子,起始密码子为ATG,终止密码子为TGA,编码261个氨基酸。图1
利用ExPASy-ProtParam tool软件分析发现,绵羊CFD蛋白的分子质量为28 092.2Da,理论等电点(Theoretical pI)为7.15,带负电荷的氨基酸残基(Asp+ Glu)的总数为27个,带正电荷的氨基酸残基(Arg+Lys)的总数为27个,分子式为C1219H1972N366O366S15,其半衰期为30 h,脂肪系数为93.41,总平均疏水指数(GRAVY)为-0.110。利用SMART结构域在线分析软件对CFD的结构分析发现,CFD含有一个能够催化三联体His、Asp和Ser组成的胰蛋白酶样丝氨酸蛋白酶结构域Tryp_SPc。图2
SignalP 4.1信号肽在线预测结果显示,CFD蛋白的前22个氨基酸为疏水性信号肽(图3)。磷酸化位点预测结果显示,CFD蛋白含有8个丝氨酸磷酸化位点,5个苏氨酸磷酸化位点和1个酪氨酸磷酸化位点(图4)。NetOGlyc 4.0、NetNGlyc 1.0软件分析发现,CFD蛋白含有1个O-糖基化位点,无N-糖基化位点。图2,图3,图4

注:方框中所示氨基酸为预测的组氨酸(His)、天冬氨酸(Asp)、丝氨酸(Ser)三个氨基酸残基的催化三联体位点
Note:The amino acids in box are catalytic sites formed by His, Asp and Ser
图1绵羊CFD基因的CDS序列和推导的氨基酸序列
Fig.1CFDCDS sequence and protein sequence

图2 CFD结构域预测
Fig. 2 CFD Structural Domain prediction

图3CFD信号肽预测
Fig.3 CFD Signal peptide prediction

图4 CFD磷酸化位点预测
利用DNAMAN软件分析绵羊CFD与牛、小家鼠、褐家鼠、人、东非狒狒、家猫、非洲爪蟾、斑马鱼等物种CFD的核苷酸序列及氨基酸序列的同源性,比较结果表明,绵羊CFD核苷酸序列及其编码的氨基酸序列与反刍动物牛的同源性均高达96.9%以上,与家猫、东非狒狒及人的核苷酸序列及氨基酸序列的同源性也均高达80%以上;绵羊CFD基因的核苷酸序列与非洲爪蟾和斑马鱼的同源性分别为53.72%、52.02%,氨基酸序列与非洲爪蟾和斑马鱼的同源性分别为49.42%、37.75%。表2

表2 绵羊CFD基因的核苷酸和氨基酸序列与其他物种的同源性比较
注:绵羊(XM_004008767.1)、牛(NM_001034255.2)、小家鼠(NM_013459.3)、褐家鼠(NM_001077642.1)、人(BC057807.1)、东非狒狒( XM_003914553.2)、猫(XM_011288647.1 )、非洲爪蟾(NM_203989.1)、斑马鱼(NM_001020532.1);牛(Bostaurus)、小家鼠(Musmusculus)、褐家鼠(Rattusnorvegicus)、人(humansapiens)、东非狒狒(Papioanubis)、家猫(Feliscatus)、非洲爪蟾(Xenopus(Silurana)tropicalis)、斑马鱼(Daniorerio)
运用Mega5.1软件,采用N-J法建立绵羊与牛、小家鼠、褐家鼠、人、东非狒狒、家猫、非洲爪蟾、斑马鱼等其他物种的CFD系统进化树,可以看出,绵羊CFD与反刍动物牛的亲缘关系最近,与斑马鱼的遗传距离最远。图5

图5 不同物种CFD蛋白的系统进化树
2.3CFD基因的组织表达谱
半定量RT-PCR结果显示,CFD基因在阿勒泰羊心脏、肝脏、脾脏、肺脏、肌肉、尾脂组织中均有表达,其中在尾脂组织中表达水平最高,其次是脾脏。图6

图6 CFD基因在阿勒泰羊不同组织组织的半定量RT-PCR结果
2.4绵羊CFD基因的实时荧光定量PCR检测
利用实时荧光定量PCR方法检测了CFD基因在阿勒泰羊正常饲喂阶段尾脂与饥饿饲养阶段尾脂组织中的表达变化,扩增曲线及溶解曲线显示,CFD基因在阿勒泰羊正常饲喂阶段尾脂组织中的表达量极显著低于饥饿饲养阶段尾脂组织中的表达(P<0.01)。图7,图8

图7 CFD基因溶解曲线图和扩增曲线

图8 CFD基因在不同营养状态阿勒泰羊尾脂中的表达水平比较
3讨 论
3.1CFD基因的序列
1985年学者Cook等在研究小鼠3T3-F442A脂肪细胞时首次发现了CFD基因及其所编码的28 kDa的蛋白,其基因定位于小鼠的第10号染色体43.0 cM上。CFD基因大小为1 748 bp,包含5个外显子和4个内含子,外显子大小分别为74、157、148、258和230 bp,内含子大小分别为475、90、141和175 bp,CFD具有丝氨酸蛋白酶家族基因的典型特征,其外显子1包含5'端非翻译区和信号肽[2]。Cook等还发现在3T3-F442A细胞系中,存在丰度相当的两种不同的CFDmRNA,区别在于其中一个CFDmRNA的第19个外显子中有三个核苷酸(C-A-G)的插入。研究通过RT-PCR方法成功克隆了阿勒泰羊CFD基因,该基因的编码区(CDS序列)大小为786 bp,包含5个外显子,起始密码子为ATG,终止密码子为TGA,编码261个氨基酸,蛋白质分子质量为28 092.2Da,理论等电点(Theoretical pI)为7.15,含有27个带负电荷的氨基酸残基(Asp+ Glu)和27个带正电荷的氨基酸残基(Arg+Lys)。蛋白结构预测结果显示,CFD含有一个能够催化三联体His、Asp和Ser组成的胰蛋白酶样丝氨酸蛋白酶结构域Tryp_SPc,更加证实了CFD基因属于丝氨酸蛋白酶基因家族。
信号肽常指新合成多肽链中用于指导蛋白质的跨膜转移(定位)的N-末端的氨基酸序列(有时不一定在N端),是引导新合成的蛋白质向分泌通路转移的短肽链(长度5~30个氨基酸)。通过预测蛋白质N端信号肽的有无,可以初步推测该蛋白是否为分泌蛋白。研究结果表明,阿勒泰羊CFD蛋白含有一个N端信号肽,说明该蛋白属于分泌蛋白。
蛋白质的翻译后修饰是调节蛋白质生物学功能的关键步骤之一,是蛋白质动态反应和相互作用的一个重要分子基础,同时,它也是细胞信号网络调控的重要靶点。蛋白质翻译后修饰几乎参与了细胞所有的正常生命活动过程,并发挥十分重要的调控作用。蛋白质糖基化参与调控蛋白质在组织和细胞中的定位、功能、活性、寿命及多样性[16,17],细胞内50%以上的蛋白质都有糖基化修饰,它们参与了各种重要的生命活动,包括细胞识别、细胞分化、发育、信号转导、免疫应答等。研究预测结果显示,绵羊CFD蛋白含有1个O-糖基化位点,无N-糖基化位点,初步推测绵羊CFD蛋白的O-糖基化修饰通过影响细胞信号转导,在细胞吞噬、炎性细胞迁移等过程中发挥重要作用。蛋白质磷酸化和去磷酸化几乎调节着生命活动的整个过程,包括细胞的增殖、发育和分化、信号转导、细胞凋亡、神经活动、肌肉收缩、新陈代谢、肿瘤发生等。研究发现,绵羊CFD蛋白含有8个丝氨酸磷酸化位点,5个苏氨酸磷酸化位点和1个酪氨酸磷酸化位点,初步推测这些磷酸化位点在细胞信号转导等过程中发挥重要的作用。
3.2CFD基因在阿勒泰羊不同组织中的表达分析
一些研究表明,CFDmRNA在小鼠脂肪组织中高丰度表达,在其他组织中检测不到CFDmRNA的表达或表达水平很低[18,19]。王晓蕾等[20]通过竞争性RT-PCR反应检测CFD基因的时空表达发现,CFD基因在小鼠肾脏、心脏、肺脏及脑组织中存在表达,在肝脏组织中不表达。试验CFD基因的组织表达谱结果显示,CFDmRNA在心脏、肝脏、脾脏、肺脏、肌肉及尾脂组织中均表达,且在尾脂组织中高表达。初步推测其在脂肪细胞发育及脂代谢过程中发挥重要作用。为进一步了解CFD基因在脂肪组织中的功能,试验进行了阿勒泰羊正常饲养和饥饿饲养试验,并分析了CFD基因在饥饿前后阿勒泰羊尾脂组织中的表达变化,结果显示,CFD基因在饥饿饲养组尾脂组织中的表达量极显著高于正常饲养组(P<0.01),初步推测CFD基因能够促进脂肪分解作用。研究结果与Flier等[3,21]的研究结果一致。Flier及其研究小组发现在许多分解代谢状态,包括禁食、链脲佐菌素诱导的糖尿病以及部分胰腺切除诱导的糖尿病个体中,CFDmRNA表达水平有所增加(2~5倍),具体作用机制有待更深层次的研究。
4结 论
采用RT-PCR检测了CFD基因在阿勒泰羊心脏、肝脏、脾脏、肺脏、肌肉、尾脂中的组织表达情况,发现其在尾脂中的表达量最高。进而采用qRT-PCR技术检测了CFD基因在常规饲养和饥饿饲养阿勒泰羊尾脂中表达量的变化,发现CFD基因在饥饿饲养组阿勒泰羊尾脂组织中的表达量极显著高于正常饲养组(P<0.01),初步推测CFD基因能够促进脂肪分解作用。
参考文献(References)
[1] Tian, Y., Kijlstra, A., Rl, V. D. V., Makridaki, M., Murray, I. J., & Berendschot, T. T. (2013). The effect of lutein supplementation on blood plasma levels of complement factor d, c5a and c3d.PlosOne, 8(8):1,016-1,020.
[2] Cook, K. S., Groves, D. L., Min, H. Y., & Spiegelman, B. M. (1985). A developmentally regulated mrna from 3t3 adipocytes encodes a novel serine protease homologue.ProceedingsoftheNationalAcademyofSciences, 82(19):6,480-6,484.
[3] Flier, J. S., Cook, K. S., Usher, P. ,., & Spiegelman, B. M. (1987). Severely impaired adipsin expression in genetic and acquired obesity.Science, 237(4813):405-408.
[4] Ceulaer, C. D., Papazoglou, S., & Whaley, K. ,. (2010). Increased biosynthesis of complement components by cultured monocytes, synovial fluid macrophages and skynovial membrane cells from patients with rheumatoid arthritis.Immunology, 51(12):2,288-2,290.
[5]Whaley, K. ,. (1980). Biosynthesis of the complement components and the regulatory proteins of the alternative complement pathway by human peripheral blood monocytes.JournalofExperimentalMedicine, 151(3):501-516.
[6]Beatty, D. W., Iii, A. E. D., Cole, F. S., Einstein, L. P., & Colten, H. R. (1981). Biosynthesis of complement by human monocytes.ClinicalImmunology&Immunopathology, 18(18):334-343.
[7]Barnum, S. R., & Volanakis, J. E. (1985). Biosynthesis of complement protein d by hepg2 cells: a comparison of d produced by hepg2 cells, u937 cells and blood monocytes.EuropeanJournalofImmunology,15(15):1,148-1,151.
[8]Zhu, L. ,., Wigle, D. ,., Hinek, A. ,., Kobayashi, J. ,., Ye, C. ,., & Zuker, M. ,., et al. (1994). The endogenous vascular elastase that governs development and progression of monocrotaline-induced pulmonary hypertension in rats is a novel enzyme related to the serine proteinase adipsin.JournalofClinicalInvestigation, 94(3):1,163-1,171.
[9] Takahashi, M., Iwaki, D., Endo, Y., Takahashi, K., Stahl, G. L., & Fujita, T. (2010). Mbl/masp-1 complexes efficiently cleave a zymogen of complement factor D.MolecularImmunology, 47(13):2,266-2,267.
[10]王晓蕾. 糖尿病肾病遗传易感候选基因adipsin表达变化的研究[D].北京:中国医科大学硕士论文,2005.
WANG Xiao-lei. (2005).Studyoftheexpressionofadipsin,asusceptiblecandidategeneindiabeticnephropathy[D]. Master Dissertation, China Medical University, Beijing. (in Chinese)
[11]Lo, J., Ljubicic, S., Leibiger, B., Kern, M., Leibiger, I., & Moede, T., et al. (2014). Adipsin is an adipokine that improves β cell function in diabetes.Cell, 158(1):41-53.
[12] Deogun, G. K., Frank, M. M., Irani, A., Jiang, H., & Gewurz, A. T. (2005). Transient deficiency of complement factor d function in infancy.RetourAuNuméro, 115(2):S85.
[13] 杨井泉, 宋天增, 张伟, 等. TCF7基因增强子区域一处 SNP 在三尾型极端差异的绵羊群体中的多态分析[J]. 新疆农业科学, 2015, 52(6):1 126-1 132.
YANG Jin-quan, SONG Tian-zeng, ZHANG Wei, et al. (2015). Polymorphism Analysis of the SNP in Sheep TCF7 Gene Enhancer Region among Three Extremely Different Fat-tail Sheep Breeds [J].XinjiangAgriculturalSciences, 52(6):1,126-1,132. (in Chinese)
[14] 许瑞霞, 高磊, 赵伟利, 等. FABP4基因在阿勒泰羊尾脂沉积与代谢模型中的表达变化规律[J]. 遗传, 2015, 37(2):174-182.
XU RUi-xia, GAO Lei, ZHAO Wei-li, et al. (2015). Analysis ofFABP4 expression pattern in rump fat deposition and metabolism of Altay sheep [J].Hereditas(Beijing), 37(2):174-182. (in Chinese)
[15] 甘尚权, 张伟, 沈敏, 等. 绵羊X 染色体59383635位点多态性与脂尾性状的相关性分析[J]. 遗传, 2013, 35(10):1 209-1 216.
GAN Shang-quan, ZHANG Wei, SHEN Min, et al. (2013). (2013). Correlation analysis between polymorphism of the 59383635th locus on X chromosome and fat-tail trait in sheep [J].Hereditas(Beijing), 35(10):1,209-1,216. (in Chinese)
[16] Parodi, A. J. (1999). Reglucosylation of glycoproteins and quality control of glycoprotein folding in the endoplasmic reticulum of yeast cells.BiochimicaEtBiophysicaActa, 1426(2):287-295.
[17] Arnold, J. N., Wormald, M. R., Sim, R. B., Rudd, P. M., & Dwek, R. A. (2007). The impact of glycosylation on the biological function and structure of human immunoglobulins..AnnualReviewofImmunology, 25:21-50.
[18]Zezulak, K. M., & Green, H. ,. (1985). Specificity of gene expression in adipocytes..Molecular&CellularBiology, 5(2):419-421.
[19] Abrera-Abeleda, M. A., Xu, Y., Pickering, M. C., Smith, R. J. H., & Sethi, S. (2007). Mesangial immune complex glomerulonephritis due to complement factor d deficiency.KidneyInternational, 71(11):1,142-1,147.
[20] 王晓蕾, 范秋灵, 王力宁, 等. 糖尿病肾病候选基因脂肪细胞蛋白酶时空表达变化的研究[J]. 中国医师杂志, 2012,14(9):1 153-1 156.
WANG Xiao-lei, FAN Qiu-ling, WANG Li-ning, et al, (2012). (2012). Research on expression variation of fat cell protease in diabetic nephropathy [J].ChinaMedicalUniversity, 14(9):1,153-1,156. (in Chinese)
[21] Takahashi, M., Iwaki, D., Endo, Y., & Fujita, T. (2009). Contributions of masp-1 and masp-3 to fat metabolism by activation of complement factor D.MolecularImmunology, 46(14):2,828.
Fund project:Supported by NSFC's joint fund Xinjiang key project (U1130302), National basic research and development plan (973) preliminary project (2011CB111501), The National Natural Science Foundation of China(31260281) and XPCC doctor funding program (2014BB014)
doi:10.6048/j.issn.1001-4330.2016.06.022
收稿日期(Received):2016-01-04
基金项目:国家自然科学基金新疆联合基金重点项目(U1130302);国家基础研究发展计划(973)前期专项项目(2011CB111501);国家自然科学基金地区项目(31260281);兵团博士资金计划项目(2014BB014)
作者简介:李星艳(1978-),女,四川人,讲师,硕士,研究方向为临床兽医诊疗技术,(E-mail)450562450@qq.com 通讯作者(Cotresponding author):张伟(1978-),男,甘肃人,副教授,博士,研究方向为畜禽繁殖,(E-mail)zhangweigsau@163.com 唐红(1980-),女,黑龙江人,助理研究员,硕士,研究方向为绵羊繁殖与体细胞克隆,(E-mail)urblockhead@163.com
中图分类号:S811.4;S826
文献标识码:A
文章编号:1001-4330(2016)06-1136-09
Cloning ofCFDGene in Altay Sheep and Analysis of Expression Levels in Tail Fat of Altay Sheep in Different Nutrition States
LI Xing-yan1,2, WANG Shi-yin3, XU Rui-xia1, WANG Xing-hua1, LIU Shou-ren1,TANG Hong1, ZHANG Wei3
(1.ResearchInstituteofAnimalHusbandryandVeterinary,XinjiangAcademyofAgriculturalandReclamationScience,ShiheziXinjiang832000,China; 2.ShiheziEngineering&TechnologySchool,ShiheziXinjiang832000,China; 3.XinjiangAgriculturalProfessionalTechnologicalCollege,ChangjiXinjiang831100,China)
Abstract:【Objective】 To clone CFD gene, then investigate expression of CFD gene in different tissues of Altay sheep and expression variation in tail fat tissue in different nutrition states, and make a base for further understanding regulation functions of CFD gene in Altay sheep tail fat growth, and finally help breed sheep with relatively low fat growth ability. 【Method】RT-PCR was chosen to clone CFD gene and detect expressions of CFD gene in different tissues of Altay sheep, then research its expression variations in tail fat tissue of Altay sheep in different nutrition states using qRT-PCR.【Result】CFD gene was cloned successfully, and the result of tissue expression showed that CFD gene expressed in heart, liver, spleen, lung, kidney, muscle and tail fat, but the expression level was the highest in tail fat tissue. The expression level of CFD gene in tail fat tissue of normally fed Altay sheep was significantly lower than that of the hunger state (P<0.01). 【Conclusion】Based on the relative results that were reported before, we could speculate that CFD gene may regulate tail fat growth of Altay sheep by promoting decomposing of fat.
Key words:Altay sheep; CFD gene; tail fat

