Par-4特异诱导肿瘤凋亡及其机制的研究新进展
吴随一,胡波,王梁华Δ
(1.第二军医大学 海医系,上海 200433;2.第二军医大学 海洋生物医药研究中心,上海 200433)
Par-4特异诱导肿瘤凋亡及其机制的研究新进展
吴随一1,胡波2,王梁华2Δ
(1.第二军医大学 海医系,上海 200433;2.第二军医大学 海洋生物医药研究中心,上海 200433)
前列腺凋亡反应基因-4(prostate apoptosis response gene-4,par-4)基因是最早在前列腺癌细胞中发现,这个基因在正常细胞和肿瘤细胞中均可表达,其编码产物前列腺凋亡蛋白-(prostate apoptosis response protein,Par-4)可通过内源性和外源性途径选择性的诱导肿瘤细胞凋亡,而对正常细胞没有影响。Par-4发挥作用可包括内源性Par-4裂解和磷酸化、内源性Par-4转运Fas/FasL并激活Fas/FasL促凋亡通路、及外源性的Par-4和细胞膜上的GPR78结合诱导细胞凋亡等过程。特别是Par-4的外源性途径在肿瘤的靶向治疗中有很重要的应用价值。本文就Par-4诱导凋亡机制及外源性Par-4在肿瘤治疗方面的最新研究进展进行综述。
前列腺凋亡反应蛋白-4;肿瘤;外源性途径;凋亡
癌症是世界范围内导致死亡的主要原因之一,也是当今人类亟待解决的健康问题。根据WHO在2016年2月4日全球癌症日上的数据显示,全球每年新增癌症患者约1400万人,每年因癌症及其相关疾病死亡的约有800万人[1]。现行的癌症治疗仍以手术、放疗和化疗为主。由于切除范围的限制或是癌细胞对放疗或是化疗的敏感性差异,肿瘤很难被彻底清除。目前通过研究调节细胞特异蛋白的表达,进而抵抗或消灭肿瘤的方法越来越受到重视[2]。因此,能选择性杀伤肿瘤细胞的治疗方式被人们越来越寄予厚望。
在癌症靶向治疗中,发现了很多促凋亡基因,前列腺凋亡反应基因-4(prostate apoptosis response-4 gene,par-4)就是其中一个[3],其编码的前列腺凋亡反应蛋白-4(prostate apoptosis response protein-4,Par-4)能够诱导前列腺癌细胞凋亡而对正常前列腺细胞无影响。Par-4不仅能在细胞内介导肿瘤细胞的凋亡,同时还能分泌出细胞,在细胞外诱导包括前列腺癌细胞在内的多种肿瘤细胞凋亡[4]。这预示着Par-4作为一种潜在的肿瘤治疗药物具有良好前景。
1 Par-4的结构
在par-4保守序列中,包括以下几个结构:(1)2个在N-端的核定位序列(nuclear localization sequence,NLS)分别是位于20-25aa处的NLS1及位于137-153aa处的NLS2。NLS2是Par-4进入细胞核在核内定位以及发挥凋亡诱导凋亡作用的关键结构域,它对Par-4功能的发挥至关重要。(2)在其C-末端(292 -332aa)有一个亮氨酸拉链区(leucine zipper domain,LZ),该区可以和许多Par-4伴侣分子如WT1、ζ蛋白激酶C和p62等相结合。(3)C-末端的核输出序列。同时,在Par-4的分子中,还有2个关键的磷酸化位点T163和S241,需分别经PKA和Akt磷酸化后才能入核诱导凋亡。这些结构在Par-4的胞内定位,二聚体形成和发挥诱导凋亡的功能中发挥重要作用[5]。
Par-4的137-195aa的59个氨基酸区域,包括了NLS2结构域以及T163位的磷酸化位点,构成了Par-4足以诱导凋亡的最小域,即选择性肿瘤细胞凋亡诱导域[6](the selective for apoptosis induction cancer cells domain,SAC)(见图1)。人类和大鼠以及小鼠的SAC是100%同源的[6]。SAC结构域可以通过大鼠肉瘤(rat sarcoma,Ras)或是蛋白激酶C(protein kinase C,PKC)抑制核转录因子-κB (nuclear factor kappa-light-chain-enhancer of activated B cells,NF-κB)的活性,协助凋亡相关因子/凋亡相关因子因子(factor associated suicide/factor associated suicide ligand,Fas/FasL)在细胞膜上定位,同时激活Fas通路以及通过与B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)启动子上的 Wilms 肿瘤蛋白1(Wilms tumor protein 1,WT1)结合位点结合下调Bcl-2表达。这个结构域和完整的Par-4有着相同的诱导肿瘤细胞凋亡的功能,Par-4发挥抑制肿瘤生长的作用就是通过这个结构域实现的[7]。
2 Par-4的细胞定位
通过绿色荧光蛋白标记Par-4的实验,发现Par-4在诱导细胞凋亡与其细胞内定位之间存在着密切的联系[8]。在大多数肿瘤细胞中,Par-4被转移至细胞核而引起细胞凋亡。相对的,在正常细胞中,Par-4定位于细胞质中,如果不发生继发的引起凋亡损伤,则不能引起细胞凋亡。类似的,如雄激素依赖的前列腺癌和激素依赖的乳腺癌细胞系等激素依赖的肿瘤细胞中,Par-4主要定位于细胞质,则它就不能引起细胞凋亡。但是,在这2种细胞衍生的激素非依赖细胞中[持续表达Ras的乳腺癌细胞系MCF-7细胞(human breast cancer cell line,MCF-7cells)Ras细胞系和持续表达IL-6的LNCaP-IL6前列腺淋巴结癌细胞系LNCaP细胞(lymph node carcinoma of prostate cell line,LNCaP cells)细胞系],Par-4可以转移至细胞核而诱导凋亡。Par-4进入细胞核后再发挥诱导肿瘤细胞凋亡的特点说明NLS2比NLS1更为重要,因为前者是决定Par-4的核内定位的。同时,Par-4可以被细胞自发的分泌至细胞外,并在细胞外选择性诱导肿瘤细胞凋亡。这个重要特性使得Par-4成为治疗肿瘤的一个潜在靶点[7]。
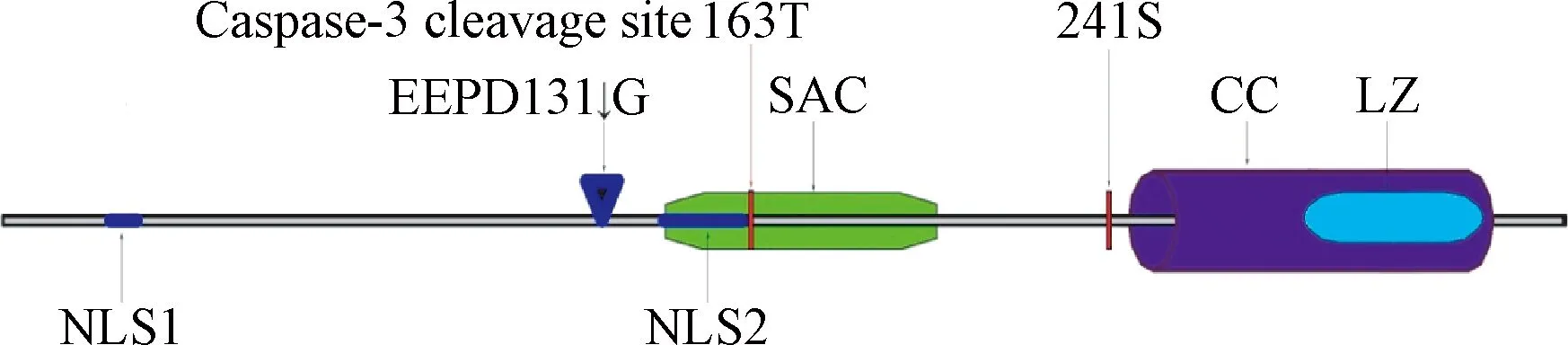
图1 Par-4蛋白质结构和关键位点示意图NLS1:核内定位序列1;cleavage site at EEPD131↓G:Caspase-3裂解位点;NLS2:核内定位序列2;T163:PKA磷酸化位点;SAC:选择性肿瘤细胞凋亡诱导域;S241:AKT磷酸化位点;LZ:亮氨酸拉链结构域;CC:C-末端输出序列Fig.1 Schematic diagram of protein structure and the specific amino acid sites of Par-4NLS1:Nuclear localization sequence 1;cleavage site at EEPD131↓G:cleavage site of Caspase-3;NLS2:Nuclear localization sequence 2;T163:Phosphorylation site of PKA;SAC:The elective for apoptosis induction cancer cells domain;S241:Phosphorylation site of AKT;LZ:Leucine zipper domain;CC:coiled-coil motif
3 Par-4诱导肿瘤细胞凋亡的机制
3.1 内源性Par-4经裂解和磷酸化后进入细胞核诱导凋亡 在正常细胞中Par-4主要分布在细胞质中,而在前列腺癌细胞中Par-4在细胞质和细胞核内均有分布,这说明Par-4的功能和它在细胞内的分布密切相关[9]。内源性Par-4选择性诱导肿瘤细胞凋亡而对正常细胞没有杀伤作用,这是因为Par-4亮氨酸拉链结构域上的S241位点能够被细胞中的Akt磷酸化[10],磷酸化的亮氨酸拉链结构域能够和细胞中的14-3-3蛋白结合形成复合物,进而停留在细胞质内[6],不能诱导正常细胞凋亡。醉茄素A(withaferin A)通过磷酸化AKT的Ser473位点抑制AKT活性后,能够促进Par-4入核诱导凋亡。抑制AKT的活性也促进了依赖于叉头框蛋白O-3a(Forkhead box O-3a,FOXO3a)的细胞凋亡,FOXO3a能结合在Par-4的启动子上调控Par-4的翻译[11]。在肿瘤细胞中Caspase-3表达水平升高,Caspase-3能够将Par-4裂解为19kd和25kd的2个片段,C端的25kd片段(包含SAC片段)进入细胞核中诱导凋亡[12]。研究发现抗癌晶体蛋白-2Aa1(parasporin-2Aa1)作用于细胞后,能够发挥和Caspase-3相同的裂解Par-4的作用[13]。
有研究将Par-4的SAC结构域在正常的细胞中过表达,尽管SAC没有亮氨酸拉链结构域,不会和14-3-3蛋白结合,应该更容易进入细胞核诱导凋亡,但实验中正常细胞并没有凋亡。研究分析Par-4的SAC结构域上的有一个发挥作用的关键位点T163,T163被细胞中的PKA磷酸化之后才会发挥诱导细胞凋亡的作用。肿瘤细胞中PKA的表达显著高于正常细胞,能够充分将SAC结构域的T163位点磷酸化,而在正常细胞中,PKA的表达含量较低,不足以将胞质中SAC结构域上的T163充分磷酸化,SAC也就不能发挥诱导凋亡的作用[4]。
3.2 Par-4入核后通过下调Bcl-2,抑制NF-κB和抑制TOPO1促进细胞凋亡 在淋巴细胞中Par-4能够通过转录和转录后修饰抑制Bcl-2蛋白家族中抗凋亡蛋白的表达。Bcl-2表达量下调[14]会引起线粒体膜电位的下降,淋巴细胞进而凋亡。Par-4和转录因子WT1相互作用后,WT1通过结合在Bcl-2基因启动子上抑制Bcl-2的转录[15];Par-4也可上调miR-24a,进而抑制Bcl-2 的mRNA的翻译[16]。研究发现Par-4浓度增高导致的Bcl-2表达下调能够促进三叠氮醉茄素A(3-azido withaferin A)诱导的前列腺癌自噬,同时Par-4上升会抑制自噬效应蛋白(Beclin 1,BECN1)从而中断Bcl-2和BECN1的相互作用[17]。所以在肿瘤细胞中Bcl-2与Par-4的表达呈负相关,Par-4也可和抗癌药物三叠氮醉茄素A发挥协同作用。Par-4影响NF-κB[11],蛋白激酶(protein kinase C,PKC)和蛋白激酶C(protein kinase B,Akt)。这3种蛋白介导的通路相互联系:PKC和Akt能促进NF-κB的激活,PKC也增强Akt的活性。Par-4结合到PKC上造成PKC构象改变,抑制了PKC的活性。Par-4能抑制NF-κB的复制和转录。同时,Par-4也可以通过结合到PKC的锌指结构域,导致PKC的空间构象改变,生物活性下降,活化IκB激酶的能力下降。IκB激酶活性下降后,IκB磷酸化受到抑制,NF-κB活化过程受阻[13]。此外,Par-4通过抑制Akt的活性来抑制NF-κB的活性。Par-4入核后还可以通过抑制TOPO1(拓扑异构酶1)的活性,使得基因DNA不能解旋,从而抑制NF-κB的激活和促进细胞凋亡[15]。
3.3 内源性Par-4将Fas/FasL转运到细胞膜上并激活Fas/FasL促凋亡通路 内源性Par-4能促进Fas/FasL转移到细胞膜上,激活Fas/FasL通路,诱导细胞凋亡。Fas受体,也称为APO1(CD95),属于I型跨膜蛋白的TNF-κB受体家族中成员。它的c-端有一个大约80aa区域,称为死亡结构域[19](death domain)。Fas受体与Fas配体结合后形成三聚体并且招募Fas死亡结构域相关蛋白(fas-associating protein with death domain,FADD),FADD可以吸引pro-Caspase-8,通过其死亡效应结构域(Death Effector Domain)形成死亡诱导信号复合体(death inducing signaling complex,DISC),从而特异切割pro-Caspase 8成活性的Caspase-8,启动凋亡[13]。只有内源性Par-4将FADD激活,形成DISC后,才能够使外源性Par-4的GPR78/FADD/Caspase8/Caspase3信号途径发挥作用,进而诱导肿瘤细胞凋亡[14]。
3.4 内质网应激后Par-4分泌到细胞外同时将GPR78转运至细胞膜上 当细胞外界条件恶劣时,例如低营养水平,缺氧等可干扰内质网的正常功能,并引起未成熟蛋白在内质网中聚集,产生内质网应激。内质网应激后,Par-4通过经典途径被分泌到胞外。3-芳基喹啉能够诱导Par-4从正常细胞的中间丝蛋白和波形蛋白上释放并促进Par-4通过旁分泌的方式和靶癌细胞结合[20]。6H也可以作为Par-4的促分泌素促进Par-4的分泌[21]。研究发现用波形蛋白处理正常细胞后,Par-4局限在细胞内而不向胞外分泌[20]。继体外实验发现前列腺癌细胞可分泌Par-4到细胞外之后,在Par-4转基因小鼠的体内实验中也发现了血清中存在Par-4,并且血清里的Par-4也可以特异性诱导肿瘤细胞凋亡[4]。作为热休克蛋白70家族成员之一,内质网分子伴侣GPR78能够与未折叠和错误折叠的蛋白结合,通过蛋白修饰纠正这些错误折叠蛋白的结构,从而减少未折叠和错误折叠蛋白[22]。Par-4在GPR78的表达或分泌中不发挥作用,但是能够影响GPR78在细胞内的定位。过表达Par-4后细胞膜上的GPR78含量增加,相似的,抑制Par-4的表达导致细胞膜上Par-4的含量下降。Par-4参与了GPR78的重新定位,但是未参与其他ER分子伴侣蛋白的定位。当肿瘤细胞表面的GPR78含量上升时,对Par-4的敏感性也随之升高。内质网应激初期,GPR78的表达量迅速增加以适应细胞的应激水平[23]。内质网稳态对于正常细胞的生存至关重要,肿瘤细胞中内质网的稳态被打破,细胞出于自我机制会自行凋亡,避免正常机体细胞受到损害[24]。
3.5 外源性Par-4和细胞表面的GPR78结合后诱导肿瘤细胞凋亡 内质网应激后,肿瘤细胞表面的GPR78含量上升。外源性Par-4和细胞表面的GPR78结合,研究人员用含有全长的GPR78载体,或是含有N端结构域突变的GPR78载体转染前列腺癌细胞,并将内源性Par-4敲除,再用外源性的Par-4处理以上细胞,发现用GPR78的N端结构域突变的载体处理的细胞不凋亡。提示:Par-4的SAC结构域和GPR78的N端特异性结合,进一步激活FADD,进而激活Caspase-8凋亡通路,最终导致细胞凋亡[5]。但是研究也发现,如果干扰掉肿瘤细胞的内源性的Par-4,使肿瘤细胞只保留细胞膜表面较高密度的GPR78,再用外源性的Par-4处理肿瘤细胞,肿瘤细胞并不发生凋亡[5]。这是因为内源性Par-4促进Fas/FasL从胞质内转移到细胞膜上,使Fas/FasL通路被激活后,外源性Par-4诱导的凋亡通路才能发挥作用。此外,Capsase-3水平升高后能够将更多的Par-4裂解为SAC,使得SAC能够进入细胞核诱导凋亡。Par-4也可以活化Caspase-3,2者形成一个正反馈调节,进一步促进了肿瘤细胞凋亡[12]。
4 讨论与展望
在肿瘤细胞中,内质网应激刺激Par-4参与GRP78的膜转移以及Par-4自身的分泌,而Par-4和GRP78在胞膜上的相互作用又可以进一步激活内质网应激,这就形成一个包括GRP78,内源性和外源性Par-4一起参与的应激环路。Par-4在多种不同的肿瘤细胞中都表现出诱导凋亡的作用,见表1。同时Par-4上升也能增加抗癌药物的作用。高浓度Par-4能够促进三叠氮醉茄素A诱导的前列腺癌自噬[17],减轻了卵巢癌的发展并且增加了对紫杉醇治疗的敏感性[9]。Par-4是醉茄素A抑制雌激素抵抗的前列腺癌的一个重要的下游靶标。关于Par-4的分泌及其在胞外诱导肿瘤细胞凋亡的作用的研究,见图2。

表1 Par-4在不同肿瘤组织中诱导凋亡及其机制
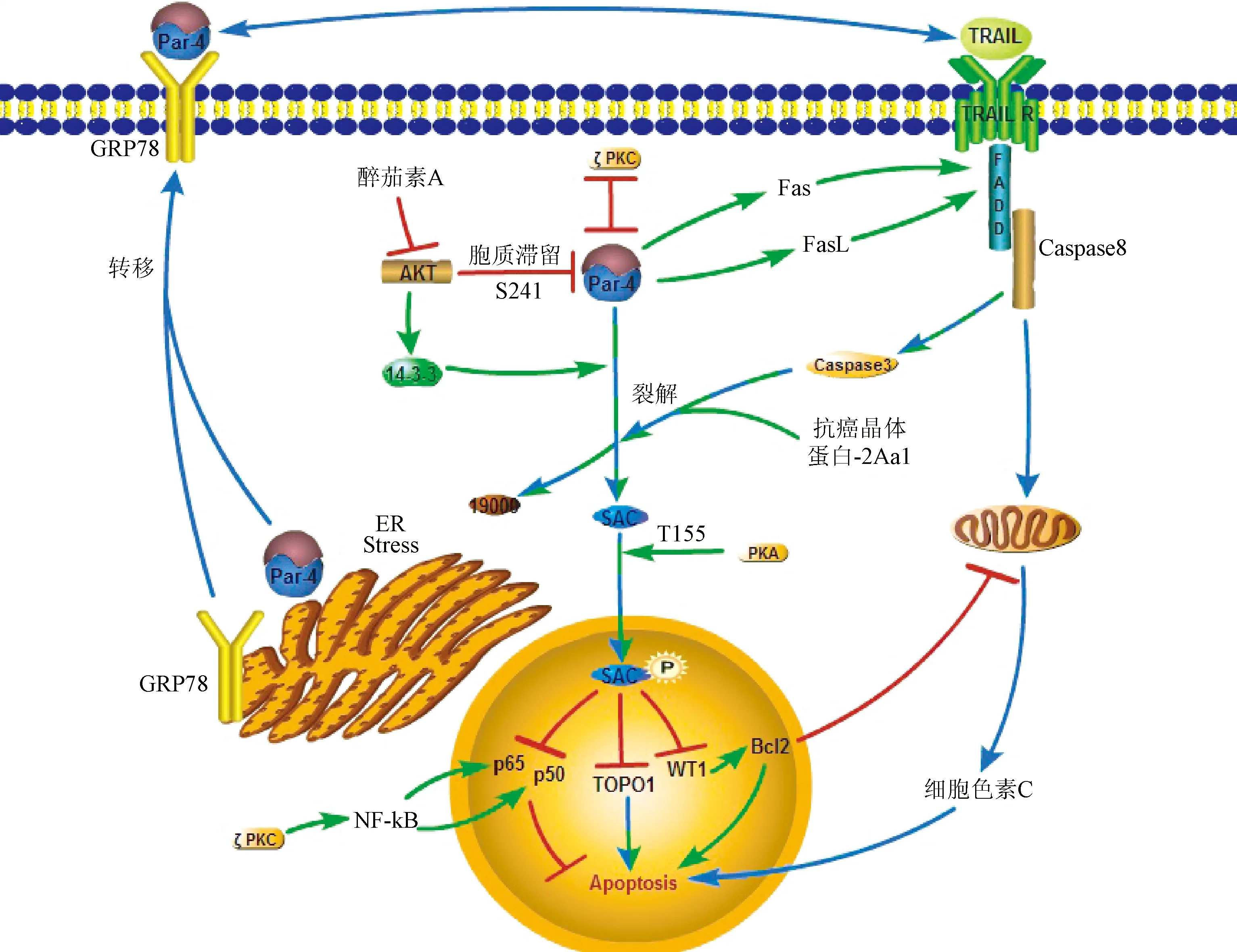
图2 肿瘤细胞中Par-4促进凋亡的通路:胞内途径;:胞外途径;:胞内外共同途径;:抑制作用;:相互抑制作用Fig.2 Signaling pathway of Par-4 inducing apoptosis in cancer cells:Intracellular promoting effect;:Extracellular promoting effect;:Intracellular and extracellular promoting effect;:Inhibitoryeffect;:Mutual inhibitory effect
关于Par-4和GRP78的研究,展现了它们在肿瘤治疗方面的良好前景。在烟草中表达par-4的SAC蛋白后,植物源性的SAC蛋白作用于前列腺癌等肿瘤细胞后均能抑制肿瘤细胞的生长;最新的研究已经实现将SAC蛋白的含量在烟草植物的总可溶性蛋白中占到0.15%[7],Par-4大规模生产后将会在肿瘤治疗中发挥重要作用。肿瘤细胞分泌的Par-4和用药物刺激后正常细胞分泌的Par-4是否有结构上的差异性?植物源性的Par-4在体内是如何运输的?是否能够构建合适的运载体提高Par-4在体内的稳定性?这些都是需要进一步研究的问题,这些问题的解答将有助于更好地发挥Par-4的抗肿瘤作用。
[1] WHO.Cancer[OL].February 2016; Available from: http://www.who.int/mediacentre/factsheets/fs297/en/.
[2] Bjorkholm M, Ohm L, Eloranta S, et al.Success story of targeted therapy in chronic myeloid leukemia: a population-based study of patients diagnosed in Sweden from 1973 to 2008[J].J Clin Oncol, 2011, 29(18):2514-2520.
[3] Sells SF, Wood DP Jr, Joshi-Barve SS, et al.Commonality of the gene programs induced by effectors of apoptosis in androgen-dependent and -independent prostate cells[J].Cell Growth Differ, 1994,5(4):457-466.
[4] Burikhanov R, Zhao Y, Goswami A, et al.The tumor suppressor Par-4 activates an extrinsic pathway for apoptosis[J].Cell, 2009,138(2):377-388.
[5] Hebbar N, Shrestha-Bhattarai T,Rangnekar VM, Cancer-selective apoptosis by tumor suppressor par-4[J].Adv Exp Med Biol, 2014(818):155-166.
[6] Gan X, Wu Q, Deng W, et al.Effect of Par-4 on the apoptosis of islet beta cell[J].Zhong Nan Da Xue Xue Bao Yi Xue Ban, 2015,40(1):6-11.
[7] Sarkar S,Jain S, Rai V, et al.Plant-derived SAC domain of PAR-4 (Prostate Apoptosis Response 4) exhibits growth inhibitory effects in prostate cancer cells[J].Front Plant Sci, 2015(6):822.
[8] Liu Y, Gilbert MR, Kyprianou N, et al.The tumor suppressor prostate apoptosis response-4 (Par-4) is regulated by mutant IDH1 and kills glioma stem cells[J].Acta Neuropathol, 2014,128(5):723-732.
[9] Meynier S, Kramer M, Ribaux P, et al.Role of PAR-4 in ovarian cancer[J].Oncotarget, 2015,6(26):22641-22652.
[10] Wu Z, Wang G, Zhang K.Pro-apoptosis and selective anticancer activities of prostate apoptosis response protein 4: research progress and prospects[J].Nan Fang Yi Ke Da Xue Xue Bao, 2014,34(1):128-132.
[11] Das TP, Suman S, Alatassi H, et al.Inhibition of AKT promotes FOXO3a-dependent apoptosis in prostate cancer[J].Cell Death Dis, 2016(7):e2111.
[12] Thayyullathil F, Pallichankandy S, Rahman A, et al.Caspase-3 mediated release of SAC domain containing fragment from Par-4 is necessary for the sphingosine-induced apoptosis in Jurkat cells[J].J Mol Signal, 2013, 8(1):2.
[13] Brasseur K, Auger P, Asselin E, et al.Parasporin-2 from a New Bacillus thuringiensis 4R2 Strain Induces Caspases Activation and Apoptosis in Human Cancer Cells[J].PLoS One, 2015,10(8):e0135106.
[14] Jagtap JC, Dawood P, Shah RD, et al.Expression and regulation of prostate apoptosis response-4 (Par-4) in human glioma stem cells in drug-induced apoptosis[J].PLoS One, 2014,9(2):e88505.
[15] Amin H, Nayak D, Ur Rasool R, et al.Par-4 dependent modulation of cellular beta-catenin by medicinal plant natural product derivative 3-azido Withaferin A[J].Mol Carcinog, 2015.doi: 10.1002/mc.22328.
[16] Nguyen KA, Hamzeh-Cognasse H, Laradi S, et al.Specific activation, signalling and secretion profiles of human platelets following PAR-1 and PAR-4 stimulation[J].Platelets, 2015,26(8):795-798.
[17] Rah B, ur Rasool R, Nayak D, et al.PAWR-mediated suppression of BCL2 promotes switching of 3-azido withaferin A (3-AWA)-induced autophagy to apoptosis in prostate cancer cells[J].Autophagy, 2015,11(2):314-331.
[18] Chen X, Sahasrabuddhe AA, Szankasi P, et al.Fbxo45-mediated degradation of the tumor-suppressor Par-4 regulates cancer cell survival[J].Cell Death Differ, 2014,21(10):1535-1545.
[19] Merhi B, Bayliss G, Gohh RY, Role for urinary biomarkers in diagnosis of acute rejection in the transplanted kidney[J].World J Transplant, 2015,5(4):251-260.
[20] Sviripa VM, Burikhanov R, Obiero JM, et al.Par-4 secretion: stoichiometry of 3-arylquinoline binding to vimentin[J].Organic & Biomolecular Chemistry, 2016,14(1):74-84.
[21] Frasinyuk MS,Bondarenko SP,Sviripa VM,et al.Development of -Chromeno[3,4-]pyrido[3',2':4,5]thieno[2,3-e]pyridazin-6-ones as Par-4 Secretagogues[J].Tetrahedron Lett,2015, 56(23):3382-3384.
[22] Ge Y, Li G, Liu B, et al.The Protective Effect of Lacidipine on Myocardial Remodeling Is Mediated by the Suppression in Expression of GPR78 and CHOP in Rats[J].Evid Based Complement Alternat Med, 2015(2015):945076.
[23] Yee SB, Choi HJ, Chung SW, et al, Growth inhibition of luteolin on HepG2 cells is induced via p53 and Fas/Fas-ligand besides the TGF-beta pathway[J].Int J Oncol, 2015,47(2):747-754.
[24] Chen W, Zou P, Zhao Z, et al.Selective killing of gastric cancer cells by a small molecule via targeting TrxR1 and ROS-mediated ER stress activation[J].Oncotarget, 2016.doi: 10.18632/oncotarget.7565.
[25] Moscat J, Diaz-Meco MT, Wooten MW.Of the atypical PKCs, Par-4 and p62: recent understandings of the biology and pathology of a PB1-dominated complex[J].Cell Death Differ, 2009,16(11):1426-1437.
[26] Lee TJ, Jang JH, Noh HJ, et al.Overexpression of Par-4 sensitizes TRAIL-induced apoptosis via inactivation of NF-kappaB and Akt signaling pathways in renal cancer cells[J].J Cell Biochem, 2010,109(5):885-895.
[27] Wang G, Dinkins M, He Q, et al.Astrocytes secrete exosomes enriched with proapoptotic ceramide and prostate apoptosis response 4 (PAR-4): potential mechanism of apoptosis induction in Alzheimer disease (AD)[J].J Biol Chem, 2012,287(25):21384-21395.
[28] Hart LS and El-Deiry WS.Cell death: a new Par-4 the TRAIL[J].Cell, 2009,138(2):220-222.
[29] Tan J, You Y, Xu T, et al.Par-4 downregulation confers cisplatin resistance in pancreatic cancer cells via PI3K/Akt pathway-dependent EMT[J].Toxicol Lett, 2014,224(1):7-15.
[30] Visavadiya NP, Li Y, Wang S.High glucose upregulates upstream stimulatory factor 2 in human renal proximal tubular cells through angiotensin II-dependent activation of CREB[J].Nephron Exp Nephrol, 2011,117(3):e62-70.
[31] Jagtap JC, Parveen D, Shah RD, et al.Secretory prostate apoptosis response (Par)-4 sensitizes multicellular spheroids (MCS) of glioblastoma multiforme cells to tamoxifen-induced cell death[J].FEBS Open Bio, 2015(5):8-19.
[32] Libich DS, Schwalbe M, Kate S, et al.Intrinsic disorder and coiled-coil formation in prostate apoptosis response factor 4[J].FEBS J, 2009,276(14):3710-3728.
[33] Lu C, Li JY, Ge Z, et al.Par-4/THAP1 complex and Notch3 competitively regulated pre-mRNA splicing of CCAR1 and affected inversely the survival of T-cell acute lymphoblastic leukemia cells[J].Oncogene, 2013,32(50):5602-5613.
[34] Alvarez JV,Pan TC, Ruth J, et al. Par-4 downregulation promotes breast cancer recurrence by preventing multinucleation following targeted therapy[J].Cancer Cell, 2013,24(1):30-44.
[35] Saegusa M, Hashimura M, Kuwata T, et al.Transcriptional regulation of pro-apoptotic Par-4 by NF-kappaB/p65 and its function in controlling cell kinetics during early events in endometrial tumourigenesis[J].J Pathol, 2010,221(1):26-36.
[36] Sviripa VM, Burikhanov R, Obiero JM, et al.Par-4 secretion: stoichiometry of 3-arylquinoline binding to vimentin[J].Org Biomol Chem, 2015,14(1):74-84.
(编校:王冬梅)
New research progresses on the prostate apoptosis response protein-4 for apoptosis induction cancer and its mechanism
WU Sui-yi1, HU Bo2, WANG Liang-hua2Δ
(1.Faculty of Naval Medicine, The Second Military Medical University, Shanghai 200433, China; 2.Marine Biomedical Research Center, The Second Military Medical University, Shanghai 200433, China)
Prostate apoptosis response gene-4(par-4)was first identified from the prostate tissue.This gene can express in both normal and cancer cells.The translation product ofpar-4 is prostate apoptosis response protein-4(Par-4),which is unique in its ability to selectively induce apoptosis in cancer cells while leaving the normal cells unaffected through intracellular and extracellular pathway.Par-4 is cleaved and phosphorylated by caspase3 and PKA; Par-4 transportsFas/FasL tocell membrane and activation of pro-apoptotic pathway;intracellular Par-4 transports GPR78 to cell membrane; extracellular Par-4 binds to GRP78 and activates it.There is a significant potential role in anti-tumors therapy of extracellular Par-4.The latest research progress on the mechanism of apoptosis induced by Par-4 and the treatment of exogenous Par-4 in tumor was discussed in this article.
prostate apoptosis response protein-4;tumor;extracellular pathway; apoptosis
第二军医大学大学生创新能力培养基金(ZD2014031)
吴随一,男,本科在读,研究方向:生物化学与分子生物学,E-mail:wusuiyi@foxmail.com;王梁华,通信作者,男,博士,副教授,研究方向:生物化学与分子生物学,E-mail:lhwang@smmu.edu.cn。
R91
A
10.3969/j.issn.1005-1678.2016.04.07

