早熟禾细胞膜脂肪酸衍生化方法比较
王 维, 黄亚亚, 王 娜, 崔浪军
( 陕西师范大学 生命科学学院 药用资源与天然药物化学教育部重点实验室, 西安 710062 )
早熟禾细胞膜脂肪酸衍生化方法比较
王维, 黄亚亚, 王娜, 崔浪军*
( 陕西师范大学 生命科学学院 药用资源与天然药物化学教育部重点实验室, 西安 710062 )
摘要:脂肪酸是生物膜的重要组成部分,由于植物细胞不同生物膜特性也不同,同一种酯化方法对不同生物膜脂肪酸酯化后测定分析的结果很难获得满意效果。为了寻找一种比较简单、可靠的衍生化方法,该研究以早熟禾叶片为材料,采用三种衍生化方法分别对其叶绿体、线粒体、液泡及细胞质膜这4种膜脂肪酸衍生化,随后进行GC定量测定分析。结果表明:相对于BF3-甲醇和HCl-甲醇两种酯化法对部分膜脂肪酸衍生化程度较低,氯乙酰酯化法对这4种膜脂肪酸的衍生化效率高、程度完全,GC测定结果重复性好、准确率高。该研究结果为其他相关植物细胞的不同膜脂肪酸测定分析提供了一定的理论借鉴。
关键词:细胞膜, 脂肪酸, 气相色谱法, 氯乙酰
脂肪酸是植物膜系统的重要组成部分,各脂肪酸的含量及其之间的比例决定着膜的流动性,而膜的流动性与植物的物质运输、信息传递、能量转换和代谢调节等生理功能密切相关(Liang et al,2005)。植物膜系统包括叶绿体膜、线粒体膜、细胞质膜和液泡膜等。膜系统中不同的生物膜其生理学功能与脂肪酸的组成及结构有很大的关系(Shaikh & Edidin,2008)。细胞膜是植物逆境伤害的首要发生地,而细胞膜的稳定性又主要决定于膜脂肪酸不饱和性,不饱和性越高,膜稳定性越高,植物抗逆性就越强(赵金梅等,2009)。因此研究植物细胞膜的脂肪酸组分与比例已成为当前抗逆生理学的热点问题(Quartacci,2001;Jiang & Gao,2004)。
目前,测定膜脂肪酸组成和含量的方法很多,但总体上主要步骤为有机溶剂对脂类抽提、脂肪酸衍生化与气相色谱的定量测定(陈炳超,2012)。衍生化是将脂肪酸转变成为挥发性物质,即脂肪酸的酯化,其中甲酯化是目前采用较多的衍生化方法。甲酯化可分为三大类:由盐酸、硫酸或三氟化硼等的酸催化和由甲氧基钠等的碱催化或由二者结合共同来完成的甲酯化方法(Rodríguez-Palmero,1997)。由于不同生物膜的脂肪酸组成特性不同,研究植物不同细胞膜系统脂肪酸的含量及其之间的比例时,不同生物膜的脂肪酸酯化采用同一种酯化方法难以得到满意效果,但如果采用不同的酯化方法,则费时费力。近年来,甲酯化法衍生脂肪酸在测定脂肪酸含量中的应用已有不少报道。已有的研究表明对于不同植物的膜系统脂肪酸、甚至对于同种植物的不同膜系统脂肪酸的衍生化采取的方法也不尽相同。蔺冬梅等(2001)在测定豌豆叶绿体膜脂肪酸时先用KOH-甲醇溶液对其皂化后,再使用HCl-甲醇甲酯化(Zhang et al,2009 )。刁丰秋(1997)对大麦叶片类囊体膜脂肪酸测定时采用乙酸-甲醇甲酯化。杨秀梅等(2008)测定番茄类囊体膜脂肪酸时用KOH-甲醇溶液碱催化甲脂化。而Ramalho et al(1998)对咖啡类囊体膜、叶绿体膜脂肪酸衍生化时,先使用KOH-甲醇溶液皂化,再用BF3-甲醇完成甲酯化。Rousch et al(2003)对海洋硅藻脂肪酸和陈鹏等(2007)用盐酸酸催化后再加入HCl-甲醇溶液完成脂肪酸甲酯化。张敏等(2009)在研究构树根与叶片内质网膜脂肪酸组成时采用BF3-乙醚-甲醇溶液酯化。因此,若能筛选出一种对植物不同细胞膜系统的脂肪酸衍生化效果均好的方法,其意义重大。
草地早熟禾(Poapratensis)是禾本科早熟禾属植物,广泛分布于世界各地,是园林绿化、运动场及牧场的主要草种,因而受到高度关注(方强恩等,2011)。本研究以早熟禾为材料,在提取获得其叶片的叶绿体膜、线粒体膜、细胞质膜以及液泡膜脂肪酸的基础上,分别用三种酯化方法对膜脂肪酸酯化,再利用气相色谱法进行比较分析,旨在选择出一种同时适用于这四种膜脂肪酸酯化的方法,从而为相关植物的细胞膜脂肪酸测定提供借鉴。
1材料与方法
1.1 材料
1.1.1 实验材料选择健康的早熟禾(Poapratensis)种子播种在装有混合培养基质(蛭石∶营养土,1∶1)的花盆中。日常管理培养20 d后采集叶片。1.1.2 试剂甲醇、异丙醇、氯仿、盐酸、氢氧化钾、正己烷、三氟化硼等均为天津市科密欧化学试剂公司;氯乙酰∶分析纯;7种脂肪酸(16∶0、16∶1、17∶0、18∶0、18∶1、18∶2、18∶3)购买于Nu-Chek Prep (Elysian,MN)。17∶0脂肪酸用作内标物。
1.1.3 仪器和设备超声波细胞破碎仪(Biosafer 4D)、离心机(eppendorf 5810R)、气相色谱仪(GC-system,HP-6890):美国Agilent公司;AB135-S型精密电子分析天平:瑞士梅特勒-托利多公司;Mili-Q Synthesis超纯水系统:美国Millipore公司。
1.2 方法
1.2.1 膜的提取叶片叶绿体和线粒体膜的提取参照张娟(2009)的方法。叶片细胞质膜与液泡膜的提取与纯化分别参照Liang et al(2005)和Quartacci et al(2001)的方法。获得的膜悬浮液置于-80 ℃保存待用。
1.2.2 膜脂肪酸的提取与测定取相同量的膜悬浮液(平均约2 mL),先加入4 mL沸腾异丙醇,后加入12 mL氯仿∶甲醇∶水=1∶1∶1(v/v/v),摇匀超声波破碎,4 500 ×g离心10 min,N2吹干下层的氯仿层获得脂肪酸。取少量提取纯化后的膜脂,加入已知量的内标(17∶0),分别用以下三种方法酯化。
方法一:参照Ramalho et al(1998)的方法。取少量提取的膜脂,先加入3 mL 0.5 mol/L KOH-甲醇溶液65 ℃水浴30 min,进行皂化反应,再用2 mL BF3-甲醇(体积比为1∶4)65 ℃酯化30 min,完成脂肪酸甲脂化。
方法二:参照Rousch et al(2003)的方法。称取少量提取的膜脂肪酸,采用盐酸酸催化后,加入2 mL 2.5%(w/w)HCl-甲醇溶液,80 ℃水浴2 h,脂肪酸甲脂化完成。
方法三:参照Masood et al(2005)对动物血红细胞膜脂肪酸测定方法。考虑到植物细胞膜系统与血红细胞质膜之间组成上的差异,本研究首先提取获得早熟禾细胞膜系统脂肪酸,再对上述衍生化方法进行简单优化。用预先制备的酯化反应储备液(1.8 mL甲醇,100 μL内标),分别配制3%、5%、7%、9%(v/v)的氯乙酰-甲醇酯化反应液。取少许等量的膜脂,密封80 ℃水浴1 h完成脂肪酸甲脂化。GC检测结果显示,用3%氯乙酰-酯化反应液衍生化后,GC检测色谱峰面积较小,出现部分齐肩峰,但5%、7%和9%(v/v)氯乙酰-酯化反应液衍生化后,GC色谱峰形及分离效果均好。因此选择5%(v/v)氯乙酰-甲醇酯化反应液进行酯化反应。
经以上三种方法完成脂类水解的脂肪酸甲脂化后,冷却至室温,先加入1 mL双蒸水和2 mL正己烷,摇匀,吸出正己烷层,N2吹干,再加入一定量的正己烷定容后得到供试品溶液,取样2 μL,用气相色谱仪(GC-system,HP-6890)检测。色谱检测条件为进样口:分流/不分流进样器,260 ℃,分流比为50∶1;检测器:FID,280 ℃;色谱柱:HP-INNOWAX柱(30 m × 0.25 mm × 0.25 μm);载气:氦气(平均限速36 cm·s-1);柱温:50 ℃保持1 min,25 ℃·min-1升温至200 ℃,而后3 ℃·min-1升温至230 ℃,再10 ℃·min-1升温至250 ℃。
1.2.3 脂肪酸含量的计算根据色谱图数据按以下公式进行计算。
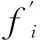
2结果与分析
2.1 叶绿体膜脂肪酸酯化气相色谱检测
图1显示,三种方法酯化叶绿体膜脂肪酸后获得的气相色谱检测图基线平稳,7种脂肪酸16∶0、16∶1、17∶0、18∶0、18∶1、18∶2和18∶3分离效果好(图1:A,B,C)。但在相同的进样量下,方法二的各个峰面积比方法一和方法三的大,表明方法二对早熟禾叶绿体膜脂肪酸的酯化程度比后两者的更高。本研究以17∶0为内标,计算结果表明叶绿体膜脂肪酸经三种方法酯化后所测定的6种脂肪酸含量无显著性差异,但方法一对叶绿体膜中几种脂肪酸含量测定的数据相对偏差较大,酯化不稳定,表明衍生化程度不完全(表1)。

图 1 三种方法酯化后叶绿体膜脂肪酸的气相色谱图A. 方法一; B. 方法二; C. 方法三 1=16∶0; 2=16∶1; 3=17∶0; 4=18∶0; 5=18∶1; 6=18∶2; 7=18∶3。下同。Fig. 1 Typical chromatogram of a fatty acid profile of chloroplast membranes from bluegrass processed by three methods A. Method I; B. Method Ⅱ; C. Method Ⅲ. 1=16∶0; 2=16∶1; 3=17∶0; 4=18∶0; 5=18∶1; 6=18∶2; 7=18∶3. The same below.
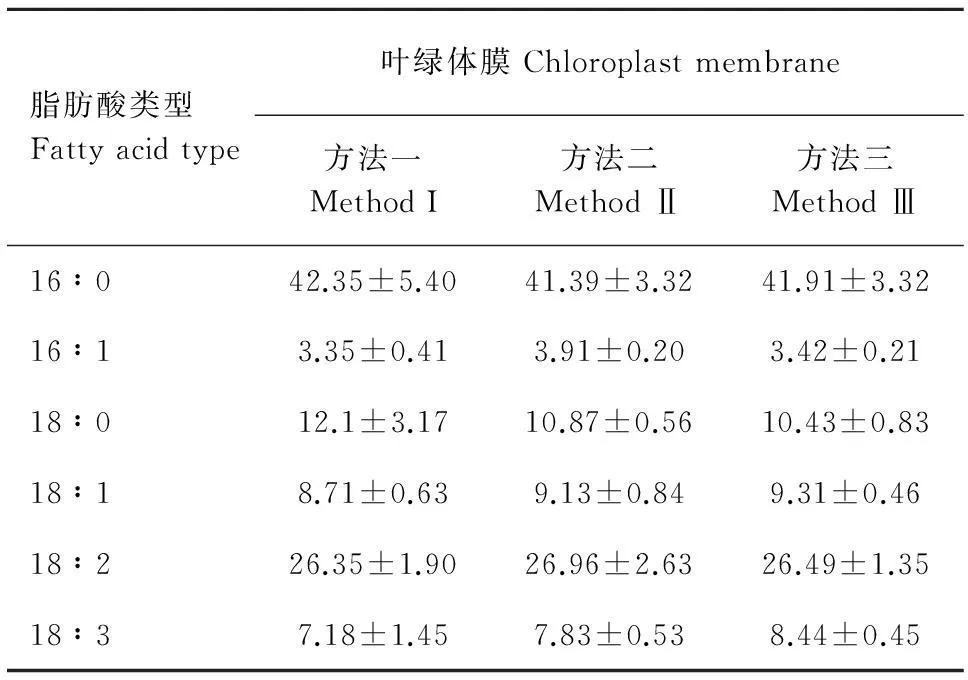
脂肪酸类型Fattyacidtype叶绿体膜Chloroplastmembrane方法一MethodI方法二MethodⅡ方法三MethodⅢ16∶042.35±5.4041.39±3.3241.91±3.3216∶13.35±0.413.91±0.203.42±0.2118∶012.1±3.1710.87±0.5610.43±0.8318∶18.71±0.639.13±0.849.31±0.4618∶226.35±1.9026.96±2.6326.49±1.3518∶37.18±1.457.83±0.538.44±0.45
注:数据为4个重复的平均值± SD。下同。
Note:Data are presented as means ± SD,n=4. The same below.
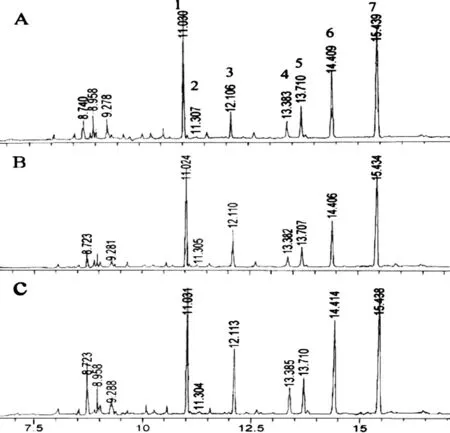
图 2 三种方法酯化后线粒体膜脂肪酸的气相色谱图Fig. 2 Typical chromatogram of a fatty acid profile of mitochondrial membranes from bluegrass processed by three methods

脂肪酸类型Fattyacidtype线粒体膜Mitochondrialmembrane方法一MethodI方法二MethodⅡ方法三MethodⅢ16∶043.53±4.8948.87±1.4542.9±2.9816∶12.03±0.541.88±0.271.98±0.1218∶010.24±1.0233.83±0.7310.89±0.1218∶19.17±0.927.52±0.839.24±0.4318∶230.92±4.117.32±0.9031.35±1.0718∶34.11±0.440.18±0.125.28±0.34

图 3 三种方法酯化后液泡膜脂肪酸的气相色谱图Fig. 3 Typical chromatogram of a fatty acid profile of tonoplast membranes from bluegrass processed by three methods
2.2 线粒体膜脂肪酸酯化气相色谱检测结果
与叶绿体膜脂肪酸酯化不同的是,在相同进样量下,线粒体膜脂肪酸经方法二酯化后的各个峰面积比方法一和方法三的小(图2)。经方法一对线粒体膜中几种脂肪酸酯化后,测定的数据相对偏差较大,衍生化效果不稳定。经方法三酯化后分离效果好,所测定的6种脂肪酸含量差异不显著(图2:A,C;表2)。用方法二酯化后色谱图表明,脂肪酸18∶1和18∶2含量很低,18∶3几乎检测不到(图2:B;表2)。说明用方法二酯化早熟禾叶片线粒体膜脂肪酸时有可能18∶1,18∶2和18∶3有时不能完全衍生化。
2.3 液泡膜和质膜脂肪酸酯化气相色谱检测结果
由图3和图4可知,用这三种方法分别对液泡膜和细胞质膜的6种脂肪酸酯化,所得色谱图中各脂肪酸峰分离效果均好。图3结果表明,方法二酯化后的各个峰面积比方法一和方法三的大,而在质膜气相色谱检测图中,三种酯化方法下各个峰面积基本接近(图4)。此外,测定二者本身的6种脂肪酸含量在方法之间差异不显著(表3,表4)。
3讨论与结论
脂肪酸衍生化程度的高低直接影响后续气相色谱的分离效果与脂肪酸含量的准确测定。本研究结果表明相同进样量、相同色谱条件下检测得到的几种脂肪酸分离效果均好,但色谱图峰面积大小有时不同,表明不同的酯化方法对同一种膜脂肪酸的酯化程度不同。在三种酯化方法中,我们所采用的均为内标法(以17∶0为内标)。内标法结合峰面积归一法和外标法的优点,在加入内标后,按峰面积归一法的分析方法进行分析,避免了由于进样的一致性及样品歧视效应导致的偶然误差。结果表明三种酯化方法对同一种膜脂肪酸的酯化程度有差异。

图 4 三种方法酯化后细胞质膜脂肪酸的气相色谱图Fig. 4 Typical chromatogram of a fatty acid profile of plasma membranes from bluegrass that was processed by three methods
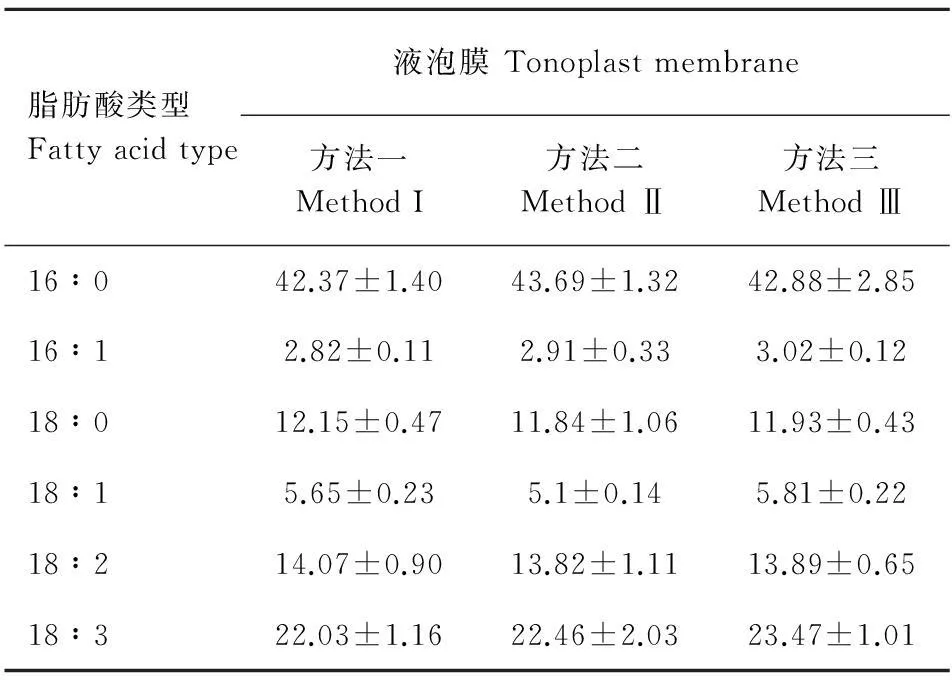
脂肪酸类型Fattyacidtype液泡膜Tonoplastmembrane方法一MethodI方法二MethodⅡ方法三MethodⅢ16∶042.37±1.4043.69±1.3242.88±2.8516∶12.82±0.112.91±0.333.02±0.1218∶012.15±0.4711.84±1.0611.93±0.4318∶15.65±0.235.1±0.145.81±0.2218∶214.07±0.9013.82±1.1113.89±0.6518∶322.03±1.1622.46±2.0323.47±1.01
酯化方法的不同,可能会影响脂肪酸定量的准确度。本研究结果表明,对早熟禾叶绿体用BF3-甲醇酯化后测得的脂肪酸16∶0和18∶0的含量数据相对偏差较大,说明方法一对该膜系统的这部分脂肪酸甲酯转化率不稳定,与方法二和方法三在衍生生化程度上存在差异。对线粒体而言,通过HCl-甲醇酯化后获得的脂肪酸18∶1、18∶2和18∶3的气相色谱峰面积相对过小,说明方法二对某些脂肪酸衍生化程度不高,而方法一和方法三酯化后的分离效果好, 脂肪酸含量测定差异不显著。但方法一对咖啡类囊体膜,叶绿体膜(Ramalho et al,1998)、方法二对海洋硅藻(Rousch et al,2003)脂肪酸衍生化程度高。造成这种差异可能与材料本身来源及特性有关。植物细胞生物膜中脂肪酸常以磷脂、糖脂、脂蛋白等形式存在,在外界影响下其含量配比会发生变化,如在铝胁迫下,小麦根液泡膜磷脂和半乳糖脂含量会增加(何飞龙,2000)。脂肪酸饱和程度会影响膜脂的流动性,在各种因素影响下,膜脂肪酸的存在形式并非固定不变,常处于液晶转换的动态平衡中。当受到紫外线B辐射时,小麦叶绿体膜类脂组分配比及脂肪酸不饱和度指数常会发生变化(杨景宏等,2000)。低温逆境下,水稻剑叶叶绿体类囊体膜内产生的大量氧自由基,引起膜脂过氧化及不饱和类脂和脂肪酸含量的变化(王静,2006)。所以材料中脂肪酸的结合形式与存在状态都可能会造成衍生化上的差异。就液泡膜和细胞质膜而言,除了方法二酯化液泡膜脂肪酸后气相测得的六种脂肪酸色谱峰面积相对大些外,总的来说用三种方法酯化后检测分离效果均好。
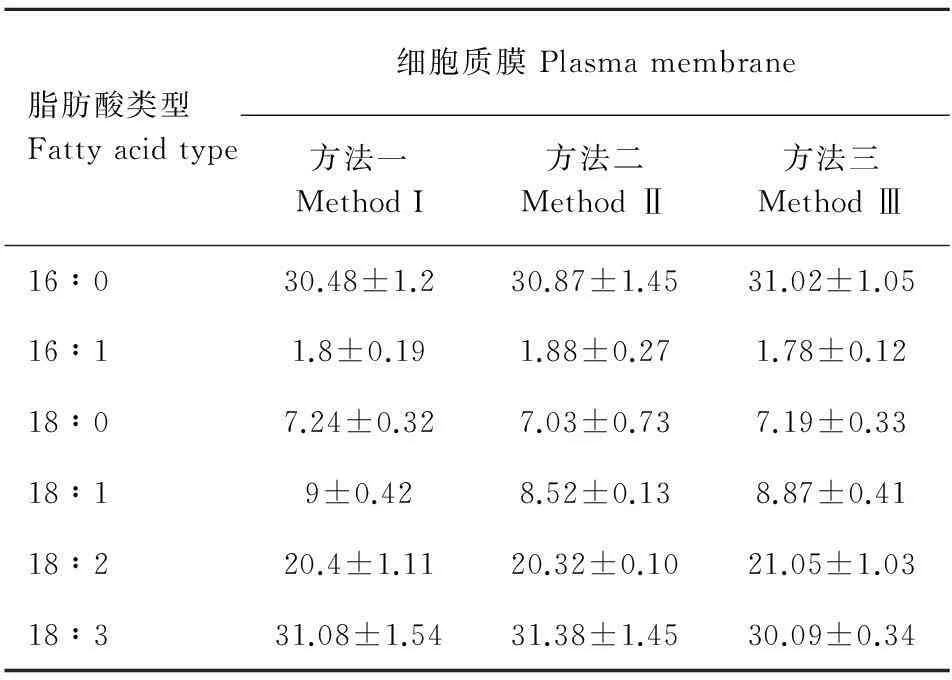
表 4 三种方法酯化后细胞质膜脂肪酸含量
综合比较分析这三种酯化的衍生化方法,发现方法三用氯乙酰对脂肪酸酯化而后进行气相色谱测定更能同时适用于早熟禾的这四种膜脂肪酸含量测定。方法三是Masood et al(2005)在Griffiths et al(2010)传统的酯化方法基础上,将许多补充的反应环节简化成的一步法,在与脂肪酸样品反应之前,先制备一种甲醇、乙酰氯储备液,然后再与脂肪酸样品反应。该方法更多是用来检测动物或人体血红细胞膜脂肪酸含量,在植物细胞膜脂肪酸酯化上的应用还很少。本研究结果表明,虽然植物细胞膜系统与动物血红细胞质膜之间组成上存在差异,但将氯乙酰与反应储备液(内标、甲醇)的配比优化后,用该方法能准确同时测定早熟禾四种不同细胞器膜脂肪酸含量,且效果显著。该方法与传统植物膜脂肪酸衍生化相比具有步骤少、操作简单、能同时准确测定几种膜系统脂肪酸等优势,这为其他相关植物的细胞膜脂肪酸测定提供借鉴。
参考文献:
CHEN BC,LIU HX,CUI YF,et al, 2012. Main chemical compositions with volatility in peel essential oil and seed oil ofPittosporumpentandrumvar.formosanumcapsule[J]. Guihaia,32(3):419-423. [陈炳超,刘红星,崔亚飞,等, 2012. 台琼海桐蒴果皮油及籽油的主要挥发性化学成分 [J]. 广西植物,32(3):419-423.]
CHEN P,JIANG WD,LIU YY,et al, 2007. Main physical chemistry characteristics and fatty acid composition of three plant oils and their bio-diesel fuels [J]. Guihaia,27(3):448-452. [陈鹏,蒋卫东,刘颖颖,等, 2007. 三种植物油及其生物柴油中脂肪酸组成的比较研究 [J]. 广西植物,27(3):448-452.]
DIAO FQ,ZHANG WH,LIU YL, 1997. Changes in composition and function of thylakoid membrane isolated from barley seedling leaves under salt stress [J]. Acta Phytophysiol Sin,23(2):105-110. [刁丰秋,章文华,刘友良, 1997. 盐胁迫对大麦叶片类囊体膜组成和功能的影响 [J]. 植物生理学报,23(2):105-110.]
FANG QE,SUN Y,BAI XM,et al, 2011. Study on the distribution of wild species ofPoaL. in Gansu [J]. Chin J Grassl,6:39-45. [方强恩,孙英,白小明,等, 2011. 甘肃早熟禾属野生植物资源分布研究 [J]. 中国草地学报,6:39-45.]
GRIFFITHS MJ,VAN HILLE RP,HAMISON STL, 2010. Selection of direct transesterification sa the preferred method for assay of fatty acid content of microalgae [J]. Lipids,45(11):1 053-1 060.
JIANG HM,GAO KS, 2004. Effects of lowering temperature during culture on the production of polyunsaturated fatty acids in the marine diatomPhaeodactylumtricornutum(Bacillariophygeae) [J]. J Phycol,40(4):651-654.
LIANG YC,ZHANG WH,CHEN Q,et al, 2005. Effects of silicon on H+-ATPase and H+-PPase activity,fatty acid composition and fluidity of tonoplast vesicles from roots of salt-stressed barley(HordeumvulgareL.) [J]. Environ Exp Bot,1(53):29-37.
LIN DM,XU SJ,ZHANG XF,et al, 2011. Effects of excess iron stress on photosynthetic characteristics and chloroplast membranes in pea seedling leaves [J]. Partac Sci, 28(11):1 950-1 956. [蔺冬梅,徐世健,张新芳,等,2011. 过量铁胁迫对豌豆幼苗光合特性和叶绿体膜的影响[J]. 草业科学,28(11):1 950-1 956.]
MASOOD A,STARK KD,JR NS, 2005. A simplified and efficient method for the analysis of fatty acid methyl esters suitable for large clinical studies [J]. Lipid Res,46:2 299-2 305.
QUARTACCI MF,COSI E,NAVARI-IZZO F, 2001. Lipids and NADPH-dependent superoxide production in plasma membrane vesicles from roots of wheat grown under copper deficiency or excess [J]. J Experim Bot,52(354):77-84.
RAMALHO JC,CAMPOS PS,TEIXEIRA M,et al, 1998. Nitrogen dependent changes in antioxidant system and in fatty acid composition of chloroplast membranes fromCoffeaarabicaL. plants submitted to high irradiance [J]. Plant Sci,2(135):115-124.
RODRíGUEZ-PALMERO M,LOPEZ-SABATER MC,CASTELLOTE-BARGALLO AI,et al, 1997. Comparison of two methods for the determination of fatty acid profiles in plasma and erythrocytes [J]. J Chromat A,1-2(778):435-439.
ROUSCH JM,BINGHAM SE,SOMMERFELD MR, 2003. Changes in fatty acid profiles of thermo-intolerant and thermo-tolerant marine diatoms during temperature stress [J]. Exp Mar Biol Ecol,295:145-156.
SHAIKH SR,EDIDIN M, 2008. Polyunsaturated fatty acids and membrane organization:elucidating mechanisms to balance immunotherapy and susceptibility to infection [J]. Chem Physics Lipids,153(1):24-33.
WANG J,ZHANG CJ,CHEN GX,et al, 2006. Effect of low temperature on photosynthetic pigments and thylakoid membrane fatty acid in flag leaves of rice at the milky stage [J]. Chin J Rice Sci,20(2):177-182. [王静,张成军,陈国祥,等, 2006. 低温对灌浆期水稻剑叶光合色素和类囊体膜脂肪酸的影响 [J]. 中国水稻科学,20(2):177-182.]
YANG JH,CHEN T,WANG XL, 2000. The influence of enhanced ultraviolet-bradiation on chloroplast membrane composition and membrane fluidity in wheat leaves [J]. Acta Phytoecol Sin,24(1):102-105. [杨景宏,陈拓,王勋陵, 2000. 增强紫外线B辐射对小麦叶绿体膜组分和膜流动性的影响 [J]. 植物生态学报,24(1):102-105.]
YANG XM,LIU XY,DONG XC,et al, 2008. Effect of increase in unsaturation of thylakoid membrane lipids on salt tolerance in tomato plants [J]. Sci Agric Sin,41(10):3 177-3 183. [杨秀梅,刘训言,董新纯,等, 2008. 类囊体膜脂不饱和度的增加对番茄耐盐性的影响 [J]. 中国农业科学,41(10):3 177-3 183.]
ZHANG J,HAN Y, 2009. Effects of He-Ne laser and UV-B radiation on Na+/K+-ATPase activity in organelles of wheat seedling [J]. Chin Bull Bot,44(4). [张娟,韩榕, 2009. He-Ne激光辐照与UV-B辐射对小麦幼苗细胞器中Na+/K+-ATP酶活性的影响 [J]. 植物学报,44(4).]
ZHAO JM,ZHOU H,SUN QZ, et al, 2009. Study on the influence of plant fatty acid desaturation on cold tolerance [J]. Pratac Sci,26(9):12-134. [赵金梅,周禾,孙启忠,等, 2009. 植物脂肪酸不饱和性对植物抗寒性影响的研究 [J]. 草业科学,26(9):12-134.]ZHANG M,LI RJ, HUANG LB,et al, 2009. Physiological and biochmical response of tonoplast vesicles isolated fromBroussonetiapapyriferato Nael stress [J]. Sci Sil Sin, 45(8):50-55. [张敏,李荣锦,黄利斌,等,2009. Nael 胁迫下构树幼苗液泡膜生理生化响应[J]. 林业科学,45(8):50-55.]
ZHANG Y,ZHAO Z,ZHANG M,et al, 2009. Seasonal acclimation of superoxide anion production,antioxidants,IUFA,and electron transport rates in chloroplasts of two Sabina species [J]. Plant Sci,176(5):696-701.
Comparison of three derivatization methods for the determination of fatty acid profiles in cell membranes for bluegrass (Poapratensis)
WANG Wei, HUANG Ya-Ya, WANG Na, CUI Lang-Jun*
(KeyLaboratoryofMedicinalResourcesandNaturalPharmaceuticalChemistry,MinistryofEducation,CollegeofLifeSciences,ShaanxiNormalUniversity, Xi’an 710062, China )
Abstract:The characteristic difference in bio-membrane in plant cells makes it difficult to use the same esterification method to determine the fatty acids contents,which are the important component of cell biological membrane. In order to establish a simple and reliable esterification method,in the present study,we isolated four kinds of cell membranes,chloroplasts,mitochondria,vacuoles and cytoplasm membrane respectively. Their fatty acids were extracted,esterified and determined by gas chromatography (GC) following three different methods. The results showed that both BF3-methanol and HCl-methanol esterification methods could not effectively esterify some of the fatty acids in mitochondria. Compared with the two approaches,acetyl chloride method could trans-esterify fatty acids completely and efficiently. Our data on fatty acids analysis with GC determination indicated that the third method had a high repeatability and accuracy. The current study provides valuable information for fatty acid determination on the plant cell membranes from different species.
Key words:cell membrane, fatty acid, gas chromatography, acetyl chloride
DOI:10.11931/guihaia.gxzw201306017
收稿日期:2014-08-10修回日期:2014-11-26
基金项目:国家科技部科技惠民计划项目(2012GS610102)[Supported by the National Planning Program Beneficial to People of Ministral of Science and Technology(2012GS610102)]。
作者简介:王维(1989-),女,陕西兴平人,硕士研究生,主要从事植物生物化学和化学生物学研究,(E-mail)wangwei89825@163.com。 *通讯作者:崔浪军,硕士生导师,从事天然产物的研究与开发,(E-mail) ljcui@snnu.edu.cn。
中图分类号:Q946
文献标识码:A
文章编号:1000-3142(2016)06-0741-06
王维,黄亚亚,王娜,等. 早熟禾细胞膜脂肪酸衍生化方法比较[J]. 广西植物,2016,36(6):741-746
WANG W,HUANG YY,WANG N,et al. Comparison of three derivatization methods for the determination of fatty acid profiles in cell membranes for bluegrass (Poapratensis)[J]. Guihaia,2016,36(6):741-746

