台湾泡桐体细胞同源四倍体的诱导及鉴定
张变莉++王杨++刘荣宁++范国强



摘要:将台湾泡桐叶片愈伤组织放置于含有不同质量浓度秋水仙素的液体培养基上进行四倍体植株的诱导,采用根尖细胞染色体计数和叶片单细胞DNA含量测定的方法进行倍性分析。结果表明,在27个试验组合中,用 30 mg/L秋水仙素处理预培养6 d的台湾泡桐叶片48 h时,四倍体诱导率最高,为5.83%。根尖染色体压片结果也表明,台湾泡桐二倍体染色体数为2n=2x=40,四倍体为2n=4x=80。此外,与二倍体相比,诱变出的四倍体植株,具有生长慢、茎加粗、叶片增宽、单个气孔面积增大、气孔密度减少等特征。
关键词:台湾泡桐;叶片;秋水仙素;四倍体
中图分类号: S792. 430.4文献标志码: A文章编号:1002-1302(2016)06-0290-04
收稿日期:2016-04-21
基金项目:河南省杰出人才创新基金(编号:321001700);河南省高校杰出科研人才工程基金(编号:2002KYC-003);河南省郑州市普通科技攻关项目(编号:153PKJGG423)。
作者简介:张变莉(1982—),女,河南通许人,硕士,讲师,主要从事园林绿化及林木生物技术的教学和科研工作。E-mail:kfzbl@163.com。
通信作者:范国强,博士,教授,主要从事泡桐丰产栽培理论与生物技术研究。E-mail:gqfan@ henau.edu.cn。植物多倍体具有抗逆性和适应性强等特点,能满足生产上高产、优质、抗病虫害等要求,而且作为遗传桥梁,对开展目的基因渐渗和转移研究具有重要意义。目前,人工诱导植物多倍体已在杨树、桑树等林木树种[ 1-12]上取得突破。泡桐在我国有着悠久的栽培历史,由于其生长快、用途广,广受栽培者的欢迎。然而,泡桐丛枝病的频发及“久治不愈”严重影响了其大面积栽植和应用。近年来,范国强等[13-18]成功诱导了同源四倍体兰考、白花、南方、豫杂一号等植株,但目前有关台湾泡桐四倍体诱导研究鲜见报道。本试验以台湾泡桐组培苗叶片为材料,采用不同质量浓度秋水仙素对其进行了同源四倍体诱导,为丰富泡桐四倍体种质资源奠定基础。
1材料与方法
1.1试验材料
本试验所用材料为河南农业大学林业试验站的台湾泡桐种子,采集后,先用70%乙醇消毒30 s,再用0.1% HgCl2 消毒 5 min,取出后,无菌水冲洗3~5次,之后将种子晾干,置于装有40 mL MS 培养基 ( 含3.0 g/L琼脂粉、25 g/L蔗糖) 的三角瓶中,在培养箱 [温度(25±2) ℃,光照时间为 16 h/d,光照度为130 μmol/(m2·s)]内培养。将生长 80 d 的同一株台湾泡桐组培苗上部2片完全展开叶片置于其器官直接发生的培养基[19]上增殖后,取其叶片待用。
1.2试验方法
1.2.1台湾泡桐叶片的预培养取台湾泡桐组培苗自顶部向下数的第 2~4 对叶片,剪成1.0 cm×1.0 cm小块,分别置于装有40 mL的MS+0.1 mg/L NAA+16.0 mg/L 6-BA的培养基[19] 的三角瓶中,在20 ℃的黑暗条件下进行不同时间(表1)的预培养。
1.2.2秋水仙素诱导台湾泡桐四倍体植株将上述预培养不同时间的外植体(台湾泡桐叶块)分别接种于含有秋水仙素液体培养基[19]的三角瓶中,并按照设计组合(表1)置于 20 ℃ 的黑暗条件下进行四倍体诱导。 诱导结束后,无菌水冲洗叶片3~5次,再将叶片表面水分用无菌滤纸吸干,之后转入不含秋水仙素的MS+0.1 mg/L NAA+16.0 mg/L 6-BA的培养基上,于光照度为130 μmol/(m2·s) 、光照时间为 16 h/d、温度为25 ℃的培养室内进行芽诱导,每处理30瓶,每瓶2个叶块。15 d后,统计台湾泡桐外植体存活数,30 d后统计外植体出芽数,并计算其存活率[(存活的外植体个数/接种外植体总数)×100%]和芽诱导率[(诱导出芽外植体数/接种外植体总数)×100%]。 将诱导后长至2 cm的幼芽剪下,接种于1/2 MS 培养基上诱导生根,每30 d 继代培养1次,共继代5次。
第5次继代苗培养后,幼芽根长至1.5~2.0 cm时,先剪其根尖制成压片[20]用于观察染色体的加倍情况,再用流式细胞仪[21]确认秋水仙素诱变的台湾泡桐幼苗的倍性,并计算其四倍体诱导率( 流式细胞仪检测四倍体幼芽数/外植体诱导出的总芽数) 。 每组试验重复2次,数据采用 SPSS 软件处理,并进行F检验。
1.2.3台湾泡桐四倍体植株的鉴定(1)幼苗根尖染色体计数。台湾泡桐二倍体幼苗及秋水仙素诱导变异幼苗的根尖细胞染色体观察参照舒寿兰等[ 20]的方法。在尼康TS-100荧光倒置显微镜(2 000×)下,观察上述根尖临时压片中的染色体条数并拍照。(2)叶片单细胞DNA相对含量测定。分别将染色体加倍的及普通二倍体的台湾泡桐叶片各50 mg置于2 mL缓冲液Ⅰ(0.5%T ween 和浓度为0.1 mol/L的柠檬酸) 中,然后用剪刀或锋利的刀片将其切碎,用300目尼龙网过滤至BD专用试管中,重复过滤2次去除杂质。留取1 mL滤液置于转速为1 500 r/min的离心机中4 ℃离心5 min,弃除上清液,并加入1 mL鞘液轻微摇匀,然后再置入上述转速离心机中4 ℃离心5 min。倒掉上清液,在沉淀中加入 0.5 mL 仪器所带荧光染色液,轻微振荡摇匀后避光放置 30 min,以便充分染色。然后用300目滤网过滤1次至试管中,用于测定叶片单细胞DNA相对含量。
1.2.4植株形态特征比较观察并记录上面生长30 d第5次继代的四倍体和二倍体台湾泡桐幼苗叶形、叶色等差异。每一指标测定10个样品,求其平均值。
1.2.5表皮细胞气孔器的比较取苗龄60 d的四倍体和二倍体台湾泡桐组培苗成熟叶片,放置于质量分数5% 的KOH溶液中煮沸3~5 min,然后置于冷水中。先在载玻片上滴一滴清水,再用镊子挑取其表皮并展平放于载玻片的水滴上,用滤纸吸去过多的水分。然后盖上盖玻片并用目镜中带有测微尺镜头的显微镜观察,在100×10的油镜下观察测量每个气孔器的长度、宽度和气孔器个数,计算气孔器密度,3次重复,取平均值。
张变莉 王杨 刘荣宁 范国强

摘要:将台湾泡桐叶片愈伤组织放置于含有不同质量浓度秋水仙素的液体培养基上进行四倍体植株的诱导,采用根尖细胞染色体计数和叶片单细胞DNA含量测定的方法进行倍性分析。结果表明,在27个试验组合中,用 30 mg/L秋水仙素处理预培养6 d的台湾泡桐叶片48 h时,四倍体诱导率最高,为5.83%。根尖染色体压片结果也表明,台湾泡桐二倍体染色体数为2n=2x=40,四倍体为2n=4x=80。此外,与二倍体相比,诱变出的四倍体植株,具有生长慢、茎加粗、叶片增宽、单个气孔面积增大、气孔密度减少等特征。
关键词:台湾泡桐;叶片;秋水仙素;四倍体
中图分类号: S792. 430.4文献标志码: A文章编号:1002-1302(2016)06-0290-04
收稿日期:2016-04-21
基金项目:河南省杰出人才创新基金(编号:321001700);河南省高校杰出科研人才工程基金(编号:2002KYC-003);河南省郑州市普通科技攻关项目(编号:153PKJGG423)。
作者简介:张变莉(1982—),女,河南通许人,硕士,讲师,主要从事园林绿化及林木生物技术的教学和科研工作。E-mail:kfzbl@163.com。
通信作者:范国强,博士,教授,主要从事泡桐丰产栽培理论与生物技术研究。E-mail:gqfan@ henau.edu.cn。植物多倍体具有抗逆性和适应性强等特点,能满足生产上高产、优质、抗病虫害等要求,而且作为遗传桥梁,对开展目的基因渐渗和转移研究具有重要意义。目前,人工诱导植物多倍体已在杨树、桑树等林木树种[ 1-12]上取得突破。泡桐在我国有着悠久的栽培历史,由于其生长快、用途广,广受栽培者的欢迎。然而,泡桐丛枝病的频发及“久治不愈”严重影响了其大面积栽植和应用。近年来,范国强等[13-18]成功诱导了同源四倍体兰考、白花、南方、豫杂一号等植株,但目前有关台湾泡桐四倍体诱导研究鲜见报道。本试验以台湾泡桐组培苗叶片为材料,采用不同质量浓度秋水仙素对其进行了同源四倍体诱导,为丰富泡桐四倍体种质资源奠定基础。
1材料与方法
1.1试验材料
本试验所用材料为河南农业大学林业试验站的台湾泡桐种子,采集后,先用70%乙醇消毒30 s,再用0.1% HgCl2 消毒 5 min,取出后,无菌水冲洗3~5次,之后将种子晾干,置于装有40 mL MS 培养基 ( 含3.0 g/L琼脂粉、25 g/L蔗糖) 的三角瓶中,在培养箱 [温度(25±2) ℃,光照时间为 16 h/d,光照度为130 μmol/(m2·s)]内培养。将生长 80 d 的同一株台湾泡桐组培苗上部2片完全展开叶片置于其器官直接发生的培养基[19]上增殖后,取其叶片待用。
1.2试验方法
1.2.1台湾泡桐叶片的预培养取台湾泡桐组培苗自顶部向下数的第 2~4 对叶片,剪成1.0 cm×1.0 cm小块,分别置于装有40 mL的MS+0.1 mg/L NAA+16.0 mg/L 6-BA的培养基[19] 的三角瓶中,在20 ℃的黑暗条件下进行不同时间(表1)的预培养。
1.2.2秋水仙素诱导台湾泡桐四倍体植株将上述预培养不同时间的外植体(台湾泡桐叶块)分别接种于含有秋水仙素液体培养基[19]的三角瓶中,并按照设计组合(表1)置于 20 ℃ 的黑暗条件下进行四倍体诱导。 诱导结束后,无菌水冲洗叶片3~5次,再将叶片表面水分用无菌滤纸吸干,之后转入不含秋水仙素的MS+0.1 mg/L NAA+16.0 mg/L 6-BA的培养基上,于光照度为130 μmol/(m2·s) 、光照时间为 16 h/d、温度为25 ℃的培养室内进行芽诱导,每处理30瓶,每瓶2个叶块。15 d后,统计台湾泡桐外植体存活数,30 d后统计外植体出芽数,并计算其存活率[(存活的外植体个数/接种外植体总数)×100%]和芽诱导率[(诱导出芽外植体数/接种外植体总数)×100%]。 将诱导后长至2 cm的幼芽剪下,接种于1/2 MS 培养基上诱导生根,每30 d 继代培养1次,共继代5次。
第5次继代苗培养后,幼芽根长至1.5~2.0 cm时,先剪其根尖制成压片[20]用于观察染色体的加倍情况,再用流式细胞仪[21]确认秋水仙素诱变的台湾泡桐幼苗的倍性,并计算其四倍体诱导率( 流式细胞仪检测四倍体幼芽数/外植体诱导出的总芽数) 。 每组试验重复2次,数据采用 SPSS 软件处理,并进行F检验。
1.2.3台湾泡桐四倍体植株的鉴定(1)幼苗根尖染色体计数。台湾泡桐二倍体幼苗及秋水仙素诱导变异幼苗的根尖细胞染色体观察参照舒寿兰等[ 20]的方法。在尼康TS-100荧光倒置显微镜(2 000×)下,观察上述根尖临时压片中的染色体条数并拍照。(2)叶片单细胞DNA相对含量测定。分别将染色体加倍的及普通二倍体的台湾泡桐叶片各50 mg置于2 mL缓冲液Ⅰ(0.5%T ween 和浓度为0.1 mol/L的柠檬酸) 中,然后用剪刀或锋利的刀片将其切碎,用300目尼龙网过滤至BD专用试管中,重复过滤2次去除杂质。留取1 mL滤液置于转速为1 500 r/min的离心机中4 ℃离心5 min,弃除上清液,并加入1 mL鞘液轻微摇匀,然后再置入上述转速离心机中4 ℃离心5 min。倒掉上清液,在沉淀中加入 0.5 mL 仪器所带荧光染色液,轻微振荡摇匀后避光放置 30 min,以便充分染色。然后用300目滤网过滤1次至试管中,用于测定叶片单细胞DNA相对含量。
1.2.4植株形态特征比较观察并记录上面生长30 d第5次继代的四倍体和二倍体台湾泡桐幼苗叶形、叶色等差异。每一指标测定10个样品,求其平均值。
1.2.5表皮细胞气孔器的比较取苗龄60 d的四倍体和二倍体台湾泡桐组培苗成熟叶片,放置于质量分数5% 的KOH溶液中煮沸3~5 min,然后置于冷水中。先在载玻片上滴一滴清水,再用镊子挑取其表皮并展平放于载玻片的水滴上,用滤纸吸去过多的水分。然后盖上盖玻片并用目镜中带有测微尺镜头的显微镜观察,在100×10的油镜下观察测量每个气孔器的长度、宽度和气孔器个数,计算气孔器密度,3次重复,取平均值。
2结果与分析
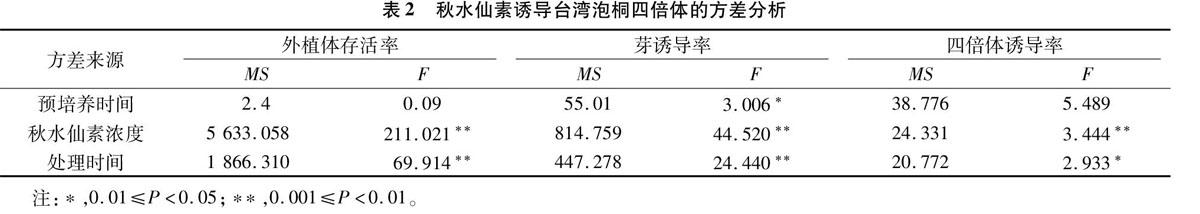
2.1不同浓度秋水仙素处理对台湾泡桐四倍体诱导的影响
从表1试验数据及统计结果可以看出,不同预培养时间及不同浓度、不同处理时间的秋水仙素诱导对台湾泡桐四倍体诱导率、芽诱导率和外植体存活率均有不同影响。 当秋水仙素浓度是10 mg/L时,伴随预培养时间和秋水仙素诱导时间的延长,四倍体诱导率、芽诱导率和外植体存活率均表现出明显不同。其中,组合11的四倍体诱导率、芽诱导率和外植体存活率分别为6.90%、20.58%及49.11%。当秋水仙素浓度为 20 mg/L 时,组合13的四倍体诱导率、芽诱导率及外植体存活率均达到最高。当秋水仙素浓度为30 mg/L时,组合16的四倍体诱导率、芽诱导率和外植体存活率达到最大,分别为345%、11.94%及32.83%。综上所述,当秋水仙素浓度不断增大,台湾泡桐叶片(外植体)的最高四倍体诱导率及芽诱导率、存活率基本呈现下降趋势,并且秋水仙素浓度对四倍体诱导率、芽诱导率及外植体存活率的影响均极显著;秋水仙素处理外植体的时间对外植体存活率、芽诱导率的影响均极显著;外植体的预培养时间对芽诱导率的影响显著,而对四倍体诱导率的影响则不显著(表2 )。这表明,台湾泡桐最高四倍体诱导率的产生是外植体预培养时间、处理时间及秋水仙素浓度共同作用的结果。因此,选择组合11(6 d预培养+10 mg/L 秋水仙素+48 h处理),作为台湾泡桐四倍体诱导的最佳组合。
2.2四倍体台湾泡桐植株的鉴定
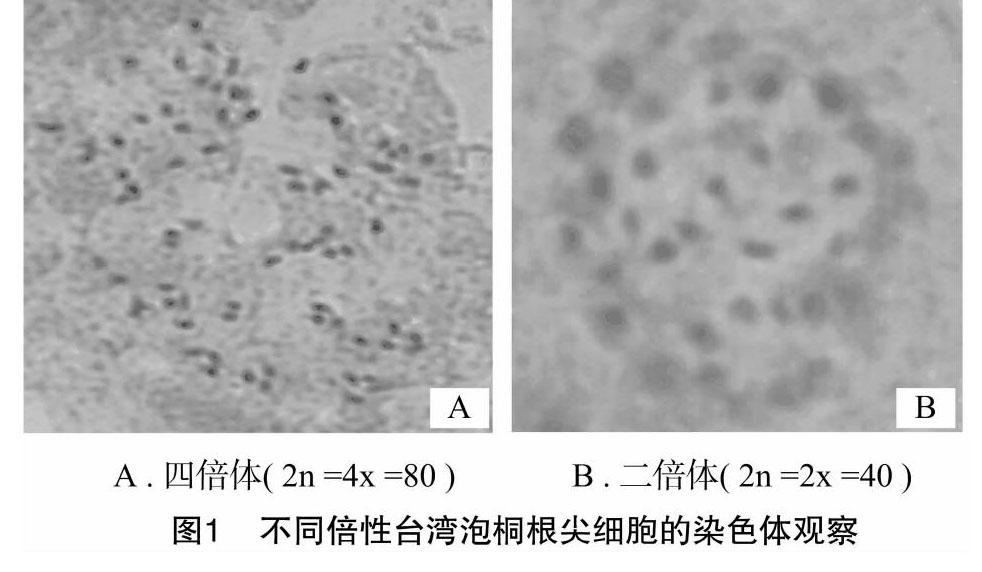
2.2.1根尖染色体观察观察显微镜下根尖临时压片显示,变异的台湾泡桐幼苗根尖细胞染色体为2n= 4x=80,正常台湾泡桐二倍体的根尖细胞染色体为2n=2x=40( 图1) 。染色体观察结果显示,秋水仙素诱变的台湾桐幼苗细胞中,染色体数均是正常二倍体的2倍。
2.2.2叶片单细胞DNA含量检测流式细胞仪检测继代5次的台湾泡桐变异幼苗和二倍体幼苗叶片单细胞DNA相对含量的检测结果(图2)表明,台湾泡桐二倍体幼苗只在相对荧光强度值为50的位置上出现1个单峰,而经秋水仙素处理后也仅在接近100的位置上出现1个单峰,即变异幼苗叶片单细胞 DNA含量为其二倍体叶片的2倍。综上所述,秋水仙素诱导获得的台湾泡桐变异幼苗为其同源四倍体幼苗。
2.3台湾泡桐二倍体与同源四倍体幼苗的形态比较
由图3和表3可知,四倍体较二倍体幼苗叶色变深,叶片变厚、增大,长宽比变小。另外,与二倍体相比,台湾泡桐四倍体叶片的气孔变大,但其叶片的气孔器密度变小。
3讨论
众所周知,当今植物多倍体诱导中效果最好、应用最广泛的化学诱变剂是秋水仙素,它在植物多倍体诱导中具有非常重要的作用[22-23]。本试验结果表明,组合11是台湾泡桐四倍体诱导率最高的组合,即将台湾泡桐叶片预培养6 d后,再在浓度为10 mg/L秋水仙素的液体培养基上诱导48 h,四倍体诱导率达到最高,为 6.90%。这与在兰考泡桐、白花泡桐和南方泡桐等叶片上得到的情况[13-18]有一定差异,台湾泡桐四倍体诱导率有显著下降。这可能是将台湾泡桐叶片直接浸泡于秋水仙素液体培养基中,造成其在较短时间内对外植体产生毒害作用,降低了外植体的存活率和芽诱导率,因而造成四倍体诱导率的显著下降。但是,与其他种类泡桐四倍体诱导所采用的双层培养基法相比,上述方法减少了一定的工作量,加快了诱导的速度,对于需要快速获得四倍体植株的植物种类,液体浸泡的方法是比较好的选择。此外,在本试验中,采用组合11处理后获得的诱变植株大部分为四倍体,并且这些四倍体能够稳定地遗传,其原因可能是用10 mg/L秋水仙素处理预培养6 d的台湾泡桐叶片48 h时,由于叶片较薄,细胞分裂旺盛、分裂的同步性好,此时秋水仙素易抑制纺锤丝的形成,从而导致大量的细胞染色体加倍,这样,获得变异植株中出现嵌合体的概率就小。
参考文献:
[1]刘荣宁,何佳,赵改丽,等. 三球悬铃木体细胞同源四倍体诱导及鉴定[J]. 沈阳农业大学学报,2013,44(1):47-51.
[2]鲁敏. 响叶杨三倍体和四倍体诱导技术研究[D]. 北京:北京林业大学,2013.
[3]罗晓丹. 四倍体刺槐诱导及其体外植株再生的研究[D]. 长沙:中南林业科技大学,2009.
[4]穆怀志. 多倍体白桦的诱导及其光合特性的分析[D]. 哈尔滨:东北林业大学,2010.
[5]聂琳. 楸树体外植株再生及其同源四倍体诱导的研究[D]. 郑州:河南农业大学,2011.
[6]聂琳,彭杰,常军,等. 四倍体刺槐研究现状及进展[J]. 中国农学通报,2013,29(4):1-4.
[7]孙日彦,粱明芝,宋慧贞,等. 秋水仙碱处理成龄桑诱导四倍体研究[J]. 蚕业科学,1997,23(1):55-56.
[8]童俊,叶要妹,冯彪,等. 秋水仙素诱导三种紫薇多倍体的研究[J]. 园艺学报,2009,36(1):127-132.
[9]张海凤,郭宝林,张成合,等. 杜仲四倍体的诱导与鉴定[J]. 园艺学报,2008,35(7):1047-1052.
[10]周玉丽,任士福,张成合.连翘多倍体诱导与鉴定[J]. 河北农业大学学报,2011,34(1):73-77.
[11]祝泽兵. 山杨和小黑杨多倍体诱导及生长与光合特性分析[D]. 哈尔滨:东北林业大学,2010.
[12]李丽琴,付春华,王圣,等. 红豆杉离体细胞四倍体的诱导[J]. 广西植物,2008,28(1):121-125.
[13]范国强,杨志清,曹艳春,等. 秋水仙素诱导兰考泡桐同源四倍体[J]. 核农学报,2006,20(6):473-476,547.
[14]范国强,曹艳春,赵振利,等. 白花泡桐同源四倍体的诱导[J]. 林业科学,2007,43(4):31-35,插1.
[15]范国强,魏真真,杨志清.南方泡桐同源四倍体的诱导及其体外植株再生[J]. 西北农林科技大学学报:自然科学版,2009(10):83-90.
[16]范国强,杨志清,曹艳春,等. 毛泡桐同源四倍体的诱导[J]. 植物生理学通讯,2007,43(1):109-111.
[17]范国强,翟晓巧,魏真真,等. 豫杂一号泡桐体细胞同源四倍体诱导及其体外植株再生[J]. 东北林业大学学报,2010,38(12):22-26.
[18]赵振利,何佳,赵晓改,等. 泡桐9501体外植株再生体系的建立及体细胞同源四倍体诱导[J]. 河南农业大学学报,2011,45(1):59-65.
[19]韩同丽. 四种泡桐体外植株再生体系建立[D]. 郑州:河南农业大学,2013.
[20]舒寿兰. 四种泡桐染色体数目的初步研究[J]. 河南农业大学学报,1985,19(1):48-50.
[21]Hiicini K,Walker D J,Bouzid S,et al. Determination ploidy level and nuclear DNA content in Tunisian populations of Atriplex halimus L.[J]. Gen Res Crop Evol,2006,53(1):1-5.
[22]王玉英,李光宏,李志敏,等. 野生黄蝉兰多倍体诱导初报[J]. 江苏农业科学,2014,42(4):132-134.
[23]刘露颖,赵喜亭,李明军. 秋水仙碱诱导药用植物多倍体的研究进展[J]. 江苏农业科学,2014,42(4):178-181.

