NRP1表达与晚期非小细胞肺癌一线含铂方案化疗敏感性及预后的相关性分析
冯卫能,张良运,石海燕,陈泽程,唐溢聪,邓燕明.佛山市第一人民医院头颈胸肿瘤内科,广东 佛山 58000;.佛山市第一人民医院病理科,广东 佛山 58000
NRP1表达与晚期非小细胞肺癌一线含铂方案化疗敏感性及预后的相关性分析
冯卫能1,张良运2,石海燕2,陈泽程1,唐溢聪1,邓燕明1
1.佛山市第一人民医院头颈胸肿瘤内科,广东 佛山 528000;2.佛山市第一人民医院病理科,广东 佛山 528000
[摘要]背景与目的:神经菌毛素-1(neuropilin-1,NRP1)作为血管内皮生长因子(vascular endothelial growth factor,VEGF)受体,在肿瘤新生血管形成和肿瘤细胞迁移中发挥重要作用。本研究目的是探索NRP1表达与晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)含铂一线化疗敏感性及预后的相关性。方法:应用免疫组织化学法检测104例一线应用含铂双药方案化疗的晚期NSCLC肿瘤组织中NRP1表达,采用χ2检验及Logistic回归模型分析NRP1表达与化疗反应率的关系。采用Kaplan-Meier和Cox比例风险回归模型分析NRP1表达对生存期的影响。结果:在104例患者中,56例(53.8%)出现NRP1高表达。NRP1高表达与年龄、性别、组织类型、分化程度、行为状态和化疗方案等临床病理因素无关。NRP1低表达患者的化疗反应率高于高表达患者(43.8% vs 23.2%,P=0.026)。Logistic多因素分析结果显示,NRP1表达为化疗反应率的独立预测因素(OR=3.103,95%CI:1.320~7.290,P=0.009),NRP1低表达患者较高表达患者具有更长的无进展生存期(4.6个月vs 3.0个月,χ2=11.273,P=0.001)和总生存期(11.5个月 vs 9.2个月,χ2=14.392,P=0.000),NRP1高表达是晚期NSCLC化疗反应率及总生存期的独立预测因素。结论:NRP1高表达与晚期NSCLC一线含铂联合化疗反应率和生存期相关,NRP1表达可能是预测晚期NSCLC化疗敏感性和预后的生物标志物。
[关键词]非小细胞肺癌;神经菌毛素-1;化疗敏感性;预后
肺癌是最常见的恶性肿瘤,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占80%,超过65%的NSCLC在诊断时已属晚期。多个随机临床试验已证实含铂双药联合化疗方案可改善患者的生存期及生活质量,含铂双药联合化疗是目前晚期NSCLC一线治疗的标准方案之一[1]。但是,对于非选择性晚期NSCLC患者,含铂双药联合化疗一线治疗的有效率仅为17%~22%,中位生存期仅为7~9个月[2]。即使根据组织类型优化选择化疗方案,也仅可让非鳞癌患者的中位生存期延长至11.8个月[3]。耐药是晚期NSCLC化疗失败的主要原因[4]。因此,发现晚期NSCLC化疗耐药的分子标志物有助于进一步提高晚期NSCLC化疗的疗效。
神经菌毛素-1(neuropilin-1,NRP1)于1997年首次被鉴定为神经导向因子3A的共受体,与神经丛素3A共同调节神经轴突的生长[5]。随后的研究显示,NRP1参与调节恶性肿瘤细胞的存活、增殖、侵袭和迁移[6],是多种恶性肿瘤的不良预后因素[7-12]。最近研究还发现,NRP1表达与骨肉瘤化疗耐药相关[12-13],但NRP1表达对晚期NSCLC化疗敏感性及生存期的影响尚不清楚。
本研究应用免疫组织化学法检测NRP1在104例晚期NSCLC患者组织标本中的表达情况,探索NRP1表达与晚期NSCLC化疗敏感性和预后的相关性。
1 资料和方法
1.1临床资料
104例患者的石蜡包埋组织标本来自佛山市第一人民医院病理科2009年10月8日—2011年12月31日的病理档案。入选病例符合以下标准:病理确诊为NSCLC;按2009年国际抗癌联盟(Union for International Cancer Control,UICC)肺癌TNM分期为Ⅳ期;无脑转移;年龄18~70岁;行为状态(performance status,PS)0~1分;一线治疗为含铂双药方案化疗;骨髓、肝和肾功能正常;有可测量病灶。本研究获得佛山市第一人民医院伦理委员会批准,组织标本收集及应用于研究经患者知情同意。
104例患者中,男性66例(63.5%),女性38例(36.5%);年龄41岁~69岁,中位年龄60岁。腺癌52例(50.0%),鳞癌52例(50.0%)。PS 0分19例(18.3%),PS 1分85例(81.7%)。肿瘤组织高分化15例(14.4%),中分化62例(59.6%),低分化27例(26.0%)。接受吉西他滨联合卡铂化疗患者62例(59.6%),接受紫杉醇联合卡铂化疗患者15例(14.4%),接受培美曲塞联合卡铂化疗患者27例(26.0%)。
化疗结束后每8周随访1次,末次随访时间为2014年1月26日,中位随访时间为12个月。
1.2化疗方案
入选病例应用含铂双药方案化疗,化疗方案包括:吉西他滨1 000 mg/m2静脉滴注,第1、8天,卡铂的药时曲线下面积(area under the concentration-time curve,AUC)=5静脉滴注,第1天;紫杉醇175 mg/m2静脉滴注,第1天,卡铂的AUC=5静脉滴注,第1天;培美曲塞500 mg/m2静脉滴注,第1天,卡铂的AUC=5静脉滴注,第1天。
每3周为1个周期,每2个周期评价疗效,化疗最多不超过6个周期。完成化疗后每8周评价1次疗效。
1.3免疫组织化学法检测
切取4 μm厚石蜡包埋组织,采用免疫组化SP法检测NRP1表达(NRP1单克隆抗体均购自美国Abgent公司),免疫组化二抗SP检测试剂盒购自美国Dako公司。主要步骤包括:二甲苯脱蜡,梯度酒精脱水,3%双氧水灭活内源性过氧化酶,PBS缓冲液冲洗,专用微波炉进行抗原微波热修复,一抗温育60 min,封闭剂温育30 min,后二抗温育30 min,用1∶20 DAB显色5 min,苏木精复染,酒精脱水,中性树胶封片。以PBS代替一抗作为阴性对照。
染色评判标准参照参考文献[7]。NRP1表达主要位于肿瘤细胞的细胞膜和细胞质,出现棕黄色颗粒为阳性。每张切片镜下随机选择5个高倍视野(×200),每个视野计数100个细胞,计算各个视野中阳性细胞的平均百分率作为该切片的阳性细胞百分率。无阳性细胞为0分,小于等于25%为1分,26%~75%为2分,大于75%为3分。染色强度以多数呈现的染色特征为标准,无染色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。然后以阳性细胞百分率计分和强度计分相加所得的总分进行结果判定,0分为阴性,1~2分为弱阳性(+),3~4分为中度阳性(++),大于等于5分为强阳性(+++)。评分小于3分为低表达,大于等于3分为高表达。
1.4临床评估
近期疗效按照实体肿瘤的疗效评价标准1.1版[14]分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD),获得CR或PR的患者4周后再确认疗效。有效率=(CR病例数+PR病例数)/总病例数。远期疗效为无进展生存期(progressionfree survival,PFS)和总生存期(overall survival,OS)。PFS定义为从化疗开始至疾病进展或任何原因导致死亡的时间。OS定义为从化疗开始至死亡的时间。
1.5统计学处理
应用SPSS 17.0软件分析。NRP1表达与化疗反应率的相关性采用χ2检验,化疗反应率多因素分析采用Logistic回归模型。NRP1表达与PFS、OS的关系采用Kaplan-Meier法分析,log-rank检验差异性。预后多因素分析采用Cox比例风险回归模型。P<0.05为差异有统计学意义。
2 结 果
2.1NRP1在晚期NSCLC组织中的表达
应用免疫组织化学法检测104例晚期NSCLC石蜡包埋组织的NRP1蛋白表达,NRP1高表达表现为细胞膜和(或)细胞质中出现棕黄色颗粒(图1),56例(53.8%)呈现NRP1高表达。
2.2NRP1表达与临床病理特征的关系
NRP1表达情况与年龄、性别、PS、组织类型、分化程度、化疗方案及后续是否接受表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKI)治疗的相关性见表1。NRP1高表达与年龄、性别、PS、组织类型、化疗方案及后续是否接受EGFR-TKI治疗均无相关性(P>0.05)。
2.3NRP1表达与化疗反应率的关系
NRP1高表达和低表达患者一线化疗反应率分别为23.2%(13/56)和43.8%(21/48),NRP1低表达患者化疗反应率高于高表达者(χ2=4.943,P=0.026)。校正年龄、性别、PS、组织类型、分化程度和化疗方案等因素,Logistic回归多因素分析显示,NRP1表达是化疗反应率的独立预测因素(OR=3.103,95%CI:1.320~7.290,P=0.009,表2)。
2.4NRP1表达与晚期NSCLC预后的关系
在104例患者中,中位PFS和中位OS分别为3.7和10.0个月。NRP1低表达患者较高表达患者PFS(4.6个月 vs 3.0个月,χ2=11.273,P=0.001,图2)和OS(11.5个月 vs 9.2个月,χ2=14.392,P=0.000,图3)更长。
将年龄、性别、组织类型、PS、分化程度、化疗方案、NRP1表达及后续是否接受EGFR-TKI治疗等预后因素纳入Cox比例风险回归模型进行分析。单因素分析结果显示,生存不良预后因素有NRP1高表达(HR=2.092,P=0.000)、男性(HR=1.728,P=0.014)、后续未接受EGFR-TKI治疗(HR=3.162,P=0.000,表3)。进一步多因素分析结果显示,NRP1高表达(HR=2.089,P=0.000)和后续未接受EGFR-TKI治疗(HR=3.179,P=0.000)均为OS的独立预测因素(表3)。
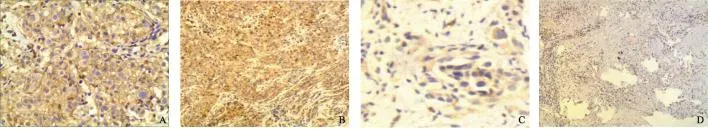
图1 免疫组织化学法检测NRP1表达Fig.1 Expression of NRP1 in NSCLC tissues detected by immunohistochemistry
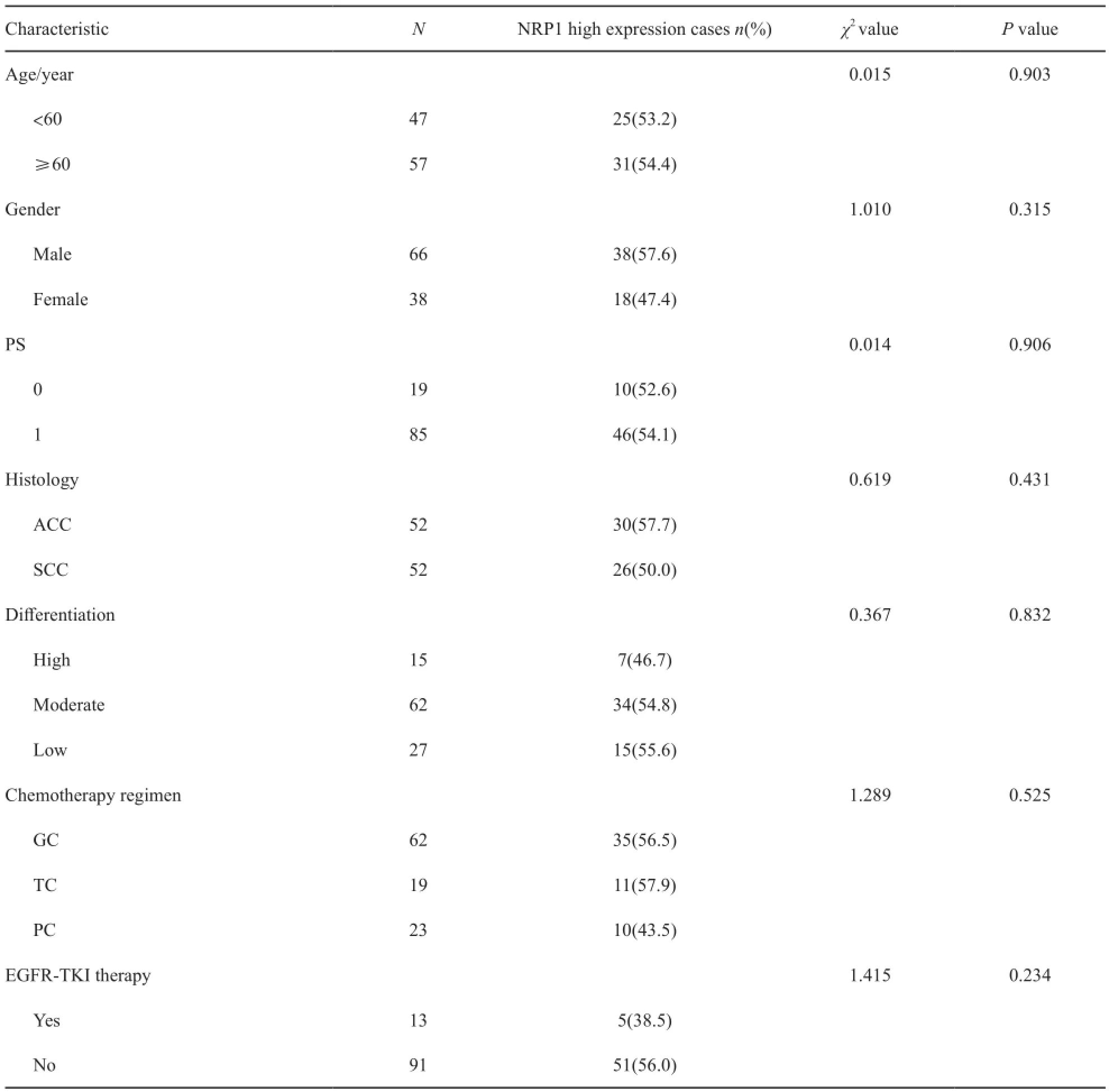
表1 NRP1表达与临床病理因素的关系Tab.1 Relationships between NRP1 expression and clinicopathologic characteristics
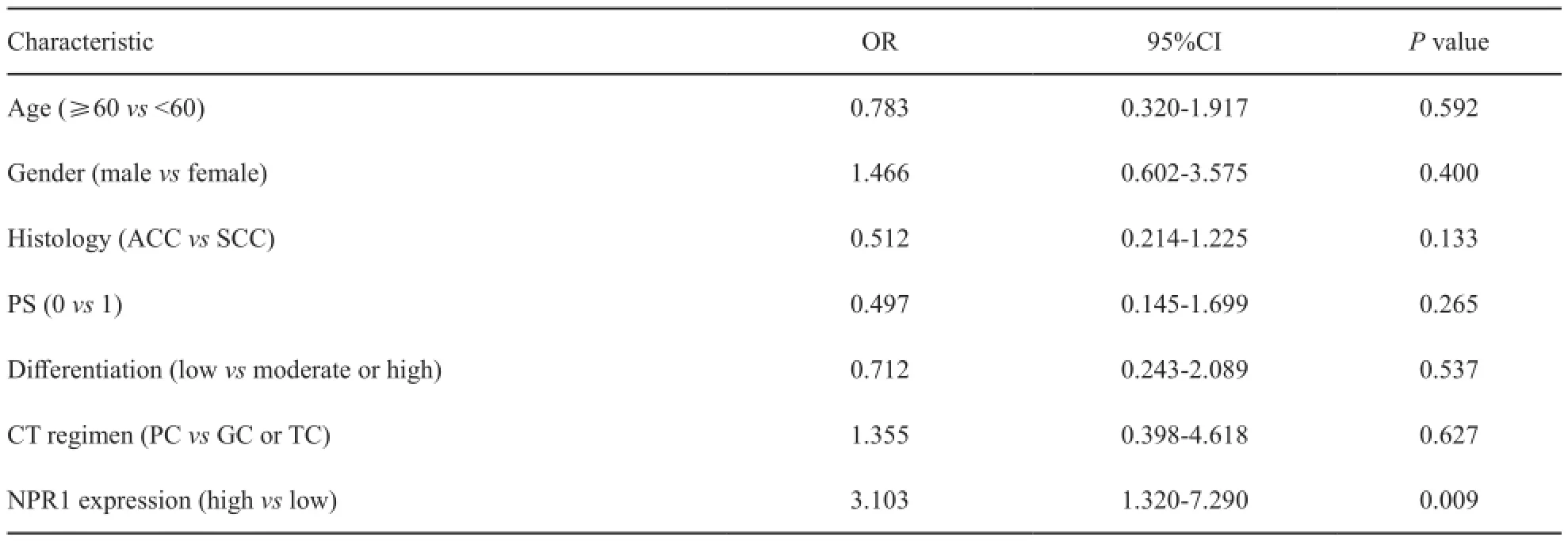
表2 化疗反应率相关因素的Logistic回归分析Tab.2 Logistic regression analysis for chemotherapy response rate
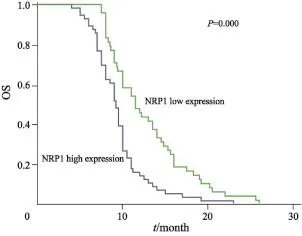
图3 NRP1表达与OS的关系Fig.3 Relationship between NRP1 expression and OS
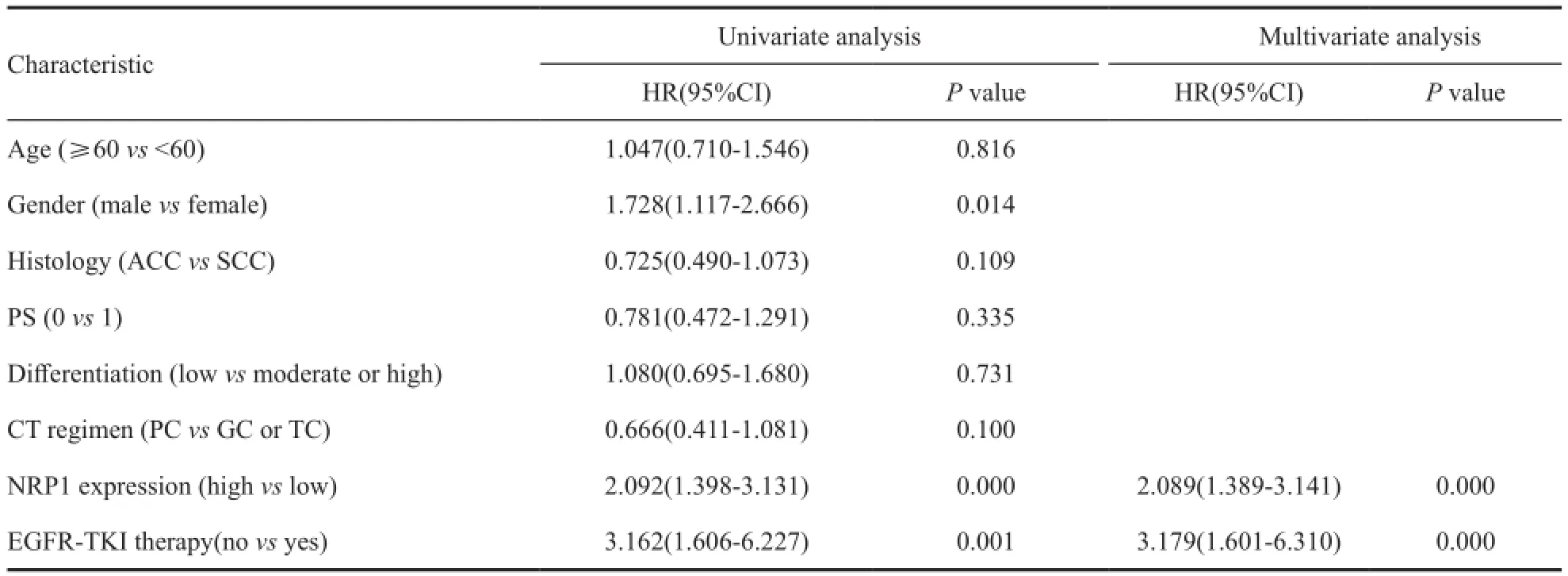
表3 NSCLC中OS相关因素的Cox风险回归模型单因素及多因素分析Tab.3 Univariate and multivariate Cox regression analysis for OS in NSCLC
3 讨 论
本研究探讨NRP1表达是否与晚期NSCLC含铂双药方案化疗敏感性及预后相关。结果显示,NRP1高表达患者的化疗反应率明显低于低表达者。而且,NRP1表达与患者的PFS及OS相关,NRP1高表达的晚期NSCLC患者比NRP1低表达者预后更差。
NRP1作为血管内皮生长因子(vascular endothelial growth factor,VEGF)家族成员的受体,以独立或依赖血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)的方式参与新生血管的生成及肿瘤的增殖和迁移[15]。有研究显示,NRP1在肺癌、前列腺癌、乳腺癌、胰腺癌、卵巢癌、胃肠道肿瘤、神经胶质瘤和黑素瘤等多种恶性肿瘤中高表达[16]。NRP1表达使NSCLC细胞更容易发生新生血管形成、侵犯和转移。NRP1低表达NSCLC患者术后生存期明显长于高表达者,NRP1表达是NSCLC术后生存期的独立预后因素[17]。另外,有研究显示,NRP1表达与骨肉瘤、前列腺癌和胰腺癌等多种恶性肿瘤的预后相关[7-12]。本研究结果显示,NRP1表达与晚期NSCLC化疗的PFS和OS相关,是OS的独立预后因素。因此,NRP1可能在晚期NSCLC疾病进展中发挥作用。
近期体外研究发现,NRP1表达与骨肉瘤对多柔比星耐药相关,下调NRP1表达可增强骨肉瘤细胞对多柔比星的敏感性[12]。临床研究结果进一步证实,NRP1表达与骨肉瘤化疗敏感性相关,在166例行新辅助化疗的骨肉瘤患者中,NRP1低表达患者的化疗反应率为55.9%,而高表达患者的化疗反应率仅为44.1%,差异有统计学意义(P=0.006)[13]。本研究显示,NRP1高表达的晚期NSCLC患者的化疗反应率明显低于低表达者,提示NRP1高表达与晚期NSCLC化疗耐药相关。迄今为止,NRP1表达引起化疗耐药的机制仍不明确。Beck等[18]的研究显示,VEGF-NRP1通路可以促进皮肤鳞癌肿瘤干细胞的形成及自我更新,但敲除NRP1基因后,VEGF则失去了促进肿瘤干细胞自我更新的能力。Hamerlik等[19]的研究显示,VEGFR2高表达的脑胶质瘤中同样存在VGFE-VEGFR2-NRP1通路,该通路可以促进脑胶质瘤干细胞的活性及增殖。仅抑制VEGF并不能阻断该通路信号转导,VEGFR2-NRP1通路仍能通过自分泌作用被激活。当敲除NRP1基因后,脑胶质瘤干细胞的活性明显减弱。这两项研究均提示,NRP1在调节肿瘤干细胞形成和增殖中发挥重要作用。此外,NRP1可以通过活化NF-κB促进口腔鳞癌细胞上皮细胞-间充质细胞转换(epithelialmesenchymal transition,EMT)形成[20]。既往研究已表明,肿瘤干细胞或EMT均可导致化疗耐药[21-22]。因此,NRP1可能通过促进肿瘤干细胞增殖及促进EMT形成导致化疗耐药。
NRP1高表达与晚期NSCLC化疗耐药相关提示,针对NRP1靶点的治疗可能进一步提高晚期NSCLC化疗疗效。最近,Yue等[12]的研究显示,敲除NRP1基因可明显提高骨肉瘤细胞对多柔比星的敏感性。Han等[23]的研究显示,应用RNA干扰技术沉默NRP1表达后,同样可以增强乳腺癌细胞的化疗敏感性。
本研究为回顾性研究,样本量小,未纳入表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变状态进行分析。EGFR基因突变状态除了可预测EGFR-TKI疗效外,还与化疗疗效相关[24-25]。应用紫杉醇联合卡铂方案一线治疗晚期NSCLC患者,EGFR突变型和野生型患者的化疗有效率分别为47.3% 和23.5%,EGFR突变的晚期NSCLC化疗有效率更高[24]。Dong等[25]的研究显示,EGFR突变状态是晚期NSCLC一线化疗PFS的独立预测因素。因此,EGFR基因突变状态被认为是晚期NSCLC化疗反应率和预后的重要影响因素[26]。
综上所述,NRP1高表达与晚期NSCLC肺癌化疗反应率及生存期相关,NRP1可能是预测晚期NSCLC化疗敏感性及预后的生物标志物。
[参考文献]
[1] RECK M, HEIGENER D F, MOK T, et al. Management of non-small cell lung cancer: recent developments [J]. Lancet, 2013, 382(9893): 709-719.
[2] SCHILLER J H, HARRINGTON D, BELANI C P, et al. Comparison of four chemotherapy regimens for advanced nonsmall cell lung cancer [J]. N Engl J Med, 2002, 346(2):92-98.
[3] SCAGLIOTTI G V, PARIKH P, VON PAWEL J, et al. Phase Ⅲ study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small cell lung cancer [J]. J Clin Oncol, 2008, 26(21): 3543-3551.
[4] CHANG A. Chemotherapy, chemoresistance and the changing treatment landscape for NSCLC [J]. Lung Cancer, 2011,71(1): 3-10.
[5] HE Z, TESSIER-LAVIGNE M. Neuropilin is a receptor for the axonal chemorepellent Semaphorin Ⅲ [J]. Cell, 1997,90(4): 739-751.
[6] WILD J R, STATON C A, CHAPPLE K, et al. Neuropilins:expression and roles in the epithelium [J]. Int J Exp Pathol,2012, 93(2): 81-103.
[7] 丁曼华, 刘 亮, 刘 毅, 等. 人非小细胞肺癌VEGFR2和NRP-1表达意义分析 [J]. 中华肿瘤防治杂志, 2014,11(21): 841-846.
[8] TALAGAS M, UGUEN A, GARLANTEZEC R, et al. VEGFR1 and NRP1 endothelial expressions predict distant relapse after radical prostatectomy in clinically localized prostate cancer [J]. Anticancer Res, 2013, 33(5): 2065-2075.
[9] BEN Q, ZHENG J, FEI J, et al. High neuropilin 1 expression was associated with angiogenesis and poor overall survival in resected pancreatic ductal adenocarcinoma [J]. Pancreas,2014, 43(5): 744-749.
[10] LU J, CHENG Y, ZHANG G, et al. Increased expression of neuropilin 1 in melanoma progression and its prognostic significance in patients with melanoma [J]. Mol Med Rep,2015, 12(2): 2668-2676.
[11] ZHAO J, GU L, LI C, et al. Investigation of a novel biomarker,neuropilin-1, and its application for poor prognosis in acute myeloid leukemia patients [J]. Tumour Biol, 2014, 35(7):6919-6924.
[12] YUE B, MA J F, YAO G, et al. Knockdown of neuropilin-1 suppresses invasion, angiogenesis, and increases the chemosensitivity to doxorubicin in osteosarcoma cells - an in vitro study [J]. Eur Rev Med Pharmacol Sci, 2014, 18(12):1735-1741.
[13] ZHU H, CAI H, TANG M, TANG J, et al. Neuropilin-1 is overexpressed in osteosarcoma and contributes to tumor progression and poor prognosis [J]. Clin Transl Oncol,2014, 16(8): 732-738.
[14] EISENHAUER E A, THERASSE P J, BOGAERTS J, et a1. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1) [J]. Eur J Cancer, 2009,45(2): 228-247.
[15] GOEL H L, MERCURIO A M. VEGF targets the tumour cell [J]. Nat Rev Cancer, 2013, 13(12): 871-882.
[16] ZACHARY I. Neuropilins: role in signalling, angiogenesis and disease [J]. Chem Immunol Allergy, 2014, 99: 37-70.
[17] HONG T M, CHEN Y L, WU Y Y, et al. Targeting neuropilin 1 as an antitumor strategy in lung cancer[J]. Clin Cancer Res, 2007, 13(16): 4759-4768.
[18] BECK B, DRIESSENS G, GOOSSENS S, et al. A vascular niche and a VEGF-Neuropilin-1 loop regulate the initiation and stemness of skin tumours [J]. Nature, 2011, 478(7369):399-403.
[19] HAMERLIK P, LATHIA J D, RASMUSSEN R, et al. Autocrine VEGF-VEGFR2-Neuropilin-1 signaling promotes glioma stem-like cell viability and tumor growth [J]. J Exp Med, 2012, 209(3): 507-520.
[20] CHU W, SONG X, YANG X, et al. Neuropilin-1 promotes epithelial-to-mesenchymal transition by stimulating nuclear factor-kappa B and is associated with poor prognosis in human oral squamous cell carcinoma [J]. PLoS One, 2014, 9(7):e101931.
[21] O'CONNOR ML, XIANG D, SHIGDAR S, et al. Cancer stem cells: A contentious hypothesis now moving forward [J]. Cancer Lett, 2014, 344(2): 180-187.
[22] SHANG Y, CAI X, FAN D. Roles of epithelial-mesenchymal transition in cancer drug resistance [J]. Curr Cancer Drug Targets, 2013, 13(9): 915-929.
[23] HAN Z, JIANG G, ZHANG Y, et al. Effects of RNA interference-mediated NRP-1 silencing on the proliferation and apoptosis of breast cancer cells [J]. Mol Med Rep,2015, 12(1): 513-519.
[24] MOK T S, WU Y L, THONGPRASERT S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma [J]. N Engl J Med, 2009, 361(10): 947-957.
[25] DONG X, ZHAO X, HAO Y, et al. Response to first-line chemotherapy in patients with non-small cell lung cancer according to epidermal growth factor receptor and K-RAS mutation status [J]. Clin Lung Cancer, 2013, 14(6): 680-687.
[26] FANG S, WANG Z. EGFR mutations as a prognostic and predictive marker in non-small cell lung cancer [J]. Drug Des Devel Ther, 2014, 8: 1595-1611.
DOI:10.19401/j.cnki.1007-3639.2016.06.006
中图分类号:R734.2
文献标志码:A
文章编号:1007-3639(2016)06-0514-07
收稿日期:(2015-11-05 修回日期:2016-01-22)
基金项目:广东省科技计划项目(20120318077);佛山市科技创新专项基金 (2014AG10003)。通信作者:邓燕明 E-mail: yanmingdeng78@126.com
NRP1 expression is associated with chemosensitivity and poor prognosis in advanced non-small cell lung cancer patients treated with frst-line platinum-based chemotherapy
FENG Weineng1, ZHANG Liangyun2, SHI Haiyan2, CHEN Zecheng1, TANG Yicong1, DENG Yanming1(1.Department of Head,Neck and Thoracic Medical Oncology, the First People's Hospital of Foshan, Foshan 528000, Guangdong Province, China; 2.Department of Pathology, the First People's Hospital of Foshan, Foshan 528000,Guangdong Province, China)Correspondence to: DENG Yanming E-mail: yanmingdeng78@126.com
[Abstract]Background and purpose: Neuropilin-1 (NRP1), a vascular endothelial growth factor (VEGF)receptor, plays an important role in tumor angiogenesis and tumor cell migration. The purpose of this study was to determine the correlation between NRP1 expression and sensitivity to frst-line platinum-based chemotherapy in patients with advanced non-small cell lung cancer (NSCLC), and between NRP1 expression and survival. Methods: NRP1 expression in tumor tissues of 104 advanced NSCLC patients treated with frst-line platinum-based regimen was detected by immunohistochemisty. A chi-square test and logistic regression model were used to analyze the relationship between NRP1 expression and the chemotherapy response rate. Kaplan-Meier and Cox proportional hazard regression models were used to analyze the efect of NRP1 expression on patient survival. Results: Among the 104 patients, 56 (53.8%)had high expression of NRP1. High expression of NRP1 was not related to age, gender, histological type, degree of differentiation, performance status, and chemotherapy regimen. The chemotherapy response rate was significantly higher in patients with low NRP1 expression than in patients with high expression (43.8% vs 23.2%, P=0.026). The low NRP1 expression was signifcantly associated with longer progression-free survival (4.6 months vs 3.0 months, P=0.001for log-rank test, χ2=11.273) and overall survival (11.5 months vs 9.2 months, P=0.000 for log-rank test, χ2=14.392) as compared with high NRP1 expression. Multivariate analysis showed that high expression of NRP1 was an independent predictor for the chemotherapy response rate and overall survival in patients with advanced NSCLC. Conclusion:NRP1 expression is associated with response rate and survival in advanced NSCLC patients treated with frst-line platinum-based chemotherapy. NRP1 expression may be a potential biomarker for predicting chemosensitivity and prognosis in patients with advanced NSCLC.
[Key words]Non-small cell lung cancer; Neuropilin-1; Chemosensitivity; Prognosis

