青霉胞外合成银纳米粒子及其表征
徐秋红,黄梅颖,冯家勋,杜良伟
(1.广西大学化学化工学院, 广西南宁530004;2.广西大学亚热带农业生物资源保护与利用国家重点实验室, 广西南宁530004;3.广西大学生命科学与技术学院, 广西南宁530004)
青霉胞外合成银纳米粒子及其表征
徐秋红1, 2,黄梅颖1, 2,冯家勋2, 3,杜良伟1, 2
(1.广西大学化学化工学院, 广西南宁530004;2.广西大学亚热带农业生物资源保护与利用国家重点实验室, 广西南宁530004;3.广西大学生命科学与技术学院, 广西南宁530004)
摘要:为了寻求绿色高效的纳米粒子合成方法,在模拟太阳光的照射下,利用青霉滤液快速胞外合成了银纳米粒子。用肉眼观察、紫外—可见吸收光谱、X射线衍射(XRD)和透射电镜(TEM)对合成的银纳米粒子进行表征。XRD结果表明合成了优先沿着(111)面生长的晶体结构的银纳米粒子。TEM结果表明,大部分纳米粒子以团聚的状态分散在溶液中,单个纳米粒子的形貌呈球形,平均粒径约为6 nm,团聚物的形状不规则,其粒径在20~50 nm。该合成方法具有条件温和、清洁、无毒、无污染的特点,是一种绿色化学和环境友好的合成方法。
关键词:青霉;生物合成;银纳米粒子;光照
金属纳米粒子因其独特的物理、化学和生物学特性,被应用于催化、生物传感器、药物载体和抗菌药物等领域中,其广阔的应用前景已经引起了人们广泛的关注。发展无毒、生物相容和环境友好的方法来合成金属纳米粒子越来越重要。微生物合成金属纳米材料是一个新兴的具有广阔发展前景的研究领域。
许多微生物能够合成纳米材料,这些微生物被认为是环境友好型的“纳米工厂”。1999年,Klaus等[1]首次报道了使用施氏假单胞菌还原制备银纳米粒子,开辟了制备纳米材料的微生物合成法,此后,细菌合成纳米粒子受到了较多的重视[2]。为了打破这种传统,印度的国家化学实验室尝试用真核生物代替原核生物合成纳米粒子,经过两年的努力,在200多种属的真菌中发现了轮枝菌和尖孢镰刀菌可以合成纳米粒子[3-4]。与细菌相比,真菌因培养条件温和、胞外分泌物多和容易进行下游处理等特点而被视为是更高效地合成纳米粒子的资源。
早期微生物合成纳米粒子的位点主要是在胞内,然而,从分析和应用的角度来说,胞内合成的纳米粒子需通过超声波破碎法[5]、去垢剂破碎法[6]或者加入细胞裂解液[7]等方法使纳米粒子从细胞中释放出来,这个过程复杂繁琐且耗费时间,因此,在溶液中进行胞外合成比胞内合成更实际可行。在胞外合成中,目前采用较多的是将菌体在无菌水中培养后收集到的滤液与前驱体离子反应生成纳米粒子。由于胞外分泌的滤液比较纯净,该合成方法更有利于研究纳米粒子的合成。
目前已经有许多微生物被用来合成银纳米粒子,但大多数的合成效率比较低,反应时间长[8-9]。最近,文献[10-11]报道,光能够有效地促进银纳米粒子的合成,而且能缩短合成时间。为此,本研究在模拟太阳光照射的条件下,用真菌青霉1-208的滤液胞外合成银纳米粒子,并对合成的纳米粒子进行表征,旨在利用可再生的微生物资源快速合成纳米粒子。
1实验部分
1.1实验试剂
硝酸银(AgNO3)(上海化学试剂有限公司);胰蛋白胨(北京奥博星生物技术责任有限公司);KH2PO4、(NH4)2SO4、MgSO4·7H2O、HCl、可溶性淀粉(国药集团化学试剂有限公司);CaCl2(生工生物工程有限公司);FeSO4·7H2O(广东汕头新宁化工厂)。所有试剂均为分析纯。实验用水均为去离子水,另有违规除外。
AgNO3储备液的配制:准确称取一定量的AgNO3固体,用去离子水溶解并定容,配制成100 mmol/L的AgNO3溶液,用锡纸包裹避光于4 ℃冰箱保存备用。
1.2主要仪器
紫外—可见分光光度计(PerkinElmer Lambda 35,美国);透射电子显微镜(Hitachi H-500,日本);X射线衍射仪(Rigaku D/MAX,日本);光化学反应仪(德洋意邦,中国上海);往复式恒温摇床(Thermo Fisher,美国);GNP-9160型隔水式恒温培养箱(上海精宏实验设备有限公司);冷冻离心机(Eppendorf,德国)。
1.3实验方法
1.3.1青霉的培养
青霉1-208来自于亚热带农业生物资源保护与利用国家重点实验室,将保存在PDA平板上的青霉1-208接种于250 mL的可溶性淀粉培养基[12]中,在28 ℃,180 r/min的往复式恒温摇床中培养3 d。
1.3.2细胞滤液的获取
将培养3 d后的菌液用4层无菌纱布进行过滤,并用足够的无菌去离子水进行冲洗,除掉培养基的成分,以免残余成分对Ag+离子的还原产生影响。得到2 g新鲜湿重的菌体,向其中加入20 mL无菌去离子水,摇晃均匀,在28 ℃,180 r/min的条件下培养3 d后,6 000 r/min离心5 min,收集上清液。
1.3.3银纳米粒子的合成
在搅拌下将100 mL AgNO3溶液逐滴地加入到10 mL的细胞滤液中,使AgNO3的最终浓度为1 mmol/L。银纳米粒子合成反应是在光辐射的条件下进行,用氙灯(500 W)模拟自然界中的太阳光。把同样的反应溶液置于黑暗处做对照实验。
1.4纳米粒子的表征方法
1.4.1紫外—可见吸收光谱
在不同的反应时间取反应溶液,将其用去离子水稀释两倍后注入石英比色皿中,以去离子水为参比,在200~900 nm的波长范围内,用紫外—可见分光光度计进行扫描,观察反应过程中溶液吸收光谱的变化。
1.4.2X射线衍射
将反应30 min后的纳米银溶液滴到洁净的单晶硅片上,待溶液自然晾干后,以CuKα为辐射源,在40 kV电压和30 mA电流下,在35~90°范围内以10°/min的速度扫描,进行XRD分析。
1.4.3透射电镜
用移液枪吸取少量反应30 min后的溶液滴在称量纸上,呈液滴状。用镊子夹住铜网,使铜网浸入液滴,大约30 s后,用镊子将铜网取下,让铜网在空气中自然晾干,在加速电压120 kV下对样品进行TEM观察。
2结果与讨论
2.1肉眼观察
为了合成银纳米粒子,在搅拌下将AgNO3溶液滴加到细胞滤液中,合成反应是在500 W氙灯的照射下进行。加入AgNO3溶液后,反应溶液立即出现轻微浑浊,我们推断细胞滤液中可能含有某些阴离子,容易与Ag+离子形成不溶盐;反应2 min后,溶液呈现微红色;随着反应时间的延长,溶液颜色逐渐加深至透明的红褐色。图1是滤液反应前后的颜色对比图,图1(a)是细胞滤液的颜色,呈淡黄色;反应30 min之后溶液颜色从浅黄色转变为澄清的红褐色(图1(b))。红褐色是银纳米粒子的特征颜色[13]。由于AgNO3溶液和细胞滤液颜色均很浅,根据颜色的变化初步断定溶液中形成了银纳米粒子。相比以前报道的胞外生物合成银纳米粒子需几小时,甚至是几天[4],本研究反应所需的时间显著缩短。将同样的反应溶液置于黑暗中进行对照实验,结果发现,在相同的时间内,反应溶液的颜色没有任何变化,即没有银纳米粒子的生成。由此推断光在银纳米粒子的合成中起了关键作用。

(a) 细胞滤液颜色

(b) 与AgNO3溶液反应后的颜色
图1青霉1-208的细胞滤液反应前后的颜色
Fig.1The colors of cell filtrate fromPenicilliumsp.1-208 before and after reaction with AgNO3solution
2.2紫外—可见吸收光谱表征
图2展示了银纳米粒子合成过程中反应溶液随着时间变化的紫外—可见吸收光谱图。从曲线1中可以看出,青霉1-208的细胞滤液在300~800 nm范围内没有吸收峰。而AgNO3溶液与细胞滤液反应10 min后,在400~430 nm出现了1个明显的吸收峰(曲线4)。已有文献证实银纳米粒子的特征峰即表面等离子共振(SPR)峰出现在这个区域[14-15],说明反应溶液中生成了银纳米粒子。接着随时间的增加,SPR峰逐渐升高,说明反应溶液中银纳米粒子的量也逐渐增加[16]。图3反映了SPR峰的吸光度随时间变化的关系图。吸光度在反应初期显著增加,随后缓慢上升,这表明在该反应过程中前期反应速度非常快,后期相对缓慢,当反应到120 min时,吸光度不再增加,表明反应基本完成。

曲线1对应细胞滤液的吸收光谱,曲线2~13分别对应2、5、10、15、20、30、40、60、80、100、120、140 min时反应溶液的吸收光谱
图2反应溶液在银纳米粒子合成过程中吸收光谱随时间的变化
Fig.2The absorption spectra of reactionsolution as a function of reaction time

图3细胞滤液与AgNO3溶液反应过程中吸光度随时间的变化
Fig.3The absorbance changes against reactiontime during the cell filtrate interactingwith AgNO3solution
2.3XRD表征

图中标记的峰是元素银的特征衍射峰图4 合成的银纳米粒子的XRD图谱Fig.4 XRD pattern of the synthesized AgNPs
为进一步研究银纳米粒子的结构特性,将反应30 min后得到的银纳米粒子做XRD表征,结果如图4所示。在银纳米粒子的XRD图谱中,在38.1°和44.3°处的衍射峰分别对应于面心立方(fcc)银晶体的Bragg衍射峰(111)和(200),这与大块的具有面心立方结构银的特征相一致,证实生成了银纳米晶体[17-18]。该样品中银颗粒所产生的衍射峰相对较宽,表明样品中所形成的银颗粒粒径较小。值得注意的是,(111)衍射峰的强度远高于(200)的衍射峰,这表明银纳米粒子优先沿着(111)面的方向生长[19]。同时,在46.2°、54.8°和57.4°处的衍射峰分别对应于氯化银的Bragg衍射峰(220)、(311)和(222)[20],说明在反应过程中生成了氯化银。由此推断反应初期出现的轻微浑浊可能是因为生成了少量的氯化银。
2.4TEM表征
TEM表征可以得到纳米粒子的形貌、粒径大小和分散情况的信息[21-22]。将反应30 min后所得的银纳米粒子进行TEM表征。图5是具有代表性的银纳米粒子的电镜图。由图5(a)中可以观察到溶液中分布着大量的银纳米粒子,但纳米粒子有明显的团聚,呈不规则的形状,团聚物的直径约在20~50 nm,其中还有粒径极小的纳米粒子分散在溶液中。在放大倍数更高的情况下(图5(b)),可以看到团聚物是由球形或近似球形的单个纳米粒子组成的。根据TEM图对单个纳米粒子进行粒径统计分析,为了确保数据的准确性,所统计的纳米粒子的数目在200个以上,结果表明,合成的银纳米粒子的粒径主要分布在3~12 nm,平均粒径约为6 nm。

(a) 80 000放大倍数TEM图

(b) 600 000放大倍数TEM图
图5胞外合成的银纳米粒子在不同放大倍数下的透射电镜图
Fig.5TEM images of the AgNPs at different magnifications
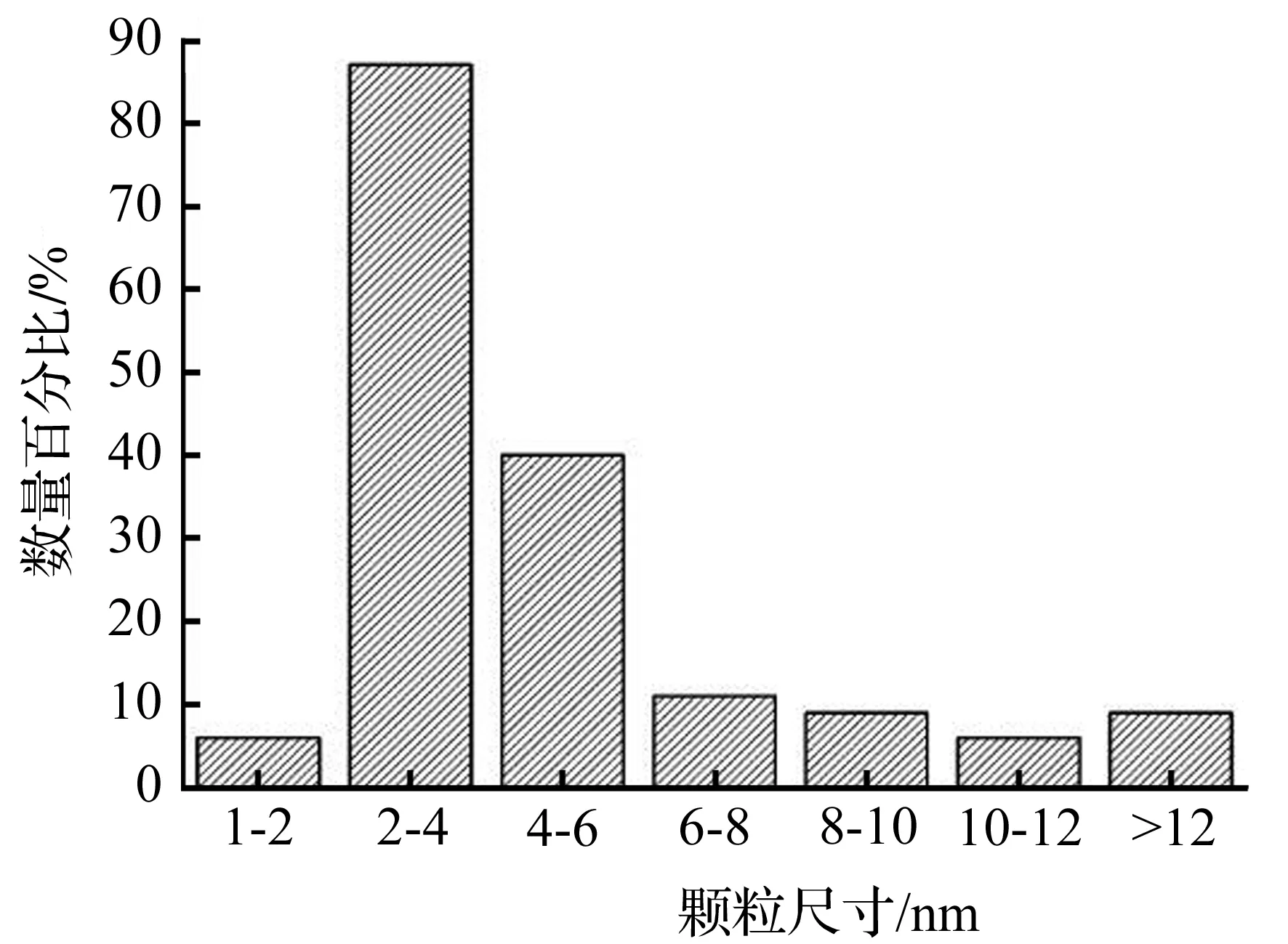
图6 从TEM图像中获得的颗粒尺寸分布图
3结语
本文在氙灯模拟太阳光的照射下,利用青霉1-208的胞外滤液快速合成银纳米粒子,并对合成的产物进行肉眼观察、紫外—可见吸收光谱、XRD和TEM表征。结果表明,银纳米粒子是面心立方的晶体结构,并且优先沿着(111)面的方向生长;部分合成的银纳米粒子以团聚物的形式分散在溶液中,团聚物的直径约在20~50 nm,其中,还有粒径极小的纳米粒子分散在溶液中,单个纳米粒子的粒径主要分布在3~12 nm,平均粒径约为6 nm。在整个反应体系中,没有加入额外的化学试剂和保护剂,合成条件温和、无毒、无污染,反应速度快,说明该合成方法是一种绿色化学和环境友好的合成方法。
参考文献:
[1]KLAUS T, JOERGER R, OLSSON E, et al.Silver-based crystalline nanoparticles, microbially fabricated[J]. Proceedings of the National Academy of Sciences, 1999, 96(24): 13611-13614.
[2]KLAUS-JOERGER T, JOERGER R, OLSSON E, et al.Bacteria as workers in the living factory: metal-accumulating bacteria and their potential for materials science[J]. Trends in Biotechnology, 2001, 19(1): 15-20.
[3]MUKHERJEE P, AHMAD A, MANDAL D, et al.Fungus-mediated synthesis of silver nanoparticles and their immobilization in the mycelial matrix: a novel biological approach to nanoparticle synthesis[J]. Nano Letters, 2001, 1(10): 515-519.
[4]AHMAD A, MUKHERJEE P, SENAPATI S, et al.Extracellular biosynthesis of silver nanoparticles using the fungusFusariumoxysporum[J]. Colloids and Surfaces B: Biointerfaces, 2003, 28(4): 313-318.
[5]KALIMUTHU K, BABU R S, VENKATARAMAN D, et al.Biosynthesis of silver nanocrystals byBacilluslicheniformis[J]. Colloids and Surfaces B: Biointerfaces, 2008, 65(1): 150-153.
[6]SAMADI N, GOLKARAN D, ESLAMIFAR A, et al.Intra/extracellular biosynthesis of silver nanoparticles by an autochthonous strain ofProteusmirabilisisolated from photographic waste[J]. Journal of Biomedical Nanotechnology, 2009,5(3): 247-253.
[7]HUSSEINY M I, EL-AZIZ M A, BADR Y, et al.Biosynthesis of gold nanoparticles usingPseudomonasaeruginosa[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2007, 67(3): 1003-1006.
[8]GOPINATH V, VELUSAMY P.Extracellular biosynthesis of silver nanoparticles usingBacillussp.GP-23 and evaluation of their antifungal activity towardsFusariumoxysporum[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2013, 106: 170-174.
[9]RODRIGUES A G, PING L Y, MARCATO P D, et al.Biogenic antimicrobial silver nanoparticles produced by fungi[J]. Applied Microbiology and Biotechnology, 2013, 97(2): 775-782.
[10]杨素玲,孟佑婷,刘桂君,等.利用产黄青霉培养液的上清液生物合成纳米银影响因素的研究[J]. 安徽农业科学,2013,41(2):503-504,506.
[11]WEI X T, LUO M F, LI W, et al.Synthesis of silver nanoparticles by solar irradiation of cell-freeBacillusamyloliquefaciensextracts and AgNO3[J]. Bioresource Technology, 2012, 103(1): 273-278.
[12]DU L W, XIAN L, FENG J X.Rapid extra-/intracellular biosynthesis of gold nanoparticles by the fungusPenicilliumsp.[J]. Journal of Nanoparticle Research, 2011, 13(3): 921-930.
[13]SANGHI R, VERMA P.Biomimetic synthesis and characterisation of protein capped silver nanoparticles[J]. Bioresource Technology, 2009, 100(1), 501-504.
[14]张杰,张映,郭瑞,等.钩状木霉生物合成纳米银及其杀菌性能[J]. 微生物学通报,2016,43(2):386-393.
[15]GANGULA A, PODILA R, M R, et al.Catalytic reduction of 4-nitrophenol using biogenic gold and silver nanoparticles derived fromBreyniarhamnoides[J]. Langmuir, 2011, 27(24): 15268-15274.
[16]白红娟,贾万利.固定化球形红细菌生物合成银纳米材料及其抑菌性能研究[J]. 贵金属,2013,34(1):8-12.
[17]WEI X T, ZHOU H C, XU L, et al.Sunlight-induced biosynthesis of silver nanoparticles by animal and fungus biomass and their characterization[J]. Journal of Chemical Technology and Biotechnology, 2014, 89(2): 305-311.
[18]GANESH BABU M M, GUNASEKARAN P.Production and structural characterization of crystalline silver nanoparticles fromBacilluscereusisolate[J]. Colloids and Surfaces B: Biointerfaces, 2009, 74(1): 191-195.
[19]ZHU Y P, WANG X K, GUO W L, et al.Sonochemical synthesis of silver nanorods by reduction of silver nitrate in aqueous solution[J]. Ultrasonics Sonochemistry, 2010, 17(4): 675-679.
[20]LIU C, YANG D, WANG Y G, et al.Fabrication of antimicrobial bacterial cellulose-Ag/AgCl nanocomposite using bacteria as versatile biofactory[J]. Journal of Nanoparticle Research, 2012, 14(8): 1-12.
[21]何秋星,李伟洲,陈权.水热法制备纳米Fe3O4的研究[J]. 广西大学学报(自然科学版),2004,29(2):170-174.
[22]续京,张炎.化学沉淀法制备纳米钛酸钡粉体[J]. 广西大学学报(自然科学版),2011,36(3):445-449.
(责任编辑张晓云裴润梅)
收稿日期:2015-11-30;
修订日期:2016-04-15
基金项目:广西自然科学基金资助项目(2012GXNSFGA060005,2013GXNSFBA019098)
通讯作者:杜良伟(198l—),女,河南南阳人,广西大学副教授;E-mail:dulily@gxu.edu.cn。
doi:10.13624/j.cnki.issn.1001-7445.2016.0857
中图分类号:TB383
文献标识码:A
文章编号:1001-7445(2016)03-0857-06
Biosynthesis and characterization of extracellular silver nanonparticles assisted by Penicillium sp.
XU Qiu-hong1, 2, HUANG Mei-ying1, 2, FENG Jia-xun2, 3, DU Liang-wei1, 2
(1.School of Chemistry and Chemical Engineering, Guangxi University, Nanning 530004, China;2.State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources,Guangxi University, Nanning 530004, China;3.College of Life Science and Technology, Guangxi University, Nanning 530004, China)
Abstract:In order to explore green and efficient methods for the synthesis of nanoparticles, extracellular silver nanoparticles (AgNPs) were rapidly synthesized assisted by the cell filtrates of Penicillium sp. 1-208 under simulated sunlight. The synthesized AgNPs were characterized by means of visual observation, UV-Vis absorption spectroscopy, X-ray diffraction (XRD) and transmission electron microscopy (TEM). The XRD results showed that the synthesized AgNPs were crystalline in nature and preferentially oriented in (111) plane. The TEM results showed that most of the nanoparticles dispersed in solution in the form of agglomerated structure, in which the single nanoparticles were spherical in shape with average particle size of 6 nm and the diameter of agglomerated structure with irregular shape ranged from 20 to 50 nm. The approach used in this study is a green and environment-friendly synthesis method with the advantage of mild condition, clean, non-toxicity and non-polluting.
Key words:Penicillium sp.; biosynthesis; silver nanoparticles; light radiation
引文格式: 徐秋红,黄梅颖,冯家勋,等.青霉胞外合成银纳米粒子及其表征[J].广西大学学报(自然科学版),2016,41(3):857-862.

