登革病毒Ⅱ型引起原代HDMECs通透性变化机制的初步研究①
赵 军 左 丽 戴雪婷 裴 华 袁 静 孔维莹
(贵州医科大学免疫学教研室,贵阳550004)
登革病毒Ⅱ型引起原代HDMECs通透性变化机制的初步研究①
赵军左丽戴雪婷裴华袁静孔维莹
(贵州医科大学免疫学教研室,贵阳550004)
[摘要]目的:了解登革病毒Ⅱ型(Dengue virus Type 2,DENV-2)感染原代人真皮微血管内皮细胞(Primary Human dermal micro-vascular endothelial cells,pHDMECs)引起细胞通透性改变的机制。方法:用103 TCID50的DENV-2感染pHDMECs;于4、8、12、24、48 h Real time-PCR、免疫荧光法及流式细胞术检测DENV-2 NS1部分序列及蛋白;Transwell法检测细胞通透性;Real time -PCR和双抗体夹心ELISA法检测IL-6和IL-8的变化;流式细胞术检测24、48、72 h细胞凋亡。结果:DENV-2感染的pHDMECs 病毒NS1基因相对表达上调,但未检测到病毒NS1蛋白;DENV-2感染的pHDMECs通透性在24、48 h显著升高;pHDMECs被感染72 h后凋亡也无明显变化; IL-6和IL-8 mRNA分别在8、24 h相对表达上调[IL-6:(2.49±0.5)倍,P<0.05;IL-8:(6.82±1.69)倍,P<0.05];对照组和感染组分泌的IL-6于8 h分别为(869.6±50.7)、(1 248.8±86.9)pg/ml,P<0.05;IL-8于48 h分别为(967.6±156.6)、(1 331.0±86.3)pg/ml,P<0.05。结论:DENV-2能感染pHDMECs;pHDMECs被DENV-2感染后,细胞的通透性增加与凋亡无关,与促炎性细胞因子IL-6和IL-8明显上调关系密切。
[关键词]登革病毒;原代人真皮微血管内皮细胞;IL-6;IL-8;通透性
登革病毒(Dengue virus,DENV)属于黄病毒科黄病毒属,感染后引起症状较轻的登革热(Dengue fever,DF)和严重的登革出血热(Dengue hemorrhagic fever,DHF)和登革休克综合征(Dengue shock syndrome,DSS)[1]。据WHO统计,全球每年约有3.9亿人受到DENV感染,出现症状的约9 600万,其中50万人需要住院治疗[2]。我国南方部分地区也不同程度地受到DENV的影响[3],目前对DENV感染仍然没有有效的疫苗和治疗方法[1,2]。
DHF/DSS是导致患者死亡的主要原因,其主要症状包括微血管通透性增加、血浆渗漏、血小板减少、出血等症状。抗体依赖的增强作用(Antibody dependent enhancement,ADE)及交叉反应性T细胞的激活被认为是DHF/DSS的重要致病机制[1,4]。二者共同作用引起“细胞因子风暴”,表现为DHF/DSS患者多种细胞因子如IL-6、IL-8、TNF-α、IFN-α、INF-γ、IL-1β、CXCL-10及MCP-1等高表达,导致血管内皮细胞(Vascular endothelial cells,VECs)功能紊乱[1]。
DHF/DSS的病人中高表达的细胞因子主要来源于单核巨噬细胞、T淋巴细胞等多种免疫细胞[1]。研究表明,DENV感染VECs后分泌的多种细胞因子参与了机体的免疫应答过程。Nadine等[5]用DENV-4感染原代人脐静脉内皮细胞(primary human umbilical vein endothelial cells,pHUVECs),发现促炎性因子IL-6、IL-8、CXCL-9、10、11及RANTES有不同程度的上调;Huang等[6]用DENV-2和DENV-3作用于HUVECs可直接上调IL-6和IL-8。临床的研究表明IL-6和IL-8与DHF发生和发展有着密切关系[7]。IL-6是一种促炎性细胞因子,作用于VECs直接增加细胞的通透性,且与IL-6的浓度有相关性[8]。IL-8是与炎症相关的趋化因子,DENV-2感染的HMEC-1分泌IL-8引起骨架重排使VECs的通透性增高[9]。至于DENV-2感染的pHDMECs通透性是否发生变化,以及与IL-6和IL-8之间的关系,目前还不清楚。
细胞凋亡是VECs损伤和通透性增加的重要因素,DENV-2感染是否引起VECs凋亡仍存在争议,Long等[10]研究表明,DENV-2感染pHUVECs后通过外源性凋亡受体Fas/FasL途径诱导细胞的凋亡产生;但是也有报道,DENV-2感染pHUVECs未见明显细胞凋亡[11]。DENV-2感染是否引起pHDMECs凋亡,目前未见相关报道。
本次研究拟采用pHDMECs为内皮细胞模型,锚定细胞凋亡的发生和细胞因子的分泌,初步探讨DENV-2作用于pHDMECs通透性变化的机制,从而为DHF/DSS的发病机制提供新的科学依据。
1材料与方法
1.1材料
1.1.1细胞株DENV-2国际标准株(NGC株) 本教研室增殖并保存于液氮。pHDMECs购于美国Sciencell公司;白纹伊蚊细胞(C6/36)购于中科院昆明细胞库;BHK细胞为本教研室传代保存。
1.1.2主要试剂及仪器ECM培养基及内皮细胞生长因子添加物(ECGS)(美国Sciencell公司);FITC AnnexinⅤ Apoptosis Detection Kit with 7-AAD凋亡检测试剂盒(Biolegend公司);SsoFast EvaGreen Supermix及Real-time detection System(Bio-Rad公司);Human IL-6 和IL-8 Platinum ELISA试剂盒(eBioscience公司);引物序列(见表1,上海捷瑞生物工程有限公司);荧光倒置显微镜(Nikon公司 TS100F);流式细胞仪(BD公司);多功能酶标仪(BioTek Synergy H4型)。
1.2实验方法
1.2.1DENV-2的增殖、滴定与鉴定用C6/36细胞增殖病毒,TCID50法检测并用Reed-Muench法计算病毒滴度,RT-PCR特异地扩增DENV-2 NS1部分序列(413 bp)及HindⅢ限制性内切酶切割扩增产物以鉴定病毒。
1.2.2pHDMECs的培养与鉴定细胞长至90%融合度时,进行传代培养,弃上清,PBS液洗涤,0.25%胰蛋白(含EDTA)消化后,加全培养基(10%FBS-ECM含ECGS)终止消化,离心,弃上清加全培养基重悬细胞,分瓶,37℃、5%CO2培养;细胞传至3~4代,收集细胞样本,分别用免疫组化法和流式细胞术检测pHDMECs的Ⅷ因子相关蛋白和CD31。
1.2.3Real-time PCR检测DENV-2 NS1部分序列的表达以103TCID50/ml的DENV-2感染pHDMECs(融合度约90%),于4、8、12、24及48 h收集细胞提取总RNA,并逆转录成cDNA,检测内参基因β-Actin和目的基因NS1部分序列扩增循环数(Ct),用2-△△Ct法计算NS1部分序列在各时间点的相对表达。
1.2.4免疫荧光法和流式细胞术检测DENV-2对pHDMECs的感染选取生长融合度为90%的pHDMECs,制成细胞悬液,2×105个细胞/孔接种于6孔板,37℃、5%CO2孵育24 h后,接种103TCID50/孔的DENV-2液孵育2 h,弃液洗涤,加2% FBS-ECM培养基(含ECGS)维持培养,分别于24、48和72 h收集细胞样本。免疫荧光法:细胞样本经过4%多聚甲醛固定,0.1%Triton-X-100破膜,2%FBS封闭后,加抗NS1单克隆抗体,4℃孵育过夜;次日,加二抗(FITC-兔抗小鼠)孵育1~2 h,DAPI工作液染核后,荧光倒置显微镜拍照记录结果。流式细胞术:细胞样本依次孵育抗NS1单克隆抗体和FITC标记二抗(兔抗小鼠),流式细胞仪检测荧光强度的变化。
1.2.5流式细胞术检测pHDMECs凋亡DENV-2感染pHDMECs,在24、48和72 h收集细胞制成细胞悬液,分别用 FITC-Annexin Ⅴ和7-AAD染色,流式细胞仪检测细胞凋亡。
1.2.6DENV-2感染的pHDMECs通透性检测将200 μl/孔细胞液含有(4×105个细胞)接种于纤粘蛋白包被的Transwell小室,下室加600 μl全培养基,放37℃、5%CO2孵育;24 h后待细胞铺满单层,接100 μl/孔DENV-2(103TCID50/ml),空白组和阳性组分别加无血清ECM培养基和LPS(0.2 mg/ml),37℃、5%CO2孵育2 h,弃液加2%FBS-ECM(含ECGS)维持培养;于4、8、12、24和48 h 加50 μl/孔 FITC-dextran(0.2 mg/ml),37℃孵育30min,收集下室培养液,用BioTek Synergy H4型多功能酶标分析仪检测荧光值(488 nm,525 nm)。
1.2.7Real-time PCR检测相关基因的表达于4、8、12、24及48 h收集DENV-2感染的pHDMECs细胞样本,提取总RNA并逆转录成cDNA,检测内参基因β-Actin和目的基因IL-6,IL-8的Ct值,用2-△△Ct法计算上述目的基因在各时间点的相对表达。
1.2.8双抗夹心ELISA法检测pHDMECs被DENV-2感染后IL-6和IL-8的浓度DENV-2感染4、8、12、24及48 h pHDMECs的培养上清依次加入待使用的孔中,同时加2% FBS-ECM(空白对照)和倍比稀释的标准品,均为复孔,每孔50 μl;然后加50 μl/孔 Biotin-conjugate液;室温孵育2 h;弃去孔中液体,用洗涤缓冲液洗涤,甩干,加入100 μl/孔 Streptavidin-HPR室温孵育1 h;用洗涤缓液洗涤;每孔加100 μl TMB显色剂,室温避光孵育10 min;各孔中迅速的加入100 μl 终止液,BioTek Synergy H4型多功能酶标分析仪检测吸光度(450 nm)。
1.3统计学方法使用SPSS22.0软件对检测数据进行统计处理,DENV-2感染组和对照组之间的差异用方差分析检验。
2结果
2.1pHDEMCs的培养与鉴定用10% FBS-ECM 全培养基(含ECGS)培养的pHDMECs在3 d左右均匀铺满单层,形态、大小一致,呈鹅卵石或者梭形(图1);免疫组化法检测Ⅷ因子相关蛋白,pHDMECs被染成棕褐色,而阴性对照BHK细胞染色前后无颜色变化(图2);另外流式细胞术检测CD31,同型对照和实验组分别呈两个独立单峰,后者阳性率达99.7%(图3)。
2.2DENV-2的滴定与鉴定Reed-Muench法计算病毒的滴度为7×106TCID50/ml;DENV-2 NS1部分序列大小为413 bp,NEBcutter V2.0软件对NS1部分序列进行分析,此序列存在一个HindⅢ限制性内切酶的酶切位点,酶切产物分别为228 bp和185 bp;RT-PCR扩增后,病毒感染组于413 bp处出现清晰明亮的条带,扩增产物经HindⅢ限制性内切酶的酶切可见明显的228 bp与185 bp条带(图4),证明此病毒为DENV-2。
图1 pHDMECs培养至第3天(×100)Fig.1 pHDMECs culture at 3rd day(×100)

图2 免疫组化法鉴定pHDMECs(×100) Fig.2 pHDMECs identified by immunohistochemistry(×100)Note: A.BHK cells as negative control;B.pHDMECs.

图3 pHDMECs CD31分子的表达Fig.3 Expression of CD31 on pHDMECs
2.3DENV-2感染的pHDMECs NS1部分序列相对表达DENV-2感染的pHDMECs 4、8、12、24及48 h NS1部分序列基因熔解曲线峰位置相同,单形单一,说明未出现非特异性扩增(图5);以4 h NS1部分序列基因的相对表达(2-△△Ct值)作为基准,其他时间点NS1部分序列基因相对表达显著升高,48 h达到最大值(图6),说明DENV-2能够感染pHDME Cs, NS1部分序列基因的拷贝数随着时间逐渐增加。
2.4免疫荧光法和流式细胞术检测DENV-2对pHDMECs的感染DENV-2感染BHK细胞和pHDMECs 72 h,免疫荧光法检测NS1部分序列蛋白的结果如图7所示;图8为流式细胞术检测结果,对照组与感染组平均荧光强度分别为(311±11)和(429±14)(P>0.05),而DENV-2感染的BHK细胞分别为(195±5.5)和(830±33.7)(P<0.05),两组之间具有明显的差别。结果表明pHDMECs被DENV-2感染72 h后无NS1部分序列蛋白的表达。

图4 DENV-2的NS1部分序列扩增产物及HindⅢ酶切片段Fig.4 Identificating partial nucleotide sequences of DENV-2 and PCR production cutting by HindⅢNote: 1.Mark Ⅰ;2.Control;3.PCR production of DENV-2;4.PCR production cutting by HindⅢ.

图5 DENV-2 NS1部分序列基因的熔解曲线Fig.5 Melt curve of DENV-2 NS1
2.5DENV-2感染的pHDMECs通透性检测通过检测FITC-dextran荧光值来反应通透性的变化,如图9所示,24 h Control及DENV-2组的荧光值分别为(62.6±17.6)和(95.8±11.8),P<0.05;48 h分别为(36.2±8.8)和(68.5±9.2),P<0.05,提示在此时间点pHDMECs的通透性增加。
2.6流式细胞仪检测DENV-2对pHDMECs凋亡pHDMECs被DENV-2感染24、48和72 h均未发生明显凋亡。如图10所示,pHDMECs被DENV-2感染72 h早期凋亡和坏死的比例分别为32.6%和3.13%,对照组为32.4%和2.36%,提示DENV-2感染pHDMECs不能引起细胞凋亡。
2.7Real time-PCR检测促炎性细胞因子β-Actin、IL-6和IL-8三种基因的熔解曲线峰为均一的单峰(如图11);IL-6和IL-8在各时间点的相对表达(2-△△Ct)如图12所示,IL-6 mRNA在8 h上调(2.49±0.5)倍,P<0.05,IL-8 mRNA在24 h上调(6.82±1.69)倍,P<0.05。

图6 DENV-2感染的pHDMECs 4、8、12、24和48 h NS1基因的相对表达Fig.6 Related expression of NS1 gene in pHDMECs in 4,8,12,24 and 48 h by DENV-2 infectionNote: Compare with 4 h,*.P<0.05;**.P<0.01;***.P<0.001.

图7 免疫荧光法检测DENV-2对pHDMECs的感染(×100)Fig.7 Immunofluorescence showed infection of pHDM-ECs and BHK cells(×100) Note: A.BHK cells was infected by DENV-2 as positive control;B.DENV-2 infected pHDMECs.

图8 FCM检测DENV-2感染的pHDMECs中NS1部分序列蛋白Fig.8 Determination of protein NS1 of DENV-2 infected pHDMECs by FCMNote: A,B.Isotype control of BHK cells and pHDMECs;C,D.BHK cells and pHDMECs was infected by DENV-2.
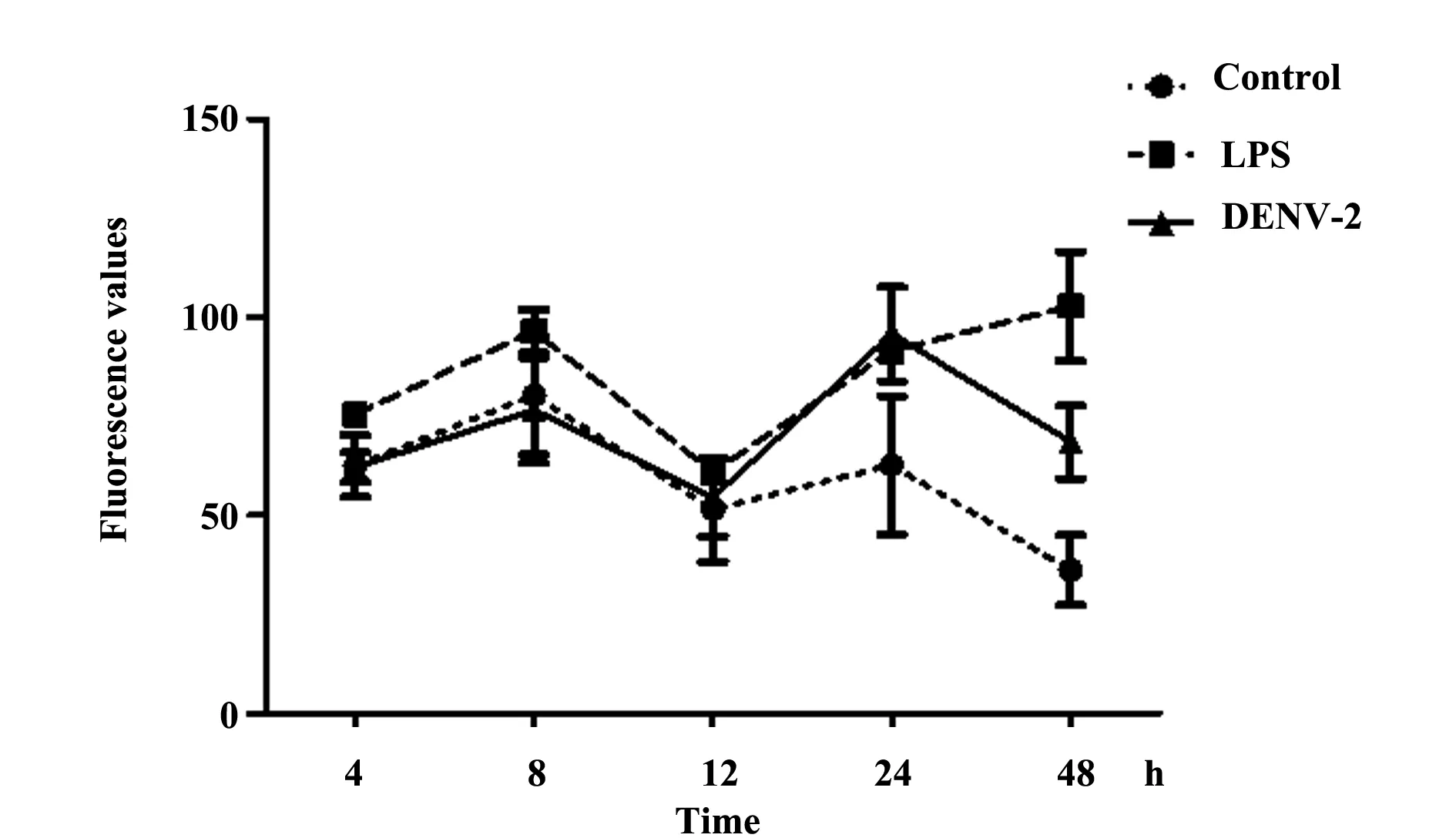
图9 Transwell小室中pHDMECs被DENV-2感染后下室荧光值的动态变化Fig.9 Dynamic fluorescence values in out-chamber of Transwell where was cultured DENV-2 infected pHDMECs

图10 DENV感染的pHDMECs 72 h的凋亡Fig.10 Apoptosis of pHDMECs with DENV-2 incubation in 72 hNote: Ratio of cell late apoptosis and necrosis was scattered in Q2;cell early apoptosis in Q3;A.Blank control;B.pHDMECs was infected by DENV-2.

图11 β-Actin,IL-6,IL-8 mRNA熔解曲线Fig.11 Melt curves of β-Actin,IL-6 and IL-8 mRNA Note: A.β-Actin;B.IL-6;C.IL-8.

图12 pHDMECs被DENV-2感染后IL-6和IL-8mRNA的相对表达变化Fig.12 Relative expression of IL-6 and IL-8 mRNA of DENV-2 infected pHDMECs in various timesNote: Compare with control,***.P<0.001.

图13 pHDMECs被DENV-2感染后IL-6和IL-8的分泌Fig.13 Assay of IL-6 and IL-8 secretion by DENV-2 infected pHDMECsNote: Compare with control,***.P<0.001.
表1相关基因的扩增引物
Tab.1Enhancement primer of related Genes

GenePrimer(5'→3')Length(bp)Tmβ-ActinF:GCATGGGTCAGAAGGATTCCTR:TCGTCCCAGTTGGTGACGAT11260NS1F:AGAGCGTGAAAAGGTGGATGR:CTGTCTGCGTAGTTGATGCC14760IL-6F:GCATAAAGACATACTCCAAACCR:ACTTCTCCACAACCCTCTG16855IL-8F:TTCGGTCCAGTTGCCTTCTR:GGTGAGTGGCTGTCTGTGTG12060
2.8双抗体夹心ELISA法检测pHDMECs被DENV-2感染后细胞因子的分泌DENV-2感染pHDMECs在各时间点IL-6和IL-8蛋白水平如图13所示,在8 h IL-6蛋白水平明显高于对照组;IL-8在4~24 h DENV-2感染组和对照组之间无明显差异,而在48 h明显增高。
3讨论
DENV主要通过白纹伊蚊和埃及伊蚊传播,可引起致命的DHF/DSS,表现为微血管渗漏、伴有血小板下降、出血甚至休克等症状,其致病机制至今尚不完全清楚[1,7]。
DENV感染过程中引起的VECs功能紊乱和通透性增加是DHF/DSS重要的发病机制[7],所以各种VECs成为研究DENV感染致病机制的细胞模型,但各种内皮细胞株并不是完美的模型。ECV 304细胞已证实为膀胱癌细胞系而不是VECs[12]。研究表明,DENV感染后重症患者微脉管系统通透性显著增强,常见胸腔积液、腹水等血浆渗漏症状和皮下、胃肠道等明显出血倾向,而不是大血管内皮细胞(如HUVECs)[13];目前也有用微血管细胞株HMEC-1研究DENV致病机制的报道,但HMEC-1是经过携带猴病毒40A基因的pSVT质粒转染得到的稳定细胞株,并非原代微血管细胞[14],因此,以上VECs模型并不能真实地反映机体各组织器官的VECs被DENV感染的情况。
DENV是否能感染VECs及DENV是否在VECs内有效增殖,是否能够引起VECs通透性的改变?研究表明,DENV可通过β3整合素或含有硫酸肝素的蛋白多糖受体感染HUVECs[15]。本课题以DENV-2作用pHDMECs,病毒NS1部分序列基因相对表达显著增加,具有时间相关性,但未能检测到DENV-2 NS1蛋白,由此可知pHDMECs能够被DENV-2感染。可能是由于DENV-2感染的pHDMECs分泌IFN-β而抑制了DENV-2相关蛋白合成[8],此结果与pHUVECs感染情况一致[11]。同时被DENV-2感染的pHDMECs通透性显著增高,提示感染后的pHDMECs形态和功能可能发生了变化,这将对DENV感染引起的出血产生重要影响,同时也验证了DHF/DSS患者出现皮下出血症状的原因[7]。
DENV-2引起pHDMECs通透性增加可能有以下两种原因:DENV-2直接对pHDMECs产生的损伤作用。细胞凋亡是VECs损伤和通透性增加的重要因素,然而DENV感染VECs是否引起细胞凋亡仍是个争论的问题。临床研究表明,DENV-2仅仅引起VECs短暂的通透性增加,并无血管内皮的损伤[15];Qi等[11,16]在体外实验证实DENV-2感染的pHUVECs没有明显细胞凋亡 。但是Long等[10]研究表明,DENV-2感染pHUVECs后通过外源性调亡受体Fas/FasL途径诱导细胞的凋亡产生。本次研究表明,以DENV-2感染pHDMECs未见明显细胞凋亡,其原因可能为上调的IFN-α诱导基因IFI6抑制了细胞凋亡[16]。因此,DENV-2引起pHDMECs通透性增加与细胞凋亡无关。VECs的损伤在DHF/DSS患者中并不具有普遍性,由此推断细胞凋亡可能不是DENV致病机制的重要因素。但有报道称,DENV-2 NS1部分序列蛋白通过TLR4途径直接引起HUVECs通透性增加,但本次研究中未检测到DENV-2 NS1部分序列蛋白,因此可排除其对pHDMECs通透性增加的直接作用[17]。
DENV-2感染的pHDMECs发生功能紊乱,分泌相关细胞因子所致。研究表明,VECs被DENV感染后导致部分细胞因子上调,这些因子可能也是DHF/DSS患者上调的细胞因子来源之一[4,5]。VECs可能作为非免疫细胞参与了DENV感染的免疫应答过程。本次研究中,DENV-2感染的pHDMECs IL-6,IL-8分泌显著增加,且与pHDMECs通透性增加的时间点有相关性。IL-6作用于HUVECs可增加细胞通透性,并与IL-6的浓度呈正相关[8]。DENV-2引起pHDMECs通透性的变化可能是IL-6调节细胞紧密连接及细胞骨架相关蛋白所致。Tina等[18]研究表明,IL-6通过PKC通路使ZO-1和细胞骨架蛋白actin发生重排增加VECs的通透性。此外,IL-6通过JUK、MEK及PI3K信号通路上调Claudin-2来调节肠上皮细胞的紧密连接[19,20]。IL-8可能直接作用于pHDMECs使其通透性发生改变。研究表明,DENV-2感染HMEC-1细胞释放的IL-8使细胞骨架发生重排使VECs的通透性增加[9]。IL-8也是CXC型趋化因子,可激活和趋化中性粒细胞、单核细胞及T淋巴细胞[21],从而间接地影响pHDMECs的结构与功能。如DENV感染的VECs释放IL-8趋化并诱导中性粒细胞脱颗粒并释放弹性蛋白酶(Elastase),后者可损伤VECs和激活补体系统而使VECs的通透性发生改变[22]。据此推测,IL-6、IL-8在DENV-2感染引起pHDMECs通透性增加过程发挥了重要的作用。
研究与DENV感染致病机制密切相关的细胞因子并作为治疗靶点对防治重症DENV感染疾病具有重要意义。pHDMECs被DENV-2感染后,是否分泌其他引起细胞通透性增加的细胞因子仍需探索。尽管如此,也有研究表明促炎性细胞因子IL-6和IL-8能激活或趋化多种免疫细胞至感染部位,在急性感染期保护机体免受病原体的侵害[23]。由此推测,在DENV感染过程中多数细胞因子既保护了机体也促进疾病发展,可能因为产生的阶段以及量上的差异而表现出相反的作用。这也为研究DENV引起VECs通透性增加的机制提供了新视角。
参考文献:
[1]John DV,Lin YS,Perng GC,etal.Biomarkers of severe dengue disease a review [J].J Biomed Sci,2015,22:83.
[2]Bhatt S,Gething PW,Brady OJ,etal.The global distribution and burden of dengue [J].Nature,2013,496(7446):504-507.
[3]Chen R,Han GZ.Dengue in china:comprehensive phylogenetic evaluation reveals evidence of endemicity and complex genetic diversity [J].Am J Trop Med Hyg,2016,94(1):198-202.
[4]Huang X,Yue Y,Li D,etal.Antibody-dependent enhancement of dengue virus infection inhibits RLR-mediated type I IFN-independent signaling through upregulation of cellular autophagy [J].Sci Rep,2016,6:22303.
[5]Nadine A,Dalrymple,Erich R,etal.Endothelial cells elicit immune-enhancing responses to dengue virus infection [J].J Virol,2012,86(12):6408-6415.
[6]Huang YH,Lei HY,Liu HS,etal.Dengue virus infects human endothelial cells and induces IL-6 and IL-8 production [J].Am J Trop Med Hyg,2000,63(1-2):71-75.
[7]Peter V,Kurt V,Sandra L.Endothelial dysfunction in dengue virus pathology [J].Rev Med Virol,2015,25(1):50-67.
[8]Tseng CY,Chang JF,Wang JS,etal.Protective effects of N-acetyl cysteine against diesel exhaust particles induced intracellular ROS generates proinflammatory cytokines to mediate the vascular rermeability of capillary-like endothelial tubes [J].PLoS One,2015,10(7):e0131911.
[9]Talavera D,Castillo AM,Dominguez MC,etal.IL8 release,tight junction and cytoskeleton dynamic reorganization conducive to permeability increase are induced by dengue virus infection of microvascular endothelial monolayers [J].J Gen Virol,2004,85:1801-1813.
[10]Long X,Li Y,Huang J,etal.XAF1 contributes to dengue virus-induced apoptosis in vascular endothelial cells [J].FASEB J,2013,27(3):1062-1073.
[11]崔丽丽,余芳芳,马静,等.水凝胶上培养的原代人脐静脉内皮细胞感染登革病毒Ⅱ型对细胞产生IL-29的表达影响[J] 中华微生物学和免疫学杂志,2015,35(1):7-13.
[12]Yang J,Zou L,Hu Z,etal.Identification and characterization of a 43 kD actin protein involved in the DENV-2 binding and infection of ECV304 cells[J].Microbes Infect,2013,15(4):310-318.
[13]Morens DM.Dengue fever and dengue hemorrhagic fever [J].Pediatr Infect Dis J,2009,28(7):635-636.
[14]Ades EW,Candal FJ,Swerlick RA,etal.HMEC-1:establishment of an immortalized human microvascular endothelial cell line[J].J Invest Dermatol,1992,99(6):683-690.
[15]任玮,左丽,吕秉乐,等.登革病毒Ⅱ型对人脐静脉血管内皮细胞通透性的研究[J].中华微生物学和免疫学杂志,2011,31(7):592-596.
[16]Qi YM,Li Y,Zhang YK,etal.IFI6 inhibits apoptosis via mitochondrial-dependent pathway in dengue virus 2 infected vascular endothelial cells [J].PLoS One,2015,10(8):e0132743.
[17]Modhiran N,Watterson D,Muller DA,etal.Dengue virus NS1 protein activates cells via Toll-like receptor 4 and disrupts endothelial cell monolayer integrity[J].Sci Transl Med,2015,7(304):304ra142.
[18]Tina R,Desai M D,Nicholas J,etal.Interleukin-6 causes endothelial barrier dysfunction via the protein kinase C pathway [J].J Surg Res,2002,104:118-123.
[19]Suzuki T,Yoshinaga N,Tanabe S.Interleukin-6 (IL-6) regulates claudin-2 expression and tight junction permeability in intestinal epithelium [J].J Biol Chem,2011,286(36):31263-31271.
[20]Al-Sadi R,Ye D,Boivin M,etal.Interleukin-6 modulation of intestinal epithelialtight junction permeability is mediated by JNK pathway activation of claudin-2 gene [J].PLoS ONE,2014,9(3):e85345.
[21]Juffrie M,Van Der Meer GM,Hack CE,etal.Inflammatory mediators in dengue virus infection in children:interleukin-8 and its relationship to neutrophil degranulation [J].Infect Immun,2000,68(2):702-707.
[22]Veszeli N,Csuka D,Zotter Z,etal.Neutrophil activation during attacks in patients with hereditary angioedema due to C1-inhibitor deficiency [J].Orphanet J Rare Dis,2015,10(1):156.
[23]Jones SA,Horiuchi S,Topley N,etal.The soluble interleukin 6receptor:Mechanisms of production and implications in disease [J].Faseb J,2001,15(1):43-58.
[收稿2016-04-06]
(编辑许四平)
doi:10.3969/j.issn.1000-484X.2016.07.003
作者简介:赵军(1989年-),男,在读硕士,主要从事抗病毒感染的分子免疫学研究,E-mail:zddjet@foxmail.com。 通讯作者及指导教师:左丽(1955年-),女,教授,博士生导师,主要从事抗病毒感染的分子免疫学方面研究,E-mail:zuoligymc@163.com。
中图分类号R392.9
文献标志码A
文章编号1000-484X(2016)07-0945-07
Primary mechanism of changing permeability in DENV-2 infected primary human dermal micro-vascular endothelial cells
ZHAO Jun,ZUO Li,DAI Xue-Ting,PEI Hua,YUAN Jing,KONG Wei-Ying.
Department of Immunology,Guizhou Medical University,Guiyang 550004,China
[Abstract]Objective:To reveal the primary mechanism of changing permeability in DENV-2 infected pHDMECs.Methods: pHDMECs was incubated by DENV-2 on the concentration of 103 TCID50,and the penetrability of the cell was detected by Transwell at 4,8,12,24,48 h,respectively.Then,the partial sequence of DENV-2 NS1 was analyzed by Real time-PCR,and NS1 protein was detected by immunofluorescence and flow cytometer (FCM).The apoptosis rate of pHDMECs was assayed by FCM.Finally,IL-6 and IL-8 secreted by pHDMECs were analyzed by Real time-PCR and double antibody sandwich ELISA.Results: The relative expression of NS1 gene was elevated but NS1 protein was not detected;the permeability of DENV-2 infected pHDMECs had dramatically increased both at 24,48 h,but the apoptosis rate has little changed even been influenced by DENV-2 at 72 h.However,the relative expression of IL-6/IL-8 mRNA was boosted at 8,24 h[(2.49±0.50) and (6.82±1.69) fold,respectively,P<0.05].In protein level,compared with control(869.6±50.70)pg/ml,IL-6 secreted by DENV-2 infected pHDMECs could reach by(1 248.8±86.9)pg/ml(P<0.05),and IL-8 was(1 331.0±86.3)pg/ml(P<0.05) while the control was (967.6±156.6)pg/ml.Conclusion: Indeed,pHDMECs can be infected by DENV-2;the increasing permeability of DENV-2 infected pHDMECs may not be caused by the pHDMECs′ apoptosis but the enhancing of pro-inflammatory cytokine IL-6 /IL-8.
[Key words]Dengue virus;Primary human dermal micro-vascular endothelial cells;IL-6;IL-8;Permeability
①本文为国家自然科学基金(31260224;81560263)和贵州省教育厅“125”重大科技专项(黔教合重大专项字[2012]008号)。

