黄海中部近岸春夏季鱼卵、仔稚鱼群落结构特征
刘 鸿, 叶振江,*, 李增光, 胡海生, 庞雨萌, 窦硕增
1 中国海洋大学水产学院,青岛 266003 2 中国科学院海洋研究所海洋生态与环境科学重点实验室,青岛 266071
黄海中部近岸春夏季鱼卵、仔稚鱼群落结构特征
刘鸿1, 叶振江1,*, 李增光1, 胡海生1, 庞雨萌1, 窦硕增2
1 中国海洋大学水产学院,青岛266003 2 中国科学院海洋研究所海洋生态与环境科学重点实验室,青岛266071
摘要:2013年4月下旬至7月上旬,采用浅水I型网垂直拖网的调查方式对黄海中部20m以浅海域(34°30′—35°30′N,119°20′—120°20′E)的鱼卵、仔稚鱼种类组成与数量分布进行了6个航次的综合调查。春夏季共采集鱼卵21种(未定种3种),共计2247粒,隶属于9科15属。仔稚鱼22种(未定种1种),共计286尾,隶属于13科17属。鱼卵优势种为日本鳀Engraulis japonicus、赤鼻棱鳀Thryssa kammalensis、江口小公鱼Stolephorus commersonnii、皮氏叫姑鱼Johnius belengerii和属Callionymus spp.。仔稚鱼优势种为大银鱼Protosalanx chinensis、白姑鱼Argyrosomus argentatus、日本鳀、赤鼻棱鳀和皮氏叫姑鱼。鱼卵丰度和分布与经度呈负相关、与SST呈正相关,但与其他环境因子如纬度、表层盐度(SSS)和水深等无显著相关性。仔稚鱼丰度和分布与上述环境因子均未表现出显著相关性。基于Bray-Curtis指数的聚类分析表明,鱼卵优势种包括集中分布于研究水域34°48′N以南海域(江口小公鱼、皮氏叫姑鱼和青鳞小沙丁Sardinella zunasi)、10m等深线以内(赤鼻棱鳀),以及北部水域(日本鳀和属)3种主要聚集类型;仔稚鱼优势种包括集中分布于34°48′N—35°12′N海域(赤鼻棱鳀和日本鳀)、连云港外海浅水区(白姑鱼、皮氏叫姑鱼和梭鱼Liza haematocheilus,以及南部水域(褐菖鲉Sebastiscus marmoratus和鲬Platycephalus indicus)3种主要聚集类型。研究结果揭示了黄海中部近岸海域鱼卵、仔稚鱼群落的时空分布格局动态,为科学认识环境变动下该海区渔业种群数量动态和资源变化提供了科学依据。
关键词:春夏季;黄海中部;鱼卵;仔稚鱼;群落结构
鱼卵、仔稚鱼作为鱼类生活史的重要发育阶段,在海洋生态系统能量传递中起了重要作用,鱼卵、仔稚鱼是主要的被捕食者,仔稚鱼又是次级生产力的重要消费者,是海洋食物链中的重要环节之一[1]。同时,鱼卵、仔稚鱼的丰度直接决定了渔业种群的补充量,因此,对鱼卵、仔稚鱼群落结构及其动态的研究是海洋鱼类补充机制研究的科学基础[2- 5]。
黄海中部是我国的传统渔场,历史上是小黄鱼(Larimichthyspolyactis)、带鱼(Trichiuruslepturus)、马面鲀(Thamnaconusspp.)以及小眼绿鳍鱼(Chelidonichthysspinosus)等鱼类的产卵场[6]。长期以来,由于受到海洋环境污染、过渡捕捞以及气候变化的影响,渔业资源严重衰退,生物群落及资源结构发生变化,进而也影响了鱼卵、仔稚鱼的组成[6]。关于黄海中部鱼卵、仔稚鱼的研究相对较少,姜言伟[7]报道了黄海中部(34°00′—36°30′N,122°00′E以西海域)主要经济鱼种的产卵场;万瑞景等[2]综合分析了黄海硬骨鱼类鱼卵、仔稚鱼的群落结构;李增光等[8]通过对黄海中部鱼卵、仔稚鱼综合调查分析(34°25′—35°35′N,119°25′—121°10′E),发现20m以浅为该海域近岸产卵鱼类的主要产卵场。然而,针对黄海中部近岸水域20m以浅的鱼卵、仔稚鱼群落结构及其分布尚无相关报道。
本文旨在通过春夏黄海中部20m以浅水域鱼卵、仔稚鱼及环境调查,分析该海域鱼卵、仔稚鱼群落结构,探究近岸鱼卵、仔稚鱼的空间分布,并结合研究海域地理、水文环境相关关系,解析该水域鱼卵、仔稚鱼聚集类型,为该水域渔业资源保护提供科学基础与依据。
1材料与方法
1.1航次与站位设置
调查水域位于黄海中部(34°30′—35°30′N,119°20′—120°20′E)近岸20m以浅。根据文献资料,主要经济鱼种产卵期一般在5月上旬至6月下旬[7],调查时间分别为2013年4月23日—24日、5月10日—12日、5月23日—25日、6月6日—8日、6月21日—23日以及7月6日—8日,每半月潮汛进行1次,共6个航次。调查租赁渔船(苏赣渔15003、苏连渔14008、苏灌渔18018、鲁日山渔63521,依次分别为150、150、100、150马力)。根据等纬度间隔原则设计站位,依据外业调查实际海况,6个航次具体实施的站位数分别为12、15、19、8、17、13个,其中4月下旬由于天气原因部分站位加以调整(图1,a—f航次)。
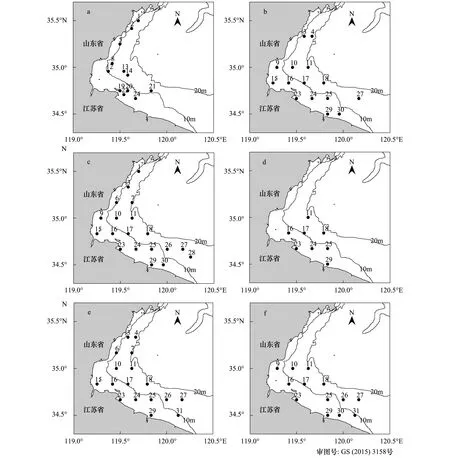
图1 黄海中部各航次调查站位Fig.1 Locations of every cruise sampling in central Yellow Seaa: 4月下旬; b: 5月上旬; c: 5月下旬; d: 6月上旬; e: 6月下旬; f: 7月上旬
1.2样品采集
调查过程中,采用RBR-XR- 420型CTD对调查站位进行现场环境数据采集,包括温度、盐度以及水深数据。采用浅水I型网(网衣长145 cm,网口内径50 cm,孔径0.505 mm)垂直采样,网口附带HYDRO-BIOS垂直流量计用以记录滤水量。采样拖速平均0.5m/s,所有采样均在白天进行。采集样品以5%福尔马林海水溶液固定保存,带回实验室分捡后,使用大型浮游生物计数板在解剖显微镜下以形态学方法进行种类鉴定[9- 11],并计数。
2数据处理方法
鱼卵、仔稚鱼丰度以每立方米水体中出现的个体数(粒/m3、尾/m3)表示。根据鱼卵、仔稚鱼优势度(Y)确定每个航次的优势种,其计算公式为[12]:
式中,Y为优势度, N为所有种类总个体数, ni为第i种的个体数,fi为该种在所有站位中出现的频率。Y≥0.04的种类确定为优势种。使用斯皮尔曼秩相关系数(Spearman′s rank correlation)分析鱼卵、仔稚鱼丰度与环境因子之间的关系[13],环境因子主要包括经度、纬度、水深、海水表层温度(SST)以及海水表层盐度(SSS)。
Bray-Curtis指数[14]能够较科学的反应生物群落之间的差异性,基于该指数的聚类分析是研究鱼卵、仔稚鱼空间聚集类型的主要方法[15- 16]。相似性分析之前,去掉种类出现频率少于2%的数据[17- 19],对原始数据进行log(x+1)变换,以便对稀有种给予不同程度的加权[20]。
使用surfer 8.0软件绘制SST与SSS等值线图,采用克里格法(kriging)对数据网格化。运用SPSS 16.0 计算斯皮尔曼秩相关系数用以相关性分析。运用PRIMER 5.1统计软件进行空间聚类分析。
3结果
3.1种类组成及优势种
3.1.1种类组成
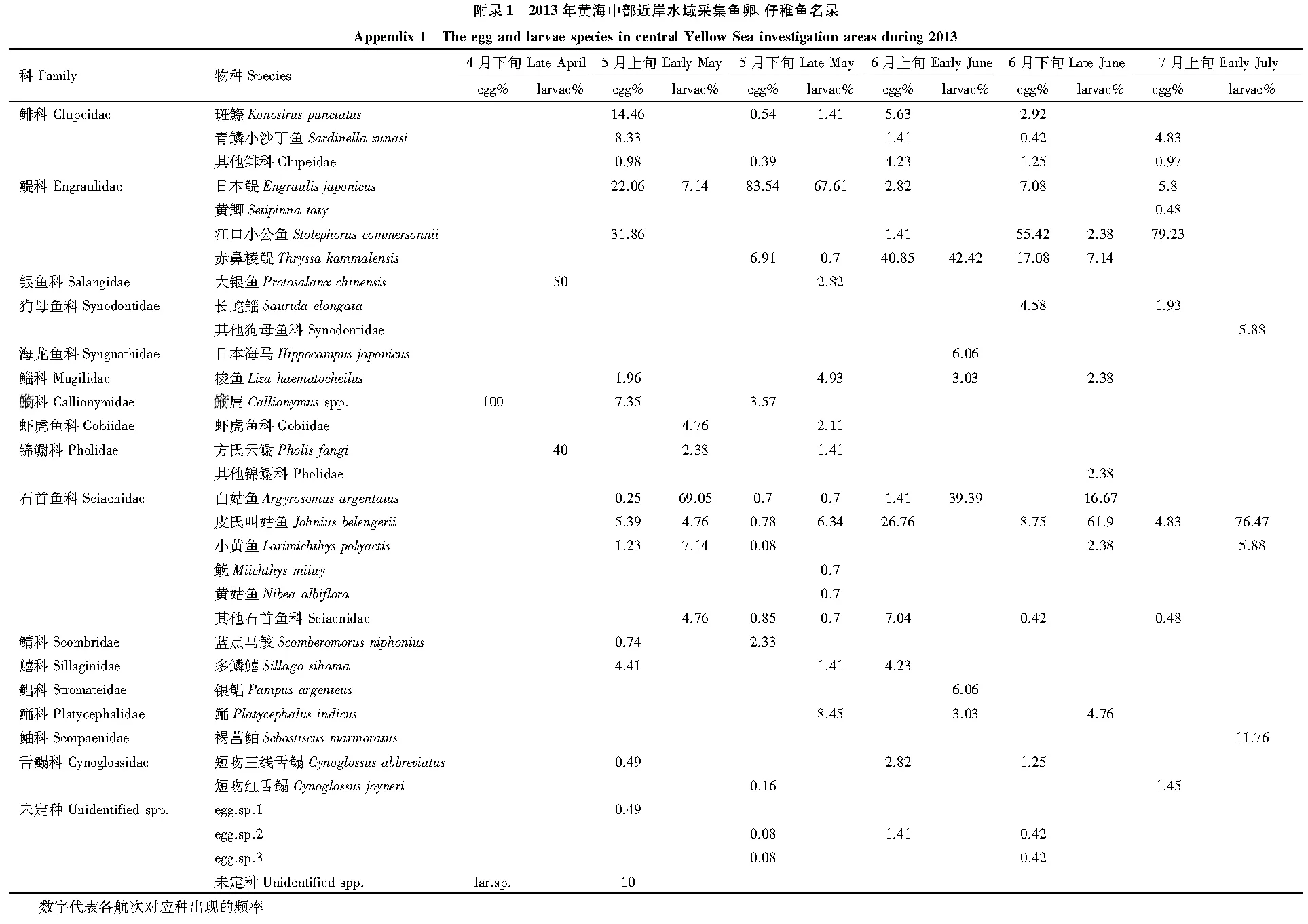
本次调查共捕获鱼卵2247粒,仔稚鱼286尾。出现鱼卵21种,隶属于9科15属,其中2种鉴定到科,16种鉴定到属或种,未定种3种。出现仔稚鱼22种,隶属于13科17属,其中4种鉴定到科,17种鉴定到种,未定种1种(附录1),其中方氏云鳚(Pholisfangi)和狗母鱼科(Synodontidae)为稚鱼,日本鳀(Engraulisjaponicus)仔鱼、稚鱼均有出现,其余种类均为仔鱼。鱼卵和仔稚鱼最大平均丰度均出现在5月下旬,分别为13.94 粒/m3和1.41尾/m3,最小丰度均出现在4月上旬,分别为0.50 粒/m3和0.11 尾/m3;鱼卵、仔稚鱼种类最大值分别出现在5月上旬和5月下旬,种类最小值均出现在4月下旬航次(图2)。
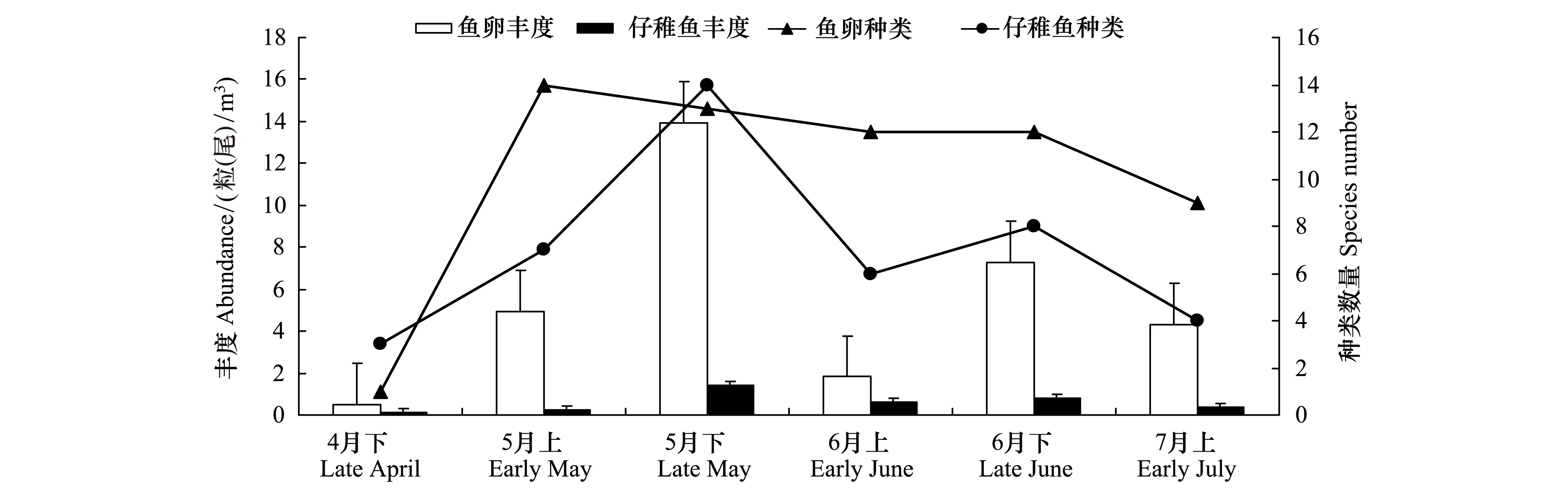
图2 黄海中部鱼卵、仔稚鱼丰度及种类数量Fig.2 Abundance and species quantity of ichthyoplankton in central Yellow Sea
3.1.2优势种

表1 黄海中部春夏季鱼卵优势种
4月下旬航次仔稚鱼优势种为大银鱼,占本航次50.00%。5月上旬、5月下旬仔稚鱼优势种均为一种,分别为白姑鱼(Argyrosomusargentatus)(69.05%)和日本鳀(67.61%)。6月上旬航次优势种为赤鼻棱鳀和白姑鱼,两者共占本航次鱼卵总量的81.81%,比例远高于其余种类。6月下旬和7月上旬仔稚鱼优势种均为皮氏叫姑鱼,分别占各航次61.90%和76.74%(表2,附录1)。

表2 黄海中部春夏季仔稚鱼优势种
3.2鱼卵、仔稚鱼丰度与环境因子关系
温度和盐度是影响鱼卵、仔稚鱼分布的主要环境因素。图3—图4分别为不同航次各站位鱼卵和仔稚鱼总丰度与海水表层温度和盐度的关系。对比发现,同一经度海水表层温度以35°N为界呈现明显的南高北低趋势(图3),表层温度较高海域鱼卵丰度相对较大。20m以浅海域低盐度中心随时间变化,表层盐度变化规律不明显(图4)。

图3 鱼卵丰度与海水表层温度关系Fig.3 Egg abundances for all species recorded and contour plots of sea surface temperaturea: 4月下旬; b: 5月上旬; c: 5月下旬; d: 6月上旬; e: 6月下旬; f: 7月上旬

图4 仔稚鱼丰度与海水表层盐度关系Fig.4 Larvae abundances for all species recorded and contour plots of sea surface salinitya: 4月下旬; b: 5月上旬; c: 5月下旬; d: 6月上旬; e: 6月下旬; f: 7月上旬
进一步对鱼卵、仔稚鱼丰度与环境因子进行相关性分析。结果表明:在P<0.05水平上,鱼卵丰度与经度负相关、与SST正相关,仔稚鱼丰度与各环境因子未表现出显著相关性(表3)。

表3 鱼卵、仔稚鱼与环境因子间的斯皮尔曼秩相关系数
*双尾检验0.05水平上显著相关
3.3鱼卵、仔稚鱼聚集类型

在12%的相似水平下,仔稚鱼种类可分为3种空间聚集类型。组1包括赤鼻棱鳀及日本鳀,分布于34°48′N—35°12′N,与对应鱼卵分布区域基本一致。此外在第27站出现日本鳀仔鱼。组2包括白姑鱼、皮氏叫姑鱼以及梭鱼(Lizahaematocheilus),集中于连云港外海浅水区域。组3为褐菖鲉(Sebastiscusmarmoratus)和鲬(Platycephalusindicus),主要分布于研究海域南部。
4讨论
4.1鱼卵、仔稚鱼群落组成

4.2鱼卵、仔稚鱼群落结构与环境关系
相关性分析结果表明,鱼卵丰度与海水表层温度以及经度显著相关(表3)。水温影响鱼类性腺成熟度,温度过低性腺发育受到抑制[24],产卵场温度适宜,亲鱼集中产卵。同纬度下,低经度区域海流环境相对稳定[8],且有地表径流附带的饵料注入,这些因素可能有利于亲鱼产卵,进而表现为鱼卵丰度与经度负相关。经度是一项能够反映综合环境因素的指标,有关鱼卵与经度的关系,有待于进一步探讨。然而有研究表明,海水表层盐度与仔稚鱼丰度显著相关[8,25],这与本文结果存在差异(表3),其原因可能与调查时间、范围以及区域内的种类差异有关。垂直拖网调查随机性相对较大,所采集样品的代表性可能不及水平拖网和斜拖网[8,26],加之本次监测站位数量有限,调查区域相对较小,这些原因均可能对分析结果产生一定影响。另外,调查结果显示,研究海域平均盐度变化范围较小,低盐度中心随时间变化(图4)。仔稚鱼低的游泳能力决定其对盐度的动态变化响应较弱,这也可能对相关性分析产生一定的影响。

仔稚鱼种类聚集类型共3组。组1为赤鼻棱鳀和日本鳀仔鱼。由于仔稚鱼游泳能力相对较弱,仔稚鱼与其鱼卵分布类似,均在35°N附近。27站出现日本鳀前期仔鱼,可能来自20m以深海域;组2包括白姑鱼、皮氏叫姑鱼以及梭鱼。黄海中部海州湾为白姑鱼主要产卵场之一[33]。黄海区皮氏叫姑鱼中心产卵区较其他石首鱼科鱼类略偏向近岸,海州湾南部为该海区较大产卵场[9]。梭鱼主要分布于近海,以黄渤海数量最多,适宜在2—8m细砂质咸淡水混合区产卵[9]。连云港近岸为河口浅水区[34],丰富的生物饵料以及泥沙质底质为皮氏叫姑鱼、梭鱼等提供了适宜生境;组3为鲬和褐菖鲉。鲬为暖温性鱼类,5月下旬组3所有站位SST温度范围为16.6—20.0℃,温度相对较高(图3),这可能为亲鱼提供理想的产卵环境;褐菖鲉为暖温广盐性卵胎生定居型鱼类,胚胎在母体内发育直至破膜产出,仔稚鱼空间分布可能与亲鱼分布、温度以及盐度等多个因子相关,有关其空间分布有待于进一步研究。
参考文献(References):
[1]万瑞景, 姜言伟. 渤、黄海硬骨鱼类鱼卵与仔稚鱼种类组成及其生物学特征. 上海水产大学学报, 2000, 9(4): 290- 297.
[2]万瑞景, 姜言伟. 黄海硬骨鱼类鱼卵、仔稚鱼及其生态调查研究. 海洋水产研究, 1998, 19(1): 60- 73.
[3]杨东菜, 吴光宗, 孙继仁. 长江口及其邻近海区的浮性鱼卵和仔稚鱼的生态研究. 海洋与湖沼, 1990, 21(4): 346- 355.
[4]M Bernal, S Somarakis, P R Witthames, C J G van Damme, A Uriarte, N C H Lo, M Dickey-Collas. Egg production methods in marine fisheries: An introduction. Fisheries Research, 2012, 117- 118: 1- 5.
[5]Friedrich W Köster, Hans-Harald Hinrichsen, Michael A St John, Dietrich Schnack, Brian R MacKenzie, Jonna Tomkiewicz, Maris Plikshs. Developing Baltic cod recruitment models. II. Incorporation of environmental variability and species interaction. Canadian Journal of Fisheries and Aquatic Sciences, 2001, 58(8): 1534- 1556.
[6]涂忠. 山东省渔业资源修复功能区划[D]. 青岛: 中国海洋大学, 2008: 115.
[7]姜言伟. 海州湾经济鱼类产卵场鱼卵的数量分布. 海洋水产研究丛刊, 1964, 18: 100- 111.
[8]Li Z G, Ye Z J, Wan R. Spatial and seasonal patterns of ichthyoplankton assemblages in the Haizhou Bay of China and its adjacent waters. Journal of Ocean University of China, 2013, DOI: 10. 1007/s11802-015- 2603- 3, in press.
[9]张仁斋, 陆穗芬, 赵传洇. 中国近海鱼卵与仔鱼. 上海: 上海科学技术出版社, 1985.
[10]Okiyama M. An atlas of the early stage fishes in Japan. Tokyo: Tokai University Publisher, 1988: 1154.
[11]Shao K T, Yang J S, Chen K C, Lee Y S. An identification guide of marine fish eggs from Taiwan. Taipei: Academia Sinica, 2001: 179.
[12]孙儒泳. 动物生态学原理. 北京: 北京师范大学出版社, 1992.
[13]Rodriguez J M, Gonzalez-Nuevo G, Gonzalez-Pola C, Cabal J. The ichthyoplankton assemblage and the environmental variables off the NW and N Iberian Peninsula coasts, in early spring. Continental Shelf Research, 2009, 29(8): 1145- 1156.
[14]Bray J R, Curtis J T. An ordination of the upland forest communities of southern Wisconsin. Ecological Monographs, 1957, 27(4): 325- 349.
[15]Wiebke J Boeing, Janet T Duffy-Anderson. Ichthyoplankton dynamics and biodiversity in the Gulf of Alaska: Responses to environmental change. Ecological Indicators, 2008, 8(3): 292- 302.
[16]Rodriguez J M, Gonzalez-Pola C, Lopez-Urrutia A, Nogueira E. Composition and daytime vertical distribution of the ichthyoplankton assemblage in the Central Cantabrian Sea shelf, during summer: An Eulerian study. Continental Shelf Research, 2011, 31(14): 1462- 1473.
[17]Grioche A, Koubbi P, Harlay X. Spatial patterns of ichthyoplankton assemblages along the eastern english channel french coast during spring 1995. Estuarine, Coastal and Shelf Science, 1999, 49(1): 141- 152.
[18]Busby M S, Duffy-Anderson J T, Mier K L, De Forest L G. Spatial and temporal patterns in summer ichthyoplankton assemblages on the eastern Bering Sea shelf 1996- 2007. Fisheries Oceanography, 2014, 23(3): 270- 287.
[19]Duffy-anderson J T, Busby M S, Mier K L, Deliyanides C M, Stabeno P J. Spatial and temporal patterns in summer ichthyoplankton assemblages on the eastern Bering Sea shelf 1996- 2000. Fisheries Oceanography, 2006, 15(1): 80- 94.
[20]周红, 张志南. 大型多元统计软件PRIMER的方法原理及其在底栖群落生态学中的应用. 青岛海洋大学学报: 自然科学版, 2003, 33(1): 58- 64.
[21]万瑞景, 姜言伟. 渤海硬骨鱼类鱼卵和仔稚鱼分布及其动态变化. 中国水产科学, 1998, 5(1): 43- 50.
[22]郑元甲, 李建生, 张其永, 洪万树. 中国重要海洋中上层经济鱼类生物学研究进展. 水产学报, 2014, 38(1): 149- 160.
[23]王小林. 海州湾及邻近海域鱼类群落结构的时空变化[D]. 青岛: 中国海洋大学, 2013: 93- 93.
[24]唐逸民. 水产海洋学基础. 北京: 农业出版社, 1980.
[25]Jennifer A Lanksbury, Janet T Duffy-Anderson, Kathryn L Mier, Matthew T Wilson. Ichthyoplankton abundance, distribution, and assemblage structure in the Gulf of Alaska during September 2000 and 2001. Estuarine, Coastal and Shelf Science, 2005, 64(4): 775- 785.
[26]Ana Faria, Pedro Morais, M Alexandra Chícharo. Ichthyoplankton dynamics in the Guadiana estuary and adjacent coastal area, South-East Portugal. Estuarine, Coastal and Shelf Science, 2006, 70(1/2): 85- 97.
[27]吴光宗. 长江口海区鳀鱼和康氏小公鱼鱼卵和仔、稚鱼分布的生态特征. 海洋与湖沼, 1989, 20(3): 217- 229.
[28]张波, 唐启升, 金显仕. 黄海生态系统高营养层次生物群落功能群及其主要种类. 生态学报, 2009, 29(3): 1099- 1111.
[29]杨宇峰, 王庆, 陈菊芳, 庞世勋. 河口浮游动物生态学研究进展. 生态学报, 2006, 26(2): 576- 585.
[30]张春霖. 黄渤海鱼类调查报告. 北京: 科学出版社, 1995.
[31]万瑞景, 魏皓, 孙珊, 赵宪勇. 山东半岛南部产卵场鳀鱼的产卵生态Ⅰ. 鳀鱼鱼卵和仔稚幼鱼的数量与分布特征. 动物学报, 2008, 54(5): 785- 797.
[32]魏皓, 王玉衡, 万瑞景, 苏健. 黄海锋区环流与鳀鱼卵的聚集. 中国海洋大学学报: 自然科学版, 2007, 37(3): 512- 516.
[33]徐兆礼, 陈佳杰. 依据大规模捕捞统计资料分析东黄渤海白姑鱼种群划分和洄游路线. 生态学报, 2010, 30(23): 6442- 6450.
[34]中国海湾志编纂委员会. 中国海湾志(第四分册). 北京: 海洋出版社, 1993.
基金项目:高等学校博士学科点专项科研基金项目(20120132130001); 中央高校基本科研业务费专项资金项目(201262004); 国家自然科学基金委-山东省联合基金项目(U1406403); 海洋公益性行业科研专项经费项目(201305030)
收稿日期:2014- 10- 09; 网络出版日期:2015- 10- 10
*通讯作者
Corresponding author.E-mail: yechen@ouc.edu.cn
DOI:10.5846/stxb201410091983
The community structure of ichthyoplankton in the central Yellow Sea in spring and summer
LIU Hong1, YE Zhenjiang1,*, LI Zengguang1, HU Haisheng1, PANG Yumeng1,DOU Shuozeng2
1CollegeofFisheries,OceanUniversityofChina,Qingdao266003,China2KeyLaboratoryofMarineEcologyandEnvironmentalSciences,InstituteofOceanology,ChineseAcademyofSciences,Qingdao266071,China
Abstract:Knowledge of the ecology of ichthyoplankton (eggs, larvae, and fry) is important for understanding the spawning ecology and the population dynamics of fishery species. In this study, a total of six fishery research cruises were conducted to investigate the community structure and ecology of ichthyoplankton in the central Yellow Sea (34°30′—35°30′ N, 119°20′—120°20′ E), one of the most concentrated spawning areas for fishery species in Chinese coastal waters, from late April to early July 2013. To collect ichthyoplankton, zooplankton nets (mouth diameter=50 cm, length=145 cm, and mesh size=0.505 mm) were vertically trawled in waters below the 20 m isobath line. The species composition, abundance, and distribution of the ichthyoplankton, and their relationships with environmental factors, were studied. A total of 2247 eggs and 286 larvae were collected during the research cruises. The eggs were identified as belonging to 18 species in 15 genera in 9 families; 3 species could not be identified. The eggs were dominated by Engraulis japonicus, Thryssa kammalensis, Stolephorus commersonii, Johnius belengerii, and Callionymus spp. The larvae were identified as belonging to 21 species in 17 genera in 13 families; only one species could not be identified. The dominant larval species included Protosalanx hyalocranius, Argyrosomus argentatus, E. japonicus, T. kammalensis, and J. belengerii. The abundance of the eggs was positively correlated with the sea surface temperature (SST) but was negatively correlated with the longitude (P<0.05). In contrast, the abundance of the larvae did not show a significant correlation with any of the investigated environmental factors, such as longitude, latitude, SST, sea surface salinity (SSS), or water depth. Cluster analysis based on the Bray-Curtis similarity index identified three assemblages of eggs and larvae at the 35% and 12% similarity levels, respectively. The eggs were grouped into assemblages dominating the southern waters from 34°48′N (S. commersonii, J. belengerii, and Sardinella zunasi), the <10 m isobath waters (T. kammalensis), and the northern waters (E. japonicas and Callionymus spp.). The larvae were grouped into assemblages that were mainly distributed in the 34°48′N—35°12′N waters (T. kammalensis and E. japonicus), the shallow waters off Lianyungang (A. argentatus, J. belengerii, and Liza haematocheilus), and the southern part of the study area (Sebastiscus marmoratus and Platycephalus indicus). The findings of this study clarified the spatial and temporal distribution patterns as well as the structure of the ichthyoplankton community in the central Yellow Sea, which may help to improve our understanding of the population dynamics of fishery species in these waters.
Key Words:spring and summer; the central Yellow Sea; fish egg; larvae; community structure
刘鸿, 叶振江, 李增光, 胡海生, 庞雨萌, 窦硕增.黄海中部近岸春夏季鱼卵、仔稚鱼群落结构特征.生态学报,2016,36(12):3775- 3784.
Liu H, Ye Z J, Li Z G, Hu H S, Pang Y M,Dou S Z.The community structure of ichthyoplankton in the central Yellow Sea in spring and summer.Acta Ecologica Sinica,2016,36(12):3775- 3784.

