固定化反硝化菌在低污染水处理中脱氮性能研究
张焕杰,余璐,朱文颖,孔海南,林燕上海交通大学环境科学与工程学院,上海 200240
固定化反硝化菌在低污染水处理中脱氮性能研究
张焕杰,余璐,朱文颖,孔海南,林燕*
上海交通大学环境科学与工程学院,上海 200240
摘要:在面源低污染水的原位修复领域,人工湿地生物脱氮过程受温度、pH波动影响以及NO2--N积累抑制反硝化脱氮效果等问题,因此强化系统脱氮性能在实际工程应用中具有重要意义。固定化微生物技术具有环境变化适应能力以及耐毒害能力强等优点。该研究通过分离筛选高效反硝化菌,对其进行DNA序列分析鉴定及其种属和系统发育地位分析,并以包埋法加以固定,考察固定化反硝化菌在不同温度、pH、DO和 C/N下的反硝化性能,分析各因素变化对固定化反硝化菌脱氮效果的影响,探究各影响因素对固定化反硝化菌脱氮性能的作用机理,以期为固定化反硝化菌强化人工湿地脱氮性能提供参考。经反硝化能力测定,筛选得到的高效反硝化菌株对NO3--N、TN的去除率分别为98.83%、98.36%,NO2--N积累量仅为0.28 mg·L-1,24 h内脱氮效率为8.59 mg·L-1·h-1,经16S rRNA测序结果表明该菌株与Pseudomonas stutzeri A1501的最大相似度为99.7%。采用PVA、SA为材料包埋固定该菌株,固定化反硝化菌的生物量为15.67 g·L-1,颗粒密度为0.93 g·mL-1。通过对固定化反硝化菌处理低污染水的性能研究得知,pH、T、DO的波动对固定化反硝化菌的脱氮效果影响均小于游离反硝化菌,固定化反硝化菌在pH为7,θ为30 ℃,DO为0.87~1.54 mg·L-1,C/N为5时的脱氮效果最好。
关键词:反硝化菌;固定化;脱氮性能;低污染水
引用格式:张焕杰, 余璐, 朱文颖, 孔海南, 林燕. 固定化反硝化菌在低污染水处理中脱氮性能研究[J]. 生态环境学报, 2016,25(5): 857-863.
ZHANG Huanjie, YU Lu, ZHU Wenying, KONG Hainan, LIN Yan. Nitrogen Removal Characteristics of Immobilized Denitrifying Bacteria for Treatment of Slightly-polluted Water [J]. Ecology and Environmental Sciences, 2016, 25(5): 857-863.
伴随工业的发展,我国大部分城镇饮用水源已受到不同程度的污染,有数据表明,我国七大水系中IV类和V类水体占22.9%,劣V类水体占32.0%(叶少帆等,2010),水源水的污染问题日益严重,寻求处理低污染水源的对策和技术变得至关重要。近年来,人工湿地作为一种生态工程手段用于处理达标后排放的尾水或污染较重的沟渠水,对这些低污染水的处理,可有效减轻湖泊流域水体的污染负荷(黄娟等,2009),其对流域面源污染水体的原位修复研究也取得了一定效果(Rai et al.,2013)。
潜流人工湿地内近 90%的有机物和含氮化合物是依靠附着在植物根系和土壤等基质表面的微生物作用去除的,其中微生物的硝化和反硝化作用是人工湿地内氮素去除的主要途径(Saeed et al.,2012),但人工湿地的脱氮效率受气温影响较大,在低于15 ℃的环境下,含氮污染物的去除效果不佳(Sun et al.,2010);脱氮过程中湿地系统内pH的变化在一定程度上也会影响硝化-反硝化的作用效果(Cheikh et al.,2013);而且,不少潜流湿地非植物根际区因溶解氧不足,硝化反应进行不彻底,导致NO2--N积累,对反硝化菌产生毒害作用,从而使生物脱氮的整个过程受阻(王小晓等,2014)。因此,削弱温度、pH等因素波动以及NO2--N积累对反硝化作用的影响可改善人工湿地的脱氮效果。
本研究将分离筛选所得的高效反硝化菌进行DNA序列分析鉴定及其种属和系统发育地位分析,并以包埋法加以固定,考察固定化反硝化菌在不同温度、pH、DO和C/N下的反硝化性能,分析各因素变化对固定化反硝化菌脱氮效果的影响,探究固定化反硝化菌脱氮的最佳条件,并为固定化反硝化菌投加至人工湿地以强化脱氮效果时的投加位置和所需碳源量提供参考。
1 材料与方法
1.1 培养基
反硝化培养液:KNO32 g·L-1,酒石酸钾钠20 g·L-1,K2HPO40.5 g·L-1,MgSO4·7H2O 0.2 g·L-1。
固态反硝化培养基:KNO31.5 g·L-1,CH3COONa 2 g·L-1,蛋白胨15 g·L-1,酵母膏3 g·L-1,葡萄糖1 g·L-1,NaCl 6 g·L-1,琼脂12 g·L-1,pH为7.0~7.2。
1.2 废水水质
人工模拟低污染水主要污染物为 NO3--N和COD,成分为 KNO3、葡萄糖、K2HPO4、MgSO4·7H2O,具体浓度根据实验需要进行调节。
1.3 反硝化菌的筛选
1.3.1 反硝化菌的富集
自云南大理邓北桥湿地采集基质样品(砾石)50 g置于500 mL锥形瓶中,加入300 mL已灭菌的反硝化培养液,盖不透气橡胶塞,置于30 ℃、100 r·min-1摇床恒温振荡培养。待观察到瓶中培养液液面有大量气泡后,吸取20 mL的菌液进行富集,连续富集5次。将富集后的菌液采用倍比稀释法稀释,并涂布至固体培养基,静置于 30 ℃恒温培养箱,培养至长出明显菌落。
1.3.2 反硝化菌的分离纯化
待上述固体培养基长出菌落后,用接种环逐个挑取形态各异的菌落至新的固体培养基平板,划线分离。挑取分离出来的菌株,在平板上划线纯化,至显微镜下观察显示无杂菌。分离出的菌株接种至斜面培养基保存备用。
1.3.3 反硝化能力测定
将分离得到的反硝化菌(8株,分别记为A、B、C、D、E、F、G、H)以 5%的接种量分别接种于装有300 mL反硝化培养液的500 mL三角瓶中,置于30 ℃、100 r·min-1摇床恒温振荡培养4 d。每隔12 h测定培养液中OD600和NO3--N、NO2--N、TN浓度,以判断菌株反硝化能力,筛选高效菌株。
1.4 纯化菌株鉴定
取菌种接种于反硝化培养液,置于30 ℃、100 r·min-1摇床恒温振荡培养24 h,8000 r·min-1离心5 min后的菌体作为样品,由微基生物(上海)科技有限公司完成菌种的鉴定。具体方法如下,菌种基因组DNA抽提采用CTAB法;16S扩增引物为8F:5'-AGAGTTTGATCCTGGCTCAG-3',1492R:5'-TACGGYTACCTTGTTAYGACTT-3'。 PCR反应条件为:94 ℃预变性5 min;94 ℃变性30 s,56.4 ℃退火30 s,72 ℃延伸90 s;步骤2循环25次,72 ℃延伸5 min。PCR产物回收采用AXYGEN公司的AxyPrepDNA凝胶回收试剂盒;PCR产物克隆使用BioLinker的pED-T载体试剂盒,PCR测序结果在NCBI中进行Blast比对。
1.5 反硝化菌扩培
从固态反硝化培养基上挑取菌株一环放入装有300 mL反硝化培养液的500 mL三角瓶中,置于30 ℃、100 r·min-1摇床恒温振荡培养24 h,然后按5%的接种量在相同条件下培养24 h,8000 r·min-1离心5 min,弃去上清液,用无菌水重复洗涤3次,制成菌悬液备用。
1.6 反硝化菌株的固定化
称取8 g PVA和2 g SA于90 mL蒸馏水中,80 ℃水浴加热并搅拌至均匀糊状,冷却至 30 ℃后,加入10 mL菌悬液,搅拌均匀后,用注射器滴入含2% CaCl2的饱和硼酸溶液中硬化24 h,交联成3~5 mm的固定化颗粒。无菌水冲洗后用于后续实验,剩余的放于4 ℃无菌生理盐水中保存。
1.7 固定化反硝化菌性能
1.7.1 固定化反硝化菌投加量的确定
分别称取固定化反硝化菌颗粒1、5、10、20 g加入装有100 mL人工模拟低污染水(NO3--N浓度约为5 mg·L-1,C/N为5)的150 mL三角瓶中,置于30 ℃、100 r·min-1摇床振荡,每12 h取水样,测定NO3--N、NO2--N、TN浓度。
1.7.2 pH、θ、DO、C/N对固定化反硝化菌脱氮效果的影响
称取固定化反硝化菌颗粒 10 g分别加入装有100 mL人工模拟低污染水(根据实验调整)的150 mL三角瓶中置于30 ℃(θ实验除外)、100 r·min-1摇床中振荡,24 h后取水样(C/N实验每隔12 h取样1次),测定NO3--N、NO2--N、TN浓度(表1)。

表1 反硝化性能实验影响因素设计表Table 1 Experiment design for factors affecting denitrification performance
1.8 测试方法
水质监测:NO3--N、NO2--N、TN的测定分别采用 QC-8500流动注射仪。DO、pH测定采用HQ300D DO测定仪,PHS-3CT pH计。
反硝化菌生长情况(OD600)测定采用UV2600紫外可见分光光度计。
2 结果与分析
2.1 反硝化菌的反硝化能力测定
根据 4 d后 8株反硝化菌在反硝化培养液中NO2--N积累量和NO3--N、TN的去除率以及OD600数据变化趋势分析可知(如图1所示),8株反硝化菌都具有较高的NO3--N去除率,但菌株A、E由于NO2--N的积累量较大而使其TN去除率较低,可见NO3--N去除率并不能作为反硝化菌反硝化能力高低的单一指标,综合分析NO2--N积累量和NO3--N、TN的去除率3个指标,筛选出NO3--N、TN去除率最高(分别为98.83%、98.36%)、NO2--N积累量最低(0.28 mg·L-1)的菌株C作为后续实验的高效反硝化菌。菌株C在48 h内的脱氮效率为5.56 mg ·L-1·h-1,在96 h内的脱氮效率为2.75 mg ·L-1·h-1。

图1 8株反硝化菌的反硝化能力及生长情况比较Fig. 1 Comparison of denitrification ability and growth of 8 strains of denitrifying bacteria
2.2 菌种鉴定及分析
对菌株C样品经基因组DNA抽提,16S PCR扩增,T载体转化(目的条带大小为1500 bp)后测序,测序结果在NCBI中进行Blast比对,鉴定结果表明菌株C与Pseudomonas stutzeriA1501(序列号为NR_074829.1)的最大相似度为99.7%。据文献报道P. stutzeriA1501可以在土壤中存活,为内生菌定殖于植物根部表面,并侵入根皮层的表面层(Rediers et al.,2003),因此该菌在人工湿地植物根区基质中可富集并分离。燕永亮等(2005)通过全基因组“Shotgun”法绘制该菌株的基因组草图,与其他反硝化菌比对结果表明,P. stutzeriA1501株中的 40个反硝化基因组成了一套完整的反硝化催化系统,且P. stutzeriA1501株中nir基因(亚硝酸盐还原酶类)有16个,是所有已知反硝化菌中nir基因数量最多的。由亚硝酸盐转化为氧化氮的过程是反硝化作用有别于其他硝酸盐代谢的标志性反应,是反硝化过程中最重要的限速步骤,亚硝酸盐还原酶(Nir)是催化此反应的限速酶(郭丽芸等,2011),且从图1 可看出,P. stutzeriA1501株的NO2--N积累量很少。另外,该菌株不仅具有反硝化功能,还表现出对硝酸盐的固氮酶活性,并且在自然环境和微好氧条件下具有很好的固氮能力。

图2 菌株C 16S rRNA系统发育树Fig. 2 Phylogenetic tree of strain C based on 16S rRNA
由图 2的系统发育树分析可知,菌株 C与Pseudomonas stutzeri的进化距离最为接近,确定其为施氏假单胞菌,其所属的假单胞菌属是自然界中存在最普遍的反硝化菌之一(方晶晶等,2010)。目前已有多种P. stutzeri的菌株被筛选出来,用于反硝化脱氮的有菌株 T13、RCH2、ZoBell等,也有用于固氮研究的,如菌株 B1SMN1、KOS6、DSM4166等(Yan et al.,2008;Li et al.,2012;Han et al.,2010;Peña et al.,2012;Busquets et al.,2012;Grigoryeva et al.,2013;Yu et al.,2011)。图 2所示进化距离与菌株 C较为接近的是Pseudomonas otitidis,有研究表明,该菌主要用于染料废水脱色,其对三苯甲烷类染料具有不错的脱色效果(Wu et al.,2009)。类产碱假单胞菌(Pseudomonas pseudoalcaligene)也具有一定的反硝化能力,不同的是其含有耐热碱性脂肪酶基因等。通过对菌株C的系统发育分析,明确了其在所属菌属中反硝化作用的能力与地位。
2.3 固定生物量
100 mL均匀糊状载体与反硝化菌菌悬液的混合物反硝化菌浓度为15.67 g·L-1,固定化反硝化菌颗粒密度为0.93 g·mL-1,1 g固定化颗粒中所含反硝化菌质量平均为0.02 g。与吸附法固定微生物相比,包埋法所固定的微生物量较高。当然,所固定微生物的量因固定材料的不同而有所差异,如Ye et al.(2012)实验研究中未经固定的活性污泥反应器中的生物量为4 g·L-1,以聚氨酯材料为载体吸附固定的微生物量为12.8 g·L-1;而Rezaee et al.(2008)研究中使用微生物纤维素吸附 P. stutzeri的生物量约为1.0 mg·g-1。
2.4 固定化反硝化菌投加量的确定
综合分析在不同固定化反硝化菌颗粒投加量下,NO2--N浓度以及TN去除率随时间的变化如图3所示。当固定化反硝化菌颗粒投加量分别为1、5、10 g时,随着固定化反硝化菌颗粒投加量增加,TN去除率增大,但当固定化反硝化菌颗粒投加量增至20 g,反硝化进行12 h后,由于NO2--N的积累,其TN去除率最低。尽管36 h后其TN去除率有所提高,但仍低于投加量10 g下相同时刻的TN去除率,说明该反硝化系统中的限速有可能发生在亚硝酸盐的转化中。
2.5 pH、θ、DO、C/N对固定化反硝化菌脱氮效果的影响
从图4中不同pH下NO3--N浓度变化图以及TN去除率变化可知,固定化反硝化菌和游离反硝化菌的适宜pH范围均为7~8。对于游离态反硝化菌,当pH低于7或高于8时,反硝化作用很弱,可见pH变化对其影响很大。当pH为8和6时,固定化反硝化菌的TN去除率明显高于游离反硝化菌,这说明,固定化作用在一定程度上缓解了 pH变化对反硝化菌的影响(He et al.,2012),其他研究者的结论也从不同角度分析了固定化作用对反硝化性能的改善,如王建龙(2003)通过分析多种有毒抑制物质及不利环境对固定化微生物的影响,认为固定化微生物对环境耐受性优于游离微生物的原因视环境因素的不同而不同,对温度、pH等环境因素的适应性则主要是由于固定化载体对微生物细胞产生了保护作用,也有研究认为这可能是由于固定化材料对NO3--N的吸收作用造成的(Ma et al.,2015)。
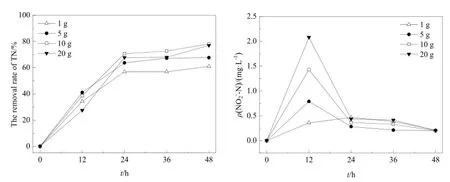
图3 不同固定化反硝化菌投加量下的TN去除率及NO2--N浓度变化Fig. 3 Changes in total nitrogen removing rate and nitrite concentration under different dosage of immobilized denitrifying bacteria
从图4可以看出,固定化反硝化菌与游离反硝化菌对TN的去除效果最好的温度均为30 ℃,不同的是二者抵抗环境温度变化的能力,当温度自30 ℃降至10 ℃,从不同温度下NO3--N浓度变化图以及TN去除率变化图中可明显看出,固定化反硝化菌的脱氮效果虽不如其在 30 ℃时,但优于相同温度下游离反硝化菌的脱氮效果。虽然在此过程中固定化反硝化菌的 NO2--N浓度稍高于游离反硝化菌,但总体 NO2--N浓度很低,而且,随着处理时间的增加,NO2--N继续减少。结合目前人工湿地在低污染水处理的脱氮效率受气温影响较大的现状(Werker et al.,2002),本实验通过比较固定化与游离反硝化菌在温度范围为 10~40 ℃时的反硝化性能,可以看出固定化反硝化菌在人工湿地系统中应用占据一定优势。
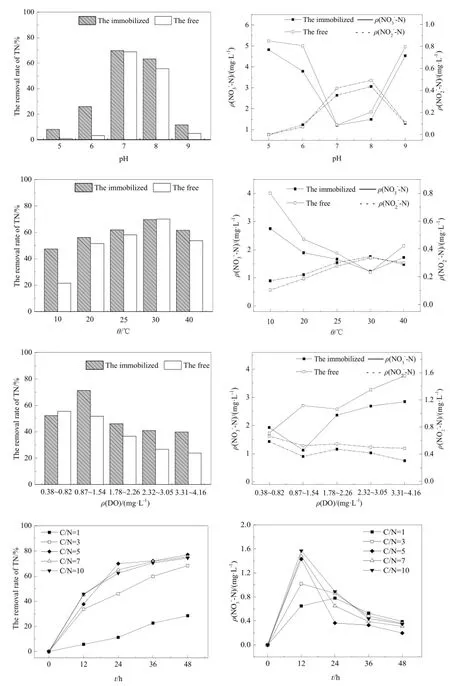
图4 pH、温度、DO、C/N对固定化反硝化菌的反硝化性能影响Fig. 4 Effects of Ph, Temperature, DO, C/N on denitrification of immobilized denitrifying bacteria
在DO对固定化反硝化菌影响实验中,DO设置为5个梯度范围。由图4中TN去除率变化分析可见,游离反硝化菌在整个 DO变化范围内,TN去除率随DO浓度升高呈减弱趋势。与此不同的是,固定化反硝菌的TN去除率先升高后降低,DO浓度为0.87~1.54 mg·-L1时固定化反硝化菌的TN去除率最高,为71.21%。结合NO3--N和NO2--N浓度变化图分析,DO浓度从 0.38~0.82 mg·L-1增至0.87~1.54 mg·L-1的过程中,固定化反硝化菌对NO3--N的利用增加,且NO2--N的积累量减少,可能是由于在一定的DO浓度范围内,适当提高混合速度有利于固定化颗粒固液界面物质的传质过程,从而有利于反硝化作用的进行。当 DO浓度从0.87~1.54 mg·L-1增至1.78~2.26 mg·L-1时,TN去除率变化明显,说明此时的DO变化对固定菌的反硝化作用影响较大。DO浓度在 1.78~2.26 mg·L-1到3.31~4.16 mg·L-1波动范围内,固定化作用对氧气扩散的阻碍(Omar,1993)使得多余DO对固定化反硝化菌的影响小于游离反硝化菌,从而使固定化反硝化菌显示出一定的优势。研究表明,固定化实验操作中微生物细胞浓度和PVA、SA凝胶的均匀性会影响固定化颗粒对氧气的扩散速率(Hulst et al.,1985;Martinsen et al.,1992)。
对于低污染水的脱氮处理常存在碳源不足的问题,通过外加碳源可加强脱氮效果,但外加碳源如果不适量,有可能造成二次污染,而通过固定化方法将反硝化过程控制在投加碳源的反应器内部,使多余碳源重复利用成为可能。由图4可知,当固定化反硝化菌处理低污染水(初始NO3--N浓度为5 mg·L-1)12 h时,NO3--N浓度随C/N的增加而减少,NO2--N浓度和TN去除率随着C/N的增加而增加,其中C/N为1的固定化反硝化菌的TN去除率明显低于其他几组。当处理48 h时,C/N为5、7、10 的3组实验之间的TN去除率相差不到2%,多余碳源的存在反而会增加NO2--N积累量。因此,实验中固定化反硝化菌所需的最佳C/N为5。在实际人工湿地系统中,可通过固定菌投加位置及方式的设计改进,综合考虑系统进水水质特点,以及湿地植物根系分泌物中可利用碳源的产生情况,提高系统对碳源的利用率,从而缓解碳源不足的问题。
3 结论
经富集、分离、纯化后得到8株反硝化菌,筛选得到NO3--N、TN去除率最高(分别为98.83%、98.36%)、NO2--N积累量最低(0.28 mg·L-1),24 h内脱氮效率为8.59 mg·L-1·h-1的菌株C,经分子生物学鉴定后为Pseudomonas stutzeriA1501(序列号为NR_074829.1)。
固定化反硝化菌的生物量为15.67 g·L-1,固定化反硝化菌颗粒密度为0.93 g·mL-1, 1 g固定化颗粒中所含反硝化菌量平均为0.02 g。对于实验中人工模拟低污染水(NO3--N浓度约为5 mg·L-1,C/N 为 5),固定化反硝化菌颗粒的最适投加量为 0.1 g·mL-1。pH为 7,θ为 30 ℃,DO质量浓度为0.87~1.54 mg·L-1时的脱氮效果最优。
在模拟低污染水处理实验研究中,pH、θ、DO的波动对固定化反硝化菌的脱氮效果影响均小于游离反硝化菌。低温10 ℃时,固定化反硝化菌仍可实现47.35%的总氮去除率。
参考文献:
BUSQUETS A, PEÑA A, GOMILA M, et al. 2012. Genome sequence of Pseudomonas stutzeri strain JM300 (DSM 10701), a soil isolate and model organism for natural transformation [J]. Journal of Bacteriology,194(19): 5477-5478.
CHEIKH A, YALA A, DROUICHE N, et al. 2013. Denitrification of water in packed beds using bacterial biomass immobilized on waste plastics as supports [J]. Ecological Engineering, 53: 329-334.
GRIGORYEVA T V, LAIKOV A V, NAUMOVA R P, et al. 2013. Draft genome of the nitrogen-fixing bacterium Pseudomonas stutzeri strain KOS6 isolated from industrial hydrocarbon sludge [J]. Genome Announcements, 1(1): e00072-12.
HAN R, GELLER J T, YANG L, et al. 2010. Physiological and transcriptional studies of Cr (VI) reduction under aerobic and denitrifying conditions by an aquifer-derived pseudomonad [J]. Environmental Science & Technology, 44(19): 7491-7497.
HE Y, TAO W, WANG Z, et al. 2012. Effects of pH and seasonal temperature variation on simultaneous partial nitrification and anammox in free-water surface wetlands [J]. Journal of Environmental Management, 110: 103-109.
HULST A C, TRAMPER J, BRODELIUS P, et al. 1985. Immobilised plant cells: respiration and oxygen transfer [J]. Journal of Chemical Technology and Biotechnology, 35(3): 198-204.
WU J, JUNG BYUNG GIL, KIM KYOUNG SOOK, et al. 2009. Isolation and characterization of Pseudomonas otitidis WL-13 and its capacity to decolorize triphenylmethane dyes [J]. Journal of Environmental Sciences, 21(7): 960-964.
LI A, GAI Z, CUI D, et al. 2012. Genome sequence of a highly efficient aerobic denitrifying bacterium, Pseudomonas stutzeri T13 [J]. Journal of Bacteriology, 194(20): 5720.
MA F, SUN Y, LI A, et al. 2015. Activation of accumulated nitrite reduction by immobilized Pseudomonas stutzeri T13 during aerobic denitrification [J]. Bioresource Technology, 187: 30-36.
MARTINSEN A, STORRØ I, SKJÅRK BRAEK G. 1992. Alginate as immobilization material: III. Diffusional properties [J]. Biotechnology and Bioengineering, 39(2): 186-194.
OMAR S H. 1993. Oxygen diffusion through gels employed for immobilization [J]. Applied Microbiology and Biotechnology, 40(2-3): 173-181.
PEÑA A, BUSQUETS A, GOMILA M, et al. 2012. Draft genome of Pseudomonas stutzeri strain ZoBell (CCUG 16156), a marine isolate and model organism for denitrification studies [J]. Journal of Bacteriology, 194(5): 1277-1278.
RAI U N, TRIPATHI R D, SINGH N K, et al. 2013. Constructed wetland as an ecotechnological tool for pollution treatment for conservation of Ganga river [J]. Bioresource Technology, 148: 535-541.
REDIERS H, BONNECARRERE V, RAINEY P B, et al. 2003. Development and application of a dapB-based in vivo expression technology system to study colonization of rice by the endophytic nitrogen-fixing bacterium Pseudomonas stutzeri A15 [J]. Applied and Environmental Microbiology, 69(11): 6864-6874.
REZAEE A, GODINI H, DEHESTANI S, et al. 2008. Biological denitrification by Pseudomonas stutzeri immobilized on microbial cellulose [J]. World Journal of Microbiology and Biotechnology,24(11): 2397-2402.
SAEED T, SUN G. 2012. A review on nitrogen and organics removal mechanisms in subsurface flow constructed wetlands: Dependency on environmental parameters, operating conditions and supporting media [J]. Journal of Environmental Management, 112: 429-448.
SUN S P, NÀCHER C P, MERKEY B, et al. 2010. Effective biological nitrogen removal treatment processes for domestic wastewaters with low C/N ratios: a review [J]. Environmental Engineering Science,27(2): 111-126.
WERKER A G, DOUGHERTY J M, MCHENRY J L, et al. 2002. Treatmentvariability for wetland wastewater treatment design in cold climates [J]. Ecological Engineering, 19(1): 1-11.
YAN Y, YANG J, DOU Y, et al. 2008. Nitrogen fixation island and rhizosphere competence traits in the genome of root-associated Pseudomonas stutzeri A1501 [J]. Proceedings of the National Academy of Sciences, 105(21): 7564-7569.
YE Z, WANG F, BI H, et al. 2012. Denitrification of nitrate-contaminated groundwater using a simple immobilized activated sludge bioreactor [J]. Water Science & Technology, 66(3): 517-524.
YU H, YUAN M, LU W, et al. 2011. Complete genome sequence of the nitrogen-fixing and rhizosphere-associated bacterium Pseudomonas stutzeri strain DSM4166 [J]. Journal of Bacteriology, 193(13): 3422-3423.
方晶晶, 马传明, 刘存富. 2010. 反硝化细菌研究进展[J]. 环境科学与技术, 33(6E): 206-210.
郭丽芸, 时飞, 杨柳燕. 2011. 反硝化菌功能基因及其分子生态学研究进展[J]. 微生物学通报, 38(4): 583-590.
黄娟, 王世和, 钟秋爽, 等. 2009. 植物生理生态特性对人工湿地脱氮效果的影响[J]. 生态环境学报, 18(2): 471-475.
王建龙. 2003. 固定化对微生物生理变化的影响[J]. 中国生物工程杂志,23(7): 62-66.
王小晓, 龚珞军, 韩炜, 等. 2014. 自然复氧人工湿地处理农村污水动力学研究[J]. 环境科学与技术, 37(2): 028.
燕永亮, 杨剑, 陈立宏, 等. 2005. 斯氏假单胞菌(Pseudomonas stutzeri)A1501反硝化相关基因结构及功能分析[J]. 中国科学C辑: 生命科学, 35(3): 246-253.
叶少帆, 王志伟, 吴志超, 等. 2010. 微污染水源水处理技术研究进展和对策分析[J]. 水处理技术, 36(6): 22-28.
DOI:10.16258/j.cnki.1674-5906.2016.05.019
中图分类号:X172
文献标志码:A
文章编号:1674-5906(2016)05-0857-07
基金项目:国家水体污染控制与治理科技重大专项(2012ZX07105-003)
作者简介:张焕杰(1991年生),女,硕士研究生,研究方向为水污染控制及生态修复。E-mail: 963484028@qq.com
*通信作者:林燕(1976年生),博士,副教授。E-mail: linyan2002@sjtu.edu.cn
收稿日期:2016-03-08
Nitrogen Removal Characteristics of Immobilized Denitrifying Bacteria for Treatment of Slightly-polluted Water
ZHANG Huanjie, YU Lu, ZHU Wenying, KONG Hainan, LIN Yan
School of Environmental Science and Engineering, Shanghai Jiao Tong University, Shanghai 200240, China
Abstract:Denitrification technology plays an important role in in situ remediation of slightly-polluted water. However, the denitrification performance is affected by temperature, pH and the nitrite accumulation particularly in constructed wetland (CW). In this work, a novel immobilized microbial technology, with the advantages of high adaptability and strong poison resistance, was developed to improve the nitrogen removal efficiency in CW systems. A dominant species denitrifying bacteria “C” was isolated and identified by DNA sequence and phylogenetic analysis. On this basis, its denitrification performances and mechanisms were investigated at varied temperatures, pH, DO, and C/N to address the optimized conditions for nitrogen removal. The results showed that strain “C”, which had 99.7% maximum sequence similarity with Pseudomonas stutzeri A1501, was the superior bacteria with the removal efficiencies of 98.83% for NO3--N and 98.36% for TN, respectively. The nitrate removal rate was found to be up to 8.59 mg N·L-1·h-1by 24 h while the nitrite accumulation was just 0.28 mg·L-1. Furthermore, the denitrifying bacteria “C” was immobilized with PVA and SA to address its denitrification performance in practice. Given the operating conditions of 15.67 g·L-1biomass and 0.93 g·mL-1density, the influence of pH, T, DO on nitrogen removal for immobilized denitrifying bacteria were less than that for free denitrifying bacteria. Also, the optimized conditions for maximum nitrogen removal were found to be pH=7, θ=30 ℃,DO=0.87~1.54 mg·L-1and for C/N=5. The results may provide a positive reference for the enhanced denitrification technology used in the remediation for constructed wetland.
Key words:denitrifying bacteria; immobilization; constructed wetland; slightly-polluted water

