大蜡螟气味受体基因Gmel/Orco的克隆与序列分析
杨 爽,赵慧婷,宋文菲,孟 娇,杨珊珊,杜亚丽,潘建芳,王树杰,姜玉锁*
(1. 云南省农业科学院蚕桑蜜蜂研究所,云南蒙自 661101; 2. 山西农业大学动物科技学院,太谷 030801;3. 山西农业大学生命科学学院,太谷 030801)

大蜡螟气味受体基因Gmel/Orco的克隆与序列分析
杨爽1,2,赵慧婷3,宋文菲1,孟娇2,杨珊珊2,杜亚丽2,潘建芳2,王树杰2,姜玉锁2*
(1. 云南省农业科学院蚕桑蜜蜂研究所,云南蒙自 661101; 2. 山西农业大学动物科技学院,太谷 030801;3. 山西农业大学生命科学学院,太谷 030801)
为进一步研究大蜡螟嗅觉通讯分子机制和寻求新的大蜡螟防治技术,本研究克隆了大蜡螟GalleriamellonellaL.的气味受体基因Gmel/Orco,并对其序列进行生物信息学分析。根据GenBank中已发表的鳞翅目昆虫非典型气味受体家族基因的氨基酸保守序列设计简并引物,采用RT-PCR方法扩增目的基因,将其克隆至T载体并测序。克隆获得大蜡螟气味受体Orco的cDNA序列,命名为Gmel/Orco(GenBank登录号:KT020861),序列分析结果显示,Gmel/Orco开放阅读框长1425 bp,编码474个氨基酸,分子量为53.36 kD,等电点为8.44,序列中有7个跨膜区,N-端在细胞膜内,C-端在细胞膜外。通过在GenBank中进行序列的同源性比较,该基因与已公布的鳞翅目螟蛾科、夜蛾科昆虫的非典型气味受体基因序列有较高的同源性。克隆所获得的基因属于非典型气味受体家族基因。
大蜡螟;气味受体;基因克隆;序列对比
大蜡螟GalleriamellonellaL.属鳞翅目Lepidoptera螟蛾科Pyralidae蜡螟亚科Galleriinae蜡螟属GalleriaFabricius昆虫,其幼虫(又叫巢虫)吞食巢脾,在巢脾上吐丝作茧,是蜜蜂尤其是中华蜜蜂的重要敌害之一(代平礼等, 2005)。在养蜂生产中,蜂农多采用药物熏蒸的方法来贮存巢脾(吴艳艳等, 2009),会导致巢脾上药物残留,不符合蜂产品无公害生产的要求,因此迫切需要寻求新的大蜡螟防治技术。
嗅觉在昆虫寻找食物、配偶、产卵和发育场所、躲避敌害等方面具有至关重要的作用,直接影响着昆虫的生存和繁衍(Bruceetal.,2005; Songetal.,2008)。近年来,解密媒介昆虫和农业害虫嗅觉的分子机制,对害虫嗅觉识别进行有效干扰,是害虫生物防治中的一个重要组成部分。气味受体(odorant receptor)是嗅觉系统的关键成分之一,是了解昆虫化学信号分子识别机制的重要基础(Clyneetal., 1999;Mombaerts, 1999; Stortkuhl and Kettler, 2001),对气味受体的研究可为大蜡螟的防治提供新的思路和途径。
气味受体可以分成两大类:一类是典型的气味受体ORs,在不同昆虫中高度分化,在同种昆虫中也表现出很低的序列相似性(Larssonetal., 2004);另一类是非典型气味受体,最早在果蝇Drosophilamelanogaster中发现,命名为Or83b,后来在蚊子Culicidae(OR7)中和鳞翅目(OR2)中陆续被鉴别,现统一命名为olfactory coreceptor (Orco),在不同昆虫中高度保守,同源性在50%-99%(Kriegeretal., 2003; Jonesetal., 2005)。研究表明,Orco本身并无感受气味的功能,通常与ORs共同作用,形成异源二聚体,充当配体门控性离子通道,帮助ORs准确定位到嗅觉神经元树突膜上面(Larssonetal.,2004; Wanneretal.,2007)。果蝇、冈比亚按蚊Anophelesgambiae和烟芽夜蛾Helicoverpavirescens等昆虫缺失表达Orco后变得对气味刺激不再敏感,而通过转基因营救重新获得Orco后,又恢复了对气味分子的敏感性,表明Orco在昆虫的嗅觉识别中的不可或缺性(Wetzeletal., 2001; Larssonetal., 2004; Jonesetal.,2005; Wanneretal., 2007) 。本研究采用RT-PCR技术,克隆获得大蜡螟的Gmel/Orco基因,利用生物信息学对其序列进行分析,并与其它昆虫Orco基因同源性进行了比较,以期为进一步研究大蜡螟嗅觉通讯分子机制和寻求新的大蜡螟防治技术提供理论依据。
1 材料与方法
1.1供试样本与试剂
大蜡螟于山西农业大学动物科技学院养蜂学实验室人工饲养所得。将刚交配后雌蛾(5 头)分装于1.5 mL的离心管中(顶端开口),待其产卵后,将同一批卵(约200粒)转入已配好的人工饲料中,置于人工气候箱(温度为30℃、湿度为60%)中饲养,待其羽化后,取1 d雌蛾80头,用镊子将其头和触角一同夹下,立刻置于液氮中研磨至粉状,转入装有1 mL Trizol的EP管中,-70℃ 保存至RNA提取。
总RNA提取试剂Trizol购自Invitrogen公司;PrimeScript 1 st Strand cDNA Synthesis Kit为TaKaRa公司产品,PCR试剂、普通琼脂糖胶回收试剂盒、感受态细胞购自康为公司;pMD19-T Vector为TIANGEN公司产品;抗生素类、X-gal、IPTG购自Sigma公司;其余试剂均为国产或进口分析纯试剂;引物合成、测序由华大基因生物技术公司完成。
1.2引物设计
根据GenBank中已发表的鳞翅目昆虫亚洲玉米螟Ostriniafurnacalis(OfurOR2)、二化螟ChilosuppressalisWalker(CsupOR2)、稻纵卷叶螟CnaphalocrocismedinalisGuenee(CmedOR2)、棉铃虫HelicoverpazeaBoddie(HzeaOR83b)、家蚕BombyxmoriLinnaeus(BmorOR2)、甜菜夜蛾SpodopteraexiguaHübner(SexiOR2)、烟芽夜蛾Heliothisvirescens(HvirOR2)、小菜蛾PlutellaxyllostellaLinnaeus(Pxyl/Orco)和甘蓝夜蛾MamestrabrassicaeLinnaeus(MbraOR83b)等非典型气味受体家族基因的氨基酸保守序列,设计扩增大蜡螟Gmel/Orco片段基因的简并引物,上游引物:5′-ATGATGACCAAR GTGAARGC-3′;下游引物:5′-TTAYTTGAGY TGTAYCAAYACCATG-3′。
1.3RNA的提取和cDNA第一链的合成
根据Trizol试剂说明书提取大蜡螟头和触角的总RNA,以总RNA为模板,按照PrimeScript 1 st Strand cDNA Synthesis Kit说明书进行两步法反转录,合成cDNA第一链。具体步骤为:
第一步,将5 × gDNA Exaser Buffer 5 μL,gDNA Exaser 2.5 μL,Total RNA 2500 ng混合,加RNase-Free H2O(up to 25 μL),在PCR仪上,42℃反应2 min;第二步,向上面所得溶液中加入5 × Prime Script Buffer 10 μL,Prime Script RT Enzyme MTK 2.5 μL,RT Prime MTK 2.5 μL,RNase-Free H2O 10 μL,37℃反应15 min,85℃反应5 s,4℃保存。
1.4PCR扩增
以合成的cDNA为模板,进行PCR反应,反应体系为20 μL:dNTPs Mix 10 μL,cDNA模板2 μL,RNase-Free H2O 6.4 μL,上、下游引物各0.8 μL;反应条件:94℃预变性4 min;接着进行33个循环,循环条件为94℃ 30 s,52℃30 s,72℃ 1 min;最后72℃延伸8 min。将产物于1%的琼脂糖凝胶上进行电泳检测。
1.5PCR产物的回收、克隆及序列测定
按照胶回收试剂盒说明对PCR产物进行割胶回收,将回收产物连接到pMD19-T Vector上(按试剂盒说明操作),转化到DH5α感受态细胞中,进行蓝白斑和氨苄青霉素筛选,挑取白色单克隆菌斑,摇菌培养后送公司进行测序。
1.6序列分析
通过DNAMAN、EditSeq等软件将测序后获得的大蜡螟Gmel/Orco基因核苷酸序列及其编码的氨基酸序列进行分析;利用NCBI上BLAST工具进行同源性比对;用在线工具TMHMM进行跨膜区域预测;利用Mega 4.1软件中Neighbor-Joining方法进行昆虫气味受体进化树的构建。
2 结果与分析
2.1大蜡螟气味受体基因Gmel/Orco序列分析
通过基因克隆,获得大蜡螟气味受体Orco的cDNA序列,命名为Gmel/Orco(GenBank登录号:KT020861)。如图1所示,Gmel/Orco开放阅读框长1425 bp,编码474个氨基酸。根据网站http://www.expasy.ch/tools/protparam.html. 预测其分子量为53.36 kD,等电点为8.44。

图1 大蜡螟Gmel/Orco核苷酸序列及推导的氨基酸序列Fig.1 Nucleotide and amino acid sequence of the gene Gmel/Orco in Galleria mellonella L.
利用TMHMM 2.0蛋白跨膜结构预测软件分析,获得的序列具有7个α螺旋跨膜区(图2),跨膜区氨基酸的位置是46-65,75-97,136-158,195-217,335-357,377-399和448-470,是一个典型的G蛋白偶联受体,序列N-端在细胞膜内,C-端在细胞膜外。
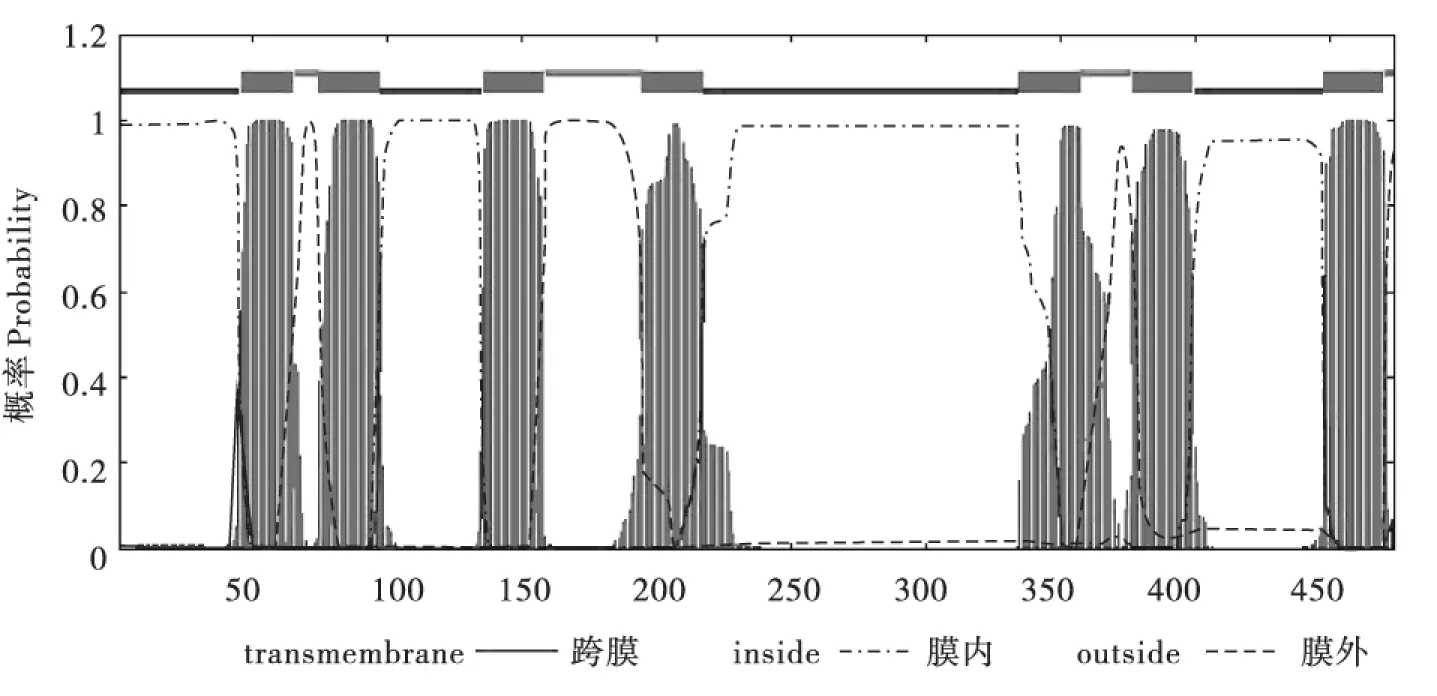
图2 大蜡螟气味受体Orco的跨膜结构预测Fig. 2 The predicted transmembrane domain of the olfactory co-receptor (Orco) from Galleria mellonella L.
2.2大蜡螟Gmel/Orco基因氨基酸同源性比较
选取大蜡螟近缘种螟蛾科的亚洲玉米螟(OfurOR2)、二化螟(CsupOR2),夜蛾科的棉铃虫Hubner(HarmOr83b)、烟芽夜蛾(HassOr83b),蚕蛾科的家蚕(BmorOR2),以及双翅目具有代表性的黑腹果蝇Drosophilamelanogaster(Dmel/Orco)、桔小实蝇BactroceradorsalisHendel(Bdor/Orco)和埃及伊蚊Aedesaegypti(AaegOR7)与大蜡螟(Gmel/Orco)基因进行序列联配,结果显示,这9种昆虫的Orco受体的C端序列具有高度的保守性(图3)。
为研究大蜡螟Gmel/Orco与其它物种之间的进化关系,利用Mega 4.1软件邻位相连法构建鳞翅目、膜翅目、鞘翅目、双翅目部分昆虫非典型气味受体的系统进化树(图4);结果显示,25个非典型嗅觉受体基因分成2个大的分支,不同目之间氨基酸序列差异较大,同一目昆虫之间差异较小;大蜡螟Gmel/Orco与鳞翅目螟蛾科、夜蛾科、蚕蛾科、菜蛾科聚为一类,通过同源对比,大蜡螟Gmel/Orco与螟蛾科二化螟OfurOR2、亚洲玉米螟OfurOR2、瓜绢野螟DindOR2,稻纵卷叶螟CmedOR2等氨基酸同源性相对较高,为90%-92%;与甜菜夜蛾SexiOR2、斜纹夜蛾SlitOR2、苜蓿叶蛾HvirOr83b、烟夜蛾HassOr83b、棉铃虫HarmOr83b等夜蛾科氨基酸同源性在80%-90%之间;与家蚕BmorOR2同源性为88%;鳞翅目与双翅目聚为一大类,大蜡螟Gmel/Orco与埃及伊蚊AaegOR7、白纹伊蚊Aalb/Orco、致倦库蚊CquiOR7,黑腹果蝇Dmel/Orco、桔小实蝇Bdor/Orco、地中海实蝇Ccap/Orco,大头金蝇Cmeg/Orco等氨基酸同源性为65%-68%;大蜡螟Gmel/Orco与膜翅目(蜜蜂、熊蜂)和鞘翅目(赤拟谷盗、华北大黑鳃金龟)遗传距离相对较远,氨基酸同源性低于60%。
3 结论与讨论
目前,利用昆虫各物种之间的保守区域进行同源克隆的方法,已从鳞翅目、双翅目、膜翅目、鞘翅目等8个目40余种昆虫中鉴定出Or83b的同源受体(Stengl and Funk., 2013),本研究通过RT-PCR 技术获得大蜡螟嗅觉受体Gmel/Orco基因的cDNA序列,该序列与鳞翅目螟蛾科二化螟OfurOR2、亚洲玉米螟OfurOR2、瓜绢野螟DindOR2,稻纵卷叶螟CmedOR2等氨基酸同源性高达90%-92%,与双翅目昆虫氨基酸同源性也达到65%-68%,这些都与Orco基因在不同昆虫体内的保守性相吻合。

图3 大蜡螟Gmel/Orco与其它昆虫气味受体蛋白的序列比对Fig.3 Sequence alignment of theGmel/Orco in Galleria mellonella L. with olfactory receptors in other insects
注:AaegOR7,埃及伊蚊(XM_001651376);BdorOrco,桔小实蝇(EU621792);BmorOR2,家蚕(NM001043595);CsupOR2,二化螟(AFQ94048.1);DmelOrco,黑腹果蝇(AY567998);GmelOrco,大蜡螟(KT020861);HarmOr83b,棉铃虫(HQ186284);HassOr83b,烟夜蛾(EU057178);OfurOR2,亚洲玉米螟(BAR43445.1)。Note:AaegOR7,Aedesaegypti(XM_001651376);BdorOrco,BactroceradorsalisHendel(EU621792);BmorOR2,BombyxmoriLinnaeus(NM001043595);CsupOR2,ChilosuppressalisWalker(AFQ94048.1);DmelOrco,Drosophilamelanogaster(AY567998);GmelOrco,GalleriamellonellaLinnaeus(KT020861);HarmOr83b,HelicoverpaarmigeraHübner(HQ186284);HassOr83b,Heliothisassulta(EU057178);OfurOR2,Ostriniafurnacalis(BAR43445.1).
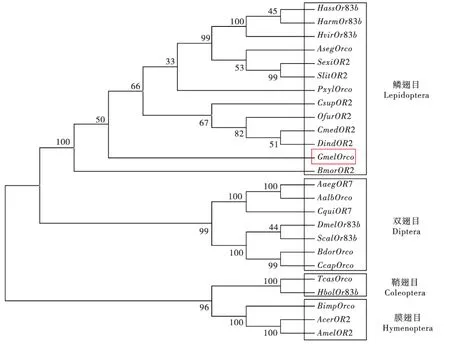
图4 大蜡螟与其它昆虫Orco氨基酸的系统发育树Fig.4 Phylogenetic tree of the Orcos of the Galleria mellone L. and other insects based on amino acid sequence
注:HassOr83b,烟夜蛾;HarmOr83b,棉铃虫;HvirOr83b,苜蓿夜蛾;AsegOrco,黄地老虎;SexiOR2,甜菜夜蛾;SlitOR2,斜纹夜蛾;PxylOrco,小菜蛾;CsupOR2,二化螟;OfurOR2,亚洲玉米螟;CmedOR2,稻纵卷叶螟;DindOR2,瓜绢野螟;GmelOrco,大蜡螟;BmorOR2,家蚕;AaegOR7,埃及伊蚊;AalbOrco,白纹伊蚊;CquiOR7,致倦库蚊;DmelOr83b,黑腹果蝇;ScalOr83b,厩螯蝇;BdorOrco,桔小实蝇;CcapOrco,地中海实蝇;TcasOrco,赤拟谷盗;HbolOr83b,华北大黑鳃金龟;BimpOrco,熊蜂;AcerOR2,中华蜜蜂;AmelOR2,西方蜜蜂。Note:HassOr83b,Heliothisassulta;HarmOr83b,HelicoverpaarmigeraHübner;HvirOr83b,Heliothisdipsacea;AsegOrco,Agrotissegetum;SexiOR2,SpodopteraexiguaHübner;SlitOR2,SpodopteralituraFabricius;PxylOrco,PlutellaxyllostellaLinnaeus;CsupOR2,ChilosuppressalisWalker;OfurOR2,Ostriniafurnacalis;CmedOR2,CnaphalocrocismedinalisGuenee;DindOR2,Diaphaniaindica;GmelOrco,GalleriamellonellaLinnaeus;BmorOR2,BombyxmoriLinnaeus;AaegOR7,Aedesaegypti;AalbOrco,Aedesalbopictus;CquiOR7,Culexquinquefasciatus;DmelOr83b,Drosophilamelanogaster;ScalOr83b,StomoxyscalcitransLinnaeus;BdorOrco,BactroceradorsalisHendel;CcapOrco,CeratitiscapitataWiedemann;TcasOrco,TriboliumcastaneumHerbst;HoblOr83b,HolotrichiaoblitaFald;BimpOrco,bumble-bee;AcerOR2,ApisceranaceranaFabricius;AmelOR2,ApismelliferaLinnaeus.
Orco受体与传统嗅觉受体的区别体现在其功能方面,Orco能够帮助传统嗅觉受体定位到嗅觉神经树突膜上的正确位点,增强传统嗅觉受体对气味的识别(Larsson MC, 2004)。在爪蟾Xenopus的卵母细胞中对家蚕气味受体的研究发现,BmOR2能增强BmOR1的表达和功能(Takaoetal., 2005)。最近研究结果表明,果蝇ORs/OR83b形成一个配体门控阳离子通道(ligand-gated cation channels),完全不同于线虫和脊椎动物依靠第二信使激活的GPCRs(Kojietal., 2008)。如通过削弱或破坏Orco及其类似蛋白的功能,就可以同时影响多个嗅觉受体的功能,并对多种近缘害虫起到控制作用,是害虫治理潜在的分子靶标。
Jones等(2011)首次发现了Orco的兴奋剂VUAAI,通过Orco受体能够激活几乎所有的嗅觉神经元,从而使嗅觉丧失对气味物质的识别,阻断昆虫嗅觉驱动的行为。进一步的研究证实VUAAI能够激活双翅目、鳞翅目和膜翅目昆虫的Orco,被认为是广谱的激动剂(Katzetal., 2008; Carey and Carlson., 2011)。此后,又发现了几种Orco的抑制剂(Sisi and Luetje,2012; Jonesetal., 2012),为以Orco为靶标的害虫防治提供了基础。鉴于大蜡螟气味受体Gmel/Orco基因氨基酸序列同中华蜜蜂AcerOR2、西方蜜蜂AmelOR2同源性分别为65%和64%,可以设计针对大蜡螟Gmel/Orco的行为调节剂,在不伤害蜜蜂的前提下,达到防治大蜡螟的目的。本研究对大蜡螟气味受体Gmel/Orco基因的成功克隆,为大蜡螟的防控提供新的理论基础,具有重要的实践意义。
References)
Bruce TJA, Wadhams LJ, Woodcock CM. Insect host location:A volatile situation[J].TrendsinPlantScience, 2005, 10(6):269-274.
Carey AF, Carlson JR. Insect olfaction from model systems to disease control[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2011, 108(32):12987-12995.
Clyne PJ, Warr CG, Freeman MR,etal. A novel family of divergent seven-transmembrane proteins: Candidate odorant receptors inDrosophila[J].Neuron, 1999, 22(2):327-338.
Dai PL, Zhou T, Wang Q,etal. Survey and control ofGalleriamellonellaL. Bee Products Professional Committee of China Apiculture Association, Bees Protection Professional Committee, Bees Pollinated the Crops and Professional Committee Academic Seminar[C] .2005.[代平礼, 周婷, 王强,等. 大蜡螟的研究概况及防治.中国养蜂学会蜜蜂产品专业委员会、蜜蜂保护专业委员会、蜜蜂授粉专业委员会联合工作会议和学术研讨会论文集[C].2005]
Jones PL, Pask GM, Rinker DC,etal. Functional agonism of insect odorant receptor ion channels[J].ProceedingsoftheNationalAcademyofSciences, 2011, 108(21):8821-8825.
Jones PL, Pask GM, Romaine IM,etal. Allosteric Antagonism of Insect Odorant Receptor Ion Channels[J].PLoSONE, 2012, 7(1):e30304.
Jones WD, Nguyen TAT, Kloss B,etal. Functional conservation of an insect odorant receptor gene across 250 million years of evolution[J].CurrentBiology, 2005, 15(4):R119-R121.
Katz TM, Miller JH, Hebert AA. Insect repellents:Historical perspectives and new developments[J].JournaloftheAmericanAcademyofDermatology, 2008, 58(2):865-871.
Koji S, Maurizio P, Takao N,etal. Insect olfactory receptors are heteromeric ligand-gated ion channels[J].Nature, 2008, 452(7190):1002-1006.
Krieger J, Klink O, Mohl C,etal. A candidate olfactory receptor subtype highly conserved across different insect orders[J].JournalofComparativePhysiologyANeuroethologySensoryNeural&BehavioralPhysiology, 2003, 189(7):519-526.
Larsson MC, Domingos AI, Jones WD,etal. Or83b encodes a broadly expressed odorant receptor essential forDrosophilaolfaction[J].Neuron, 2004, 43(5):703-714.
Mombaerts P. Seven-transmembrane proteins as odorant and chemosensory receptors[J].Science, 1999, 286(5440):707-711.
Sisi C, Luetje CW. Identification of new agonists and antagonists of the insect odorant receptor co-receptor subunit[J].PloSONE, 2012, 7(5):e36784-e36784.
Song HG, Kwon JY, Han HS,etal. First contact to odors: Our current knowledge about odorant receptors[J].Sensors, 2008, 8(10):6303-6320.
Stengl M, Funk NW. The role of the coreceptor Orco in insect olfactory transduction[J].JournalofComparativePhysiology, 2013, 199(11):897-909.
Stortkuhl KF, Kettler R. Functional analysis of an olfactory receptor inDrosophilamelanogaster[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2001, 98(16):9381-9385.
Takao N, Takeshi S, Takaaki N,etal. Insect sex-pheromone signals mediated by specific combinations of olfactory receptors[J].Science, 2005, 307(5715):1638-1642.
Wanner KW, Nichols AS, Walden KKO,etal. A honey bee odorant receptor for the queen substance 9-oxo-2-decenoic acid[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2007, 104(36):14383-14388.
Wetzel CH, Behrendt HJ, Gisselmann G,etal. Functional expression and characterization of a Drosophila odorant receptor in a heterologous cell system[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2001, 98(16):9377-9380.
Wu YY, Zhou T, Wang Q,etal. Comprehensive prevention and control ofGallriamellonellaL.[J].ApicultureofChina, 2009, 8:22-23.[吴艳艳, 周婷, 王强,等. 蜡螟的综合防治[J]. 中国蜂业, 2009, 8:22-23]
Gene cloning and sequence analysis of (greater wax moth) the odorant receptor geneGmel/OrcoinGalleriamellonellaL.
YANG Shuang1,2, ZHAO Hui-Ting3, SONG Wen-Fei1, MENG Jiao2, YANG Shan-Shan2, DU Ya-Li2, PAN Jian-Fang2, WANG Shu-Jie2, JIANG Yu-Suo2*
(1. Institute of Sericulture and Apiculture, Yunnan Academy of Agricultural Sciences, Mengzi 661101, Yunnan Province, China; 2. College of Animal Science and Veterinary Medicine, Shanxi Agricultural University, Taigu 030801, Shanxi Province, China; 3. College of Life Science, Shanxi Agricultural University, Taigu 030801, Shanxi Province,China)
For further study the mechanism of olfactory communication and seek new prevention technology inGalleriamellonellaL. (greater wax moth), the olfactory receptor gene (Gmel/Orco) was cloned, and analysed by bioinformatics analysis. According to the conserved amino acid sequences of the Lepidoptera insects olfactory receptor gene family published in GenBank, the degenerate primer were designed for RT-PCR. The cDNA sequence of wax moth olfactory receptor gene was cloned, and namedGmel/Orco(GenBank accession number: KT020861), the results of sequence analysis showed that the open reading frame ofGmel/Orcoconsisted of 1425 nucleotides, encoding 474 amino acid with a molecular weight of 53.36 kD, an isoelectric point of 8.44 and 7 putative transmembrane domains in the sequence,with an intracellular N-terminal and extracellular C-terminus. By comparing the homology of the sequences in GenBank, the sequence shared high identy with Orco orthologue chemoreceptor sequences from other previously reported insects. The result indicated that the gene belongs to atypical olfactory receptor gene family.
GalleriamellonellaL.; odorant receptors; gene cloning; sequence alignment
云南省农业科学院蚕桑蜜蜂研究所青年创新基金(QC2013003)
杨爽,男,湖北仙桃人,研究实习员,在读博士,主要从事蜜蜂病虫害防治研究,E-mail: yangshuang19860724@163.com
Author for correspondence,E-mail: jiangys-001@163.com
2015-10-14;接受日期Accepted:2015-11-24
Q963;S895.2
A
1674-0858(2016)04-0798-07

