糖尿病患者外周血白细胞端粒酶活性变化及其影响因素分析
王建飞,曹若琼,孙阳阳,邱宇,王君,钟理,3
(1河北大学生命科学学院,河北保定 071002;2保定市第一中心医院;3 Western University of Health Science)
糖尿病患者外周血白细胞端粒酶活性变化及其影响因素分析
王建飞1,曹若琼1,孙阳阳1,邱宇1,王君2,钟理1,3
(1河北大学生命科学学院,河北保定 071002;2保定市第一中心医院;3 Western University of Health Science)
目的观察糖尿病患者白细胞端粒酶活性变化,并分析外周血白细胞端粒酶活性的影响因素。方法以1型糖尿病(T1DM)患者40例为A组,2型糖尿病(T2DM)患者80例为B组,健康体检者50例为对照组。抽取各组外周静脉血5 mL,离心后提取白细胞,采用荧光定量PCR法检测各组白细胞中端粒酶活性。采用多元线性回归分析法分析T2DM患者白细胞中端粒酶活性的影响因素。结果A、B、C组外周血白细胞端粒酶活性(Ct值)分别为31.64±1.03、32.22±0.75、33.19±0.95,组间两两比较,P均<0.05。性别、吸烟状况与T2DM患者外周血白细胞端粒酶活性有关(P均<0.05)。结论糖尿病患者外周血白细胞端粒酶活性升高,且T1DM患者白细胞端粒酶升高更明显。性别、吸烟状况是T2DM患者外周血白细胞端粒酶活性的影响因素。
端粒酶;端粒酶活性;白细胞;糖尿病;1型糖尿病;2型糖尿病
端粒是真核细胞染色体末端的一段特殊DNA结构,可保护染色体末端免于降解,维持细胞活性。端粒缩短常被临床用作细胞凋亡的生物学标志[1]。端粒酶是一种核糖核酸蛋白质复合体,由具有逆转录活性的端粒酶逆转录酶(TERT)、端粒酶RNA基因(TERC)、端粒重复序列结合因子(TRF)三个亚基构成[2]。既往研究[3,4]发现,糖尿病患者由于自身免疫作用或氧化应激反应会导致外周血白细胞端粒存在非正常长度缩短现象,检测糖尿病患者外周血白细胞的端粒酶活性可能成为糖尿病的重要分子指标。2014年10月~2015年12月,本研究观察了糖尿病患者的外周血端粒酶活性变化,并分析其影响因素。现将结果报告如下。
1 资料与方法
1.1临床资料选择2014年10月~2015年12月我院收治的120例糖尿病患者,其中男63例、女57例,年龄23~78岁;均符合《内科学(第7版)》提出的T1DM的诊断标准[5];无大血管、肾脏病变等并发症。120例糖尿病患者分为T1DM患者40例(A组)和T2DM患者80例(B组)。B组中男43例、女37例,年龄(55.71±10.61)岁,BMI(27.21±2.94)kg/m2,患病时间(7.39±7.12)年,其中吸烟24例、不吸烟56例;A组中男20例、女20例,年龄(43.50±13.19)岁,BMI(25.26±7.40)kg/m2,患病时间(6.33±4.85)年,其中吸烟13例、不吸烟27例。对照组为同期50例健康成年人,其中男23例、女27例,年龄23~78(46.11±15.85)岁,BMI(25.16±3.40)kg/m2,其中吸烟16例、不吸烟34例。 本研究经医院伦理委员会批准,三组均知情同意并签署知情同意书。
1.2各组外周血白细胞端粒酶活性检测①外周血白细胞获取:抽取各组静脉血5 mL,2 500 r/min离心30 min,提取分层中的白细胞,将提取白细胞用PBS 清洗两遍,在显微镜下利用细胞计数板计算单位体积白细胞数。取1×106个细胞,加入200 μL Lysis buffer(凯基生物公司,中国南京),震荡混匀,冰浴30 min。4 ℃、13 000 r/min离心30 min,取上清,液氮急速冷冻后-80℃超低温冰箱保存备用。②白细胞中端粒酶活性检测:采用荧光定量PCR法检测各组外周血白细胞与血浆中的端粒酶活性[6,7],所有操作均严格按照使用说明书进行。端粒酶相关引物 ACX:5′-GCGCGGCTTACCCTTACCCTTACCCTAACC-3′ ;TS:5′-AATCCGTCGAGCAGAGTT-3′,引物均由上海生工生物工程技术服务有限公司合成。反应体系(20 μL):2x SYBR q-PCR Master Mix 10 μL、上游引物TS 1 μL、下游引物ACX 0.5 μL、端粒酶样品5 μL、RNase free water 3.5 μL。反应条件:25 ℃孵育30 min,95 ℃灭活端粒酶5 min,40个循环;95 ℃变性15 s,60 ℃退火30 s;熔解曲线设定为65 ℃、95 ℃。采用CFX96 荧光定量PCR仪(Bio-Rad公司,美国)观察各组白细胞与血浆中Ct值。以Ct值表示端粒酶活性强弱,Ct值大说明端粒酶活性低;Ct值小说明端粒酶活性高。实验重复3次,取平均值。

2 结果
2.1各组白细胞中端粒酶活性A、B、C组外周血白细胞端粒酶活性分别为31.64±1.03、32.22±0.75、33.19±0.95,组间两两比较,P均<0.05。
2.2T1DM患者外周血白细胞端粒酶活性影响因素在三组样本的基本资料对比中,年龄与BMI差异性显著(P均<0.05);性别、患病时间与吸烟情况没有显著性差异(P均>0.05)。 糖尿病多元线性回归分析显示,A组性别、年龄、BMI、患病时间与吸烟情况与外周血白细胞的端粒酶活性均无关(P均>0.05),见表1。B组年龄、BMI、患病时间与外周血白细胞端粒酶活性均无关(P均>0.05);B组性别与吸烟情况与端粒酶活性呈负相关(β=-1.022、-0.714;P均<0.05),见表2。
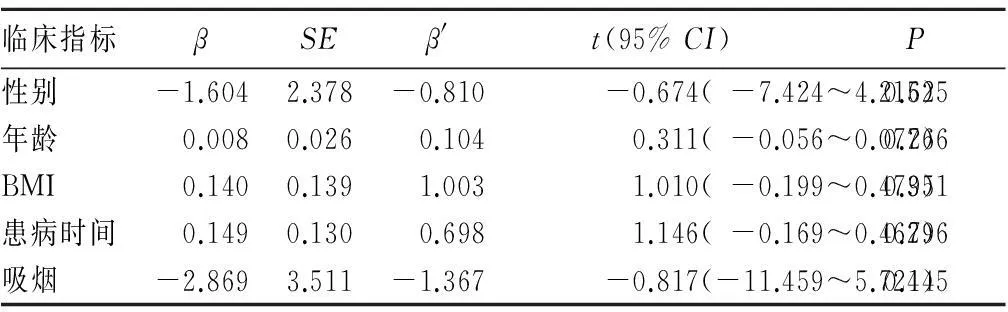
表1 T1DM患者外周血白细胞端粒酶活性影响因素的多元线性回归分析结果
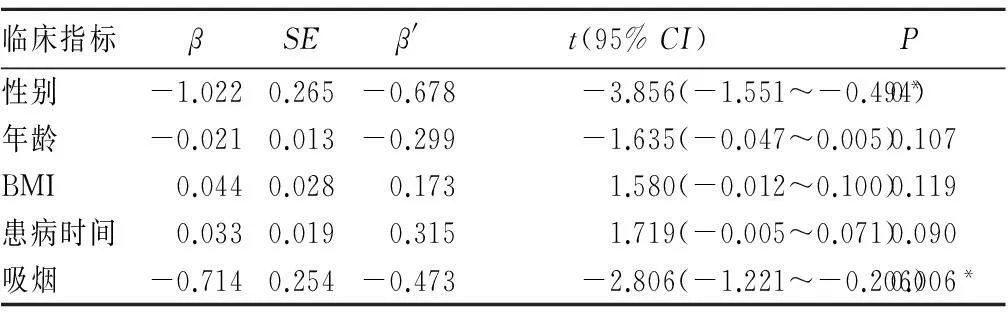
表2 T2DM患者外周血白细胞端粒酶活性影响因素的多元线性回归分析结果
3 讨论
超过90%人类肿瘤组织中均能发现端粒酶活性,而且活性异常,是比较广谱的肿瘤标志物之一,但在大多数正常组织和细胞中并没有发现端粒酶活性[8,9]。研究发现白细胞中也存在端粒酶活性[10],而且在很多疾病中也发现了外周血白细胞的端粒酶活性异常现象,例如白血病、类风湿关节炎、系统性红斑狼疮[11]等。许多疾病的体液中也能检测出端粒酶活性,例如膀胱癌患者的尿液中[12]、肺癌患者的支气管洗液等;并且恶性肿瘤患者的血浆中通常可以检测出端粒酶活性,是由于肿瘤细胞破裂所致,而血浆端粒酶活性也成为恶性肿瘤检测的重要标志物之一。端粒酶活性与端粒长度是密切相关的,二者共同作用与人类身体健康与衰老密切相关。
外周血白细胞端粒酶活性检测的试验中发现,T1DM患者的端粒酶活性要强于T2DM患者,并且二者的白细胞端粒酶活性都强于健康志愿者[15]。表明糖尿病与外周血白细胞的端粒酶活性密切相关,一些研究也发现在缺乏端粒酶的成年小鼠中,会出现血糖耐受量异常的现象。糖尿病患者端粒酶活性异常的作用机制的说法有:氧化应激反应产生的反应性氧族会对DNA造成严重损害,并主要破坏线粒体DNA而产生更多的氧族,从而破坏细胞功能导致端粒酶活性异常;或者糖尿病影响并提高患者外周血白细胞端粒酶活性是为抑制高血糖所致的细胞凋亡[6]。而且T1DM对端粒酶活性的影响更大,T1DM是一种建立在遗传基础之上并与T细胞相关联的自身免疫性疾病,自身T淋巴细胞对胰岛素多种抗原成分出现免疫不耐受,导致T淋巴细胞会攻击胰岛β细胞使其大量凋亡最终导致糖尿病的出现,并且与胰岛细胞相关联的淋巴细胞也会出现异常凋亡现象[13]。T1DM外周血免疫细胞的异常凋亡与端粒长度的减短可能导致了细胞内的端粒酶活性的异常。T2DM与T1DM的发病机制完全不同,T2DM是由于胰岛素缺乏或者胰岛素抵抗而产生的一种代谢性疾病,而长期的代谢紊乱可以导致端粒酶活性的异常,胰岛素抵抗也会增加氧化应激程度导致端粒酶活性的异常出现[14]。推测其原因可能是由于T1DM对人体细胞的破坏程度更大,氧化应激反应与自身免疫反应将会严重影响细胞的端粒酶活性,因此,T1DM患者的端粒酶活性高于T2DM患者;以后还要加大试验量并积极探究影响糖尿病患者端粒酶异常机制。
在T2DM 患者中男性与吸烟患者的外周血白细胞端粒酶活性高于女性与不吸烟者,这可能与男性的不良生活习惯有关,吸烟、喝酒、熬夜、高脂肪摄入等不良的生活习惯会导致机体的代谢紊乱继而影响端粒酶活性;随着年龄的增长,细胞老化、端粒长度减短而细胞进入程序性死亡过程,一般不会引起端粒酶的变化,肥胖是导致糖尿病产生的主要原因,而肥胖也会加重氧化应激反应的程度,BMI的增加会加重糖尿病的病情,对于此次试验的结果在今后的研究中应加大BMI的选择范围与样本量,探究BMI是否对细胞端粒酶活性有影响。
综上所述,糖尿病患者存在外周血白细胞端粒酶活性升高,且T1DM患者外周血白细胞端粒酶升高更明显。糖尿病患者外周血血浆中未见端粒酶活性。性别、吸烟状况是T2DM患者外周血白细胞端粒酶活性的影响因素。
[1] Zakian VA.Structure,function,and replication of Saccharomyces cerevisiae teleromes [J].Annu Rev Genet,1996,30(1):141-172.
[2] Shay JW,Wright WE.Hallmarks of telomeres in ageing research [J].J Pathol,2007,211(2):114-123.
[3] Fyhrquist F,Tiitu A,Saijonmaa O,et al.Telomere length and progression of diabetic nephropathy in patients with type 1 diabetes [J].J Intern Med,2010,267(3):278-286.
[4] Liu ZL,Zhang JH,Yan JT,et al.Leucocyte telomere shortening in relation to newly diagnosed type 2 diabetic patients with depression [J].Oxid Med Cell Longev,2014,2014:1-8.
[5] 程桦.糖尿病[M].7版.北京:人民卫生出版社,2009:365-371.
[6] 蒋玉艳,何敏,杨莉,等.荧光定量PCR法检测肿瘤细胞端粒酶活性的变化[J].现代生物医学进展,2006,6(7):12-16.
[7] Wege H,Chui MS,Le HT,et al.SYBR Green real-time telomeric repeat amplification protocol for the rapid quantification of telomerase activity [J].Nucleic Acids Res,2003,31(2):E3.
[8] 刘莹,董成永,崔晓楠.人端粒酶逆转录酶肿瘤相关反馈调节机制的研究进展[J].大连医科大学学报,2015,37(6):605-609.
[9] Chen W,Chen SM,Yu Y,et al.Telomerase inhibition alters telomere maintenance mechanisms in laryngeal squamous carcinoma cells [J].J Laryngol Otol,2010,124(7):780-783.
[10] Hiyama K,Hirai Y,Kyoizumi S,et al.Activation of telomerase in human lymphocytes and hematopoictic progenitor cells [J].J Immunol,1995,155(8):3711.
[11] Kurosaka D,Yasuda J,Yoshida K,et al.Abnormal telomerase activity and telomere length in T and B cells from patients with systemic lupus erythematosus [J].J Rheumatol,2006,33(6):1102-1107.
[12] Stewart SA,Ben Porath I,Carey VJ,et al.Erosion of the telomeric single-strand overhang at replicative senescence [J].Nature Genet,2003,33(4): 493-496.
[13] 鲁燕,陆轶群,程绪杰,等.1型糖尿病患者外周血白细胞端粒长度的变化及其意义[J].江苏医药,2007,33(2):127-128.
[14] Qinan W,Ling Z,Bing C.The influence of the telomere-telomerase system on diabetes mellitus and its vascular complications [J].Expert Opin Ther Targets,2015,9(6):849-864.
国家自然科学基金资助项目(81472744,81272444)。
钟理(E-mail:lee_z@yahoo.com)
10.3969/j.issn.1002-266X.2016.27.030
R587.1;R363.2
B
1002-266X(2016)27-0085-03
2016-01-28)

