鸭茅香柱菌形态学、生理学及系统发育研究
王正凤,李秀璋,李春杰*
(1.草地农业系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020;2.白银市农业科学研究所,甘肃 白银 730900)
鸭茅香柱菌形态学、生理学及系统发育研究
王正凤1,2,李秀璋1,李春杰1*
(1.草地农业系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020;2.白银市农业科学研究所,甘肃 白银 730900)
本文对新疆鸭茅进行采样调查,发现在鸭茅的分蘖上长有真菌子座,子座圆柱状,成熟期为黄色,表面粗糙,子座长45~55 mm;在PDA培养基上25℃培养2周后,菌落直径45~54 mm,菌落正面白色,棉质,质地紧密,中央隆起或稍有皱褶,背面白色至黄色;菌丝体细长,分枝,分隔,不易产生分生孢子。在受到胁迫时产生孢子,孢子梗长13~33 μm,基部宽2.7~4.1 μm,顶端变尖小于1 μm;分生孢子无色透明,椭圆形或肾形,单个顶生,(4.1±0.5) μm×(2.2±0.5) μm;为典型的Epichloё属真菌。利用碳源能力由强到弱依次为:蔗糖>果糖>葡萄糖>淀粉。利用硝酸铵的能力最强,之后依次为蛋白胨和硝酸钾,具有分解酪蛋白淀粉能力。选择菌株Ed0907,利用rDNA-ITS序列分析构建了系统发育树,结果表明分离菌株(Ed0907)与Epichloёtyphina聚为一枝,相似率为100%。根据以上结果,确定分离菌株为Epichloё真菌。
内生真菌;Epichloё-Dactylisglomerata共生体;培养特征;ITS序列
鸭茅(Dactylisglomerata)又名鸡脚草、果园草,是禾本科疏丛型多年生优质牧草[1],营养丰富,草质柔软,适口性好,产草量高,耐旱、耐热、耐瘠薄以及耐荫能力均较强[2],近年来,鸭茅在我国四川、重庆、山西、甘肃、黑龙江、青海、新疆、陕西、贵州、云南、湖北、吉林、江苏等省广泛栽培应用[3]。据报道,2004年在美国俄勒冈州生产的鸭茅种子几乎均感染香柱菌,由此造成的损失约为820000美元;在法国,被香柱菌侵染的鸭茅在一年或两年后将失去再生产能力;英国一年生的鸭茅发生香柱菌的几率很低,但是二年生和五年生的鸭茅其侵染率分别达到33%和81%[4]。国内有关香柱菌侵染鸭茅的研究鲜见于报道。
香柱菌(Epichloё)是一类侵染禾本科植物的麦角菌科的内生真菌, 其主要分布于宿主禾草地上部分,往往与宿主形成较为稳定的互惠共生关系。携带这类真菌的大部分宿主禾草可产生大量的吲哚乙酸、麦角缬氨酸和波胺等次级代谢物,增加宿主分蘖数,促进禾草生长,提高宿主禾草抗病虫、抗食草动物等[5-6]。在一些生长环境条件下,部分Epichloё属真菌在宿主禾草分蘖上产生子座,阻碍该分蘖的抽穗和结实,严重影响种子发育[7]。
目前,已报道Epichloё属真菌共有43种[15],中国7种,我国内生真菌资源较为丰富,仍有许多未知内生真菌有待于进一步挖掘[15-16]。Li等[17]首次从分布于新疆的鸭茅叶鞘上发现了香柱菌形成的子座,并对其形态特征进行了初步报道。本文以这一内生真菌菌株为研究材料,对其形态学、生理学特征及系统发育学进行深入研究,为香柱菌与鸭茅的共生机制及其这一真菌资源的有效利用提供基础。
1 材料与方法
1.1材料
2009年在新疆阿勒泰地区采集叶鞘上长有真菌子座的鸭茅。将植物样品从茎基部剪断,取其地上部分,样品于4℃低温保存备用。
1.2香柱菌属真菌的分离、培养和保存
将植物样品组织切成小段(5 mm),经NaClO(1%)消毒后置于PDA 培养基上,培养皿置于25℃培养箱中培养3~7 d。待组织切口处长出菌丝,及时转接至新鲜PDA培养基上培养,重复纯化4次以上,然后接到试管斜面放入4℃冰箱保存。
1.3香柱菌属真菌分类学及生理学特征研究
香柱菌在PDA平板上25℃培养3周后,用灭菌的打孔器(孔径6 mm)在培养基的周围新鲜菌丝上打孔,将菌饼接入盛有PDA、不同的碳源(蔗糖、果糖、葡萄糖和淀粉)、氮源(硝酸钾、硝酸铵和蛋白胨)、淀粉-牛奶平板培养基的培养皿(9 cm)上,每皿接一个菌饼(设置3个重复),25℃培养3周。采用十字法测量菌落直径大小,测定该菌对4种碳源、3种氮源的利用情况,分解酪蛋白和淀粉的能力。使用SPSS 17.0软件对数据进行分析。
1.4目的DNA序列的测序和系统发育学分析
将rDNA-ITS序列PCR产物交由上海美吉生物医药科技有限公司进行测序,引物为ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)和ITS5 (5′-GGAAGTAAAAGTCGTAACAAGG-3′)。获得序列后,在GenBank中 BLAST进行同源性搜索,从中调出与该序列相似性较高的核酸序列。使用Clustal X(1.83)软件进行多重序列匹配排列和聚类分析,使用 Mega 6.0软件,采用最大似然法(maximum likelihood)构建系统发育树,并通过自举分析(bootstrap)进行置信度检测,自举数据集为1000次。
2 结果与分析
2.1真菌在植物中的形态特征
鸭茅的部分分蘖上长有真菌的子座(图1A, B, C)。子座包裹着叶鞘,阻碍了宿主植物花序的生长,子座为黄色,表面粗糙,子座长45~55 mm;茎髓部菌丝体细长,粗细均匀,略带弯曲,很少分叉(图1D)。所发现的鸭茅群落中,长有子座的植株较少。
2.2真菌的形态特征
从形成子座的鸭茅上分离的香柱菌属真菌,在PDA培养基上25℃培养2周后,菌落直径45~54 mm,正面白色,棉质,质地紧密,中央隆起或稍有皱褶,背面白色至黄色;菌丝体细长,分枝,分隔(图2A, B, C)不易产生分生孢子。在受到胁迫时产生孢子,孢子梗长13~33 μm,基部宽2.7~4.1 μm,顶端变尖小于1 μm;分生孢子无色透明,舟形或肾形,单个顶生,(4.1±0.5) μm×(2.2±0.5) μm(图2D)。
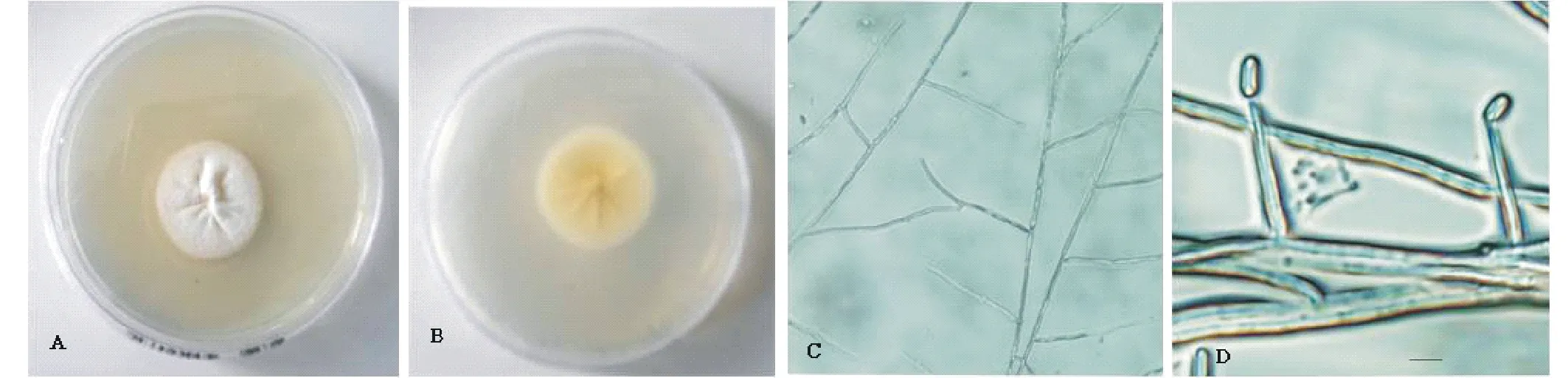
图2 从鸭茅中得到的真菌菌落及培养特征Fig.2 Colony characteristics of fungal isolate from glomerata A:菌落正面 Obverse of the colony; B:菌落背面 Reverse of the colony; C:菌丝体 Hyphae; D:分生孢子梗和分生孢子(标尺=5 μm) Conidiophores and conidia (Scale=5 μm).
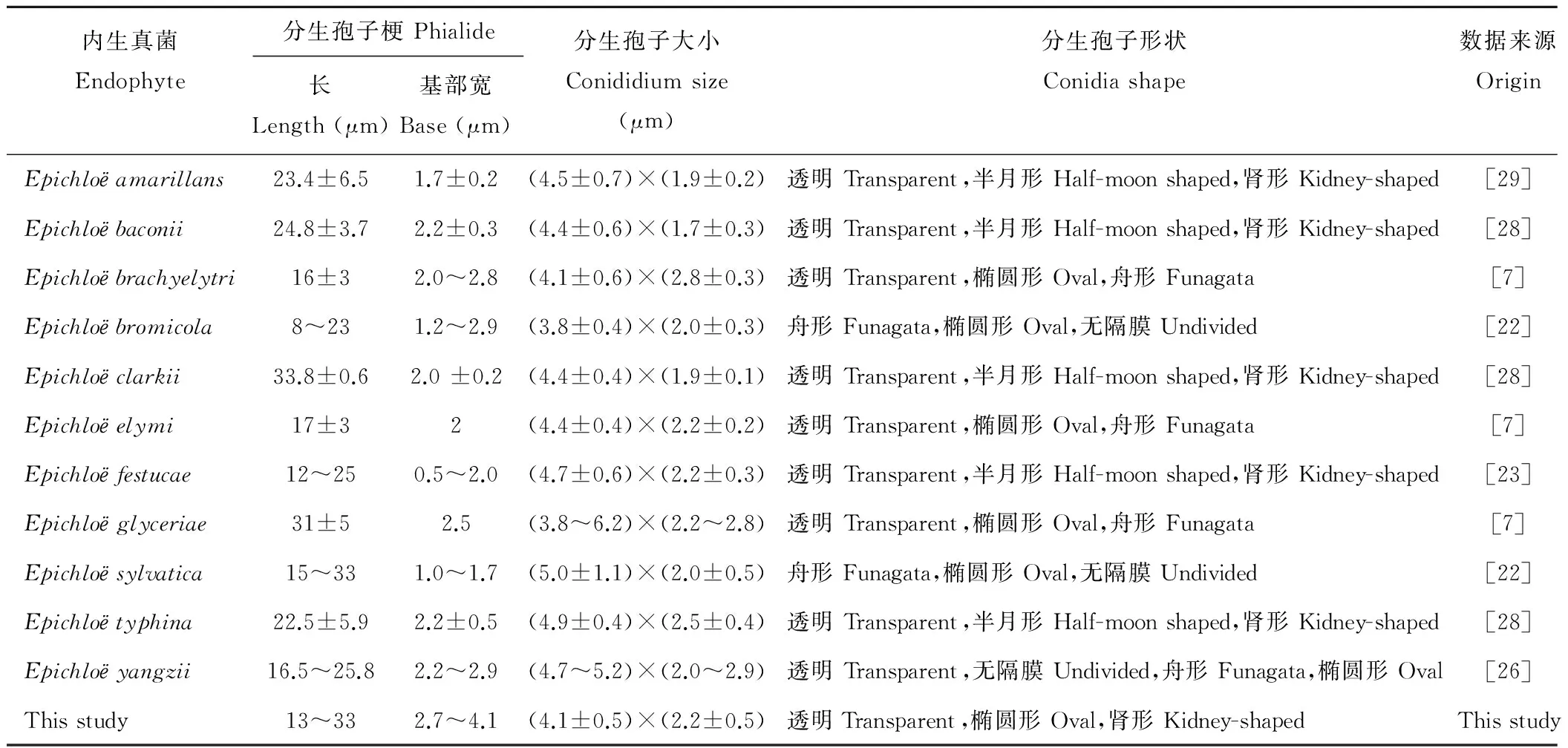
内生真菌Endophyte分生孢子梗Phialide长Length(μm)基部宽Base(μm)分生孢子大小Conididiumsize(μm)分生孢子形状Conidiashape数据来源OriginEpichloёamarillans23.4±6.51.7±0.2(4.5±0.7)×(1.9±0.2)透明Transparent,半月形Half-moonshaped,肾形Kidney-shaped[29]Epichloёbaconii24.8±3.72.2±0.3(4.4±0.6)×(1.7±0.3)透明Transparent,半月形Half-moonshaped,肾形Kidney-shaped[28]Epichloёbrachyelytri16±32.0~2.8(4.1±0.6)×(2.8±0.3)透明Transparent,椭圆形Oval,舟形Funagata[7]Epichloёbromicola8~231.2~2.9(3.8±0.4)×(2.0±0.3)舟形Funagata,椭圆形Oval,无隔膜Undivided[22]Epichloёclarkii33.8±0.62.0±0.2(4.4±0.4)×(1.9±0.1)透明Transparent,半月形Half-moonshaped,肾形Kidney-shaped[28]Epichloёelymi17±32(4.4±0.4)×(2.2±0.2)透明Transparent,椭圆形Oval,舟形Funagata[7]Epichloёfestucae12~250.5~2.0(4.7±0.6)×(2.2±0.3)透明Transparent,半月形Half-moonshaped,肾形Kidney-shaped[23]Epichloёglyceriae31±52.5(3.8~6.2)×(2.2~2.8)透明Transparent,椭圆形Oval,舟形Funagata[7]Epichloёsylvatica15~331.0~1.7(5.0±1.1)×(2.0±0.5)舟形Funagata,椭圆形Oval,无隔膜Undivided[22]Epichloёtyphina22.5±5.92.2±0.5(4.9±0.4)×(2.5±0.4)透明Transparent,半月形Half-moonshaped,肾形Kidney-shaped[28]Epichloёyangzii16.5~25.82.2~2.9(4.7~5.2)×(2.0~2.9)透明Transparent,无隔膜Undivided,舟形Funagata,椭圆形Oval[26]Thisstudy13~332.7~4.1(4.1±0.5)×(2.2±0.5)透明Transparent,椭圆形Oval,肾形Kidney-shapedThisstudy
本文分离的菌株与已经报道的Epichloё属菌株的形态特征比较结果显示,从鸭茅子座分离的真菌是典型的Epichloё属真菌,但此菌株在形态上与已报到的菌株有一定的差异。分离的菌株可以从不同的特征方面与已报到的11个香柱菌加以区别(表1):该菌的分生孢子梗和分生孢子与Epichloёclarkii、Epichloёsylvatica、Epichloёglyceriae这三种相近,与其他种类相差较大。此外,不同Epichloё属菌株分生孢子的形状各异,主要为透明椭圆形、舟形、肾形、半月形,本文分离的菌株分生孢子形状为透明椭圆形和肾形。
2.3真菌的生理学特征
从表2可以看出,本文所分离的Epichloё真菌对碳源利用能力由强到弱依次为:蔗糖>果糖>葡萄糖>淀粉。5种Epichloё内生真菌对蔗糖的利用能力最强,本文所分离的Epichloё真菌和Epichloёtyphina香柱菌对果糖的利用能力大于葡萄糖,其他3种香柱菌利用葡萄糖的能力大于果糖。无论何种碳源,本文所分离得到的香柱菌利用碳源能力均高于其他种类。由此可以看出,不同种类的香柱菌对碳素营养的利用能力各不相同。对于分解淀粉和酪蛋白的能力也存在差异,本文从鸭茅子座分离的Epichloё真菌与其他3种香柱菌(Epichloёbaconii、Epichloёclarkii、Epichloёtyphina)分解酪蛋白和淀粉能力(酪蛋白>淀粉)相似。这反映了它们在生理适应与宿主是紧密相关的。
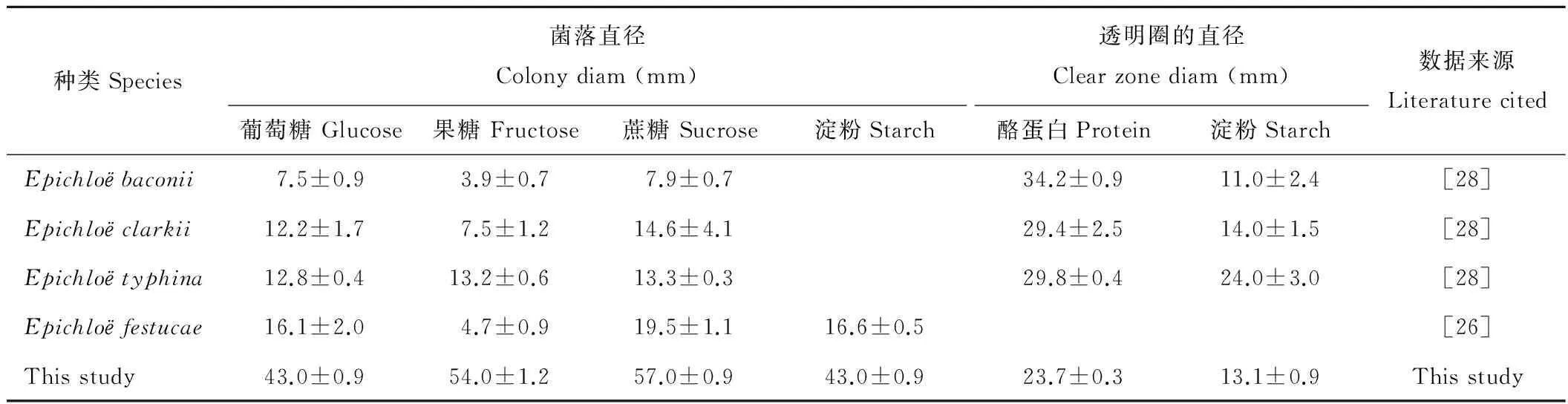
表2 部分香柱菌属真菌培养特征比较Table 2 Cultural characters of Epichloё sp.
由表3可知,不同Epichloё真菌对氮源的利用也存在一定的差异性,醉马草、高羊茅、羊茅内生真菌利用蛋白胨的能力最强,其次为硝酸钾,利用硝酸铵的能力很小,甚至于不能利用,而从鸭茅子座分离的Epichloё真菌恰恰相反,其利用硝酸铵的能力最强,依次为蛋白胨和硝酸钾。
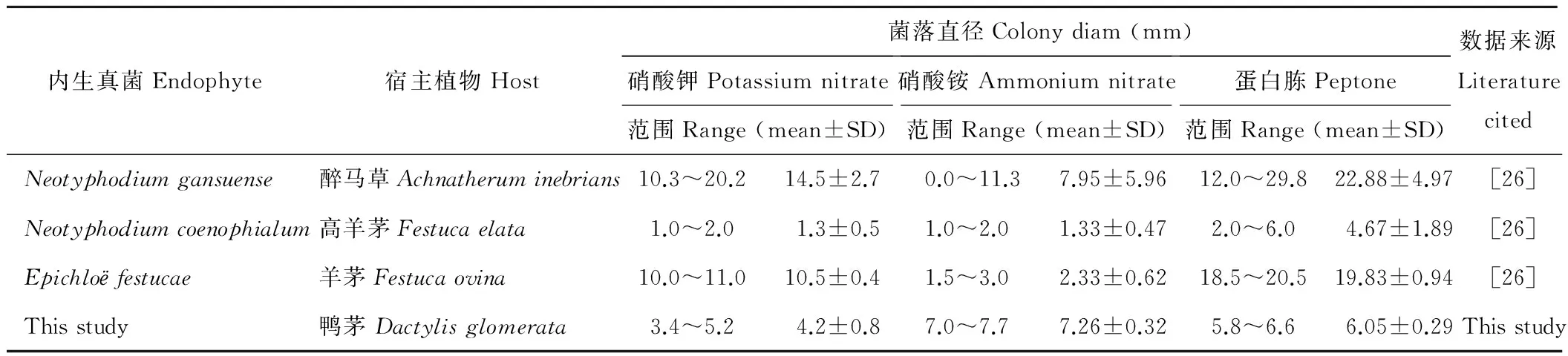
表3 部分内生真菌利用氮源特征比较Table 3 Morphological characters of Epichloё sp. growth on different nitrogen sources
2.4分离菌株的分类学鉴定
将测序结果在NCBI/GenBank 数据库中进行Blast比对,结果表明菌株(Ed0907)与Epichloёtyphina(LN714543)聚为一枝,相似率为100%,这表明这两个真菌亲缘关系十分接近(图3)。综合外部形态、菌落、显微形态特征与ITS基因序列分析结果,将菌株Ed0907初步鉴定为子囊菌门Ascomycota、肉座菌目Hypocreales、麦角菌科Clavicipitaceae、香柱菌属的Epichloёtyphina。

图3 根据rDNA-ITS序列进行构建的鸭茅香柱菌最大简约系统发育树Fig.3 The maximum parsimony tree based on rDNA-ITS sequences of Epichloё endophyte with Dactylis glomerata 分支上的数字代表该分支的自展支持率(bootstrap值,1000次重复,显示>50%)。The number on each branch denotes bootstrap value (>50%, 1000 replication).
3 讨论
鸭茅近年来在我国被广泛栽培应用,张盼盼等[18]对新疆昭苏种马场阿克达拉草原和昭苏小洪纳海禁牧草场的鸭茅带菌率进行了检测,结果发现这两个地方的鸭茅种子糊粉层和种皮带菌率检测结果也各不相同,分别为48.40%,42.90%和83.90%,70.00%,同一种属的不同地理位置检测到的感染率不同。
但有关新疆分布的鸭茅属植物Epichloё属的真菌形态、生理及系统发育学方面没有报道。本研究首次从我国新疆分布的鸭茅中发现并分离得到了Epichloё属真菌[17],内生真菌在鸭茅植株上形成的子座、体内形态及分离的植株形态学特征均呈现典型的Epichloё属真菌特征,与其他各地鸭茅属植物中分离的菌株形态特征类似。本研究发现的鸭茅香柱菌的子座长达45~55 mm。调查发现,香柱菌子座长约5~10 cm,未成熟时呈浅绿色,成熟时的子囊孢子呈橘黄色[19-21]。Alderman等[22]调查发现鸭茅Epichloёtyphina子座长为150~200 mm。
本文从鸭茅分离的真菌菌株(Ed0907)分生孢子梗长为13~33 μm;分生孢子大小(4.1±0.5) μm×(2.2±0.5)μm(表1),已报到的Epichloё属真菌的分生孢子梗长度为15~76 μm;分生孢子大小为(5.0±1.1) μm±(1.7±0.25) μm,本文所分离地菌株与Epichloё属真菌的变幅近似。由此可见,宿主植物的分类地位及分布地区在Epichloё属真菌的鉴定中起着很重要的作用,来自不同宿主植物的菌株往往自成一种[23]。例如,来自欧洲和北美洲的Agrostis属植物中的Epichloё属真菌在形态上及遗传上存在明显不同,因此分别被鉴定为E.baconii和E.amarillans。E.typhina是目前发现的该属内分布最广[24],宿主植物种类最多的一个种[17],但与本试验所得菌株相比,在形态和生理学上也存在差异(表2,表3),呈现出了内生真菌形态的多样性[25]。
本研究所得的菌株(Ed0907)对碳源利用范围比较广,己糖、二糖、多糖都可以利用,而利用蔗糖的能力比较强(表2);对于氮源来说,利用硝酸铵的能力最强,之后依次为蛋白胨和硝酸钾(表3),与Kulkarni和Nielsen[27]将31种碳源对E.coenophiala(N.coenophialum)的利用能力筛选和Li等[26]对羊茅香柱菌研究结果基本一致。
从鸭茅中分离到的Epichloё菌株(Ed0907)分解酪蛋白的能力强于分解淀粉的能力,White等[28-30]对E.baconii、E.clarkii、E.typhina三种菌分解淀粉以及酪素结果表明,E.baconii分解酪素能力显著强于E.clarkii、E.typhina种,而分解淀粉的能力较低。E.mollis(N.typhinum)可形成子座的菌系从植物获取果糖和葡萄糖的能力显著强于那些不形成子座的菌系(P<0.05)。Li等[26]对羊茅香柱菌研究结果表明,乳糖的促进作用显著高于其他碳源;蛋白胨可显著促进甘肃内生真菌、高羊茅内生真菌和羊茅香柱菌3种内生真菌的生长。White等[30]对E.baconii、E.clarkii、E.typhina三种菌分解淀粉以及酪蛋白结果表明,E.baconii分解酪素能力显著强于E.clarkii、E.typhina种,而分解淀粉的能力较低。本试验结果表明,菌株(Ed0907)分解酪蛋白的能力低于前3种,而其分解酪素的能力强于分解淀粉的能力。
本研究从采自我国新疆鸭茅中分离得到的一株内生真菌(Ed0907),采用形态学与分子生物学方法对其鉴定。菌株形态学特征包括生长速度、菌落特征、分生孢子特征等呈现香柱菌属(Epichloё)真菌特征,基于获得的ITS基因序列测定结果在NCBI上的同源性比对,同时结合基于ITS序列构建的系统发育树结果得出,该菌株与香柱菌(Epichloёtyphina)高度聚类,相似性达100%。因此根据菌株形态学特征、系统发育学分析,将菌株Ed0907鉴定为香柱菌属的Epichloёtyphina。
References:
[1]Li X F, Ding H. Orchard-grass (Dactylisglomerata) biological characteristics and cultivation techniques. Journal of Henan Forestry Science and Technology, 2000, 20(3): 24-25.
[2]Peng Y, Zhang X Q. Progress on physiology, ecology and reproduction ofDactylisglomerata. Acta Prataculturae Sinica, 2005, 14(4): 8-14.
[3]Chao X R, Song L L, Hu X R,etal. High efficiency induction of multiple shoots from orchard-grass (DactylisglomerataL.) and regeneration of salt-tolerant plantlets. Shandong Agricultural Science, 2005, 1: 7-10.
[4]Pfender W F, Alderman S C. Regional development of orchard-grass choke and estimation of seed yield loss. Plant Disease, 2006, 90: 240-244.
[5]Gentile A, Rossi M S, Cabral D. Origin, divergence, and phylogeny ofepichloё endophytes of native Argentine grasses. Molecular Phylogenet Evolution, 2005, 35(1): 196-208.
[6]Schardl C L, Young C A, Pan J,etal. Currencies of mutualisms: sources of alkaloid genes in vertically transmittedEpichloae. Toxin, 2013, 5: 1064-1088.
[7]Schardl C L, Leuchtmann A, Spiering M J. Symbioses of grasses with seed borne fungal endophytes. Annual Review of Plant Biology, 2004, 55: 315-340.
[9]Leyronas C, Raynal G. Role of fungal ascospres in the infection of orchard-grass (Dactylisglomerata) byEpichloёtyphinaagent of choke disease. Journal of Plant Pathology, 2008, 90(1): 15-21.
[10]Leyronas C, Raynal G. Role of fungal ascosporesin infection of orchard-grass (Dactylisglomerata) byEpichloёtyphinaagent of choke disease. Cryptogamie Mycologie, 2008, 29: 11-17.
[11]Large E C. Surveys for choke (Epichloёtyphina) in cocksfoot seed crops 1951-1953. Plant Pathology, 1954, 3: 6-11.
[12]Hoffman G D, Rao S. Fertilization ofEpichloёtyphinastromata by mycophagous slugs. Mycologia, 2014, 106(1): 1-7.
[13]Alderman S C. Survival, germination, and growth ofEpichloёtyphinaand significance of leaf wounds and insects in infection of orchard-grass. Plant Disease, 2013, 97: 323-328.
[14]Ji C D, Zhou Y Y. Effects of interaction between endophyte fungi andDactylisglomerateon the salt resistance of host plants. Journal of Anhui Agriculture Science, 2015, 43(5): 109-112.
[15]Leuchtmann A, Bacon C W, Schardl C L,etal. Nomenclatural realignment ofNeotyphodiumspecies with genusEpichloё. Mycologia, 2014, 106: 202-215.
[16]Li X Z, Yao X, Li C J,etal. Potential analysis of grass endophytesNeotyphodiumas biocontrol agents. Chinese Journal of Plant Ecology, 2015, 39(6): 621-634.
[17]Li C J, Wang Z F, Chen N,etal. Report of choke disease caused byEpichloёtyphinaon orchard grass (Dactylisglomerata) in China. Plant Disease, 2009, 93(6): 673 (DOI: 10.1094/PDIS-93-6-0673B).
[18]Zhang P P, Shi C, Li G Z,etal. Microscopic detection of endophytic fungus carrying rate from wild and lawn gramineous grasses in Xinjiang. Chinese Agricultural Science Bulletin, 2013, 29(19): 35-38.
[19]Kirby E J M. Host-parasite relations in the choke disease of grasses. Transactions of the British Mycological Society, 1961, 44: 493-503.
[20]Bucheli E, Leuchtmann A. Evidence for genetic differentiation between choke-inducing and asymptomatic strains of theEpichloё grass endophyte fromBrachypodiumsylvaticum. Evolution, 1996, 50(5): 1879-1887.
[21]Pfender W F, Alderman S C. Geographical distribution and incident of orchard-grass choke, caused byEpichloёtyphina, in Oregon. Plant Disease, 1999, 83: 33-35.
[22]Alderman S C, Pfender W F, Welty R E,etal. First report of choke, caused byEpichloёtyphina, on orchard-grass in Oregon. Plant Disease, 1997, 81: 1335.
[23]Leuchtmann A, Schardl C L. Mating compatibility and phylogenetic relation ships among two new species ofEpichloё and other congeneric European species. Mycological Research, 1998, 102: 1169-1182.
[24]Jin W J, Li C J, Wang Z F. Research advances on diversity of grassEpichloё endophytes. Acta Prataculturae Sinica, 2015, 24(1): 168-175.
[25]Western J F, Cavett J J. The choke of cocksfoot (Dactylisglomerata) caused byEpichloёtyphina(Fr.) Tul. Trans. Br. mycology. Science, 1959, 42:298-307.
[26]Li C J, Nan Z B, Li F. Biological and physiological characteristics ofNeotyphodiumgansuensesymbiotic withAchnatheruminebrians. Microbiological Research, 2007, 163: 431-440.
[27]Kulkarni R K, Nielsen B D. Nutritional requirements for growth of a fungus endophyte of tall fescue grass. Mycologia, 1986, 78: 781-786.
[28]White J F. Endophyte-host associations in grasses. XIX. A systematic study of some sympatric species ofEpichloё in England. Mycologia, 1993, 85: 444-455.
[29]White J F. Endophyte-host associations in grasses. XX. Structural an dreproductive studies ofEpichloёamarillanssp. nov. and comparisons toE.typhina. Mycologia, 1994, 86: 571-580.
[30]White J F, Morgan-Jones G, Morrow A C. Taxonomy, life cycle, reproduction and detection ofAcremoniumendophytes. Agricultural Ecosystem Environment, 1993, 44: 13-37.
[1]李先芳, 丁红. 鸭茅生物学特性及栽培技术. 河南林业科技, 2000, 20(3): 24-25.
[2]彭燕, 张新全. 鸭茅生理生态及育种学研究进展. 草业学报, 2005, 14(4): 8-14.
[3]晁相蓉, 宋玲玲, 胡孝瑞, 等. 鸭茅高效丛生芽体系的建立及耐盐植株的再生. 山东农业科学, 2005, 1: 7-10.
[14]姬承东, 周芸芸. 内生真菌-鸭茅互作对宿主植物抗盐性的影响. 安徽农业科学, 2015, 43(5): 109-112.
[16]李秀璋, 姚祥, 李春杰, 等. 禾草内生真菌作为生防因子的潜力分析. 植物生态学报, 2015, 39(6): 621-634.
[18]张盼盼, 施宠, 李桂真, 等. 新疆几种野生禾草和草坪禾草的内生真菌带菌率检测. 中国农学通报, 2013, 29(19): 35-38.
[24]金文进, 李春杰, 王正凤. 禾草内生真菌的多样性及意义. 草业学报, 2015, 24(1): 168-175.
*Morphological, physiological and phylogenetic characteristics ofEpichloё endophyte associated withDactylisglomerata
WANG Zheng-Feng1,2, LI Xiu-Zhang1, LI Chun-Jie1*
1.StateKeyLaboratoryofGrasslandandAgro-ecosystems,CollegeofPastoralAgricultureScienceandTechnology,LanzhouUniversity,Lanzhou730020,China; 2.AgricultureScienceInstituteofBaiyin,Baiyin730900,China
Surveys conducted in Xinjiang revealed aDactylisglomeratapopulation infected byEpichloё endophyte. The conidial stroma on the grass tillers were waxy, yellow and 45-55 mm in length. The endophyte was isolated and incubated on PDA (potato dextrose agar) medium for two weeks at 25℃. The diameter of colonies ranged from 45-54 mm. They were compact, centrally raised with a white cottony mass of aerial hyphae and white to yellow on the underside. Hyphae were long with septum and conidia very sparse unless the colony was stressed. Conidiophores were hyaline, smooth, 13-33 μm long, 2.7-4.1 μm at base and less than 1.0 μm at the tip. Conidia were hyaline, oval to reniform and size ranged; (4.1±0.5) μm×(2.2±0.5) μm. These dimensions are typical ofEpichloё endophytes. The preference of these isolatedEpichloё endophytes for carbon source was sucrose>fructose>glucose>starch and for nitrogen sources, ammonium nitrate>peptone>potassium nitrate. These isolations exhibited differences in the hydrolysis of casein and starch. ITS sequence of isolation-Ed0907 was analysis and the phylogenetic tree constructed; it showed that the tested isolation clustered withEpichloё typhina with 100% similarity rate. Based on these morphological, physiological and phylogenetic characteristics, the endophyte isolated fromD.glomeratawas identified asEpichloё spp.
endophyte;Epichloё-Dactylisglomeratasymbionts; culture character; ITS sequence
10.11686/cyxb2015419
http://cyxb.lzu.edu.cn
2015-09-07;改回日期:2015-11-02
国家973计划课题(2014CB138702)和国家自然科学基金项目(31372366)资助。
王正凤(1983-),女,甘肃靖远人,农艺师,硕士。E-mail:wangzhengfeng222@163.com
Corresponding author. E-mail: chunjie@lzu.edu.cn
王正凤,李秀璋,李春杰. 鸭茅香柱菌形态学、生理学及系统发育研究. 草业学报, 2016, 25(6): 118-125.
WANG Zheng-Feng, LI Xiu-Zhang, LI Chun-Jie. Morphological, physiological and phylogenetic characteristics ofEpichloё endophyte associated withDactylisglomerata. Acta Prataculturae Sinica, 2016, 25(6): 118-125.

