紫外光诱导氧合型肌红蛋白氧化反应及机理
曹洪玉 高凌星 唐 乾 苏晋红 郑学仿,,,*(大连大学生命科学与技术学院,辽宁大连66;大连大学环境与化学工程学院,辽宁大连66;大连大学,辽宁省生物有机化学重点实验室,辽宁大连66)
紫外光诱导氧合型肌红蛋白氧化反应及机理
曹洪玉1,3高凌星2唐乾1,3苏晋红2郑学仿1,2,3,*
(1大连大学生命科学与技术学院,辽宁大连116622;2大连大学环境与化学工程学院,辽宁大连116622;3大连大学,辽宁省生物有机化学重点实验室,辽宁大连116622)
肌红蛋白通常在无光条件下可进行输氧、储氧等重要功能,实验中我们发现紫外光照射可促进氧合肌红蛋白(MbO2)的氧化反应,证实其在光照时部分生理功能会发生变化。紫外-可见(UV-Vis)吸收光谱数据显示,光照射时MbO2的Soret带最大吸收波长蓝移、Q吸收带544和580 nm处还原峰强度下降,说明紫外光光照促进O2解离,MbFe(II)可被氧化至MbFe(III)。四种波长光对光照氧化的影响程度为254 nm>280 nm> 430 nm>409 nm;通入CO气体时氧合肌红蛋白较难发生光照氧化反应,即Fe的第六配位强度影响反应程度;溶液中的H+或OH-对光照氧化反应有促进作用;254、280 nm波长光照射时,苯丙氨酸(Phe)、酪氨酸(Tyr)、色氨酸(Trp)三种游离氨基酸均促进光照氧化反应的进行,而409、430 nm波长光照射时三种游离氨基酸对光照氧化反应的影响较小。以上数据表明体内光诱导MbO2氧化反应过程中蛋白质内的Fe(II)能否被光照激发形成未成对电子处于激发态是O2离去和二价铁被氧化的关键。
氧合肌红蛋白;紫外光;游离氨基酸;光照氧化;光谱法
[Article]
www.whxb.pku.edu.cn
1引言
生物进程中,血红素蛋白具有输氧、储氧或电子传递等重要的功能1,2,其结构及配体结合动力学过程成为当前研究重点3-6。血红素辅基具有特殊的共轭和金属配位结构,可吸收特定波长的光,改变血红素电子激发态,并进一步影响蛋白功能,目前光照射血红素类蛋白的研究也逐渐受到关注7-12。Mb在肌肉组织中扮演着重要的生理角色,如细胞内氧气的供应,促进O2从细胞外围到线粒体末端的运输等13,14。Mb轴向配体的光解离反应动力学同样引起了相当多的关注,Nollmann和Etchegoin15及Etchegoin等16曾分别用共振拉曼光谱和表面增强拉曼谱对光诱导的血红蛋白的去氧进行了研究,Franzen等17曾报道Mb激发态弛豫过程涉及两个中间体MbI*和MbII*,MbI*是MLCT血红素的激发态,MbII*是LMCT血红素的激发态。荧光技术研究了光诱导肌红蛋白去氧的过程,结果表明光照量增强时,去氧量增大,光照时温度越高,去氧速率越快18,整个光解过程受到温度、溶剂粘性、激发光强度和激发波长的影响19;利用紫外-可见光可以诱导高铁肌红蛋白、细胞色素C的还原反应20-22,反应会受试剂、pH值、温度、时间、气体、氨基酸等因素的影响23。但根据我们目前所查阅的文献情况,肌红蛋白紫外-可见光照射下可引发的氧化反应尚缺乏实验报道和机理阐释,体液中的游离氨基酸是否影响光照肌红蛋白氧化还原反应?因此本实验利用UV-Vis吸收光谱、荧光光谱、圆二色谱(CD)方法研究了溶液中不同紫外定波长、pH值、氨基酸以及不同气体等对光诱导氧化的影响,通过检测血红素中心铁原子价态、蛋白构象的变化,来阐明MbO2光照氧化的潜在机制。
2 实验部分
2.1试剂与仪器
仪器:紫外可见分光光度计(V-560,日本Jasco公司),荧光分光光度计(FP-5600,日本Jasco公司),圆二色分光光度计(J-810,日本Jasco公司),制冷和加热循环器(F-12,德国Julabo公司,实验室pH计(PHSJ-4A,上海雷磁分析仪器厂),实验用光源为荧光分光光度计氙灯。
试剂:马心肌红蛋白样品(购自美国Sigma公司),UV-Vis吸收光谱特征表明全部为高铁肌红蛋白,将其溶解在pH=7.4的PB缓冲溶液(0.05 mol∙L-1)中,用过量的连二亚硫酸(0.1 mol∙L-1)将其还原,过量的连二亚硫酸钠通过透析的方法除去,用紫外吸收法测定其浓度。酪氨酸、色氨酸、苯丙氨酸分别溶解在0.05 mol∙L-1的PB缓冲溶液中配置成浓度均为0.01 mol∙L-1的氨基酸溶液,实验用水为去离子水。
2.2实验方法
2.2.1UV-Vis吸收光谱
将已经处理好的样品置于1 cm石英比色池中进行测定,测定条件为:狭缝宽度为2 nm,扫描波长范围为220-700 nm,扫描速率为200 nm∙min-1,响应时间中等。
2.2.2CD光谱
将已经处理好的样品置于1 mm石英比色池中进行CD光谱测定,测定条件为:狭缝宽度1 nm,扫描波长范围为190-50 nm,扫描速率为50 nm∙min-1,响应时间为2 s,累计次数3次。
3 结果与讨论
3.1MbO2的化学氧化与光照氧化
图1A是MbO2的紫外-可见吸收光谱变化曲线,曲线a→f是氧化剂铁氰化钾对MbO2紫外-可见吸收光谱的影响,在MbO2溶液中加入铁氰化钾(MbO2与铁氰化钾的摩尔比为1.5:1)时,其Q带544、580 nm处吸收峰消失,Soret带416 nm处吸收峰蓝移至409 nm处,505、630 nm处出现新的吸收峰,即MbO2被完全氧化为氧化态。
通入恒定N2气流、避光90 min后MbO2的特征吸收峰强度有轻微的变化(图S1见Supporting Information),但经254 nm波长紫外光照射1.5 h后(图1B),随着光照时间的增加,MbO2蛋白的Soret带特征吸收416 nm处,吸收峰强度升高并蓝移至409 nm处;Q带544和580 nm处吸收峰强度有一定的降低,而在503和630 nm附近处出现两个新峰,并且吸收峰强度逐渐增强,与未光照时相比发生了明显的变化,说明氙灯254 nm光诱导的氧化反应与加入氧化剂铁氰化钾的效果相同。

图1 氧化剂与氙灯光照对MbO2的紫外-可见吸收光谱的影响Fig.1 Effects of oxidizing agent and irradiation of xenon lamp on UV-Vis absorption spectra of MbO2(A)oxidizing agent potassium ferricyanide;(B)254 nm irradiation of xenon lamp. a→f:MbO2added potassium ferricyanide(0,0.2,0.6,1.0,1.4,1.6)×10-8mol∙L-1,respectively.
3.2光照氧化的波长选择
为研究紫外波段光源照射MbO2的氧化情况,我们选用FP-6500型荧光光谱仪上氙灯的不同定波长来光照MbO2蛋白溶液。MbO2样品在不同定波长(254,280,409和430 nm)氙灯光照后,其Soret带416 nm处吸收峰强度增大并发生蓝移,在Q带544和580 nm处吸收峰强度降低,503和630 nm处吸收峰强度增强,随着光照时间增加,503 nm处峰面积在不断增大(见图2)。在不同定波长的光照射下,Q带的峰面积变化也不相同,其中在254 nm光照射下544和580 nm处吸收峰面积降低的趋势最大,即氧化产物MbFe(III)最多。由于metMb三价铁结合水的吸收峰在409 nm处,二价铁离子还原态在430 nm处,且430 nm波长光为MbO2的最佳激发波长19,O2解离后五配位的二价铁易于吸收430 nm波长光。由此可见,四种波长光对光照氧化的影响程度为254 nm>280 nm>430 nm> 409 nm。铁卟啉可吸收上述四种波长的光,但吸收后,铁卟啉被激发后所处的激发态不同,后期过程的能量转移途径不同,因此对氧化还原的影响程度不同,高能量的254和280 nm波长光使卟啉处于激发态,能量和电子在卟啉内转移,会促使铁氧化过程发生,虽然430和409 nm波长光处于卟啉的强吸收带Soret带,但由于吸收后电子转移能力较差,铁不易被氧化。

图2 不同定波长氙灯光照射MbO2后吸收峰面积随时间变化图Fig.2 Peak area changes of MbO2irradiation with time by xenon lamp at different fixed wavelengths (A)area changes at 544 nm;(B)area changes at 580 nm;pH=7.4
3.3氨基酸对光照氧化的影响
芳香族游离氨基酸的紫外吸收在200-300 nm波长区域,为此我们选取300-650 nm光谱范围来研究光照射时氧合肌红蛋白的变化,从而排除游离氨基酸的光吸收对所测得MbO2光谱产生光谱叠加的干扰。避光条件下,游离氨基酸与MbO2作用1 h后的紫外-可见吸收光谱,相较于未加入氨基酸的MbO2,五条谱线完全重合(图S3),这表明未光照时游离的氨基酸与MbO2的化学反应基本不存在。在相同定波长光照射下,由于不同种类的游离氨基酸所含原子基团、表面电荷以及对光的选择吸收的不同,会对MbO2的光诱导氧化产生不同影响。图3(A,B)分别为254、280 nm波长光照射加入Trp、Tyr和Phe的MbO2的紫外-可见吸收光谱。254 nm波长光照射加入三种氨基酸的MbO2蛋白溶液1 h后,Soret带416 nm处吸收峰蓝移程度变大,Q带544和580 nm处吸收峰强度下降十分明显,且在Phe和Tyr存在下,MbFe(II)已被完全氧化为MbFe(III);280 nm波长光照射时,加入Phe、Tyr和Trp的MbO2蛋白溶液,其MbFe(II)均已被完全氧化为MbFe(III);而在409 nm(图S4)、430 nm (图S4)波长光照射时,氨基酸对光照氧化反应几乎没影响。在有色游离氨基酸存在时,254和280 nm波长光激发致使氧化程度增强可能有两个途径:途径一是光激发有色氨基酸,氨基酸进行能量传递至铁卟啉;途径二是氨基酸被光激发后产生氨基酸自由基形式,进一步激发卟啉形成自由基。芳香族氨基酸在409、430 nm波长处无紫外吸收,在此波长光照射下氨基酸不被激发,因而对光照氧化反应进程无影响。氨基酸实验也进一步证明,较低能量激发卟啉,卟啉自由基电子能量较低难以激发Fe的电子致激发态,Fe(II)能否被光照激发形成未成对电子处于激发态是O2离去和二价铁被氧化的关键。
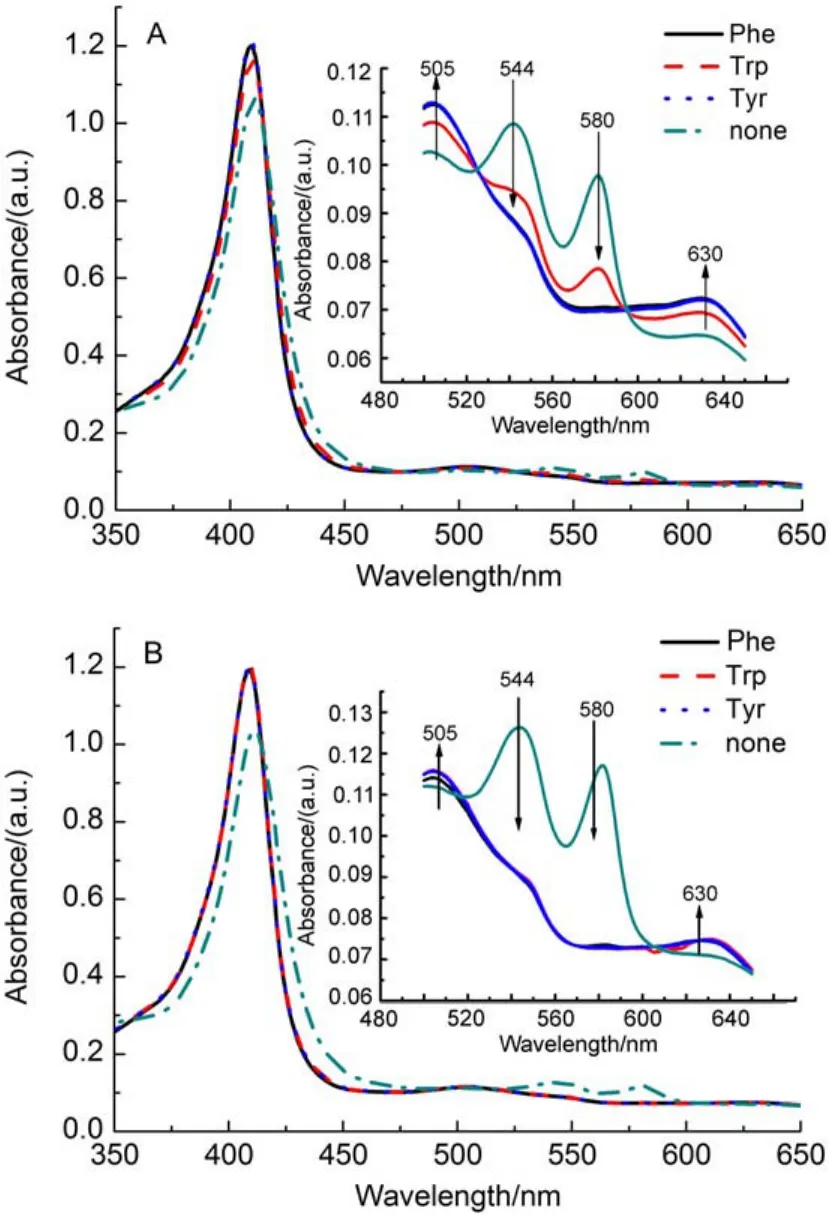
图3 加入不同氨基酸光照射MbO2后的紫外-可见吸收光谱Fig.3 UV-Vis absorption spectra of MbO2with different amino acids after irradiation (A)254 nm irradiation of xenon lamp; (B)280 nm irradiation of xenon lamp
3.4气体、pH值对光照氧化过程的影响
处于还原态的MbO2蛋白溶液不稳定,易被空气中的氧化物缓慢氧化,CO可以与还原态肌红蛋白结合,不与高铁肌红蛋白结合。图4是不同气体存在条件下光照引起MbO2氧化的结果,通入N2和O2均可促进光照氧化,且O2>N2>空气。通入CO后,促使O2离去之后,不发生光照氧化反应,而是CO与空位Fe(II)发生配位反应20,使得Soret带发生红移,是因为Fe的第六配位强度影响反应程度,促使反应向配位反应进行,而不发生二价铁的氧化反应。
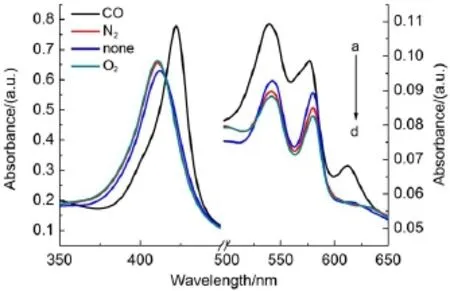
图4 不同气体对光氧化MbO2的影响Fig.4 Effects of different gases on the photo oxidation of MbO2a→d:MbO2irradiated with 1 h were saturated with CO,none,N2,O2, respectively;254 nm irradiation of xenon lamp
metMb在低pH时是水合的,即aqua-形式,在pH 5.5→4.0时,蛋白质随着pH值继续降低,氨基酸基团质子化造成了血红素结合位点的改变,并使蛋白质构象发生了巨大的改变24;但在pH达到9.0时溶液中氢氧根浓度足够大,从而取代了原来血红素中第六配位的水进行配位,即hydroxide-形式,pH值大于9.0时,肌红蛋白还易形成二聚体,为此我们考查了pH值为5.5、6、7.4、8.0的缓冲溶液中MbO2光照氧化情况。MbO2蛋白溶液在恒定N2气流下避光静置1.5 h后(图S2),pH值为7.4、8.0时其特征吸收峰强度无变化,pH为6.0时其特征吸收峰强度相对于另外两种pH值有微小变化,但总体来讲避光条件下pH对MbO2蛋白溶液无影响。图5为不同pH值下MbO2蛋白在254 nm波长氙灯照射下,544和580 nm处吸收峰面积随照射时间变化图。光照1.5 h后544和580 nm处吸收峰强度降低,pH为7.4时两处吸收峰面积均比pH为5.5、6.0或8.0时下降程度小,说明偏酸、偏碱性条件均有利于光照氧化的发生。
3.5MbO2光照氧化二级结构的变化
蛋白质是由氨基酸通过肽键连接而成的具有特定结构的生物大分子,在蛋白质或多肽中,主要的光活性基团是肽链骨架中的肽键、芳香族氨基酸残基及二硫桥键。远紫外区CD光谱反应肽键的圆二色性,因此,根据所测得蛋白质或多肽的远紫外CD光谱,能反映出蛋白质或多肽链二级结构的信息25。如图6A所示,在靠近192 nm有一正的谱带,在222和208 nm处表现出两个负的特征肩峰谱带,这是典型的α-螺旋结构蛋白质的CD光谱特征。随着光照时间增加,192 nm正吸收峰与208和222 nm处表现出的两个负吸收峰的强度减小,但形状和肩峰的位置未发生明显改变,这说明光照氧化MbO2引起其二级结构的变化。图6B为加入氨基酸并光照1 h后的远紫外CD光谱,MbO2的结构变化不是很大,和未加氨基酸光照1 h后的CD曲线基本重合,这说明在整个光照氧化过程中MbO2结构的改变是由光照引起的,而不是和氨基酸直接作用发生的,这也说明氨基酸在MbO2的光照氧化过程中是间接影响光照氧化的。

图6 氙灯光照射MbO2的圆二色(CD)光谱图Fig.6 Circular dichroism(CD)spectra of MbO2after irradiation of xenon lamp (A)irradiation by 254 nm xenon lamp;(B)added different amino acids with 254 nm irradiation. a→d:the irradiation time was 0,0.5,1,and 1.5 h,respectively.
3.6光诱导MbO2氧化反应机制
通过以上实验数据分析我们可推出MbO2的光照氧化的可能机理,Fe(II)的d电子组成为d6,未光照时,Fe(II)电子组态处于强场,可以提供d轨道与O2的孤电子对形成配位键,以携带储存氧气;光照使铁卟啉至激发态,Fe(II)电子组态处于弱场,成对电子被激发后Fe上d轨道电子处于自旋多重态,Fe电子占据铁的空轨道,空轨道减少,配位键减弱,氧气离去。处于多重态的五配位的Fe(II)电子转移至卟啉,形成卟啉自由基,Fe(II)被氧化为Fe(III)。通入CO后,Fe(II)与CO配位能力较强,且CO因含有π键,Fe被激发后的电子可能转移到CO的LUMO轨道,因此CO较难离去,Fe无法将电子转移至卟啉,从而光照氧化还原反应难以进行,证实了步骤(I)的推测(如图7所示)。

图7 MbO2光诱导氧化机理Fig.7 Photo oxidation mechanism for MbO2
409和430 nm波长光照射氧化能力不如254和280 nm,说明409和430 nm波长光虽然是卟啉环Soret带最大吸收峰波长,但卟啉吸收致激发态后总能量较低,难以使Fe(II)达到高自旋状态,因而Fe(II)难以被氧化,而254和280 nm波长光被卟啉吸收后可以发生配体-金属电荷转移(LMCT),使Fe至激发态。卟啉自由基不稳定,进一步激发溶液中的H2O产生∙H和OH-,在偏酸或偏碱性条件下,∙H和OH-分别被溶液中的OH-和H+破坏,光照反应右移氧化程度增大,我们的pH实验证实了此步骤机理(II)的推测(见图7)。光照后蛋白质的二级结构也发生了变化,随着光照氧化时间增加,MbFe(III)含量升高。这是因为MbFe(II)是六配位结构较为稳定,蛋白α-螺旋含量较高,而MbFe(III)是五配位结构,Fe与四个N原子不在同一平面上,光照致使卟啉环平面变化,进而影响了蛋白的二级结构,同时CD数据表明,MbO2蛋白溶液在光照氧化过程中并未变性,说明整个过程中蛋白三维结构将发生变化,协助O2离去、Fe被氧化过程,并适应以上过程中铁卟啉的结构变化。
4 结论
通过光谱法研究光诱导氧合型肌红蛋白的氧化反应,结果表明不同定波长、pH值以及气体、游离有色氨基酸等外界因素对光氧化MbO2均有影响。254、280 nm波长光能量较高,照射较易激发铁卟啉进而进行光照氧化过程,卟啉Soret带最大吸收波长光被吸收后较难激发铁卟啉;pH在偏酸性或偏碱性条件下均对MbO2的光照氧化较有利;加入游离有色氨基酸对光照氧化反应的影响程度取决于紫外光的波长;通入N2、O2均可促进光照氧化,通入CO后,不发生光照氧化反应,而是CO与Fe(II)发生配位反应,CO不易离去,致使光照氧化反应难以进行。通过CD光谱分析发现,光诱导促进MbO2氧化反应进行后,蛋白肽链伸展结构增加,色氨酸所处的微环境极性增加,α-螺旋含量降低,蛋白在结构上也适应光照氧化反应的过程。数据表明体内光诱导MbO2氧化反应过程中蛋白质内的Fe(II)能否被光照激发形成未成对电子处于激发态是O2离去和二价铁被氧化的关键。以上实验结果与方法将有助于深入的了解光照射对生物体内血红素蛋白结构及功能的影响,在生理学和医学上具有重要的价值。
Supporting Information:avaliable free of charge via the internet at http://www.whxb.pku.edu.cn.
References
(1)Wittenberg,J.B.;Wittenberg,B.A.Annu.Rev.Biophys. Biophys.Chem.1990,19,217.doi:10.1146/annurev. bb.19.060190.001245
(2)Takahashi,E.;Endoh,H.;Doi,K.Biophys.J.2000,78,3252. doi:10.1016/S0006-3495(00)76861-5
(3)Brunori,M.Trends Biochem.Sci.2001,26,209.doi:10.1016/ S0968-0004(01)01824-2
(4)Cossins,A.;Berenbrink,M.Nature 2008,454,416.doi: 10.1038/454416a
(5)Kachalova,G.S.;Popov,A.N.;Bartunik,H.D.Science 1999, 284,473.doi:10.1126/science.284.5413.473
(6)Chu,K.;Vojtchovsky,J.;McMahon,B.H.;Sweet,R.M.; Berendzen,J.;Schlichting,I.Nature 2000,403,921.doi: 10.1038/35002641
(7)Bazin,M.;Pierre,J.;Debey,P.;Santus,R.Eur.J.Biochem. 1982,124,539.doi:10.1111/j.1432-1033.1982.tb06627.x
(8)Sakai,H.;Onuma,H.;Umeyama,M.;Takeoka,S.;Tsuchida, E.Biochemistry 2000,39,14595.doi:10.1021/bi0014204
(9)Liang,X.Q.;Chen,G.F.;Zhang,X.;Liu,S.L.;Li,G.X. Photo-Chem.Photobiol.B 2008,90,53.doi:10.1016/j. jphotobiol.2007.11.001
(10)Vorkink,W.P.;Cusanovich,M.A.Photochem.Photobiol. 1974,19,205.doi:10.1111/php.1974.19.issue-3
(11)Masuda,T.;Minemura,A.;Yamauchi,K.;Kondo,M.J.Radiat Res.1980,21,149.doi:10.1269/jrr.21.149
(12)Winterle,J.S.;Einarsdóttir,Ó.Photochem.Photobiol.2006, 82,711.doi:10.1562/2005-09-14-RA-684
(13)Wittenberg,J.B.Physiol.Rev.1970,50,559.
(14)Scholander,P.F.Science 1960,131,585.doi:10.1126/ science.131.3400.585
(15)Nollmann,M.;Etchegoin,P.Spectrochimica Acta Part A 2000, 56,2817.doi:10.1016/S1386-1425(00)00384-X
(16)Etchegoin,P.;Liem,H.;Maher,R.C.;Cohen,F.;Brown,R.J. C.;Milton,M.J.T.;Gallop,J.C.Chem.Phys.Lett.2003,367, 223.doi:10.1016/S0009-2614(02)01705-0
(17)Franzen,S.;Kiger,L.;Poyart,C.;Martin,J.L.Biophys.J. 2001,80,2372.doi:10.1016/S0006-3495(01)76207-8
(18)Ma,J.Y.;Zheng,X.F.;Guo,M.;Tang,Q.;Ma,J.;Gao,D.B.; Hu,J.H.Science in China Series B 2008,51,414.
[马君燕,郑学仿,郭明,唐乾,马静,高大彬,胡皆汉.中国科学B辑,2008,51,414.]doi:10.1007/s11426-008-0014-7
(19)Zhou,H.W.;Cao,H.Y.;Tang,Q.;Ma,J.Y.;Zhang,Y.Y.; Zheng,X.F.Chem.Res.Chin.Univ.2011,27(6),1060.
(20)An,L.M.;Cao,H.Y.;Tang,Q.;Zheng,X.F.Chin.J.Inorg. Chem.2012,28,1461.
[安良梅,曹洪玉,唐乾,郑学仿.无机化学学报,2012,28,1461.]
(21)Liu,Y.W.;Cao,H.Y.;Tang,Q.;Zheng,X.F.Acta Chimica Sinica 2014,72(2),246.
[刘艳伟,曹洪玉,唐乾,郑学仿.化学学报,2014,72(2),246.]doi:10.6023/A13101029
(22)Zhou,H.W.;Cao,H.Y.;Tang,Q.;An,L.M.;Zheng,X.F. Acta Chimica Sinica 2011,69(13),1559.
[周华伟,曹洪玉,唐乾,安良梅,郑学仿.化学学报,2011,69(13),1559.]
(23)Cao,H.Y.;Liu,Y.W.;Zhao,J.M.;Guo,X.J.;Zheng,X.F. Protein&Peptide Letters 2015,22,853.doi:10.2174/ 0929866522666150707115231
(24)Zhang,Y.J.;Tang,Q.;Cao,H.Y.;Zheng,X.F.Acta Phys.-Chim.Sin.2013,29(8),1785.
[张玉姣,唐乾,曹洪玉,郑学仿.物理化学学报,2013,29(8),1785.] doi:10.3866/PKU.WHXB201305271
(25)Huang,H.C.;Jiang,Z.F.;Zhu,H.J.Chemistry 2007,70,501.
[黄汉昌,姜招峰,朱宏吉.化学通报,2007,70,501.]
Mechanism of Oxymyoglobin Oxidation Reaction Induced by Ultraviolet Light
CAO Hong-Yu1,3GAO Ling-Xing2TANG Qian1,3SU Jin-Hong2ZHENG Xue-Fang1,2,3,*
(1College of Life Science and Biotechnology,Dalian University,Dalian 116622,Liaoning Province,P.R.China;2College of Environmental and Chemical Engineering,Dalian University,Dalian 116622,Liaoning Province,P.R.China;3Liaoning Key Laboratory of Bio-Organic Chemistry,Dalian University,Dalian 116622,Liaoning Province,P.R.China)
Myoglobin(Mb)achieves its biological functions such as oxygen transfer and storage in the dark. In this research,we found that UV light irradiation could promote oxidation of ferroporphyrin,which significantly affected the physiological function of oxymyoglobin(MbO2).The blue shift of the Soret band and decreased intensities of Q-band reduction peaks at 544 and 580 nm observed in UV-Vis absorption spectra revealed that UV light could promote O2dissociation,and consequently MbFe(II)was oxidized to MbFe(III).The effect sequence of wavelength on the strength of this photo-oxidation was 254 nm>280 nm>430 nm>409 nm.CO could inhibit the photo-oxidation process,indicating that the strength of the sixth coordination bond of Fe with a gas molecule influences the degree of photo-oxidation.The H+and OH-in the solution could also promote the photo-oxidation process.Irradiated by 254 and 280 nm light,free amino acids phenylalanine(Phe),tyrosine (Tyr),and tryptophan(Trp)promoted the light oxidation reaction.Meanwhile,irradiation with 409 and 430 nm light had less influence on the UV-light-induced oxidation reaction under the same conditions.The results illustrated that in photo-induced oxidation of MbO2,the formation of an excited state of Fe(II)with unpairedelectrons upon irradiation is crucial process for O2dissociation and Fe(II)oxidation.
November 9,2015;Revised:December 28,2015;Published on Web:January 4,2016.*Corresponding author.Email:dlxfzheng@126.com;Tel:+86-411-87402343. The project was supported by the National Natural Science Foundation of China(21571025,21271036)and Science&Technology Project Department of Education,Liaoning Province,China(L2013470,L2013471).
Oxymyoglobin;UV light;Free amino acid;Photo oxidation;Spectrometry
O641
10.3866/PKU.WHXB201601046
国家自然科学基金(21571025,21271036)和辽宁省教育厅科学技术研究项目(L2013470,L2013471)资助

