基于1H NMR技术的急性腐蹄病奶牛血清代谢组学分析
郑家三,张洪友,夏 成,徐 闯,王洪斌
(1.东北农业大学动物医学学院,黑龙江哈尔滨150030;2.黑龙江八一农垦大学动物科技学院,黑龙江大庆163319)
基于1H NMR技术的急性腐蹄病奶牛血清代谢组学分析
郑家三1,2,张洪友2,夏成2,徐闯2,王洪斌1
(1.东北农业大学动物医学学院,黑龙江哈尔滨150030;2.黑龙江八一农垦大学动物科技学院,黑龙江大庆163319)
通过1H核磁共振(1H NMR)技术结合主成分分析(PCA)和正交偏最小二乘判别分析法(OPLS-DA),分别分析奶牛在患有急性腐蹄病时内源性代谢产物的变化,研究腐蹄病的发生对奶牛代谢过程的影响,寻找差异表达的代谢物.运用1H NMR技术获得两组奶牛血清代谢谱.所采集的数据经过模式分析获得差异代谢物.结果急性腐蹄病组与健康对照组相比,奶牛血清内差异性代谢物为21个.结果显示,在奶牛发生腐蹄病时体内糖类、氨基酸、脂类和能量代谢均发生了改变.表明结合1H NMR谱检测分析的急性腐蹄病组对照组比对的差异代谢物,全景式地揭示了腐蹄病发生过程中奶牛机体内发生了广泛的代谢紊乱,为今后深入探究腐蹄病的发病机理和新的防治策略奠定了基础.
腐蹄病;代谢组学;核磁共振波谱;多元统计分析
尽管在奶牛酮病、乳热、脂肪肝和真胃变位等研究中均有利用代谢组学的1H NMR技术的相关报道,且关于腐蹄病奶牛血清的蛋白组学的多项检测研究也有报道[1-2],但关于急性期奶牛腐蹄病的血清代谢组学的研究报道也尚未发现.因此,本试验首次应用1H NMR技术探讨奶牛发生急性腐蹄病时的血清代谢组学的变化,为深入探究奶牛腐蹄病发生的新机制和寻求新的生物标识物奠定了基础.
1 材料与方法
1.1试验动物选择和分组在黑龙江省暴发急性腐蹄病的某牧场进行样品采集,3~5岁且产2~ 3胎的经产荷斯坦奶牛作为试验对象,其中10头奶牛为急性腐蹄病组(F组),10头奶牛为健康对照组(C组).试验组选取标准:患病奶牛出现跛行,且呈急性经过(病程为1~3 d),并通过PCR方法验证患蹄趾间棉拭子采样样品中有坏死杆菌白细胞毒素基因存在,从而确诊奶牛患有急性腐蹄病.本试验中两组奶牛饲喂全混日粮,其日粮组成如本实验室另一研究中所示[6].清晨空腹采集奶牛尾静脉血液样本后,4℃下以3 000 r/min离心10 min.上清液贮存于-80℃检测待用.
1.2样品采集和血清1H NMR检测1H NMR的血清代谢谱检测:血清样品4℃下以12 000 r/min离心10 min.每份样品抽取200 μL上清液与150 μL磷酸盐缓冲液(pH值7.4)和150 μL三甲硅烷基丙磺酸钠(TSP,1 mg/mL)混合后,经12 000 r/min(4℃)离心10 min,取500 μL上清液转移至5 mm核磁共振管.在280 k下,利用Bruker Avance 500 MHz超导核磁共振谱仪上记录所有的1H NMR谱.
1.31H NMR数据处理和统计分析1H NMR数据进行傅里叶变换后,导入TopSpin软件(V3.0 BRUKER BIOSPIN,德国)中对所有谱图信号基线校正并以TSP出峰位置定为δH 0.00[3].利用R(http://www. cran.r-project.org)软件包将所有样品光谱数据的积分区间设置为δ 0.4-8.0积分间距为δ 0.003,并去掉δ 4.2-8.0包含残余的水峰.采用SIMCA-P+软件(V13.0 Umetrics AB,于默奥,瑞典)进行主成分分析法(PCA)和正交偏最小二乘判别分析(OPLSDA).利用Chenomx NMR Suite 7.5软件(Chenomx Inc.,埃德蒙顿,加拿大),并结合以为文献进行代谢物归属.应用SPSS软件(SPSS,Inc.,芝加哥,美国)单因素方差分析对差异代谢物进行统计分析,整个研究过程中阈值P值设定为0.05.
2 结果
2.1两组血清样品的1H NMR谱图1显示了两组具有代表性的血清样品1H NMR.主要包括酮体、氨基酸物质、有机酸、碳水化合物和脂蛋白等.之后通过多元统计分析对二组数据进行进一步的统计分析.图中代谢物的数据列于表1.
2.2多元统计分析首先进行的PCA分析(图2a),获得了两个主成分(PC1与PC2),贡献率分别为PC1=43.91%和PC2=14.49%,且R2X=0.79,Q2= 0.75.而后使用第一组分和第二正交组分构建OPLS-DA模型.基于OPLS-DA,其得分图(图2b)中腐蹄病和对照组(C)比较得到R2X=79.1%,Q2=75.4.由图2b可见,两组沿t[1]已达到最大化的差异,说明奶牛腐蹄病组的血清代谢轮廓与对照组存在明显差异.

图1 通过1H NMR仪器检测的获得的腐蹄病组(F)和对照组(C)中具有代表性的样品图谱
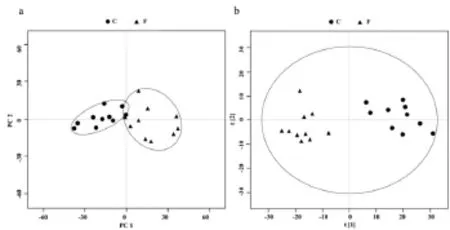
图2 (a)两组的奶牛血清1H NMR数据的PCA得分图;(b)两组的奶牛血清1H-NMR数据的OPLS-DA得分图腐蹄病组(F);方块(■);对照组(C);三角形(▲)
OPLS-DA模型的血清载荷图3a和3b(δ 0.4-2.5和δ 2.6-4.2)显示了组间的代谢物变化,显示不同组间差异代谢物上调或下调的表达变化,该结果列于表1.通过对标准化的NMR数据进行t检验,二组间中丙酮酸、肌氨酸、乳酸、琥珀酸和缬氨酸水平差异显著(P<0.05).根据鉴定的差异代谢物进行代谢通路分析,腐蹄病奶牛的代谢通路主要参与了氨基酸、糖和脂代谢中.图中代谢物的数据列于表1.
3 讨论
1H NMR技术已经成为反刍动物疾病诊断和鉴定的强有力工具,利用该技术对奶牛酮病、乳热和脂肪肝等疾病的研究提供了一定的理论基础[3-5].本试验中显示在急性腐蹄病发生时奶牛体内氨基酸、糖类和脂类等多个代谢通路发生了改变.
3.1氨基酸代谢异常甘氨酸、丝氨酸、缬氨酸以及其代谢中间体(3-羟基异丁酸)是机体内糖异生代谢途径中主要的代谢产物[6].而由丙酮酸合成的丙氨酸,是机体内肌肉组织中最重要的能量来源之一.以往研究中均报道过腐蹄病奶牛因蹄部疼痛而出现跛行和采食量下降等问题.但是在本试验中的腐蹄病奶牛呈现急性病程,疾病组奶牛并未出现采食量下降.基于此原因并结合1H NMR试验结果,证实糖异生底物的缺乏是奶牛突发腐蹄病的发病机制之一.

图3 两组的奶牛血清1H NMR数据(3a,δ 0.4-2.5;3b,δ 2.6-4.2)的OPLS-DA载荷图

表1 三组间差异代谢物的表达变化
肌酸在机体内具有重要的生物学作用,不仅能够促进细胞内三磷酸腺苷(ATP)的合成,也在尿素循环中参与代谢[7].腐蹄病组奶牛血清中肌酸含量的降低进一步说明奶牛发生急性腐蹄病时机体内能量利用增多.
以往的研究中指出1-甲基组氨酸与机体内炎症、氧化应激和能量蛋白的过度消耗具有密切的关系.而3-甲基组氨酸作为肌动蛋白和肌球蛋白甲基化的产物,是肌肉蛋白质分解的代谢指标[8].本试验中腐蹄病奶牛血清中1-甲基组氨酸和3-甲基组氨酸的变化,提示奶牛发生腐蹄病时膳食蛋白摄入出现不足.
3.2碳水化合物代谢异常本试验结果显示,腐蹄病组奶牛的血清样本中葡萄糖和丙酮酸含量与对照组相比均下降.葡萄糖通过糖酵解途径产生ATP,也能在有氧条件下转化为丙酮酸后进一步转化为乙酰辅酶A进入三羧酸(TCA)循环.奶牛发生腐蹄病时,机体内因糖原分解、糖酵解和TCA循环发生改变,也导致ATP合成减少,因此机体内通过增加乳酸水平而通过糖酵解增加ATP的产生[9].
作为磷酸甘油的衍生物,1,3-二磷酸甘油酸、2-磷酸甘油酸,2,3-二磷酸甘油酸和3-磷酸甘油酸,是糖酵解途径中重要的代谢中间体[10].琥珀酸不仅能够在呼吸链中传递电离子,也在TCA循环中具有重要作用.本试验中腐蹄病奶牛血清的甘油和琥珀酸含量较低,提示奶牛出现了糖代谢紊乱.
3.3脂代谢异常肉碱在脂肪酸代谢途径中,促进脂肪动员而进一步为机体供能[11].但促进脂肪酸代谢的同时,也释放出大量游离脂肪酸进入血液和肝脏.而酮体(即乙酰乙酸、3-羟基丁酸和丙酮)是脂肪酸在肝脏进行分解代谢的中间产物,若肝中合成酮体的量超过肝外组织利用酮体的能力,将导致体内酮体含量增多.腐蹄病奶牛血清中肉碱水平的下降,提示奶牛发生腐蹄病时增强了脂肪酸转运至线粒体;而腐蹄病组血清中乙酰乙酸和丙酮含量的增多也进一步说明机体内脂肪酸合成的增强.
4 结论
本试验应用基于1H NMR检测技术的代谢组学方法阐述奶牛急性腐蹄病的发病机理.急性腐蹄病奶牛与对照组奶牛血清代谢谱进行比较,分析差异代谢物,揭示了腐蹄病与机体内氨基酸代谢、糖代谢和脂代谢途径的内在联系,并将差异代谢物与以往的研究进行比较研究.
[1]Sun D,Zhang H,Guo D,et al.Shotgun Proteomic Analysis of Plasma from Dairy Cattle Suffering from Footrot:Characterization of Potential Disease-Associated Factors[J].Plos One,2013,8(2).
[2]郑家三,舒适,夏成,等.基于双向凝胶电泳/基质辅助激光解析离子化飞行时间质谱技术的腐蹄病奶牛血浆蛋白质组学轮廓分析[J].中国生物制品学杂志,2015,28(7).
[3]Xu C,Sun L W,Xia C,et al.1H-Nuclear Magnetic Resonancebased Plasma Metabolic Profiling of Dairy Cows with Fatty Liver [J].Asian Australasian Journal of Animal Sciences,2015.
[4]Sun L W,Zhang H Y,Wu L,et al.(1)H-Nuclear magnetic reso⁃nance-based plasma metabolic profiling of dairy cows with clini⁃cal and subclinical ketosis[J].Journal of Dairy Science,2014,97 (3):1552-1562.
[5]Sun Y,Xu C,Li C,et al.Characterization of the serum metabolic profile of dairy cows with milk fever using1H-NMR spectroscopy [J].Veterinary Quarterly,2014,34(3):159-163(5).
[6]Gerich J E,Meyer C,Woerle H J,et al.Renal gluconeogenesis: its importance in human glucose homeostasis[J].Diabetes Care,2001,24(2):382-391.
[7]Wei D D,Ge-Dong,Guo P P,et al.A bird's eye view of anisatin induced convulsive seizures in brain by a1H NMR based metabol⁃ic approach[J].Molecular Biosystems,2014,10(11):2923-2934.
[8]Sjolin J,Stjernstrom H,Henneberg S,et al.Evaluation of urinary 3-methylhistidine excretion in infection by measurements of 1-methylhistidine and the creatinine ratios[J].American Journal of Clinical Nutrition,1989,49(1):62-70.
[9]Carpenter K L H,Jalloh I,Hutchinson P J.Glycolysis and the sig⁃nificance of lactate in traumatic brain injury[J].Frontiers in Neu⁃roscience,2015,9:112.
[10]Sass J O,Fischer K,Wang R,et al.D-glyceric aciduria is caused by genetic deficiency of D-glycerate kinase(GLYCTK) [J].Human Mutation,2010,31(12):1280-1285.
[11]Ferrari R,Merli E,Cicchitelli G,et al.Therapeutic effects of L-carnitine and propionyl-L-carnitine on cardiovascular diseases:a review[J].Annals of the New York Academy of Sciences,2004,1033(1):79-91.
Serum Metabolites in Dariy Cow with AcuteFootrot Using1H NMR based Metabonomics
ZHENG Jia-san1,2,ZHANG Hong-you2,XIA Cheng2,XU Chuang2,WANG Hong-bin1
(1.College of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China; 2.College of Animal Science and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319,China)
Through the application of biological1H nuclear magnetic resonance(1H NMR)technique combined with the princi⁃pal component analysis(PCA)and orthogonal partial least-squares discriminant analysis(OPLS-DA),changes of endogenous me⁃tabolites of cows with acute footrot were analyzed to study the effects of footrot on cow metabolic process,and find the different me⁃tabolites.The serum metabolic profiles of the two groups were obtained by1H NMR.The collected data were analyzed with the mode analysis to get different metabolites.Compared with the healthy control group,21 different metabolites were obtained in foot⁃rot group.The cows with footrot had altered carbohydrate,amino acid,lipid,and energy metabolic pathways.The results show that1H NMR spectra combined with pattern recognition technique can effectively get the different metabolites of diagnosing footrot in cows,and reveal the widely metabolic disorder in cows in the process of footrot,which lays the foundation for the exploration of footrot mechanism in the future.
Footrot;Metabolomics;Nuclear Magnetic Resonance Spectrum
WANG Hong-bin
S852.5+3
A
0529-6005(2016)06-0007-03
2016-02-24
黑龙江省自然科学基金(C201229);"十二五"农村领域国家科技课题(2012BAD12B05-2);国家科技支撑计划(2013BAD21BO1)
郑家三(1978-),男,副教授,博士生,从事临床兽医学研究,E-mail:595095793@qq.com
王洪斌,E-mail:hbwang@ncau.edu.cn

