乳酸菌素分离纯化和特性及在食品领域的应用研究进展
杜静芳,缪璐欢,白凤翎,励建荣
(渤海大学食品科学与工程学院,辽宁省食品安全重点实验室, 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013)
乳酸菌素分离纯化和特性及在食品领域的应用研究进展
杜静芳,缪璐欢,白凤翎*,励建荣
(渤海大学食品科学与工程学院,辽宁省食品安全重点实验室, 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013)
乳酸菌素是由某些乳酸菌核糖体合成的对相同或相近生境微生物具有拮抗作用的一类多肽、蛋白质类次级代谢产物,作为天然生物防腐剂已用于食品防腐保鲜领域。经过硫酸铵沉淀、凝胶层析和高效液相色谱等分离纯化流程获取乳酸菌素,进而对其热稳定性、pH适应性和分子量等进行分析,其中,乳酸菌素纯化技术是限制其研究和应用的技术瓶颈。本文对近几年乳酸菌素分离纯化如硫酸铵沉淀(ASP)、细胞吸附和解吸(ADPC)、甲醇丙酮萃取(MAE)、凝胶过滤层析(GFC)、阳离子交换色谱(CEC)、琼脂糖凝胶电泳(SP-SFF)和反向液相色谱(RP-HPLC)等技术及其综合运用进行比较分析,并对乳酸菌素性质研究和在食品领域的应用进展进行综述,为开发高效乳酸菌生物保护剂提供借鉴与参考。
乳酸菌素,分离纯化,特性,食品防腐剂,应用
乳酸菌(lactic acid bacteria,LAB)是一类能利用碳水化合物形成乳酸为主要代谢产物的革兰氏阳性细菌的通称。它们天然存在于动物肠道、传统发酵食品和发酵饲料等各种生态环境中,可以通过生态位竞争和营养物竞争、形成各种拮抗活性物质等控制环境中他种微生物的生长繁殖。拮抗活性物质既包括乳酸、乙酸、丙酸等酸性代谢产物,还包括乳酸菌素、过氧化氢、双乙酰、罗伊氏菌素等次级代谢产物[1-2]。乳酸菌素是一些乳酸菌在代谢过程中通过核糖体合成的一类具有生物活性的蛋白质、多肽或前体多肽,可以杀死或抑制与之相同或相似生境的微生物,产生乳酸菌素的细菌对其自身分泌的乳酸菌素具有免疫性。
自1969年英国食品防腐剂委员会和世界卫生组织联合食品添加剂专家委员会确认乳酸链球菌素(Nisin)为食品防腐剂以来,作为首个应用于食品中的乳酸菌素,Nisin以其产生基因稳定、抑菌效果好、食用安全而陆续被许多国家所接受[3]。迄今已经发现有百余种乳酸菌素,但真正用于商业化的却很少,主要是因为乳酸菌素的性质和分离纯化方法等诸多因素限制了乳酸菌素的获取及其工业化生产。乳酸菌素纯化流程是一个多元化系统,建立高效、快速的纯化流程是促进乳酸菌素研究及在食品中的应用的关键所在。
本文对国内外乳酸菌素的分离纯化技术及特性的最新研究成果进行分析比较,并对其在食品领域的应用进展进行综述,为进一步开发乳酸菌素资源的研究与应用提供借鉴与参考。
1 乳酸菌素及其分类
细菌素是由某些细菌的核糖体合成分泌到细胞外对近缘微生物具有抑制或杀灭作用的一类小分子肽或蛋白质[4]。乳酸菌素是一类可用于抑制食品中致腐和致病微生物生长的由乳酸菌产生的多肽或蛋白质。根据乳酸菌素氨基酸结构、分子量大小、热稳定性及抑菌谱等的差异,Klaenhammer和Nes等[5-7]将其分为3类,后拓展为4类,分别是Ⅰ类:羊毛硫抗生素(lantibiotics);Ⅱ类:小分子热稳定性的多肽;Ⅲ类:大分子热不稳定性的蛋白质;Ⅳ类:由蛋白质和脂类或碳水化合物部分组成的复合细菌素。
Ⅰ类主要包括Nisin、Lacticin481、LactocinS、CarnocinUI49等,代表物为Nisin。这类细菌素含有不饱和氨基酸、羊毛硫氨酸或3-甲基羊毛硫氨酸等,分子量小于5 ku的多肽,抑菌谱较广,具有热稳定性;Ⅱ类被称为“抗李斯特菌活性多肽”,分子量小于10 ku,具有一定的热稳定性,以片球菌素类细菌素为代表,一般含有36~48个氨基酸残基,序列中有多个谷氨酸,N-末端一般含有“Y-G-N-G-V-N”序列;Ⅲ类主要包括HelveticinJ、HeleveticinV-1829、AcidophilucinA、LacticinA、LacticinB等,分子量大于30 ku,对热敏感;Ⅳ类由蛋白质、碳水化合物或脂质等组合而成,其抑菌活性来自三者共同作用,代表物有PlantaricinS、LeuconocinS、Lactocin27等[8],目前有关这类乳酸菌素结构和功能的报道较少。Ⅰ类和Ⅱ类乳酸菌素因其抑菌的高活性和专一性具有在食品防腐保鲜中应用的潜在价值。
2 乳酸菌素分离纯化方法研究进展
2.1乳酸菌素的产生
乳酸菌素一般产生于乳酸菌生长的对数末期或稳定期,是其次级代谢产物,因其浓度较低使得纯化受到限制,分析掌握其最高形成阶段是分离乳酸菌的关键所在[9]。
Elayaraja等[10]发现乳酸菌素产量与乳酸菌生长曲线具有一致性,从生长的对数末期开始产生,到稳定期(20~34 h)时达到高峰,产量与培养温度和发酵液的pH密切相关。Liu等[11]从百岁老人肠道分离的动物双歧杆菌(Bifidobacteriumanimals),在37 ℃培养16 h开始产生细菌素bifidocin A(80 AU/mL),到稳定中期(32~44 h)达到最大值(640 AU/mL),表明bifidocin A为动物双歧杆菌的次级代谢产物。因此,准确把握乳酸菌素的最佳产生时间对下一步的分离纯化至关重要。
2.2乳酸菌素的分离纯化方法
揭示乳酸菌素生化性质及结构和作用位点对深入研究乳酸菌素很重要,这些必须建立在获取乳酸菌素纯品的基础上[12]。由于乳酸菌素具有蛋白质的基本特性,一般应用纯化蛋白质方法获取乳酸菌素纯品,乳酸菌素纯化流程分为粗提、中度纯化和精细纯化三个阶段[13],为了取得良好纯化效果,各个阶段乳酸菌素的纯化方法要依据自身的特异性来选择。
粗提阶段目的是澄清、浓缩和稳定目标蛋白,获得粗提物。通常采用硫酸铵沉淀、有机溶剂萃取及吸附和解吸等[14-16]技术从乳酸菌无细胞上清液中获取粗提物质,粗提的乳酸菌素可用于研究其理化性质,为后续纯化阶段提供材料。中度纯化常应用离子交换柱色谱、凝胶柱层析和疏水层析等[15,17]各技术进行纯化,纯化的作用是除去粗提物中大量的杂蛋白。采用Tricine-SDS-PAGE和反相高效液相色谱等[18-19]技术对中度纯化的产物进一步纯化,使其纯度达到99%左右。经过精细纯化的乳酸菌素才能进行质谱分析和氨基酸序列测定。
随着近年来分离纯化技术的快速发展,乳酸菌素的纯化流程日臻成熟。衡量纯化技术流程的标准主要包括样品前处理、纯化活性与产率以及纯化成本等因素,同时还要考虑适用对象和预期产品[20]。表1是近些年国内外一些学者的乳酸菌素纯化技术流程和结果。Cheikhyoussef等[21]采用两步法纯化B.infantisBCRC 14602产生的乳酸菌素,先将无细胞上清液冷冻干燥,活性为228 AU/mg;基于细胞的吸附和解吸特性,利用磷酸和氢氧化钠所形成的酸性环境使抑菌活性物质活性提高到31605 AU/mg,为原培养液的120倍。H-Kittikun等[22]则采用四步法对EnterococcusfaecalisKT2W2G所产细菌素进行分离纯化。首先,用70%硫酸铵沉淀乳酸菌无细胞上清液,活性提高了11倍;其次,通过Sep-Pak C8固相萃取,活性提高了32倍;第三,通过阳离子交换层析,活性达到12620.51 AU/mg;最后,通过2次C8反向高效液相色谱进一步纯化,最终活性达到13470.53 AU/mg,提高了48.10倍。Gao等[23]对LactococcusgarvieaeLG34所产细菌素Garviecin LG34进行纯化,经过甲醇萃取、G50葡聚糖凝胶层析、阳离子交换色谱后冷冻干燥,其活性达到54.9 AU/mg,提高了20.3倍。Casaburi等[24]对分离自意大利传统发酵香肠中的Lactobacilluscurvatus54M16所产乳酸菌素经反向液相色谱纯化,通过解析电离飞行时间质谱后得出分子量为2.5 ku。
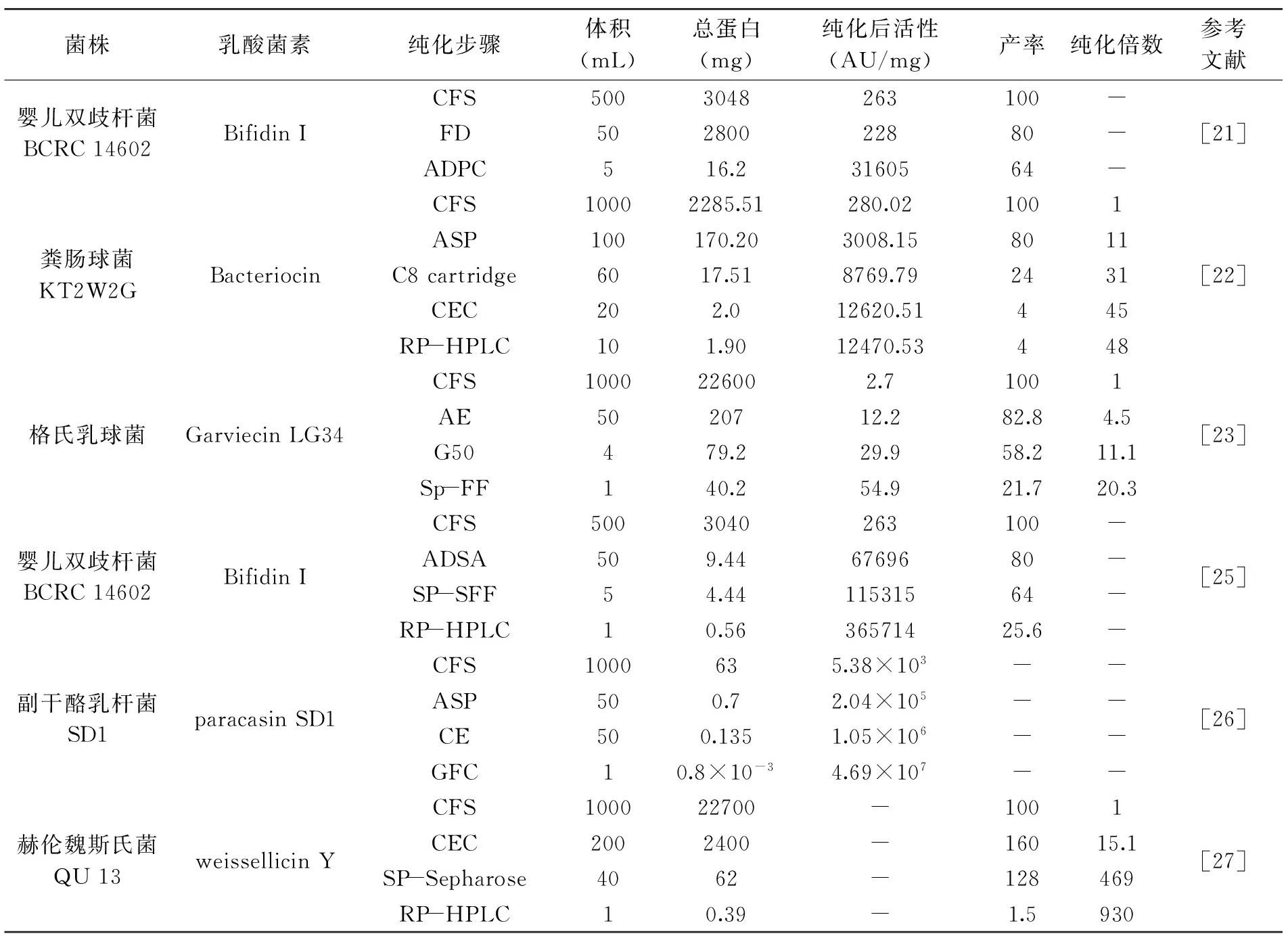
表1 乳酸菌素分离纯化技术流程和结果
注:CFS:无细胞上清液;FD:冷冻干燥;ADPC:细胞的吸附和解吸;RP-HPLC:反向高效液相色谱;ASP:硫酸铵沉淀;CEC:阳离子交换色谱;ADSA:硅酸吸附和解吸;AE:丙酮萃取;GFC:凝胶过滤层析;CE:三氯甲烷萃取;SP-SFF:琼脂糖凝胶电泳;(-):未测。
综上结果表明,乳酸菌的不同,产生的乳酸菌素不同,因此依据每种乳酸菌素的特性选择设计优化不同的分离纯化流程,才能获取纯度较高的高活性乳酸菌素。
3 乳酸菌素的性质及在食品中的应用
乳酸菌素的特性研究是评价其安全性和适用性的前提和基础。目前研究比较清楚的是Nisin的分子结构及特性,但Nisin只对大多数革兰氏阳性菌起作用,抑菌范围相对较窄[28],因此,需发掘和探究新的乳酸菌资源,获取抗菌活性强和抑菌范围广的新型乳酸菌素[29]。
表2是对近几年国内外发现乳酸菌素的特性及在食品中应用情况,从表2中可以看出所获取的乳酸菌素多属于Ⅱ类细菌素。这些乳酸菌素的特点是结构错综复杂,分子量和生化特性差异性较大,热稳定性好,pH适应性相近,在食品中多用于L.monocytogenes、Salmonellatyphimurium和Enterococcusfaecalis等致病菌的安全控制。
对乳酸菌素特性研究结果表明,主要是在拮抗菌筛选的基础上对乳酸菌素的分离纯化和性能进行研究。Xin等[30]从新疆舒巴特乳中分离的Lb.caseiTN-2所产的乳酸菌素TN-2进行研究,结果表明TN-2分子量为6.352 ku,在Lb.caseiTN-2生长至60~72 h时呈现最大抑菌活性,pH耐受性较宽,经121 ℃、20 min后仍保持活性。Todorov等[31]从葡萄牙传统烟熏猪肉肠中分离的Lb.plantarum可产生乳酸菌素bacST202Ch和bacST216Ch,经Trycine-SDS-PAGE证明分子量分别约为3.5 ku和10.0 ku,在生长的为27 h和22 h表现出最大抑菌活性,细胞吸附实验表明二者对自身细胞均有吸附性。bacST216Ch经121 ℃处理2 h不影响其活性,经100 ℃处理2 h后两种乳酸菌素仍保留抑菌活性。
在食品保鲜和安全控制方面,乳酸菌素作为一种生物保护剂已应用于各种食品中[32]。Chakchouk等[33]从鸡胗中分离产生乳酸菌素BacJ1的菌株WeissellaparamesenteroidesJ1,将BacJ1纯化后用于抑制火鸡肉片中S.typhimurium。结果表明接种107CFU/gS.typhimurium的火鸡肉片4 ℃放置30 h后,S.typhimurium数量增至108CFU/g,而加入BacJ1的实验组中S.typhimurium的数量已经检测不出,控制作用较好。Barbosa等[34]将分离自意大利香肠中的Lb.curvatus产生的乳酸菌素MBSa2用于控制香肠中的L.monocytogenes,在10 d和20 d后L.monocytogenes的数量分别降低2.0和1.5个数量级,表明乳酸菌素MBSa2能够很好地抑制食品中L.monocytogenes的生长。

表2 乳酸菌素特性及在食品中的应用
注:“-”表示未做说明。
Dortu等[35]应用两株产乳酸菌素的菌株Lb.sakeiCWBI-B1365和Lb.curvatusCWBI-B28和不产乳酸菌素的菌株Lb.sakeiLMG17302控制禽肉和牛肉中的L.monocytogenes,两种载体中三株乳酸菌的生长曲线基本一致。新鲜牛肉中添加3.1×102CFU/g目标菌,空白对照中L.monocytogenes的数量在21d 后降至为1×102CFU/g,稍有降低。添加菌株Lb.sakeiCWBI-B1365的实验组中L.monocytogenes7 d后降低1.5个数量级,14 d后降低2.0个数量级,21 d终点时降至2×101CFU/g。而添加相同数量不产乳酸菌素的菌株Lb.sakeiLMG17302中L.monocytogenes在21 d后仅降低0.7个数量级。如此表明降低L.monocytogenes数量的是乳酸菌素作用的结果,排除了乳酸菌所产生的有机酸的作用。进而以新鲜禽肉为载体进行研究,空白对照组中L.monocytogenes的数量从初始值2×102CFU/g 21 d 后增加到5×104CFU/g,分别添加三种菌株在禽肉保藏期间均未能显著控制禽肉中L.monocytogenes的生长,表明单一菌株产生的乳酸菌素并不能很好地抑制L.monocytogenes的增殖,可以看出,应用载体不同,乳酸菌素的作用效果也不同。Udhayashree等[36]将从鸡肠道分离的Lb.fermentumCECT5716所产细菌素UN01添加到苹果汁和新鲜鱼中,在4 ℃冰箱条件下可将产品的货架期从3 d延长至9 d,保鲜效果明显。很多研究均证实乳酸菌素在食品保鲜方面有着化学防腐剂无法比拟的作用,因此,生物保鲜剂在食品防腐保鲜领域有着巨大的应用潜力。
4 结论与展望
随着生活水平的提高,人们对富有营养的生鲜食品需求日益增加。然而,由于化学防腐剂和抗生素在生鲜食品保鲜应用中存在药物残留和耐药性等不足,因此,生物防腐剂越来越显示出优势。Nisin等乳酸菌素作为生物防腐剂的杰出代表在食品防腐领域广泛应用,尚有潜在高效抑菌谱广、稳定性好的乳酸菌素有待于开发与利用。限制乳酸菌素资源开发的关键技术是纯化流程,对乳酸菌素的纯化流程依据细菌素的性质多采用综合纯化技术,以便高效地获得纯品。本文对近年来国内外对乳酸菌素纯化的综合技术应用进行分析比较,可以看出纯化流程一般都要选择粗提阶段的硫酸铵沉淀、细胞吸附与解吸、有机溶剂萃取,中度纯化阶段的凝胶过滤层析、阳离子交换色谱以及精细纯化的小分子量凝胶电泳、反向高效液相色谱等技术并加以结合使用获取纯品。进而对乳酸菌素的产生菌株来源、特性及其应用进行分析比较,可以看出来源与应用之间具有相似性原则。
从目前对乳酸菌素的研究结果来看,主要集中在对乳酸菌素的拮抗活性、热稳定性、pH耐受性及其分子量等性质进行分析,建立在乳酸菌素分离纯化基础上的乳酸菌菌株遗传特性及基因调控方面的研究具有重要的理论和应用价值。
[1]贡汉生,孟祥晨.乳酸菌细菌素分类与作用机制[J].食品与发酵工业,2008,34(1):105-109.
[2]白凤翎,励建荣.抗真菌性乳酸菌生物保护剂的研究进展[J].现代食品科技,2014,30(5):311-319.
[3]诸永志,姚丽娅,徐为民,等.乳酸菌细菌素应用于肉制品防腐剂的研究进展[J].食品科技,2008,33(2):136-139.
[4]Balciunas E M,Martinez F A C,Todorov S D,et al. Novel biotechnological applications of bacteriocins:A review[J]. Food Control,2013,32(1):134-142.
[5]Klaenhammer T R. Bacteriocins of Lactic Acid Bacteria[J]. Biochimie,1988,70:337-349.
[6]Klaenhammer T R. Genetics of bacteriocins produced by lactic acid bacteria[J].FEMS Microbiological Review,1993,12:39-85.
[7]Nes I F,Diep D B,Havarstein L S. Biosynthesis of Bacteriocins in Lactic Acid Bacteria[J]. Antonie van Leeuwenhoek,1996,70:113-128.
[8]丹彤,张和平.乳酸菌细菌素的分类、生物合成及其应用[J].中国乳品工业,2013,41(3):29-32.
[9]O’ Shea E F. Strategies to improve the bacteriocin protection provided by lactic acid bacteria[J]. Current Opinion in Biotechnology,2013,24(2):130-134.
[10]Elayaraja S,Annamalai N,Mayavu P,et al. Production,purification and characterization of bacteriocin fromLactobacillusmurinusAU06 and its broad antibacterial spectrum[J]. Asian Pacific Journal of Tropical Biomedicine,2014,4(4):S305-S311.
[11]Liu G,Ren L,Song Z,et al. Purification and characteristics of bifidocin A,a novel bacteriocin produced byBifidobacteriumanimalsBB04 from centenarians’ intestine[J]. Food Control,2015,50:889-895.
[12]Saraniya A,Jeevaratnam K. Purification and Mode of Action of Antilisterial Bacteriocins Produced by Lactobacillus pentosus SJ65 Isolated from UttapamBatter[J]. Journal of Food Biochemistry,2014,38(6):612-619.
[13]谢继辉,陈晓琳,张明.有关细菌素分离纯化方法的评价[J]安徽农学通报,2008,14(15):60-61.
[14]Chen C,Chen X,Jiang M,et al. A newly discovered bacteriocin from Weissella hellenica D1501 associated with Chinese Dong fermented meat(NanxWudl)[J]. Food Control,2014,42(2):116-124.
[15]An J,Zhu W,Liu Y,et al. Purification and characterization of a novel bacteriocin CAMT2 produced byBacillusamyloliquefaciensisolated from marine fish Epinephelusareolatus[J]. Food Control,2015,51:278-282.
[16]Yang R,Johnson M C,Ray B. Novel method to extract large amounts of bacteriocins from lactic acid bacteria.[J]. Appl Environ Microbiol,1992,58(10):3355-3359.
[17]Woraprayote W,Pumpuang L,Tosukhowong A,et al. Two putatively novel bacteriocins active against Gram-negative food borne pathogens produced by Weissella hellenica BCC 7293[J]. Food Control,2015,55:176-184.
[18]Schgger H,Von J G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa.[J]. Analytical Biochemistry,1987,166(2):368-379.
[19]Chen Y S,Wang Y C,Chow Y S,et al. Purification and characterization of plantaricin Y,a novel bacteriocin produced byLactobacillusplantarum510[J]. Archives of Microbiology,2014,196(3):193-199.
[20]张建飞. 乳酸菌细菌素的纯化及应用的研究进展[J].中国畜牧兽医,2012,39(10):225-228.
[21]Cheikhyoussef A,Pogori N,Chen H,et al. Antimicrobial activity and partial characterization of bacteriocin-like inhibitory substances(BLIS)produced byBifidobacteriuminfantisBCRC 14602[J]. Food Control,2009a,20:553-559.
[22]H-Kittikun A,Biscola V,El-Ghaish S,et al. Bacteriocin-producingEnterococcusfaecalisKT2W2G isolated from mangrove forests in southern Thailand:Purification,characterization and safety evaluation[J]. Food Control,2015,54:126-134.
[23]Gao Y,Li D,Liu S,et al. Garviecin LG34,a novel bacteriocin produced byLactococcusgarvieaeisolated from traditional Chinese fermented cucumber[J]. Food Control,2015,50:896-900.
[24]Casaburi A,Martino V D,Ferranti P,et al. Technological properties and bacteriocins production byLactobacilluscurvatus54M16 and its use as starter culture for fermented sausage manufacture[J]. Food Control,2016,59:31-45.
[25]Cheikhyoussef A,Cheikhyoussef N,Chen H,et al. Bifidin I-a new bacteriocin produced byBifidobacteriuminfantisBCRC 14602:purification and partial amino acid sequence[J]. Food Control,2010,21:746-753.
[26]Wannun P,Piwat S,Teanpaisan R. Purification and characterization of bacteriocin produced by oralLactobacillusparacaseiSD1[J]. Anaerobe,2014,27:17-21.
[27]Masuda Y,Zendo T,Sawa N,et al. Characterization and identification of weissellicin Y and weissellicin M,novel bacteriocins produced byWeissellahellenicaQU 13[J]. Journal of Applied Microbiology,2012,112(1):99-108.
[28]Delves-Broughton J,Blackburn P,Evans R J,et al. Applications of the bacteriocin,nisin[J]. Antonie van Leeuwenhoek,1996,69(2):193-202.
[29]Zhao F,Ma H,Lu Y,et al. Complete genome sequence ofLactococcuslactis S0,an efficient producer of nisin[J]. Journal of Biotechnology,2015,198:15-16.
[30]Xin L,Pan H,Ying D,et al. Purification and partial characterization of a novel bacteriocin produced byLactobacilluscaseiTN-2 isolated from fermented camel milk(Shubat)of Xinjiang Uygur Autonomous region,China[J]. Food Control,2014,43(5):276-283.
[31]Todorov S D,Ho P,Vaz-Velho M,et al.Characterization of bacteriocins produced by two strains ofLactobacillusplantarumisolated from Beloura and Chourico,traditional pork products from Portugal[J]. Meat Science,2010,84(3):334-343.
[32]Resa C P O,Gerschenson L N,Jagus R J. Starch edible film supporting natamycin and nisin for improving microbiological stability of refrigerated argentinian Port Salutcheese[J]. Food Control,2016,59:737-742.
[33]Chakchouk-Mtibaa A,Elleuch L,Smaoui S,et al. Characterization of the bacteriocin BacJ1 and its effectiveness for the inactivation ofSalmonellatyphimuriumduring turkey escalope storage[J]. Food Chemistry,2014,152c(2):566-572.
[34]Barbosa M D S,Todorov S D,Ivanova I,et al. Improving safety of salami by application of bacteriocins produced by an autochthonousLactobacilluscurvatusisolate[J]. Food Microbiology,2015,46:254-262.
[35]Dortu C,Huch M,Holzapfel W H,et al. Anti-listerial activity of bacteriocin-producingLactobacilluscurvatusCWBI-B28 andLactobacillussakeiCWBI-B1365 on raw beef and poultry meat[J]. Letters in Applied Microbiology,2008,47(6):581-586.
[36]Udhayashree N,Senbagam D,Senthilkumar B,et al. Production of bacteriocin and their application in food products[J]. Asian Pacific Journal of Tropical Biomedicine,2012,2:S406-S410.
[37]Martinez R C R,Wachsman M,Torres N I,et al. Biochemical,antimicrobial and molecular characterization of a noncytotoxic bacteriocin produced byLactobacillusplantarumST71KS.[J]. Food Microbiology,2013,34(2):376-381.
[38]Martinez R C R,Staliano C D,Vieira A D S,et al. Bacteriocin production and inhibition ofListeriamonocytogenesbyLactobacillussakeisubsp.sakei2a in a potentially synbiotic cheese spread[J]. Food Microbiology,2015,48:143-152.
[39]Junior A A D O,Moura T R D,Barbosa A A T,et al. Stability,antimicrobial activity,and effect of nisin on the physico-chemical properties of fruit juices[J]. International Journal of Food Microbiology,2015,211:38-43.
Advances on purification,characterization and application of bacteriocin from lactic acid bacteria
DU Jing-fang,MIAO Lu-huan,BAI Feng-ling*,LI Jian-rong
(College of Food Science and Technology,Bohai University,Food Safety Key Lab of Liaoning Province, National & Local Joint Engineering Research Center Storage,Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products,Jinzhou 121013,China)
Bacteriocin,that can be regarded as natural preservatives to apply to food industry,are secondary metabolites produced from lactic acid bacteria,such as proteins and peptides. They are ribosomally synthesized,which can inhibit microorganism in the same or similar habitat. The pure product can be achieved through ammonium sulfate precipitate(ASP),gel-filtration chromatography(GFC),high performance liquid chromatography(HPLC)and so on. And then the thermostability,tolerance for pH and molecular weight can be analyzed.The process of purification is the technical bottle neck to limit the study and applications of bactericins. The methods,such as ASP,adsorption-desorption producer cells(ADPC),methanol acetone extraction(MAE),GFC,cation exchange chromatography(CEC)and reversed phase high-performance liquid chromatography(RP-HPLC)to purify bacteriocins produced by lactic acid bacteria,were mainly compared and analysised in this paper. At the same time,the recent research advance on characterizations and applications of bacteriocins were reviewed highlightly,which aims to provide reference for protective agent of lactic acid bacteria.
bactericins;purification;characterization;food preservatives;application
2015-10-27
杜静芳(1988-),女,硕士研究生,研究方向:食品质量与安全控制,E-mail:dujingfang2013@163.com。
白凤翎(1964-)男,博士,教授,研究方向:食品质量与安全控制和食品微生物学,E-mail:baifling@163.com。
“十二五”国家科技支撑计划课题(2012BAD29B06)。
TS201.3
A
1002-0306(2016)10-0391-06
10.13386/j.issn1002-0306.2016.10.073

