内部沸腾法提取箬叶总黄酮的研究
乐 薇,李 刚
(武汉工商学院 环境与生物工程学院,湖北武汉 430065)
内部沸腾法提取箬叶总黄酮的研究
乐薇,李刚
(武汉工商学院 环境与生物工程学院,湖北武汉 430065)
目的:确定内部沸腾法提取箬叶总黄酮的优化工艺。方法:以黄酮得率为指标,分别在解吸过程和提取过程的单因素实验基础上,进行正交实验,考察内部沸腾法提取箬叶总黄酮含量的最佳条件,并与回流法、超声波法、微波法进行了比较。结果:内部沸腾法提取箬叶总黄酮最佳条件是在固液比1∶3的90%乙醇溶液中解吸25 min后,在85 ℃下,在固液比为1∶30的30%乙醇溶液中提取5 min,箬叶总黄酮的得率达到2.05%,异荭草苷含量为1.656 mg·g-1,荭草苷含量为0.454 mg·g-1,与回流法、超声波法和微波法相比,黄酮得率差异不显著(p>0.05),但乙醇用量少,成本低。
内部沸腾法,总黄酮,箬叶
箬叶为禾本科竹亚科箬竹属植物叶的总称。该属植物约为20种以上,均产至我国,主要分布于长江以南各省区,自古以来就是端午节标志食品-粽子的包装物[1]。据我国医书记载,箬叶味甘,性寒,有清热止血、解毒消肿之功效。箬叶中含有黄酮类、活性多糖、特种氨基酸和肽类、微量元素、维生素、挥发油等多种功能性成分,杀菌、防腐、抗癌等多种功能作用显著,可广泛应用于医药、食品及日化用品等[2-9]。作为箬叶中重要的抗菌活性成分之一,箬叶总黄酮已经逐渐引起研究者的重视[10-12],但关于总黄酮的提取方法报道不多,已有报道采用的是常规的回流法[13],但该法提取时间长,能量消耗大,溶剂量大。内部沸腾法是一种新型的提取分离技术,该法首先用少量低沸点溶剂浸润物料,使被提取组分得到充分浸润,然后加入另外一种高于浸泡物料溶剂沸点的提取剂,让渗入物料内部的溶剂来不及扩散就沸腾,从而将被提取组分大量的挟带至提取溶剂中,可大大缩短提取时间,强化了提取过程[14-16]。目前内部沸腾法已在丹参[17]、三七皂苷[18]、香菇多糖[19]、绞股蓝总黄酮[20]等的提取中取得了较好的效果。本文拟采用内部沸腾法对箬叶总黄酮进行强化提取,旨在为箬叶的开发应用提供参考。
1 材料与方法
1.1材料与仪器
箬叶湖北武陵山区,洗净后于烘箱中40 ℃干燥6 h,于粉碎机中粉碎,过16目筛,于样品袋中冷藏保存。
氢氧化钠天津市凯通化学试剂有限公司;95%无水乙醇天津市北联精细化学品开发有限公司;亚硝酸钠洛阳市化学试剂厂;硝酸铝天津市天力化学试剂有限公司;冰乙酸天津市科密欧化学试剂有限公司;以上试剂均为分析纯;乙腈色谱纯、天津市化学试剂三厂;甲醇色谱纯、天津市科密欧化学试剂有限公司;荭草苷、异荭草苷、芦丁 标准品 南京春秋生物工程有限公司。
722E型可见分光光度计上海光谱仪器有限公司;KQ3200E超声波发生器昆山市超声仪器有限公司;LC-1000型高效液相色谱仪山东鲁南瑞虹化工仪器有限公司;RE52CS旋转蒸发器上海亚荣生化仪器厂;FD-1A-50冷冻干燥机北京博医康实验仪器有限公司。
1.2箬叶黄酮含量的测定
1.2.1光度法测定总黄酮含量标准曲线的绘制:准确称取芦丁标准品15 mg溶于30%乙醇中,并定容至100 mL。用移液管分别取0、0.5、1.0、2.0、3.0、4.0 mL于10 mL容量瓶中,加入5%亚硝酸钠0.3 mL,使其混匀,放置6 min后加入10%硝酸铝0.3 mL。摇匀静置6 min后加入4 mL 4%氢氧化钠,以30%乙醇定容至刻度,摇匀静置10 min后在波长510 nm处测吸光度,参比为不加芦丁标准品的溶液。以测定的吸光度A为纵坐标,芦丁标准品浓度c为横坐标,绘制标准曲线。箬叶提取液中黄酮含量的测定:准确移取1.00 mL黄酮提取液于10 mL容量瓶中,按标准曲线的绘制方法加入各种试剂,以不加黄酮提取液的溶液为参比,在波长510 nm处测定吸光度,并按式(1)计算总黄酮得率:

(式1)
式中:c为总黄酮的浓度(μg·mL-1);m为箬叶粉末的质量(g);V为溶液的体积(mL);n为稀释倍数。
1.2.2HPLC测定提取液中黄酮碳苷的含量制备标准溶液:准确称取异荭草苷、荭草苷各10 mg分别于50 mL容量瓶中,用甲醇溶解并定容至刻度,用超声震荡辅助对照品溶解。制成浓度为200 μg·mL-1的混合对照品溶液;HPLC检测条件:C18色谱柱(150 mm×4.6 mm);流动相:乙腈/水(14/86,v/v),水中含有0.5%的乙酸;流速:0.8 mL·min-1;检测波长360 nm[21-23]。
1.3内部沸腾法提取箬叶总黄酮
准确称取1.0 g箬叶粉末后,采用单因素及正交实验进行内部沸腾法提取箬叶总黄酮,测定各提取液中总黄酮的含量,并计算出对应的得率,具体步骤如下:
1.3.1解吸过程的单因素实验采取少量乙醇润湿箬叶粉末一段时间,以使箬叶黄酮能被解吸。乙醇浓度的影响:取3 mL一定浓度乙醇溶液解吸20 min后,在85 ℃下用25 mL的30%乙醇溶液提取5 min,共进行两次;解吸时间的影响:取3 mL 的80%乙醇溶液解吸一定时间后,在85 ℃下用25 mL的30%乙醇溶液进行提取5 min,共进行两次;解吸剂用量的影响:取一定体积的80%乙醇溶液解吸20 min后,在85 ℃下用25 mL的30%乙醇溶液提取5 min,共进行两次。
1.3.2解吸过程的正交实验准确称取1.0 g箬叶粉末,按表1进行解吸过程的正交实验,然后在85 ℃下用25 mL 30%乙醇溶液提取5 min,共提取两次,以箬叶总黄酮的得率为指标进行考察。

表1 解吸过程的正交实验因素水平表Table 1 The factors and levels of orthogonal test for desorption process
1.3.3提取过程的单因素实验乙醇浓度的影响:取3 mL 90%乙醇溶液解吸20 min后,在85 ℃下用25 mL的一定浓度乙醇溶液提取5 min,共进行两次;提取温度的影响:取3 mL 90%乙醇溶液解吸20 min后,在不同温度下用25 mL的30%乙醇溶液进行提取5 min,共进行两次;提取剂用量:取3 mL 90%乙醇溶液解吸20 min后,在85 ℃下用不同体积的30%乙醇溶液进行提取5 min,共进行两次;提取时间的影响:取3 mL 90%乙醇溶液解吸20 min后,在85 ℃下用25 mL 30%乙醇溶液提取5 min,共进行两次。
1.3.4提取过程的正交实验准确称取1.0 g箬叶粉末,取3 mL 90%乙醇溶液解吸20 min后,按照表2进行提取过程的正交实验,共提取两次,以箬叶总黄酮的得率为指标进行考察。
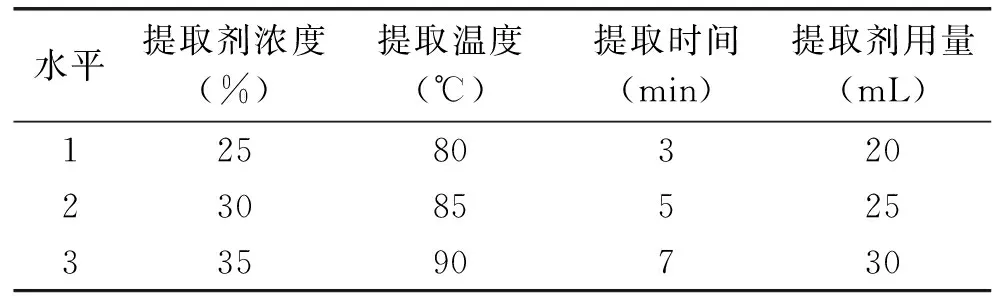
表2 提取过程的正交实验因素水平表Table 2 The factors and levels of orthogonal test for extraction process
1.3.5其他方法提取箬叶总黄酮选取了前期实验已经优化的箬叶黄酮提取工艺条件分别对箬叶总黄酮进行提取,并测定提取液中的总黄酮含量及异荭草苷、异牡荆苷的含量。超声波法提取箬叶总黄酮:按固液比为1∶25加入60%的乙醇溶液,在150 W的超声波清洗机超声提取35 min,共提取两次;回流法提取箬叶总黄酮:按固液比1∶20加入85%的乙醇回流50 min,共提取两次;微波法提取箬叶总黄酮:按固液比1∶20加入80%的乙醇,700 W微波提取2 min,共提取两次。
1.4数据统计分析
用Microsoft Excel软件进行数据的统计分析,结果以平均值±标准误差(M±SE)表示,采用Origin软件进行做图。
2 结果与讨论
2.1光度法测定箬叶黄酮含量的标准曲线及回归方程
按1.2.1操作,绘制标准曲线如图1所示,得到回归方程为A=0.0105c+0.0017,R2=0.9998。
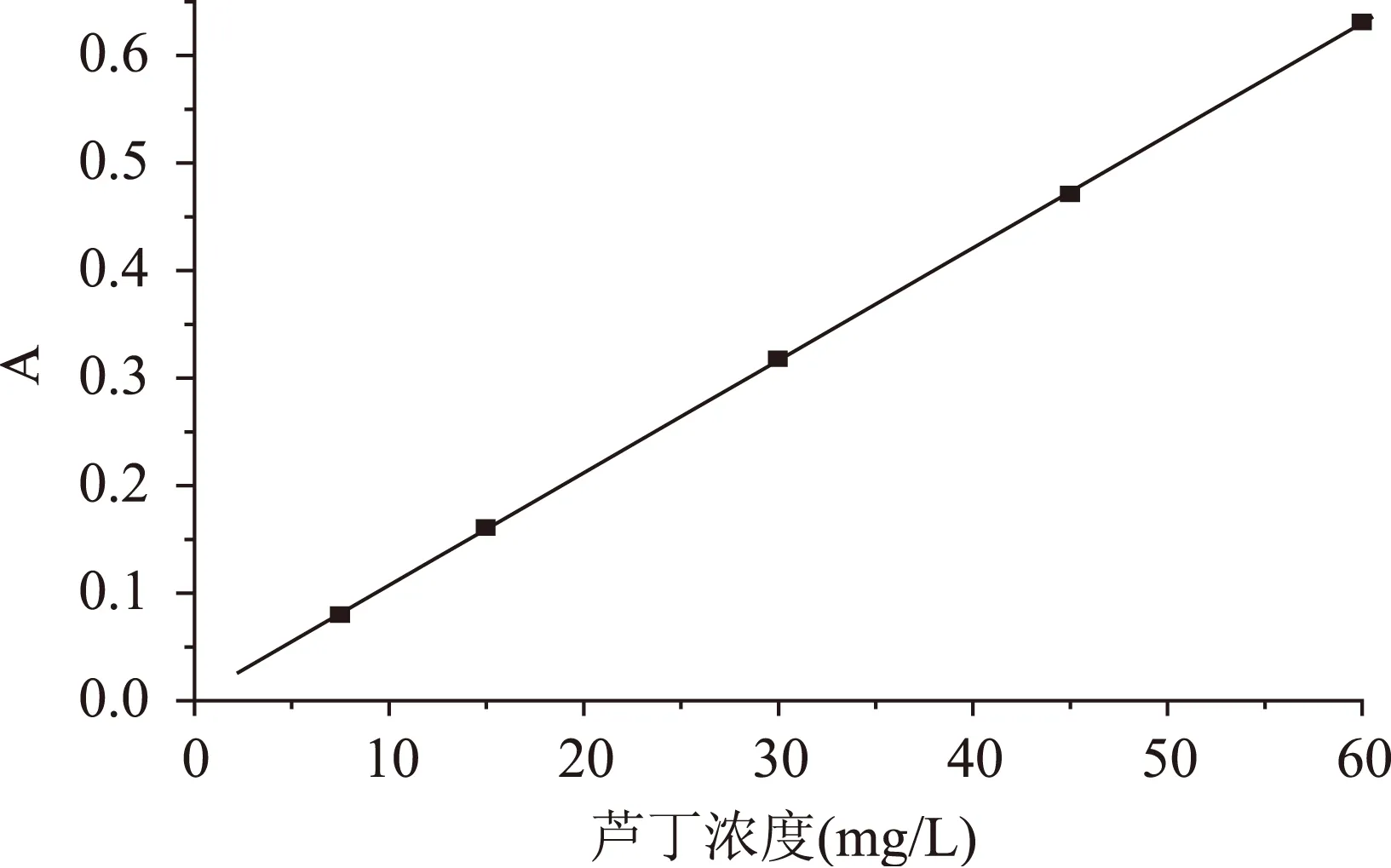
图1 标准曲线Fig.1 The standard curve of rutin
2.2内部沸腾法解吸过程的单因素实验
2.2.1解吸剂浓度对箬叶总黄酮得率的影响解吸剂浓度对箬叶总黄酮得率的影响如图2所示。可知,解吸剂体积分数在50%~80%间,箬叶总黄酮得率随乙醇体积分数的升高而增大,当乙醇体积分数大于80%后,得率随乙醇体积分数的升高而减小。原因可能是乙醇的体积分数不同,渗透进入箬叶细胞内部的能力也不同,解吸黄酮的效果也有差别。在一定乙醇浓度范围内,解吸黄酮的能力随乙醇的体积分数增大而增大,但是当乙醇浓度增大到一定程度时,乙醇的渗透能力下降,反而导致黄酮浸出受影响。所以解吸剂最佳体积分数约80%。
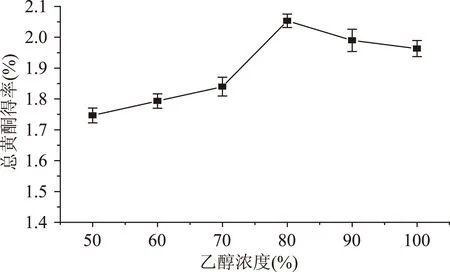
图2 解吸剂浓度对总黄酮得率的影响Fig.2 The effect of desorption agent’s concentration on the yield of flavonoids
2.2.2解吸时间对箬叶总黄酮得率的影响解吸时间对箬叶总黄酮得率的影响如图3所示。可知在5~20 min间,箬叶黄酮得率随解吸时间的增大而增大,20 min后箬叶总黄酮浸出量趋于稳定,说明此解吸过程可能以普通的分子扩散过程为主。为节省时间,解吸时间选择为20 min。
2.2.3解吸剂用量对箬叶总黄酮得率的影响由图4可知解吸剂用量少时,箬叶总黄酮的渗透及解吸不充分,但进一步增大用量时,箬叶黄酮与解吸剂接触表面积增大,可充分解吸,用量为3 mL时趋于稳定,此后再增加解吸剂用量,黄酮得率基本不变。因此选择3 mL乙醇溶液解吸。
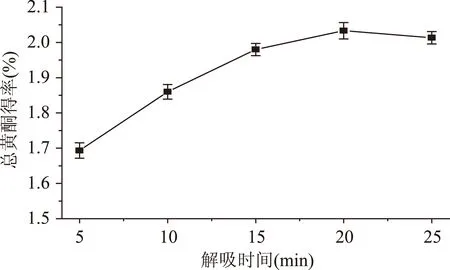
图3 解吸时间对总黄酮得率的影响Fig.3 The effect of desorption time on the yield of flavonoids
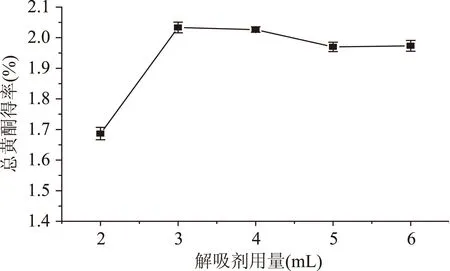
图4 解吸剂用量对总黄酮得率的影响Fig.4 The effect of desorption agent’volume on the yield of flavonoids
2.3解吸过程的正交实验
2.3.1正交实验结果在单因素实验的基础上,进行了正交实验,结果见表3和表4。
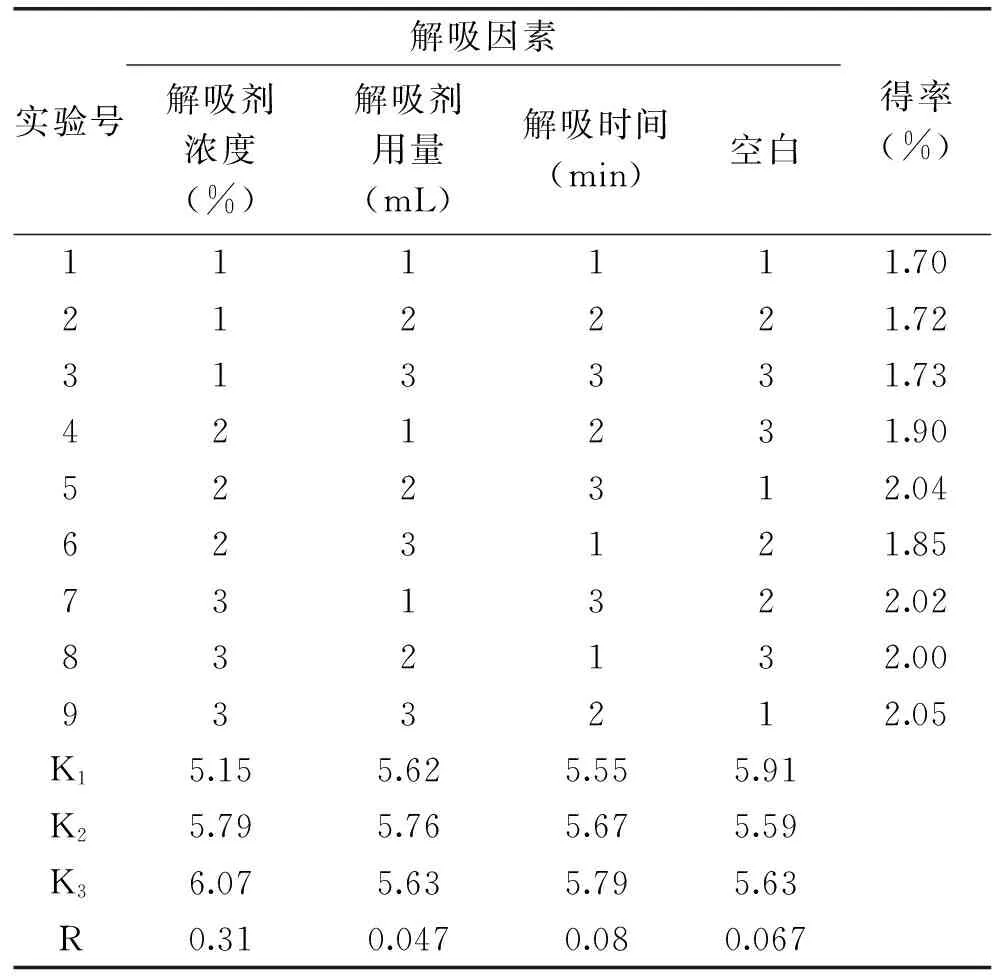
表3 箬叶中提取总黄酮中解吸过程正交实验结果Table 3 The results of orthogonal test for desorption process
可知箬叶总黄酮得率受解吸剂浓度影响程度达到显著水平,对黄酮得率的极差分析可知影响能力大小顺序为:解吸剂浓度>解吸时间>解吸剂用量。由正交实验可得解吸阶段最佳工艺水平是3 mL的90%的乙醇解吸25 min。
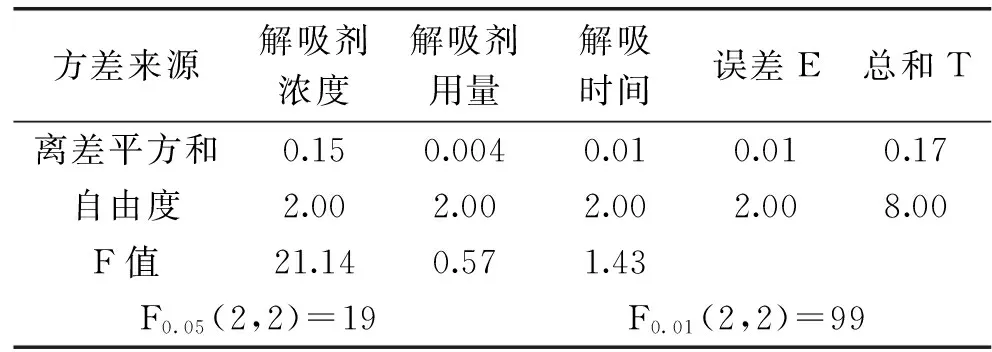
表4 解吸过程正交结果方差分析Table 4 The analysis of variance for desorption process
2.3.2验证实验在解吸最佳条件下,重复3次,实验结果见表5,可知,实验的重复性较好。
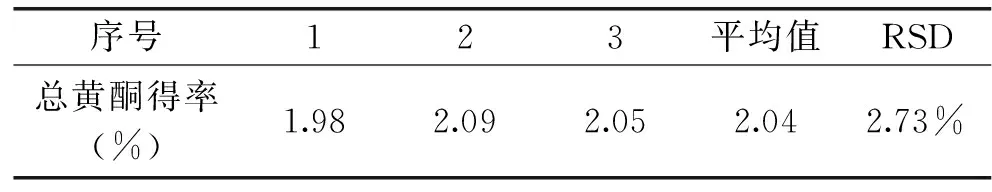
表5 解吸过程的重复性实验结果Table 5 The results of repetivite experiment for desorption process
2.4内部沸腾法提取过程的单因素实验
2.4.1提取剂浓度对箬叶总黄酮得率的影响由图5可知,随着提取剂乙醇浓度的提高,总黄酮得率呈现先升高后下降的趋势,在30%时黄酮得率最高。这可能是增大乙醇浓度时,一方面使提取过程中黄酮溶解速度加快,但同时也使乙醇溶液汽化挥发加快,沸腾持续过程短,降低了黄酮在箬叶中的传质效果。因此选取提取剂的最适浓度是30%。

图5 提取剂浓度对总黄酮得率的影响Fig.5 The effect of extrction agent’s concentration on the yield of flavonoids
2.4.2提取温度对箬叶总黄酮得率的影响由图6可知,当温度范围处于75~85 ℃之间时,黄酮浸出效果随温度的增大而增强,温度大于85 ℃后,黄酮浸出量反而减小。温度低于85 ℃时,黄酮成分在提取溶液中扩散较慢,溶解不完全,提取效果较差,随着温度的增大,乙醇沸腾越来越剧烈。当沸腾速度超过一定速度时,由于乙醇挥发较快,对流传质持续的过程不长,同样造成箬叶中黄酮浸提不完全。因此选择提取的最佳温度是85 ℃。
2.4.3提取剂用量对箬叶总黄酮得率的影响由图7可知,提取剂用量低于25 mL时,黄酮浸出不充分,随着提取剂的增加,黄酮得率提高,在25 mL时基本达到最大浸出,此时箬叶中黄酮成分基本浸出,继续增加提取剂用量而黄酮不再增加,即25 mL为最合适的提取剂用量。
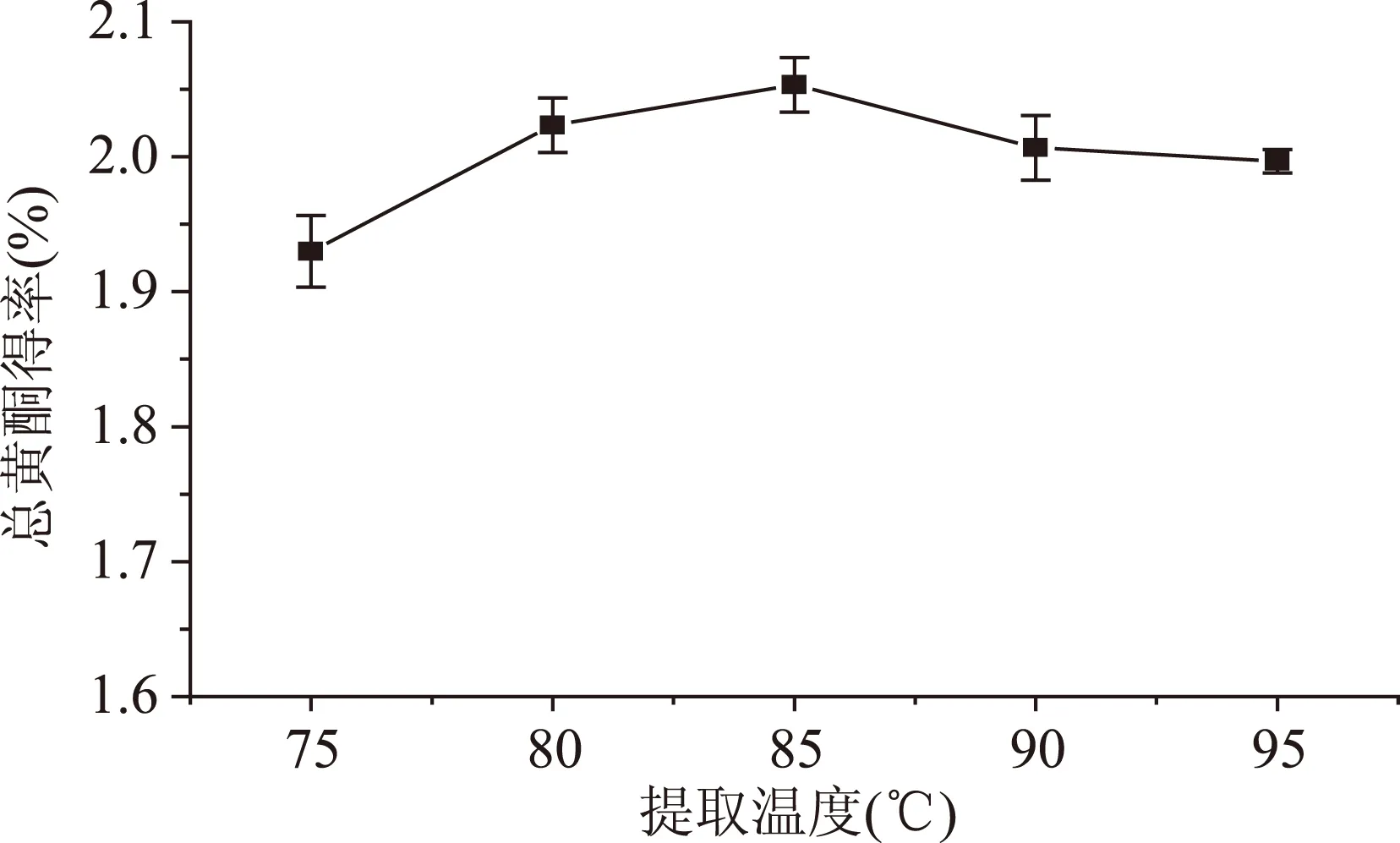
图6 提取温度对总黄酮浸出量的影响Fig.6 The effect of extraction temperature on the yield of flavonoids

图7 提取剂用量对总黄酮浸出量的影响 Fig.7 The effect of extraction agent’volume on the yield of flavonoids
2.4.4提取时间对箬叶总黄酮得率的影响由图8可知,在1~5 min间,随着提取时间的增长,箬叶中提取的黄酮得率越来越高,5~9 min间,黄酮提取量趋于稳定而不再增加,内部沸腾法提取黄酮效率较高,在5 min完成浸提,继续浸提没有更多黄酮浸出。所以提取过程选择5 min。

图8 提取时间对总黄酮浸出量的影响Fig.8 The effect of extraction time on the yield of flavonoids
2.5提取过程的正交实验
内部沸腾法提取过程的正交实验结果见表6和表7。可知箬叶总黄酮的提取过程中,四种因素对黄酮得率均未达到显著影响,影响能力大小顺序是提取剂用量>提取剂浓度>提取温度>提取时间。根据正交实验可知内部沸腾法的提取阶段最佳工艺为30 mL的30%的乙醇溶液在90 ℃下提取7 min,但由于提取时间和提取温度对箬叶黄酮的得率影响较小,从生产成本考虑,可进一步优化提取工艺为30 mL的30%的乙醇溶液在85 ℃下提取5 min。

表7 提取过程正交结果方差分析Table 7 The analysis of variance for extraction process

表6 箬叶中总黄酮提取过程正交实验结果Table 6 The results of orthogonal test for extraction process
2.6内部沸腾法提取箬叶中总黄酮的重现性实验
在优化的解吸及提取条件下重复三次实验,结果见表8,说明优化工艺的稳定性良好。并将提取液减压浓缩后冷冻干燥,得到浸膏,浸膏中黄酮含量为19%。
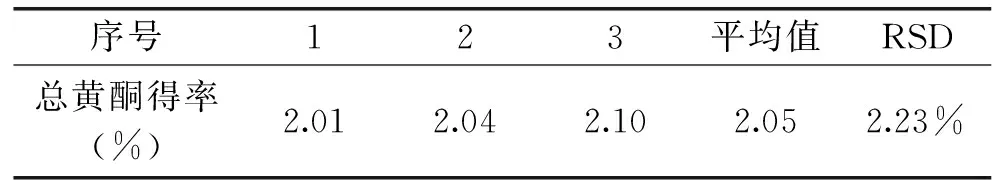
表8 内部沸腾法提取箬叶总黄酮的重现性实验Table 8 The results of repetivite experiment for extraction process
2.7内部沸腾法与其他提取箬叶总黄酮方法的比较
采用不同方法对箬叶总黄酮进行提取,结果如表9~表10所示。超声波法、微波法、回流法和内部沸腾法等提取方法对箬叶黄酮得率不存在显著差异(p>0.05)。在4种提取方法中,回流法能耗最高,微波法所需时间最短。但内部沸腾法实验设备简单,无需超声波法和微波法所需的特殊仪器,且消耗乙醇量最少,单次提取时间仅比微波法多3 min,尽管比其他方法多了25 min的润湿时间(即解吸时间),但此步过程不需加热,所以内部沸腾法成本更低。
3 结论
通过解吸过程和提取过程的单因素实验确定了内部沸腾法提取箬叶总黄酮的最适条件。解吸过程最佳条件为:解吸剂浓度90%乙醇、解析时间20 min、解吸剂用量3 mL·g-1。提取过程最佳条件为:提取剂浓度30%、提取时间5 min、提取温度85 ℃、提取剂用量30 mL·g-1。通过解吸过程的正交实验得到三个因素的影响能力大小顺序为:解吸剂浓度>解吸时间>解吸剂用量。提取过程的正交实验得到四个因素的影响能力大小顺序为:提取剂用量>提取剂浓度>提取温度>提取时间。与超声波法、微波法及回流法相比,内部沸腾法在黄酮得率上无显著差异,但成本更低,可以用于箬叶总黄酮的提取。
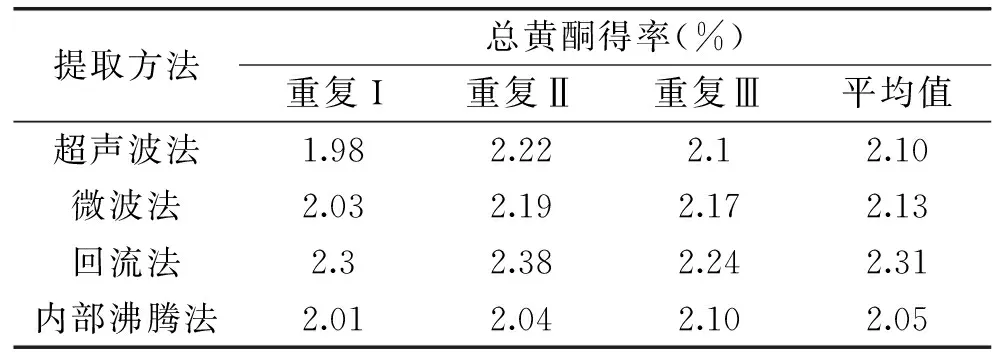
表9 提取方法对箬叶总黄酮含量的影响Table 9 The effect of extraction methods on the yield of flavonoids
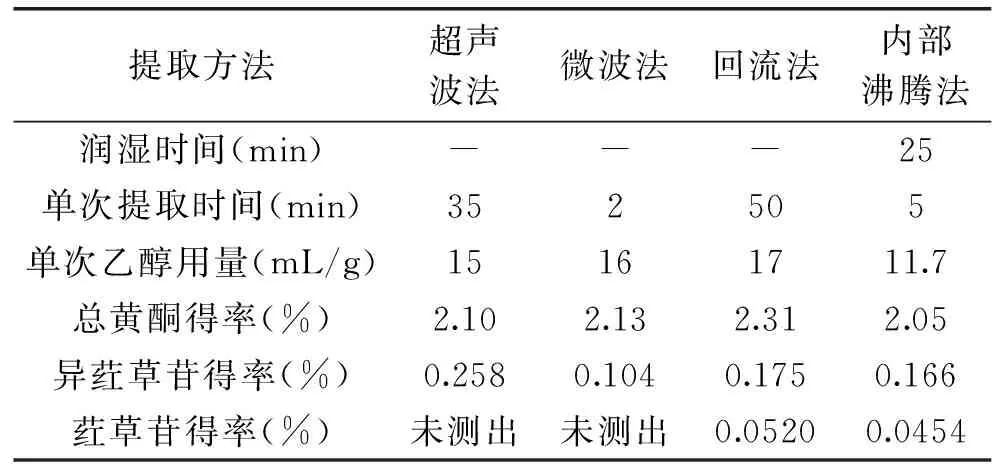
表10 多种方法提取箬叶总黄酮的比较Table 10 The comparison of different methods for extraction of flavonoids
[1]李水芳.箬叶化学成分的研究[D].长沙:中南林业科技大学,2006.
[2]李胜华,伍贤进,佘朝文. 阔叶箬竹叶的化学成分研究[J].中药材,2014,(4):604-607.
[3]王恩军,季文琦,范林林,等. 箬叶多糖抗肿瘤及调节免疫作用研究[J]. 医药导报,2013,32(5):586-589.
[4]李水芳,李姣娟. 箬叶化学成分的比较研究[J]. 食品研究与开发,2008,29(12):7-10.
[5]黄龙翔,戴果先,胡长玉. 箬叶提取物的制备及抗氧化活性研究[J]. 中国农学通报,2009,25(3):45-48.
[6]喻谨. 箬竹属竹叶化学成分研究[D]. 中国林业科学研究院,2014.
[7]李水芳,文瑞芝,曾栋,等. 阔叶箬竹叶和箬竹叶中挥发油的提取及成分分析[J]. 色谱,2007,25(1):53-57.
[8]艾文胜,汤腾方,杨建胜等.箬竹利用现状及叶用园营建技术[J].林业科技开发,2005,20(1):69-71.
[9]陈召桂,朱理,何剑飞,等. 不同地区箬叶中18种微量元素快速检测及分析[J]. 食品科技,2014,(10):323-326.
[10]孙克奎.响应面法优化箬叶多糖提取工艺及抑菌活性研究[J].食品工业,2014,35(4):35-38.
[11]苏春花,王福升,丁雨龙. 长节箬竹叶总黄酮提取工艺[J]. 林业科技开发,2010,24(5):87-90.
[12]崔健.箬竹属植物黄酮类物质与挥发性成分的研究[D].北京:中国林业科学研究院,2011.
[13]李水芳,喻勋林,李姣娟.箬叶总黄酮提取方法的研究[J].安徽农业科学,2007,35(20):6032-6033.
[14]郑韵英,童张法,韦藤幼.内部沸腾法提取银叶树叶总黄酮的研究[J].广西大学学报,2013,38(3):21-26.
[15]Shi L G,Wei T Y. Extraction of Total Flavonoids from Ginkgo biloba by Decompressing Inner Ebullition[J]. Medicinal Plant,2012,3(5):16-19.
[16]张艳军,彭重威,徐淑庆,等.银叶树树叶中总黄酮提取工艺优化[J].中草药,2012,35(4):638-641.
[17]陈晓光,韦藤幼,彭梦薇,等.丹参酚酸B减压内部沸腾法提取的动力学及相关热力学研究[J].高校化学工程学报,2012,25(6):961-965.
[18]翁艳英,韦藤幼,童张法.内部沸腾法提取三七多糖的研究[J].时珍国医国药,2011,22(6):1435-1436.
[19]陈晓光,韦藤幼,彭梦薇,等 .内部沸腾法提取香菇多糖的工艺优化[J].食品科学,2011,32(10):31-34.
[20]翁艳英,谭业怀. 减压内部沸腾法提取绞股蓝总黄酮的效果[J]. 湖北农业科学,2014,53(14):3367-3370.
[21]龚金炎,吴晓琴,夏道宗,等 .RP-HPLC法测定竹叶提取物中黄酮类和酚酸类成分[J].中草药,2010,41(1):63-65.
[22]张春娟,孟志芬,郭雪峰,等 . HPLC结合紫外光谱快速定性定量分析四种竹叶黄酮碳苷[J].光谱学与光谱分析,2014,34(9):2568-2572.
[23]孙冬梅,谭志灿,毕晓黎,等 . RP-HPLC法同时测定布渣叶中牡荆苷和异牡荆苷的含量[J].中国药房,2013,24(7):630-633.
Extraction of total flavonoids from leaves of Indocalamus using inner ebullition method
YUE Wei,LI Gang
(Wuhan Technoligy and Business University,Wuhan 430065,China)
Objective:To explore the optimum extraction process of total flavonoids from leaves of Indocalamus by inner ebullition method. Methods:Through single-factor experiments of desorption/extraction process and the orthogonal experiments,the optimal extract conditions of the total flavonoids from leaves of Indocalamus by using inner ebullition method was studied. The method was also compared with reflux method,ultrasonic method and microwave method. Results:The optimal desorption conditions were as follows:solid-liquid ratio was 1∶3,ethanol concentration was 90%,the resolution time was 25 min. The optimal extraction conditions were:solid-liquid ratio was 1∶30,the temperature was 85 ℃,ethanol concentration was 30%,the extraction time was 5 min .The yield of total flavonoids was 2.05%,the content of isoorientin and orientin was 1.656,0.454 mg·g-1.Comparing with reflux method,ultrasonic method and microwave method,the inner ebullition method had no significant difference of yield of flavonoids,but lesser amount of ethanol and cheaper cost.
inner ebullition;total flavonoids;Indocalamus
2015-06-18
乐薇(1979-),女,硕士,副教授,研究方向:生物分析:E-mail:yuewei11@126.com。
湖北省自然科学基金资助项目(2013C111)。
TS201.1
B
1002-0306(2016)05-0263-06
10.13386/j.issn1002-0306.2016.05.043

