[C4mim]BF4/MgSO4双水相萃取锁阳总黄酮及抗氧化分析
张喜峰,张芬琴,罗光宏
(1.河西学院农业与生物技术学院,甘肃张掖 734000;2.河西学院凯源生物技术开发中心,甘肃省微藻工程技术研究中心,甘肃张掖 734000)
[C4mim]BF4/MgSO4双水相萃取锁阳总黄酮及抗氧化分析
张喜峰1,张芬琴1,罗光宏2,*
(1.河西学院农业与生物技术学院,甘肃张掖 734000;2.河西学院凯源生物技术开发中心,甘肃省微藻工程技术研究中心,甘肃张掖 734000)
对[C4mim]BF4(1-丁基-3-甲基咪唑四氟硼酸盐)/MgSO4双水相萃取锁阳总黄酮的工艺条件及抗氧化作用进行研究。以[C4mim]BF4质量分数、MgSO4质量分数、锁阳总黄酮粗提物质量分数为响应因子,利用三因素三水平的响应面分析对锁阳总黄酮萃取条件进行优化,初步评价锁阳总黄酮抗氧化作用。结果表明,锁阳黄酮的最佳萃取条件为:[C4mim]BF4质量分数为13.025%、MgSO4质量分数为17.5%及粗提液质量分数12%,萃取率达到98.4%。锁阳总黄酮的抗氧化性随着浓度升高而升高,当总黄酮浓度为0.6 mg/mL时,OH自由基清除率和DPPH自由基清除率分别达到65%和67.2%。
锁阳,双水相体系,总黄酮,抗氧化
锁阳(CynomoriumsongaricumRuPr.)是锁阳科(Cynomoriaceae)锁阳属多年生肉质草本植物,多寄生于蒺黎科(Zygophvllaceae)白刺属(Nityaria L.)植物根部,是全寄生种子植物[1]。主要产于甘肃、新疆、青海、宁夏、内蒙古等地。黄酮是锁阳中主要活性成分之一[2],具有抗肿瘤、抗疲劳、抗衰老作用[3-6]。
目前锁阳黄酮提取方法主要有醇提法[7]、超声波辅助提取[8]、超临界CO2萃取法[9]。这些提取方法存在提取效率较低、溶剂残留、能耗高、成本高等缺点。双水相是指两种水溶性的物质不相容而造成它们的混合溶液分离形成两相,通过溶质在两相之间分配系数的差异而进行萃取纯化或直接用其作为提取剂的体系[10]。离子液体双水相具有无毒、不易乳化、粘度低、分相时间短、操作简单等特点[11],已被广泛用于天然产物的分离[12-15]。
本实验以锁阳为材料,采用单因素实验和响应面分析法,优化C4mim]BF4/MgSO4双水相体系萃取黄酮的工艺,并探讨锁阳黄酮抗氧化能力,为其进一步开发提供实验依据。
1 材料与方法
1.1材料与仪器
锁阳产地甘肃,由甘肃凯源生物技术开发中心提供。
芦丁标准品(纯度≥98%)上海源叶生物科技有限公司;[C4mim]BF4中国科学院兰州化学物理研究所;MgSO4,无水乙醇,VC天津光复精细化工研究所;亚硝酸钠,硝酸铝,硫酸亚铁,双氧水,邻二氮菲均为分析纯天津百世化工有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)天津市富宇精细化工有限公司。
722可见分光光度计上海光谱仪器有限公司;旋转蒸发仪上海青浦沪西仪器厂。
1.2实验方法
1.2.1锁阳粗黄酮的制备精确称取锁阳干粉约10 g,置于500 mL烧杯中,按照1∶25(g/mL)加入80%乙醇,在325 W功率超声提取其中黄酮10 min,2000 r/min,离心10 min,得上清液,在旋转蒸发仪中蒸发浓缩,转入50 mL容量瓶中,加80%乙醇定容,即得锁阳黄酮粗提液[16]。
1.2.2锁阳黄酮双水相萃取方法体系总质量为10.00 g,加入适量的[C4mim]BF4、MgSO4和黄酮粗提液,充分振荡使成相物质溶解,静置至两相达到分离,锁阳黄酮富集于双水相系统的上相中,读取上下相体积,求相比R;分别测定上下相黄酮浓度,计算锁阳黄酮的分配系数K及提取率Y[14],如下式:
R=上相体积(Vt)/下相体积(Vb)
K=上相黄酮浓度(Ct)/下相黄酮浓度(Cb)
Y(%)=RK/(1+RK)×100
1.2.3标准曲线的绘制采用亚硝酸钠-硝酸铝-氢氧化钠法测定黄酮[17]。
1.2.4双水相萃取单因素实验室方法[C4mim]BF4质量分数对锁阳黄酮分配行为的影响:在[C4mim]BF4/MgSO4双水相体系中,MgSO4质量分数为20%,粗提液质量分数为10%,分别设定[C4mim]BF4质量分数为10%、12.5%、15%、17.5%、20%进行双水相萃取;MgSO4质量分数对锁阳黄酮分配行为的影响:在[C4mim]BF4/MgSO4双水相体系中,[C4mim]BF4质量分数为15%,粗提液质量分数为10%,改变MgSO4质量分数为15%、17.5%、20%、22.5%、25%进行双水相萃取;在[C4mim]BF4/MgSO4双水相体系中,[C4mim]BF4质量分数为15%,MgSO4的质量分数为17.5%,改变粗提液质量分数为1%、2%、3%、4%、5%进行双水相萃取。
1.2.5Box-Behnken组合设计研究最佳萃取条件在单因素实验的基础上,选取[C4mim]BF4、MgSO4和粗提液三个自变量,采用Design-Expert 7.0软件设计三因素三水平Box-Behnken实验,因素水平及编码见表1。

表1 Box-Behnken实验因素与水平
1.2.6锁阳总黄酮抗氧化分析
1.2.6.1锁阳总黄酮对·OH的清除实验参照加列西·那甫等[16]的方法。取0.75 mmol/L邻二氮菲溶液1 mL于试管中,依次加入0.2 mol/L pH7.4磷酸盐缓冲液2 mL,0.75 mmol/L硫酸亚铁1 mL,摇匀,加入0.01%过氧化氢溶液1 mL,于37 ℃水浴加热60 min,在536 nm波长处测定吸光度,所测得吸光度为损伤管的吸光值(A损伤)。未损伤管以1 mL水代替损伤管中过氧化氢,利用1.2.5萃取后的总黄酮溶液,配制不同浓度的样品溶液。依次取0.2 mL代替损伤管中的水,操作方法同损伤管,可测的536 nm波长处未损伤管的吸光值(A空白,A样品);芦丁、维生素C对羟自由基的清除效果测定方法同上。
1.2.6.2锁阳黄酮对DPPH的清除实验利用1.2.5萃取后的总黄酮溶液,配制不同浓度的样品溶液。分别取2 mL样品溶液,分别加入浓度为3×10-4mol/L的DPPH溶液2.0 mL,混合摇匀,反应20 min后在517 nm测定其吸光值A1。以2 mL无水乙醇代替DPPH的吸光值为A2,以2 mL蒸馏水代替样品溶液的吸光值为A0,以无水乙醇作空白对照[16]。DPPH自由基清除率可表示:
E(%)=[(1-(A1-A2)/A0]×100
1.3数据统计分析
单因素实验数据和响应面分析分别采用Excel2003和Design-Expert7.0.5软件分析,所有实验均重复三次,取平均值。
2 结果与分析
2.1标准曲线绘制
在510 nm处测定不同含量的芦丁的吸光值,以芦丁含量(mg)为横坐标(X),吸光值为纵坐标(Y),计算得到回归方程:Y=1.367X-0.0134,R2=0.9912。
2.2单因素实验结果与分析
2.2.1[C4mim]BF4质量分数对锁阳黄酮分配行为的影响由图1可知,随着[C4mim]BF4质量分数逐渐增大,黄酮萃取率和分配系数先增加后减小,在[C4mim]BF4质量分数为15%时,萃取率和分配系数达到最大值。主要原因是离子液体[C4mim]BF4和黄酮化合物之间形成π-π体系,促使黄酮转移至上相,当离子液体质量分数过大时,使得体系的黏稠度高,阻止相间分子转移,不利于黄酮的转移、分配及萃取。我们的观点与Yan etal等[17]的观点是一致的。因此,确定[C4mim]BF4质量分数为15%。

图1 [C4mim]BF4质量分数对锁阳黄酮分配行为的影响Fig.1 Effect of the mass percent of [C4mim]BF4on partitioning behaviour of total flavonoids of cynomorium songaricum
2.2.2MgSO4质量分数对锁阳黄酮分配行为的影响由图2可知,锁阳黄酮的萃取率和分配系数随MgSO4用量不同,呈规律性变化,表现为先增大后减小的趋势。在MgSO4质量分数为17.5%时,萃取率和分配系数同时达到最大,分别为99.35%和42.5。因为随着MgSO4质量分数的增加,双水相体系离开成相临界点距离增大,使上下相电位差值增大,而电位差的大小直接影响到分配系数和萃取率;MgSO4的质量分数过高,不仅影响黄酮的表面疏水性,而且扰乱双水相系统,改变各相中成相物质的组成,使萃取率和分配系数降低。因此,确定MgSO4的质量分数为17.5%。
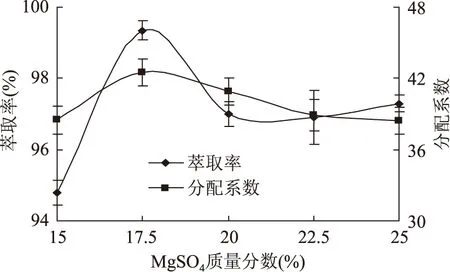
图2 MgSO4质量分数对锁阳黄酮分配行为的影响Fig.2 Effect of the mass percent of MgSO4on partitioning behaviour of total flavonoids of cynomorium songaricum
2.2.3粗提液质量分数对锁阳黄酮分配行为的影响结果表明,粗提液质量分数为10%时,锁阳黄酮的分配系数和萃取率达到最大,分别为98.16%和46.2(图3),原因可能是黄酮类化合物羟基基团破坏水分子之间的氢键网络,黄酮类化合物和水分子之间形成新的氢键网络促使粗提物中其他类物质转移至下相;当粗提液质量分数大于10%时,萃取率和分配系数均逐渐降低;这是由于过量黄酮类化合物集聚在两相间,影响两相中传质过程。因此确定粗提液质量分数10%为最佳萃取条件。
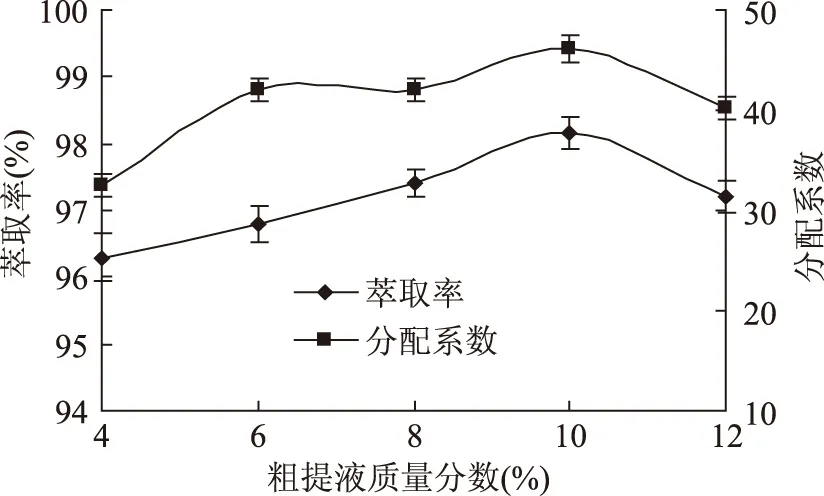
图3 粗提液质量分数对锁阳黄酮分配行为的影响Fig.3 Effect of the mass percent of crude flavone on partitioning behaviour of total flavonoids of cynomorium songaricum
2.3响应面分析实验结果
2.3.1Box-Behnken Design实验数据分析根据以上单因素实验结果,采用响应面方法进一步优化实验条件。根据Box-Behnken组合设计原理,以萃取率为响应值,以[C4mim]BF4质量分数(A)、MgSO4质量分数(B)和粗提液质量分数(C)为实验因素设计实验,分析实验结果见表2。
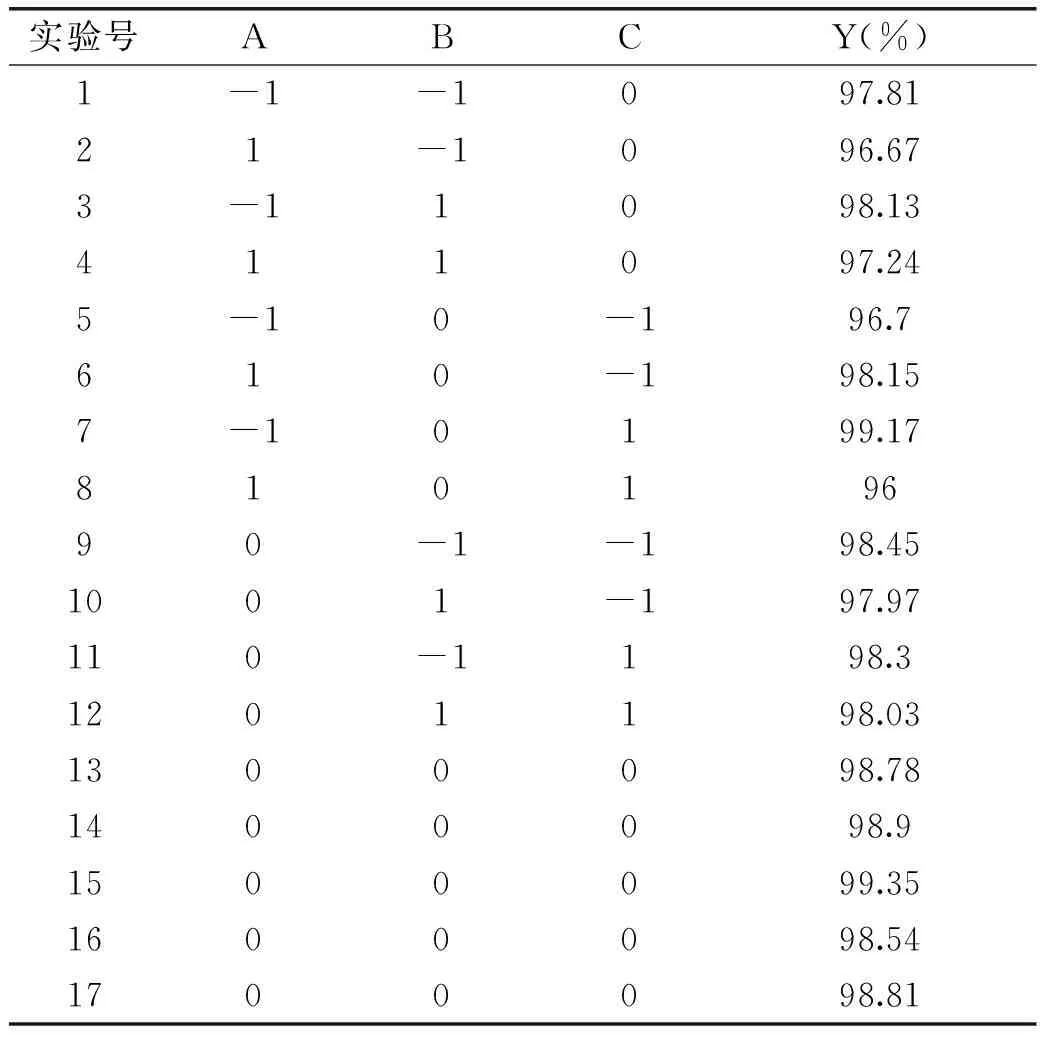
表2 Box-Behnken实验设计与结果
以锁阳黄酮萃取率Y(%)为响应值,根据表2的实验结果,用Design-Expert7.0软件对各因素进行二元多次回归拟合,得到[C4mim]BF4质量分数(A)、MgSO4质量分数(B)和粗提液质量分数(C)与锁阳黄酮之间的二次多项回归方程:
Y=98.876-0.46875A+0.0175B+0.02875C+0.0625AB-1.155AC+0.0525BC-1.048A2-0.3655B2-0.323C2
由表3可以看出,本模型拟合程度明显,p=0.001<0.01,模型极显著。失拟项p为0.3653(p>0.05)没有显著意义,说明数据中没有异常点。模型决定系数为94.82%,说明该模型具有较好的可信度,自变量与响应值之间的线性关系显著,可用于实验的理论预测。模型一次项A(p<0.01)对黄酮萃取率有极显著意义,B、C对黄酮萃取率不显著;二次项A2(p<0.01)对黄酮萃取率有极显著意义;交互项AC(p<0.01)对黄酮萃取率有极显著意义,AB、BC对黄酮萃取率不显著。在所选取的各因素水平范围内,各因素的主效应关系为:[C4mim]BF4质量分数(A)>粗提液质量分数(C)>MgSO4质量分数(B)。

表3 对拟合二次多元模型的方差分析结果
2.3.2双水相萃取锁阳黄酮的响应面图分析根据回归模型作出相应的响应面图,如图4所示,每个响应面图分别代表2个独立变量之间的相互作用,由响应面可以看出,AC之间有一定相互作用,AB、BC交互作用较小。
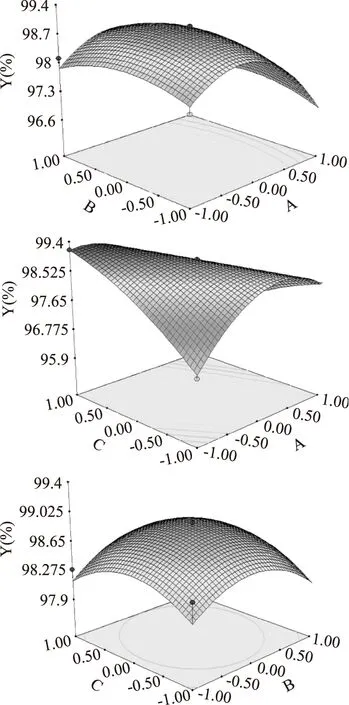
图4 各因素交互作用的响应面立体图Fig.4 Response plots for the pairwise interactive effects
2.3.3模型优化及验证实验以响应面优化实验得到双水相体系组成条件:[C4mim]BF4质量分数为13.025%、MgSO4质量分数为17.5%,粗提液质量分数12%,此时锁阳黄酮的萃取效果最佳,萃取率为99.21%。在此条件下做三组平行实验进行验证,所得结果为98.4%,与模型预测值基本一致,实验结果具有一定的使用参考价值。
2.4锁阳黄酮抗氧化活性分析
2.4.1羟自由基清除能力由图5可知,萃取后锁阳黄酮对羟自由基清除能力随着黄酮浓度增加而升高,当黄酮浓度为0.6 mg/mL时,锁阳黄酮对羟自由基清除能力达到65%,锁阳黄酮对羟自由基清除能力的IC50值为0.445 mg/mL;同样条件下,VC对羟自由基清除能力强于锁阳黄酮。

图5 锁阳黄酮对羟自由基的清除能力Fig.5 Hydroxyl Radical Scavenging effect of total flavonoids of cynomorium songaricum
2.4.2DPPH自由基清除能力由图6可知,随着黄酮浓度不断增大,对DPPH自由基清除能力也增大;当黄酮浓度为0.6 mg/mL时,锁阳黄酮对DPPH自由基清除能力达到67.2%。锁阳黄酮DPPH自由基清除能力的IC50值为0.469 mg/mL;在黄酮浓度0.1~0.6 mg/mL范围内,VC对DPPH自由基清除能力优于锁阳黄酮。
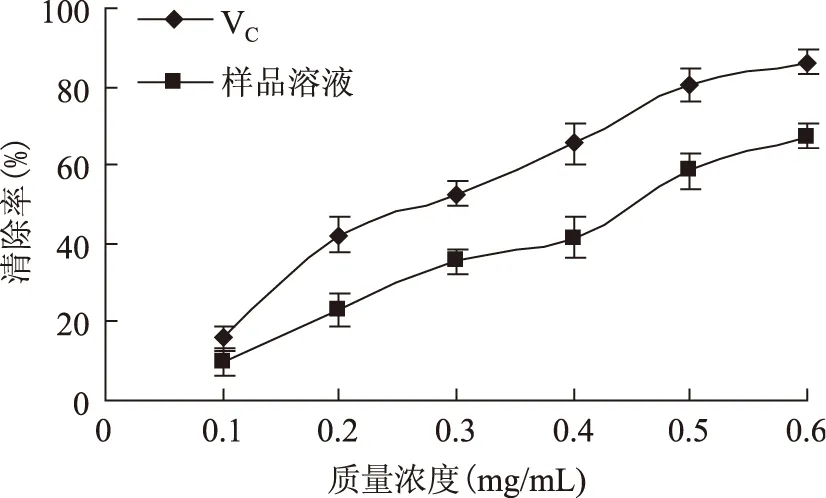
图6 锁阳黄酮对DPPH自由基的清除率Fig.6 DPPH free radical scavenging effect of total flavonoids of cynomorium songaricum
3 结论
采用离子液体双水相萃取锁阳黄酮,在单因素实验的基础上,以锁阳黄酮萃取率为响应值,得到锁阳黄酮的最佳提取工艺为[C4mim]BF4质量分数为13.025%、MgSO4质量分数为17.5%和粗提液质量分数12%,在此提取条件下锁阳黄酮的萃取率为98.4%,说明采用响应面法优化离子液体双水相萃取锁阳黄酮是比较可靠的。
萃取后锁阳黄酮的抗氧化能力实验结果表明,当黄酮浓度在0.1~0.6 mg/mL时,黄酮对羟自由基和DPPH清除能力逐渐增大的;锁阳黄酮对羟自由基清除能力的IC50值为0.445 mg/mL;锁阳黄酮DPPH自由基清除能力的IC50值为0.469 mg/mL;同样条件下,对羟自由基和DPPH自由基清除能力低于VC。
[1]袁晶,张霁红,曾朝珍,等.锐孔法制作锁阳提取物微胶囊的工艺优化研究[J].农业工程技术·农产品加工业,2014(2):28-32.
[2]杨瀚春,王荣,夏鹏霄,等.用 HPLC 法同时测定锁阳中的多种有效成分[J].药学服务与研究,2014,14(2):122-124.
[3]Chen F,Xiong H,Wang J,et al. Antidiabetic effect of total flavonoids from Sanguis draxonis in type 2 diabetic rats[J]. Journal of ethnopharmacology,2013,149(3):729-736.
[4]Jin S,Yin Y.Invivoantioxidant activity of total flavonoids from indocalamus leaves in aging mice caused by D-galactose[J].Food and Chemical Toxicology,2012,50(10):3814-3818.
[5]俞发荣,冯书涛,谢明仁,等.锁阳黄酮对老年大鼠的抗疲劳作用[J].中国康复理论与实践,2008,14(12):1141-1142.
[6]俞发荣,冯书涛,谢明仁,等.锁阳黄酮对大鼠运动耐力的影响及抗氧化作用[J].现代药物与临床,2009,24(1):52-54.
[7]康新平,热娜,卡斯木,等.新疆锁阳中总黄酮的提取工艺优化及含量测定[J].时珍国医国药,2009,20(1):105-106.
[8]杨林,林鹏,钱娇玲,等.响应面法优化锁阳总黄酮超声提取工艺[J].中医药学报,2013,41(5):76-80.
[9]栾娜,李迪.超临界CO2萃取锁阳中黄酮的工艺研究[J].中药材,2010(7):1167-1171.
[10]潘利华,姜苏薇,罗建平.一种灵芝酸和灵芝多糖的双水相体系提取方法[P].中国:201010246731.6.
[11]沙永春.离子液体双水相技术的应用进展[J].化学世界,2013,54(11):698-701.
[12]巩育军,牛盛童,黄学锋,等.离子液体双水相萃取山楂黄酮和多糖的研究[J].化学与生物工程,2014,31(7):27-29.
[13]苏文斌,兰瑞家,徐瑶瑶.离子液体双水相微波辅助萃取姜黄中姜黄素[J].理化检验(化学分册),2014,50(5):579-582.
[14]Desai R K,Streefland M,Wijffels R H,et al. Extraction and stability of selected proteins in ionic liquid based aqueous two phase systems[J].Green Chemistry,2014,16(5):2670-2679.
[15]Vicente F A,Malpiedi L P,e Silva F A,et al. Design of novel aqueous micellar two-phase systems using ionic liquids as co-surfactants for the selective extraction of(bio)molecules[J]. Separation and Purification Technology,2014,135:259-267.
[16]加列西,马那甫,景伟文.甘草籽黄酮,多糖复合提取工艺参数优化及抗氧化性研究[J]. 药物分析杂志,2014,34(4):686-692.
[17]Yan JK,Ma HL,Pei JJ,et al. Facile and effective separation of polysaccharides and proteins from Cordyceps sinensis mycelia by ionic liquid aqueous two-phase system[J].Separation and Purification Technology,2014,135:278-284.
Aqueous two phase system based on[C4mim]BF4/MgSO4for isolation of total flavonoids fromCynomoriumSongaricumand its antioxidation activity analysis
ZHANG Xi-feng1,ZHANG Fen-qin1,LUO Guang-hong2,*
(1.The College of Agriculture and Biotechnology(CAB),Hexi University,Zhangye 734000,China;2.Microalgae Engineering Research Center of Gansu Province,Kaiyuan Bio-tech Development Center,Hexi University,Zhangye 734000,China;)
An efficient aqueous two-phase based on[C4mim]BF4/MgSO4extraction technique was developed to extract total flavonoids fromCynomoriumSongaricumand evaluate the antioxidant activity.[C4mim]BF4concentration(%w/w),MgSO4concentration(%w/w),and crude extract concentration(%w/w)were selected as response factors,and the yield of total flavonoids was used as response value. The optimum conditions for total flavonoids extraction were obtained based on three-factor-three-level experiment design according to the principles of response surface methodology,and antioxidation activity was evaluated. The optimum conditions were 13.025%(w/w),17.5%(w/w),and 12%(w/w)for[C4mim]BF4concentration,MgSO4concentration,and crude extract concentration respectively. Maximum yield of extracted total flavonoids from the experiments was determined to be 98.4% under the optimal conditions. The antioxidant property of total flavonoids enhanced with flavonoids concentration increased. Hydroxy radical scavenging rate and DPPH free radical reached 65% and 67.2% respectively when total flavonoids concentration was 0.6 mg/mL.
CynomoriumSongaricum;aqueous two-phase system;total flavonoids;antioxidation
2015-03-10
张喜峰(1982-),男,硕士,讲师,研究方向:天然产物开发,E-mail:curiouslysxsd@163.com 。
罗光宏(1965-),男,硕士,教授,研究方向:天然产物开发,E-mail:464690924@qq.com。
甘肃省中小企业创新基金项目(1047GCCG001);河西学院校长基金项目(XZ2014-29)。
TS
A
1002-0306(2016)01-0000-00
10.13386/j.issn1002-0306.2016.01.000
——以渤海S油田为例

