重组产番茄红素大肠杆菌工程菌株中异戊烯异构酶(IDI)基因的筛选
韩 莉,张莎莎,王博军,刘京国,刘伟丰,*,王艳萍,陶 勇
(1.天津科技大学 食品工程与生物技术学院,天津 300457;2.中国科学院微生物研究所,北京 100101;3.北京农学院 生物科学与工程学院,北京 102206)
重组产番茄红素大肠杆菌工程菌株中异戊烯异构酶(IDI)基因的筛选
韩莉1,2,张莎莎2,王博军3,刘京国3,刘伟丰2,*,王艳萍1,*,陶勇2
(1.天津科技大学 食品工程与生物技术学院,天津 300457;2.中国科学院微生物研究所,北京 100101;3.北京农学院 生物科学与工程学院,北京 102206)
番茄红素是一类在食品、医药等领域具有广泛应用价值的萜类化合物。异戊烯基焦磷酸异构酶(isopentenyl diphosphate isomerase,IDI)是番茄红素合成途径中的关键酶,也是代谢工程改造的主要靶点。本研究为了系统比较不同来源IDI对重组大肠杆菌番茄红素(Lycopene)产量的影响,分别克隆了原核微生物、真核微生物、植物、古菌等多种来源的I型及II型异戊烯基焦磷酸异构酶(IDI)基因,在大肠杆菌E.coli中异源表达,在加强自身2-C-甲基-D-赤藓糖醇-4-磷酸(MEP)代谢途径的背景下,通过优化多靶点组合及转化时间提高番茄红素的合成水平。结果表明酿酒酵母来源的I型IDI(ScIDI)及枯草芽孢杆菌来源的II型IDI(BsIDI)在经优化的背景下可以获得最高的番茄红素产量,产量分别达到9.96 mg/g DCW,8.78 mg/g DCW,番茄红素积累在转化8 h达到最高,最高能达到10.29 mg/g DCW。本研究最终确定了不同类型IDI发挥功能的条件,为后续番茄红素以及萜类化合物的代谢途径的改造提供依据。
异戊烯基焦磷酸异构酶(IDI),大肠杆菌,番茄红素,代谢工程,MEP途径
番茄红素是一种天然萜类色素,主要存在于番茄等茄科植物的成熟果实中。它是目前自然界中发现的最强抗氧化剂之一。番茄红素可以有效地防治因衰老,免疫力下降引起的各种疾病。在食品、医药、饲料等领域具有广泛的应用价值。与所有的萜类化合物一样,番茄红素是由萜类通用前体——异戊烯焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)装配合成的[1]。通用前体物质IPP/DMAPP在生物体内主要有两条生成途径:甲羟戊酸途径(mevalonate pathway,MVA pathway)和2-C-甲基-D-赤藓糖醇-4-磷酸(2-methyl-D-erythritol-4-phosphate pathway,MEP pathway)生物合成途径[2-4]。其中,MVA途径主要存在于古细菌、真菌、以及动物体;而高等植物、大多数细菌、藻类则主要以MEP途径合成。野生型大肠杆菌以MEP途径作为唯一的萜类前体合成途径[5]。Martin等[6]在大肠杆菌中引入酿酒酵母(Saccharomyces cerevisiae)的MVA途径,从而构建了能够高产紫槐二烯(Amorphadiene)的工程菌,并为其他萜类化合物的生产提供了理论基础。Ajikumar P K等[7-9]就MEP途径中的各关键基因进行优化,来提高异戊二烯(Isoprene)的产量。
异戊烯基焦磷酸异构酶(isopentenyl diphosphate isomerase,IDI)催化IPP与DMAPP的异构化反应,是萜类化合物生物合成的一个重要的限速酶[10]。Rad S A等[11]在大肠杆菌中分别过表达大肠杆菌E.coli和地衣芽孢杆菌(Bacilluslicheniformis)的IDI基因,使番茄红素的产量有较大提高。在MVA途径和MEP途径中,异戊烯基焦磷酸异构酶IDI催化通用前体物质IPP/DMAPP之间进行异构化,再经过后续的酶催化反应,生成所要的目标产物。MVA途径中,两分子的乙酰辅酶A经过一系列的酶的催化作用,生成前体物质IPP,IPP经过IDI的异构化作用,生成其异构体DMAPP;而在MEP途径中,3-磷酸甘油醛和丙酮酸在一系列酶的作用下,同时生成IPP和DMAPP,IDI作为异构酶,平衡前体物质IPP/DMAPP的量,使得DMAPP在下游酶的作用下,进入目标产物的合成途径[12],如图1所示。
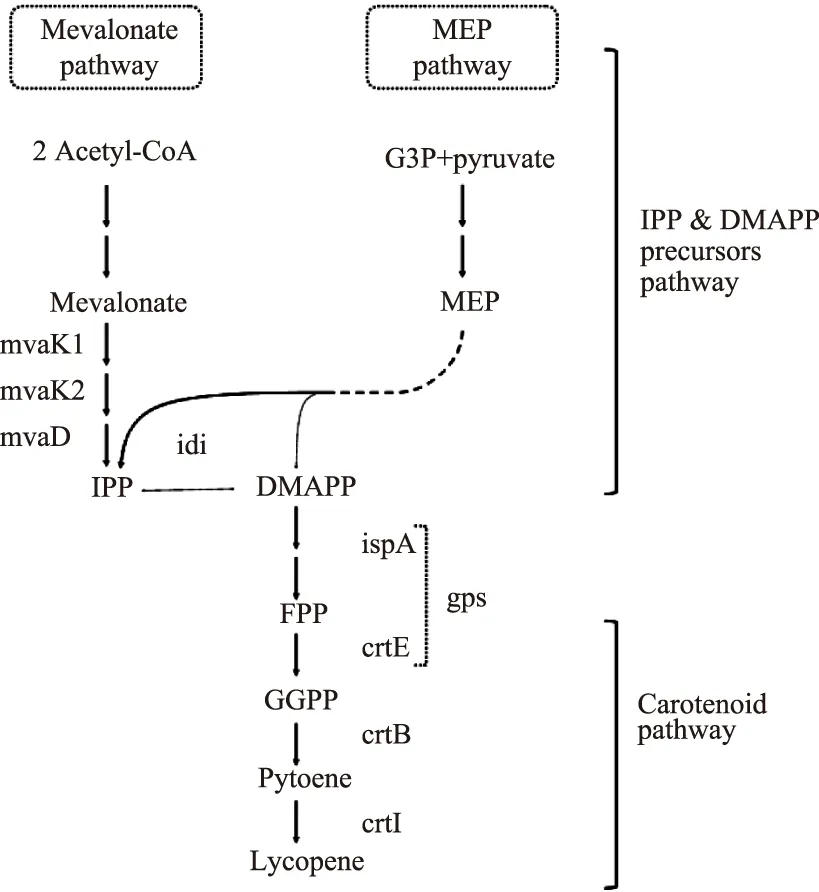
图1 IDI在番茄红素合成途径的作用[14]Fig.1 The role of IDI on lycopene biosynthesis pathway[14]
IDI在萜类化合物代谢途径中起到了至关重要的作用[13],目前工程菌株中强化IDI的策略往往局限在大肠杆菌来源基因idi等少数候选基因。IDI根据序列及催化机理可以分成I型IDI和II型IDI[10]。其中I型IDI分子量较小,约为20 u左右。催化中心为二价金属离子。II型IDI分子量约为35 u左右。催化活性中心含有FMN等辅基。不同来源IDI在大肠杆菌中的表达特性各不相同,对提高工程菌株中番茄红素产量的作用也各不相同。仍然有大量不同来源的idi基因没有得到表征。在本研究中,我们分别对不同种来源的I型及II型idi基因进行异源过表达,对不同来源IDI对工程菌株合成番茄红素的作用进行系统性研究,为后续萜类化合物代谢途径的进一步改造优化提供依据。
1 材料和方法
1.1材料与仪器
克隆宿主菌E.coliDH5α及表达宿主菌E.coliBW25113由中科院微生物所微生物生理与代谢工程院重点实验室保存;各种质粒由本实验室提供(具体信息见表1);胰蛋白胨、酵母粉Oxoid公司;DNA 分子量标准、蛋白分子量标准Thermo Scientific公司;TransStart FastPfu DNA聚合酶北京全式金生物技术有限公司;限制性内切酶(NcoⅠ、XhoⅠ等)NEB(北京)公司;质粒提取试剂盒、普通DNA 回收试剂盒和琼脂糖凝胶回收试剂盒Omega(北京)有限公司;其他试剂国产分析纯。
离心机Eppendorf 公司;凝胶成像系统美国BIO-RAD公司;SDS-PAGE 电泳仪美国BIO-RAD公司;UV-Vis(-NIR)分光光度计岛津公司(中国)。
1.2实验方法
1.2.1培养基和溶液的配制LB液体培养基(g/L):1%蛋白胨,0.5%酵母浸粉,1% NaCl。
LB固体培养基(g/L):1%蛋白胨,0.5%酵母浸粉,1% NaCl,1.5%琼脂粉。
抗生素终浓度:氯霉素17 μg/mL,卡那霉素50 μg/mL,链霉素50 μg/mL。
自诱导培养基(g/L):1%蛋白胨,0.5%酵母浸粉。
1000×微量元素:50 mmol/L FeCl3,20 mmol/L CaCl2,10 mmol/L MnCl2,10 mmol/L ZnSO4,CoCl2、NiCl2、Na2MO4、Na2SeO3、H3BO3各 2 mmol/L。
50×M:1.25 mol/L Na2HPO4,1.25 mol/L KH2PO4,2.5 mol/L NH4Cl,0.25 mol/L Na2SO4。
50×5052:25%甘油,2.5%葡萄糖,10%阿拉伯糖。

表1 用于本研究的菌株和质粒
1 mol/L MgSO4:称取24.6 gMgSO4·7H2O加ddH2O溶解,定溶至 100 mL,高压灭菌。
自诱导培养基[15]ZYM:在100 mL ZY 培养基中加入 2 mL 50×M,2 mL 50× 5052,200 μL 1 mol/L MgSO4,100 μL 1000×微量元素。
M9培养基:100 mL培养基中含终浓度 2 mmol/L MgSO4,0.1 mmol/L CaCl2,20 mL 5×M9盐溶液(200 mL溶液中含Na2PO4·7H2O 12.8 g,KH2PO43.0 g,NaCl 0.5 g,NH4Cl 1.0 g)
1.2.2目的基因的克隆以实验室保存的基因组为模版,按表2中相应的正反向配对引物,使用pfu DNA聚合酶分别扩增得到ecoidi,savidi,scoidi,ptidi,mmidi,bsidi,scidi这几个目的基因。PCR条件:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,30个循环;72 ℃ 5 min。
1.2.3目的基因构建到表达载体将载体pSB1s用NcoI和XhoI双酶切,回收条带。同样上述目的基因的PCR产物用相应的限制性内切酶处理,按照表1的描述,将相应的目的基因片段与载体连接[16],转化E.coliDH5α。涂相应抗性的Str(使用终浓度为50 μg/mL)平板,待长出菌落后挑取克隆鉴定,验证引物分别pBAD-F/pBAD-R,鉴定正确的送北京睿博兴科测序,鉴定正确的重组载体分别命名pSEco、pSSav、pSSco、pSPt、pSBs、pSSc及pSMm(如表1描述)。将载体pSX用NcoI和XhoI双酶切,回收目的条带。将相应的目的基因片段与载体连接,按上述过程筛选鉴定得到相应重组质粒pSXEco、pSXSav、pSXSco、pSXPt、pSXBs、pSXSc及pSXMm(如表1描述)。
1.2.4重组菌株的诱导表达及生物转化在MEP途径强化菌株PX中表达不同来源的IDI的实验部分,分别将pSEco、pSSav、pSSco、pSPt、pSBs、pSSc及pSMm与番茄红素报告质粒pREIBk共转化入PX菌株,同时在此背景中转入空载体pSB1s。其中PX菌株以敲除pgi使得糖代谢途径进入ED途径以及PP途径,对MEP的前体物质3-磷酸甘油醛和丙酮酸的量进行平衡[17]。在利用异源的IDI构建高水平合成番茄红素的工程菌株的实验部分,分别将pSXEco、pSXSav、pSXSco、pSXPt、pSXBs、pSXSc及pSXMm与番茄红素报告质粒pREIBk共转化入PXDF菌株,涂Str、Kan(使用终浓度为50 μg/mL)平板进行筛选培养,得到相应的MEP重组菌株,同时在此背景中转入空载体pSX。其中PXDF菌株是在菌株PX的背景上,对MEP途径的关键基因靶点ispD、ispF的染色体上的内源启动子用强的T5启动子进行替换,而得到的MEP背景强化菌株。
挑取单克隆在新鲜的相应抗性的LB培养基中培养,待OD值到达0.6~0.8,以1%的接种量转接到5 mL的相应抗性的ZYM培养基中,诱导培养12~14 h,诱导后测OD600,并取30OD诱导后的菌,在4 ℃,4000 r/min的条件下离心,弃去培养基,然后用M9培养基和4% 葡萄糖(总体积3 mL)的转化液重悬菌体,37 ℃,280 r/min摇床进行生物转化20 h。分别测定转化前后番茄红素产量水平。在对相应工程菌株进行转化时间的优化时,如前所述,接种工程菌株于自诱导培养基诱导后,转接于含4%葡萄糖的M9培养基中。分别选取转化0、8、20 h,进行番茄红素合成水平的检测。
1.2.5番茄红素的测定番茄红素的测定方法参照Li Chun等[17]。具体操作:对进行生物转化前后的菌体细胞,分别测定转化0 h和20 h的OD600,取1×108cfu细胞的培养液离心收集菌体,双蒸水洗涤菌体一次,于菌体中加入1 mL丙酮,冰上萃取2 h后,13000 r/min,10 min离心,吸取上清液,用分光光度计扫描340~550 nm的吸收光谱,并读取474 nm处的特征吸收峰值。再根据标准曲线计算番茄红素的产量。实验设计三次重复。

表2 用于本研究的引物
注:Restriction sites are underlined.
2 结果与讨论
2.1I型IDI与II型IDI的序列分析
选择大肠杆菌(Escherichiacoli)来源IDI(EcIDI)、阿维链霉菌(Streptomycesavermitilis)来源IDI(SavIDI)以及天蓝链霉菌(Streptomycescoelicolor)来源IDI(ScoIDI)作为原核微生物I型IDI代表;选择酿酒酵母(Saccharomycescerevisiae)来源IDI(ScIDI)为真核微生物I型IDI的代表;选择杨树(Populustomentosa)来源IDI(PtIDI)为植物I型IDI的代表。同时我们选择了芽孢杆菌(Bacillussubtilis)来源IDI(BsIDI)作为原核微生物II型IDI的代表;选择了马氏甲烷八叠球菌(Methanosarcinamazei)来源IDI(MmIDI)为古菌II型IDI的代表。
采用Vector NTI分别对所选择的I型IDI和II型IDI进行了序列比对分析。结果表明在所选I型IDI中(图2),SavIDI、ScoIDI、PtIDI、ScIDI与EcoIDI的氨基酸序列一致性分别为43.43%、38.58%、25.93%、36.51%。所有5种I型IDI均含有保守的与催化功能相关的二价金属离子结合位点。BsIDI与MmIDI二种II型IDI间的氨基酸序列一致性为41.91%。二种II型IDI均含有与FMN辅酶结合的保守氨基酸位点(图3)。

图2 I型IDI的序列分析Fig.2 Sequence analysis of type I IDI

图3 II型IDI的序列分析Fig.3 Sequence analysis of type II IDI
2.2I型IDI及II型IDI的重组表达
为了有利于在代谢工程应用中的不同蛋白间表达平衡,实验将全部IDI克隆到以pSC101为复制起始位点的低拷贝表达载体pSB1s中。将重组质粒转入大肠杆菌表达宿主BW25113中。其中在BW25113中转入pSB1s作为对照。经阿拉伯糖诱导后检测可溶性表达情况。SDS-PAGE分析结果表明(图4),所有I型IDI未见明显可溶性表达带。这一结果与实验之前表达EcIDI的结果相一致,表明I型IDI在大肠杆菌中发挥作用与重组蛋白表达量没有必然关系。来源于枯草芽孢杆菌的II型IDI(BsIDI)可见明显可溶性表达带,而MmIDI的表达带则不明显,则无法通过SDS-PAGE检测。
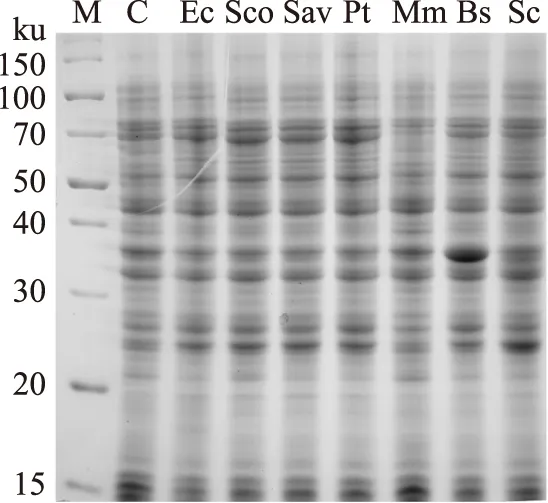
图4 不同IDI的SDS-PAGE分析Fig.4 SDS-PAGE analysis of IDIs注:M:蛋白分子量标准;C:对照组pSB1s。
2.3在MEP途径强化菌株中表达IDI对番茄红素产量的影响
将上述构建的重组质粒转入含有番茄红素合成质粒pREIBk的MEP途径强化菌株PX中,获得不同的IDI/PX菌株。在含有阿拉伯糖的自诱导培养基中诱导培养16 h后,在含有4%葡萄糖的M9培养基中转化20 h。以番茄红素的产量作为检测指标,比较不同来源的IDI在MEP背景菌株中对于番茄红素产量的影响。结果如图5,在异源表达不同种来源的IDI基因后,重组菌株的番茄红素产量得到了不同程度的提高。重组表达I型IDI能够更有效地提高番茄红素产量。其中,表达SavIDI(阿维链霉菌来源)、ScoIDI(天蓝链霉菌来源)、PtIDI(杨树来源)的菌株番茄红素产量要明显高于其它菌株,番茄红素产量分别可达6.78、6.59、6.29 mg/g DCW。其中最高的SavIDI比没有转化IDI的对照菌株产量(0.69 mg/g DCW)可提高约9倍。

图5 不同IDI对番茄红素产量的影响Fig.5 The effects of IDIs on lycopene production
I型IDI对番茄红素产量的影响为SavIDI>ScoIDI>PtIDI>EcoIDI>ScIDI。而强化II型IDI工程菌株中,番茄红素产量明显低于I型IDI强化菌株。其中BsIDI对番茄红素产量的影响接近I型IDI中的ScIDI,番茄红素产量为4.41 mg/g DCW,约为对照菌株的6倍。而MmIDI则对番茄红素产量提高最低,仅提高了约60%。
2.4利用异源IDI构建高水平合成番茄红素的工程菌株
以上结果表明异源IDI的强化对MEP途径的强化具有明显的作用。但合成番茄红素工程菌株的构建需要在强化IDI的同时,协同强化其它代谢途径靶点。其中DXS是MEP途径中另一关键性的强化靶点。为了构建高水平合成番茄红素的大肠杆菌工程菌株,实验将不同来源的idi基因构建到上游含有大肠杆菌dxs基因的pSB1s载体中。通过协同表达DXS和IDI两种靶点来进一步提高番茄红素的合成水平。我们将相关质粒转化到强化MEP途径的PXDF菌株中,获得不同的XI/PXDF菌株。在含有阿拉伯糖的自诱导培养基中诱导培养16 h后收集菌体,转入含有4%葡萄糖的M9培养基中进行生物转化。检测转化20 h后番茄红素产量。结果表明(图6),强化ScIDI的工程菌株获得了最高的番茄红素产量,番茄红素产量可达9.96 mg/g DCW。而强化II型IDI的BsIDI强化菌株番茄红素产量可达8.78 mg/g DCW。以上结果暗示,I型IDI和II型IDI均可在合成番茄红素工程菌株中发挥明显的作用。但其作用不仅与IDI本身的活性有关,同时与DXS等其它靶点强化背景有关。

图6 不同IDI在工程菌株中的作用Fig.6 The effects of IDIs in engineering strains
2.5工程菌株合成番茄红素转化时间的优化
以上结果表明,异源IDI对合成番茄红素的作用在不同背景下各不相同。为了确定最优的番茄红素合成条件,我们进一步系统比较了上述工程菌株中分别含有EcoIDI、ScoIDI、SavIDI、PtIDI、ScIDI等5种I型IDI及BsIDI(II型IDI)等6株工程菌株的番茄红素合成特性。结果表明(图7),所有6株工程菌株均在8 h时达到番茄红素的最高积累。其中含有ScIDI的工程菌株番茄红素产量最高,于转化8 h时可达10.29 mg/g DCW。以上结果显示,在进行自诱导培养后,细胞内获得代谢途径中一定的酶积累量,在提供生物转化培养基进行进一步的转化时,产物呈现逐步积累的状态,但同时细胞处于生长状态,随着转化的进行,前体物质不断消耗使得前体物质供应不足,导致在转化的后期单位细胞的产量有所下降。从而呈现出在8 h 时产量最高的现象。

图7 转化时间对番茄红素产量的影响Fig.7 The effects of bioconversional time on lycopene production
3 结论与讨论
异戊烯焦磷酸异构酶(IDI)是合成番茄红素、β-胡萝卜素、异戊二烯等萜类化合物的关键催化酶类。也是代谢工程对萜类化合物合成途径改造的最重要的靶点之一。IDI在蛋白质序列及催化机制上可以分成I型与II型,但2种IDI在生物工程改造中促进萜类化合物的各自作用仍然不清楚。Rad S A[11]等报道II型IDI在大肠杆菌工程菌株中更有利于番茄红素的合成,但由于候选基因过少,并没有对2类IDI进行系统性比较。在本研究中,我们分别选择原核微生物、真核微生物、植物、古菌等来源的2类IDI进行了系统性分析,分别通过过表达及与其它靶点的协同作用研究了不同IDI种类在工程菌株的作用。为进一步萜类化合物代谢工程的改造提供了充足的依据。
在代谢工程构建微生物工程菌株过程中,通常过表达单个基因会造成“蛋白质预算”的失衡[18]。有研究表明采用强启动子、高拷贝复制起始位点蛋白重组表达常用的元件,往往不能达到模块功能的理想最优状态。Jones KL等[19]认为强启动子、高拷贝数质粒往往会在菌株代谢过程中造成代谢压力,有毒产物积累,同时在菌体内存在稳定性问题,相反,低拷贝质粒能够通过缓解代谢压力而对产物水平进行优化。为此我们采用低拷贝的pSB1s表达载体表达IDI,为进一步工程菌株的改造和多靶点蛋白表达的协同优化打下基础。我们的结果显示I型IDI在发挥功能时往往不需要过高的表达量,从而减少了对其它靶点的干扰,使这一类IDI成为番茄红素工程菌株构建时的良好候选酶类。在工程菌株中,来自于酿酒酵母的I型IDI(ScIDI)与来自枯草芽孢杆菌的II型IDI(BsIDI)能够最有效地促进工程菌株番茄红素的合成,而在单独强化IDI时杨树来源的IDI(PtIDI)则作用最为明显。这一结果显示IDI在不同的背景下发挥作用各不相同,可能是由于不同强化靶点叠加时的影响造成的。因此在实际应用过程中需充分考虑启动子、基因顺序等具体的表达手段。
IPP与DMAPP作为萜类化合物合成途径的通用前体物质,是在IDI作用下的同分异构体,这两种物质的分配比例会涉及到下游目标产物的合成,因此建立对IPP/DMAPP的含量进行检测的方法成为一个难点。本研究对于不同来源IDI基因对MEP途径菌株的番茄红素的产量的影响,分别从MEP途径中筛选出具有针对性的较好来源的IDI基因,可以应用于萜类化合物代谢途径改造的设计,同时也为生产番茄红素的基因工程菌株的改造提供一定的思路。
[1]Misawa N.Pathway engineering for functional isoprenoids[J].Current opinion in biotechnology,2011,22(5):627-633.
[2]Bochar D A,Stauffacher C V,Rodwell V W.Sequence comparisons reveal two classes of 3-hydroxy-3-methylglutaryl coenzyme A reductase[J].Molecular Genetics and Metabolism,1999,66(2):122-127.
[3]Hedl M,Tabernero L,Stauffacher C V,et al.Class II 3-hydroxy-3-methylglutaryl coenzyme A reductases[J].Journal of Bacteriology,2004,186(7):1927-1932.
[4]Kuzuyama T.Mevalonate and nonmevalonate pathways for the biosynthesis of isoprene units[J].Bioscience,Biotechnology,and Biochemistry,2002,66(8):1619-1627.
[5]Rodríguez-Concepción M,Boronat A.Elucidation of the methylerythritol phosphate pathway for isoprenoid biosynthesis in bacteria and plastids.A metabolic milestone achieved through genomics[J].Plant Physiology,2002,130(3):1079-1089.
[6]Martin V J J,Pitera D J,Withers S T,et al.Engineering a mevalonate pathway in Escherichia coli for production of terpenoids[J].Nature Biotechnology,2003,21(7):796-802.
[7]Ajikumar P K,Xiao W H,Tyo K E J,et al.Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli[J].Science,2010,330(6000):70-74.
[8]Lv X,Xu H,Yu H.Significantly enhanced production of isoprene by ordered coexpression of genes dxs,dxr,and idi in Escherichia coli[J].Applied Microbiology and Biotechnology,2013,97(6):2357-2365.
[9]Zurbriggen A,Kirst H,Melis A.Isoprene production via the mevalonic acid pathway in Escherichia coli(Bacteria)[J]. BioEnergy Research,2012,5(4):814-828.
[10]Berthelot K,Estevez Y,Deffieux A,et al.Isopentenyl diphosphate isomerase:A checkpoint to isoprenoidbiosynthesis[J].Biochimie,2012,94(8):1621-1634.
[11]Rad S A,Zahiri H S,Noghabi K A,et al.Type 2 IDI performs better than type 1 for improving lycopene production in metabolically engineered E. coli strains[J].World Journal of Microbiology and Biotechnology,2012,28(1):313-321.
[12]de Ruyck J,Wouters J,Poulter C D.Inhibition Studies on Enzymes Involved in Isoprenoid Biosynthesis:Focus on Two Potential Drug Targets:DXR and IDI-2 Enzymes[J].Current Enzyme Inhibition,2011,7(2).
[13]Zhou C,Li Z,Wiberley-Bradford A E,et al.Isopentenyl diphosphate and dimethylallyl diphosphate/isopentenyl diphosphate ratio measured with recombinant isopentenyl diphosphate isomerase and isoprene synthase[J].Analytical Biochemistry,2013,440(2):130-136.
[14]Yoon S H,Kim J E,Lee S H,et al.Engineering the lycopene synthetic pathway in E. coli by comparison of the carotenoid genes of Pantoea agglomerans and Pantoea ananatis[J].Applied Microbiology and Biotechnology,2007,74(1):131-139.
[15]Studier F W.Protein production by auto-induction in high-density shaking cultures[J].Protein Expression and Purification,2005,41(1):207-234.
[16]Gibson D G,Young L,Chuang R Y,et al.Enzymatic assembly of DNA molecules up to several hundred kilobases[J]. Nature Methods,2009,6(5):343-345.
[17]Li C,Ying L Q,Zhang S S,et al.Modification of targets related to the Entner-Doudoroff/pentose phosphate pathway route for methyl-d-erythritol 4-phosphate-dependent carotenoid biosynthesis in Escherichia coli[J].Microbial Cell Factories,2015,14(1):117.
[18]刘伟丰,陶勇. 蛋白质预算:合成生物学的成本标尺[J]. 生物工程学报,2013,29(8):1123-1132.
[19]Jones K L,Kim S W,Keasling J D.Low-copy plasmids can perform as well as or better than high-copy plasmids for metabolic engineering of bacteria[J].Metabolic Engineering,2000,2(4):328-338.
Screening of isopentenyl diphosphate isomerase(IDI) in engineeringEscherichiacolistrains for lycopene production
HAN Li1,2,ZHANG Sha-sha2,WANG Bo-jun3,LIU Jing-guo3,LIU Wei-feng2,*,WANG Yan-ping1,*,TAO Yong2
(1.College of Food Engineering and Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China;2.Institute of Microbiology,Chinese Academy of Sciences,Beijing 100101,China;3.College of Biological Science and Engineering,Beijing University of Agriculture,Beijing 102206,China)
Lycopene is a terpenoid pigment that has diverse applications in the fields of food and medicine. A prospective approach for lycopene production is by metabolic engineering in microbial hosts such asEscherichiacoli. Isopentenyl diphosphate isomerase(IDI)is the key enzyme in lycopene biosynthetic pathway,and one of the most important targets during metabolic engineering. In this study,in order to systematic compare the effects of different IDI on lycopene production,the type1 and type2 genes of isopentenyl diphosphate isomerase were cloned from different species,including prokaryotic microbe,eukaryotic microbe,plant,archaea,and heterologous expressed inEscherichiacoli. The effects of different IDI on lycopene production and the bioconversional conditions were investigated in a MEP-enhanced background inEscherichiacoli. In the result,ScIDI and BsIDI were the most efficient IDI species for lycopene production and the yield of lycopene rose to 9.96 mg/g DCW,8.78 mg/g DCW. As observed after bioconversion for 8 h,the yield of lycopene was up to a maximum of 10.29 mg/g DCW. The results will provide new information for further metabolic engineering study involved in lycopene and terpenoid production.
isopentenyl diphosphate isomerase(IDI);Escherichiacoli;lycopene;metabolic engineering;MEP pathway
2015-11-03
韩莉(1988-),女,硕士研究生,研究方向:食品科学,代谢工程,E-mail:hanlireal@163.com。
刘伟丰(1976-),男,博士,助理研究员,研究方向:代谢工程,E-mail:liuwfv@im.ac.cn。
王艳萍(1962-),女,博士,教授,研究方向:食品科学、生物技术,E-mail:ypwang@tust.edu.cn。
国家自然科学基金项目(31170038);中国科学院重点部署项目(KSZD-EW-Z-016-1)。
TS201.3
A
1002-0306(2016)13-0137-06
10.13386/j.issn1002-0306.2016.13.019

