野生蝉花与发酵菌丝体挥发性化合物分析
卫亚丽,刘爱英,吕 昱,汤洪敏,*(.贵州民族大学化学与环境科学学院,贵州少数民族医药资源开发与利用重点实验室,贵州贵阳550025;2.贵州大学农学院,贵州贵阳550025;.贵州大学真菌资源研究所,贵州贵阳550025)
野生蝉花与发酵菌丝体挥发性化合物分析
卫亚丽1,2,刘爱英3,吕 昱1,汤洪敏1,*
(1.贵州民族大学化学与环境科学学院,贵州少数民族医药资源开发与利用重点实验室,贵州贵阳550025;2.贵州大学农学院,贵州贵阳550025;3.贵州大学真菌资源研究所,贵州贵阳550025)
为研究不同提取方法对野生蝉花与发酵菌丝体挥发性化合物种类及含量的影响,首先通过ITS基因序列分析、菌落及产孢结构的形态特征对菌株GZU1205241进行鉴定。然后通过顶空固相微萃取(HS-SPME)和水蒸气蒸馏对野生蝉花和发酵菌丝体的挥发性化合物进行提取,并利用气相色谱-质谱(GC-MS)对两者挥发性化合物进行了测定。结果表明,菌株GZU1205241为蝉棒束孢菌。野生蝉花和发酵菌丝体分别含有56和58种挥发性物质,其中25种为共有物质。野生蝉花主要以酸类(90.08%)物质为主,其中油酸的相对含量达到了45.09%,棕榈酸的含量为21.18%,亚油酸的含量为9.44%。发酵菌丝体中主要也以酸类物质(86.57%)物质为主,其中棕榈酸的相对含量达到了38.44%,亚油酸的相对含量达到了18.58%,油酸的相对含量为12.83%。两种方法获得的野生蝉花及发酵菌丝体的挥发性成分种类及相对含量上有明显差别,水蒸气蒸馏法鉴定出的挥发性成分较多,而顶空固相微萃取鉴定出的挥发性成分比较少。但不论是蒸气蒸馏法还是顶空固相微萃取,野生蝉花及发酵菌丝体的挥发性成分都是以脂肪酸为主。
蝉花,挥发性化合物,顶空固相微萃取,气相色谱-质谱联用,蝉棒束孢
蝉花Cordyceps cicadae又称大虫草、金蝉花、蝉茸、虫花等,是蝉若虫感染蝉拟青霉菌(Paecilomyces cicadae)后形成的虫生真菌。现代药理学研究表明,蝉花能增强机体免疫调节功能[1],改善肾功能[2-3],抑菌[4-5],抗肿瘤[6-8]、抗病毒、抗辐射、抗疲劳、抗应激、抗氧化、抗惊厥[9]等。对于蝉花及蝉棒束孢活性物质的研究,主要集中在多糖[10]、氨基酸、核苷[11-12]、虫草酸等方面,对其他次生代谢产物,如麦角甾醇、脂肪酸、多球壳菌素[13]等研究较少。目前对野生蝉花和发酵菌丝体的挥发性物质研究未见报道,而从药食用真菌挥发性物质中鉴定分离药理活性物质,提取香精香料,通过研究天然挥发性化合物形成机制研制新的挥发性物质生物催化剂等已成为一个新兴的并且具有广泛商业前景的研究领域。
挥发性成分的提取多采用传统水蒸汽蒸馏法(HD)及顶空-固相微萃取法(HS-SPME)。目前,尚未见水蒸汽蒸馏法(HD)及顶空-固相微萃取法用于蝉花及菌丝体挥发性成分的研究报道。为了更系统地了解蝉花及菌丝体所含的挥发性成分,本文采用液体发酵技术对蝉棒束孢菌株进行培养,获得蝉棒束孢菌菌丝体;进一步采用挥发油提取器、顶空固相微萃取(HS-SPME)结合气相色谱-质谱(GC-MS)法确定野生蝉花与发酵菌丝体的挥发性物质组成,希望对从野生蝉花和菌丝体中分离鉴定新的或有价值的挥发性物质提供重要的理论意义;同时,对野生蝉花和菌丝体中挥发性物质进行比较,以期对研究野生蝉花和菌丝体中挥发性物质组成差异提供理论基础。
1 材料与方法
1.1 材料与仪器
野生蝉花 购自浙江中药材市场,经贵州大学真菌资源研究所鉴定为蝉花;菌株 采用组织分离法从野生新鲜蝉花中分离、纯化获得蝉棒束孢菌株(编号GUF1205241);正己烷 色谱纯,默克;氯化钠 分析纯,天津市科密欧化学试剂开发中心;马铃薯培养基PDA、莎氏培养基SDA、察氏培养基CDA 杭州百思生物技术有限公司。
试剂盒 宝生物工程(大连)有限公司;Agilent 7890A/5975C气-质联用仪 美国安捷伦公司;SB-100DT型超声波清洗仪 济南天华超声电子仪器有限公司;RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂。
1.2 液体发酵
将活化后的菌种接种至装有100 mL液体培养基的300 mL三角瓶中,置恒温恒湿培养箱中,28℃培养7 d,然后按10%的接种量转接至1 L三角瓶中。28℃恒温恒湿条件下静置培养15 d。过滤得发酵菌丝体,用清水洗涤3次,干燥,粉碎,制得液体发酵菌丝体样品。
1.3 形态学观察
1.3.1 菌落形态 将沙氏SDA、查氏CDA及PDA三种固体培养基制成平板,以点植法接种已经活化的蝉棒束孢菌种,即用接种针尖蘸取少量孢子点植在平板的中心位置,然后于28℃恒温培养箱中倒置培养,
14 d后观察并描述。
1.3.2 菌丝体及孢子形态观察 采用乳酸石炭酸棉蓝染色法对菌丝体及孢子进行染色,采用蔡氏数码显微镜进行观察照相。
1.4 菌种鉴定
1.4.1 菌株的形态观察及鉴定 将观察记载的宏观特征和微观产孢结构特征,参照Browm&Smith和Samson的分类系统进行经典的分类。
1.4.2 菌株的ITS基因序列测定及分子系统发育树的构建 DNA提取、基因扩增采用Lysis Buffer for Microorganism to Direct PCR(100次量)及Premix Taq
Version 2.0(Loading dye mix)试剂盒;DNA测序由上海英俊生物技术有限公司进行;测序获得的序列导入Mega 5.2中进行比对后,人工进行修正保存为fasta格式文件[14]比对后的序列用Mega 5.2程序的MP建树,经1000次bootstrap验证。
1.5 野生蝉花、菌丝体挥发性成分分析
1.5.1 水蒸气蒸馏法 取干燥的野生蝉花及菌丝体粉末,称取10 g,加300 L水浸泡2 h,参照《中国药典》2010年版一部附录XD挥发油测定法(甲法)提取。得到淡黄色油状物,用1 mL乙酸乙酯萃取,经无水硫酸钠干燥24 h后进行测定。
1.5.2 顶空固相微萃取法 分别将2 g野生蝉花、菌丝体样品放置在20 mL的顶空瓶中,加入2 g NaCl和8 mL经过煮沸冷却的蒸馏水,摇匀,用具有聚四氟乙烯垫的密封盖密封,将老化后的60 μm PDMS/DVB萃取头插入样品瓶顶空部分,于80℃吸附40 min,吸附后的萃取头取出后插入气相色谱进样口,于250℃解吸3 min,用于GC-MS分析检测。在萃取前,将萃取头在气相色谱进样口250℃活化10 min。
1.6 气质联用GC-MS分析
1.6.1 仪器 Agilent 7890A/5975C气-质联用仪,色谱柱:HP-FFAP,25 m×0.32 mm×0.25 μm。
1.6.2 气相色谱条件 采用不分流进样,进样口温度250℃;载气为氦气,流速1 mL/min。程序升温条件:40℃保留5 min后,以5℃/min上升到100℃,再以10℃/min,上升到150℃保留5 min,最后6℃/min升至230℃保留10 min。
1.6.3 质谱条件 接口温度250℃,EI离子源,电离能为70 eV,电离源温度为230℃,扫描范围:50~550。
2 结果与分析
2.1 菌落的形态特征
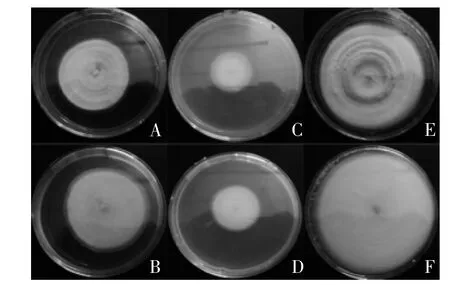
图1 GUF1205241菌株在三种不同培养基上的菌落形态Fig.1 Strains colony morphology on the three different medium
从图1可以看出,菌株都能在三种固体培养基上生长,菌株在PDA固体培养基上的直径最大,生长速度最快,其次在莎氏培养基上生长较快,在察氏培养基上的生长速度最慢。三种固体培养基上的菌落正面基本为白色,呈厚厚的绒毛状,背面培养基的颜色都有淡淡黄色,在SDA和PDA培养基上,菌落表面呈同心环,且整个菌落致密、平展,凸起部分有厚厚孢子粉,边缘为全缘。
2.2 菌株产孢结构

图2 GUF1205241菌株的分生孢子及分生孢子梗Fig.2 The conidium and conidium terrier of strains GUF1205241
从图2可以看出,菌株GUF1205241瓶状小梗有两型,即基部膨大的瓶形和基部不膨大的披针形,顶端皆具拉长的、偏离主轴的细管,瓶状小梗上溢出干燥的向基性分生孢子链,分生孢子内具油滴,分生孢子壁光滑、透明,两端皆稍尖细,腰微收,呈拟卵圆形、柱形及梭形,这些特征与Samson(1974)的描述相近似。
2.3 菌株系统发育分析

图3 GZU1205241菌株和相似属的一些种基于rDNA ITS-5.8S-ITS2序列构建的系统发育树Fig.3 Phylogenetic tree based on analysis of rDNA ITS-5.8S-ITS2 sequences of GZU1205241 and some related species
从GenBank中进行BLAST下载相似度大于95%的种以及一些形态相似的种共13个菌株,以Mariannaea camptospora为外群,用ClustalX 1.83软件进行多序列比对,用MEGA 5.2软件最大简约法(MP)构建系统发育树(图3)。从树图看出菌株GZU1205241与蝉棒束孢以100%的支持率聚在一起。综合菌株的菌落特征、产孢结构特征及系统发育分析将菌株GUF1205241鉴定为蝉棒束孢Isaria cicadae Miq.。
2.4 野生蝉花及发酵菌丝体挥发性成分分析
2.4.1 水蒸气蒸馏法 野生蝉花和菌丝体的挥发性成分GC-MS总离子流图见图4,通过NIST08谱库检索,野生蝉花中共鉴定出56种挥发性物质,发酵菌丝体中鉴定出58种挥发性物质,具体见表1。
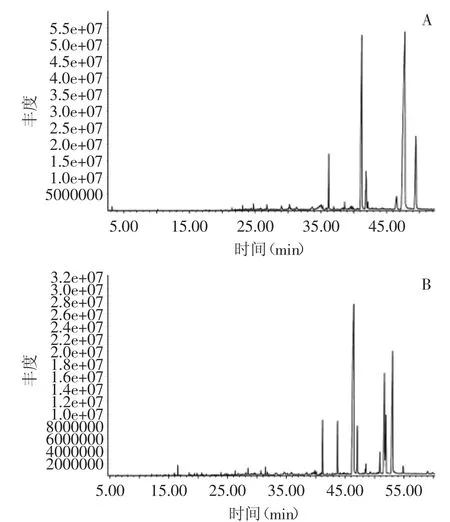
图4 野生蝉花(A)和发酵菌丝体(B)挥发性化合物总离子流色谱图(水蒸气蒸馏)Fig.4 Total ion chromatograms for the volatile components identified Cordyceps cicadae(A)and mycelia(B)of Isaria cicadae by steam distillation
从表1可以看出,野生蝉花中鉴定出56种挥发性化合物中含有醇(4种)、烷(18种)、烯(8种)、酮(4种)、醛(4种)、酸(12种)、酯(3种)等物质,主要以酸类(90.08%)物质为主,其中油酸的相对含量达到了41.48%,棕榈酸、亚油酸、十四酸、棕榈油酸、硬脂酸的相对含量分别为21.18%、9.44%、3.57%、3.20%、2.13%。其次是烷类、醇类、烯类化合物,分别占4.42%、2.64%、2.13%。酯类、酮类、醛类及其他化合物分别占0.64%、0.35%、0.10%、0.28%。
发酵菌丝体中58种挥发性化合物含有烷(20种)、烯(4种)、酮(2种)、酸(12种)、酯(9种)、萘(3种)、酚(2种)、醛(4种)、其他(2种)等挥发性物质,其中要以酸类(86.57%)物质为主,其中棕榈酸的相对含量达到了38.44%,亚油酸的相对含量达到了18.58%,油酸的相对含量达到了12.83%。十五烷酸、肉豆蔻酸、棕榈油酸、硬脂酸的相对含量分别为4.22%、4.19%、3.92%、2.28%;其次为酯类化合物(7.71%),酯类化合物中含量最高的是邻苯二甲酸二异辛酯(6.46%);烷类、酚类、醛类、烯类、其他、酮类、萘类相对含量分别为3.50%、0.73%、0.63%、0.63%、0.50%、0.10%、0.08%。
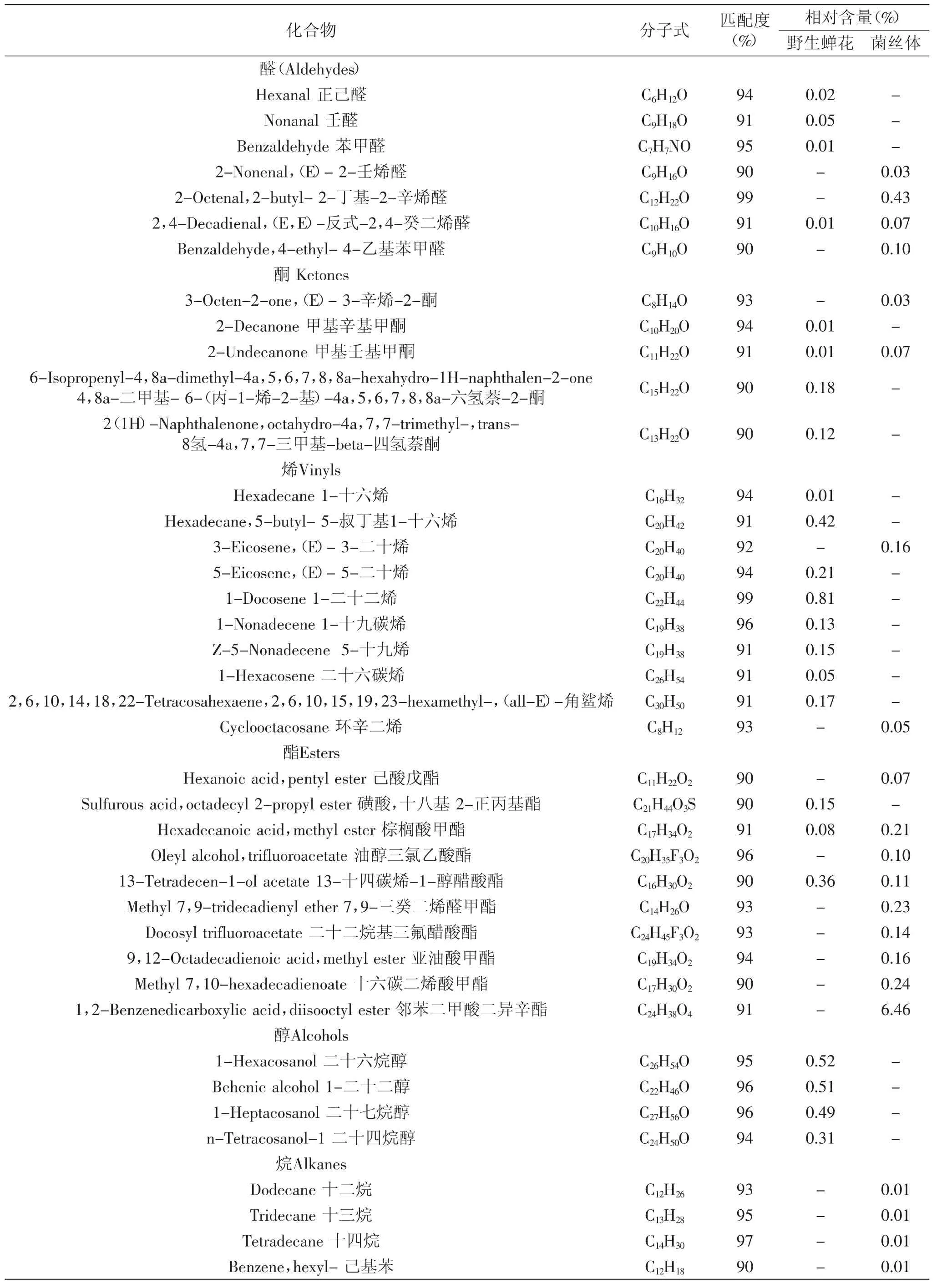
表1 野生蝉花及菌丝体挥发性化合物GC-MS分析Table1 Volatile compounds in Cordyceps cicadae Shing and cultured mycelia of Isaria cicadae analysed by GC-MS(steam distillation)

续表
综上所述,水蒸气蒸馏提取的挥发性的成分较多,野生蝉花及发酵菌丝体挥发性成分主要以酸类物质为主,两者共有物质有25种。
2.4.2 顶空固相微萃取 野生蝉花和菌丝体的挥发性成分GC-MS的总离子流图见图5,野生蝉花中共鉴定出22种挥发性物质。发酵菌丝体中鉴定出23种挥发性物质(顶空固相微萃取)见表2。
从表2可以看出,野生蝉花中鉴定出22种挥发性化合物,主要以酸类(83.62%)物质为主,其中油酸的相对含量为18.98%,除此之外,还含有棕榈酸(16.73%)、苯甲酸(6.81%)、壬酸(5.33%)、豆蔻酸(5.30%)、7-十六碳烯酸(5.12%)、庚酸(4.61%)、己酸(4.25%)、辛酸(4.11%)、癸酸(3.88%)、亚油酸(3.85%)、月桂酸(2.82%)、十五烷酸(2.44%)、乙酸(0.13%)。其次为酮(5.32%)、酚(4.70%)、酯(2.38%)、其他(2.22%)。发酵菌丝体中23种挥发性化合物含有烷(1种)、酮(5种)、酸(11种)、酯(1种)、酚(3种)、醛(2种)等挥发性物质,其中要以酸类(86.51%)物质为主,其中棕榈酸的相对含量达到了42.18%,油酸的相对含量为11.46%,亚油酸的相对含量为15.13%;硬脂酸、棕榈油酸、十四烷酸、十五酸的相对含量分别为4.23%、3.51%、2.44%、2.05%;其次为酮类化合物(7.94%),酚类化合物(2.59%),醛(1.67%)。
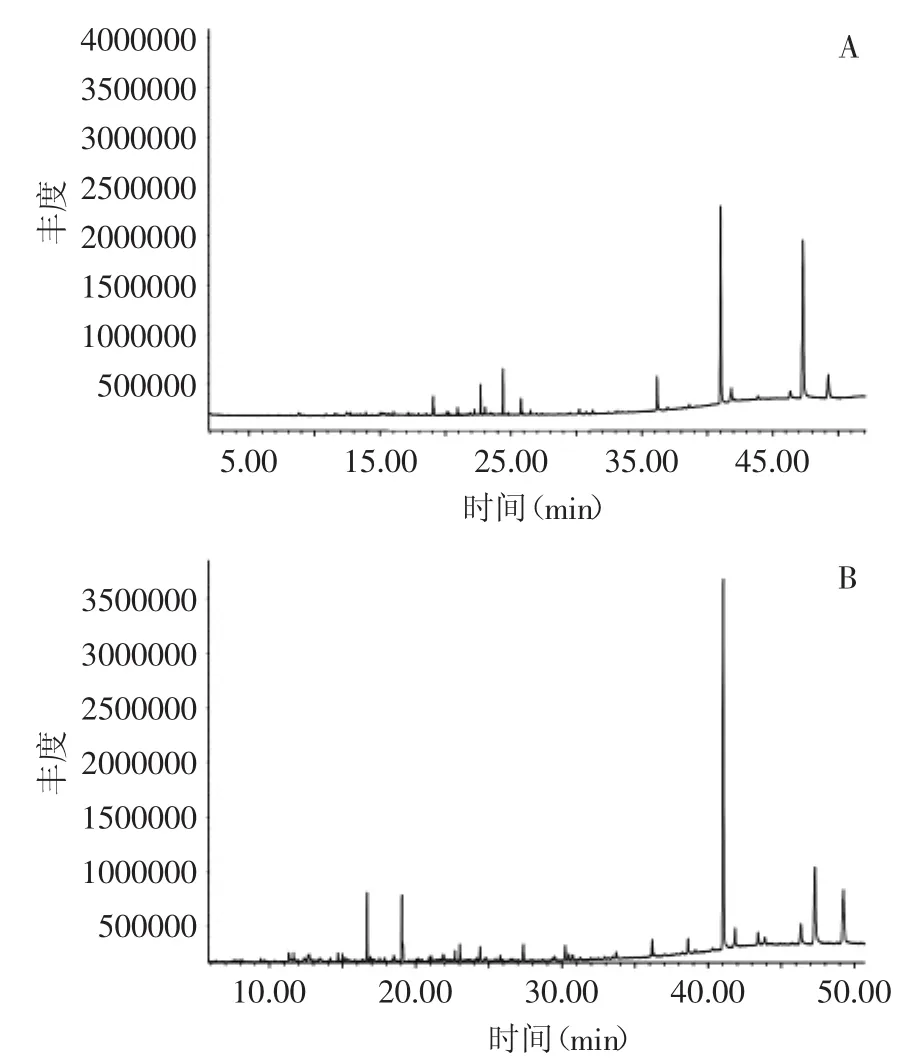
图5 野生蝉花(A)和发酵菌丝体(B)挥发性化合物总离子流色谱图(固相微萃取)Fig.5 Total ion chromatograms for the volatile components identified Cordyceps cicadae(A)and mycelia(B)of Isaria cicadae by HS-SPME
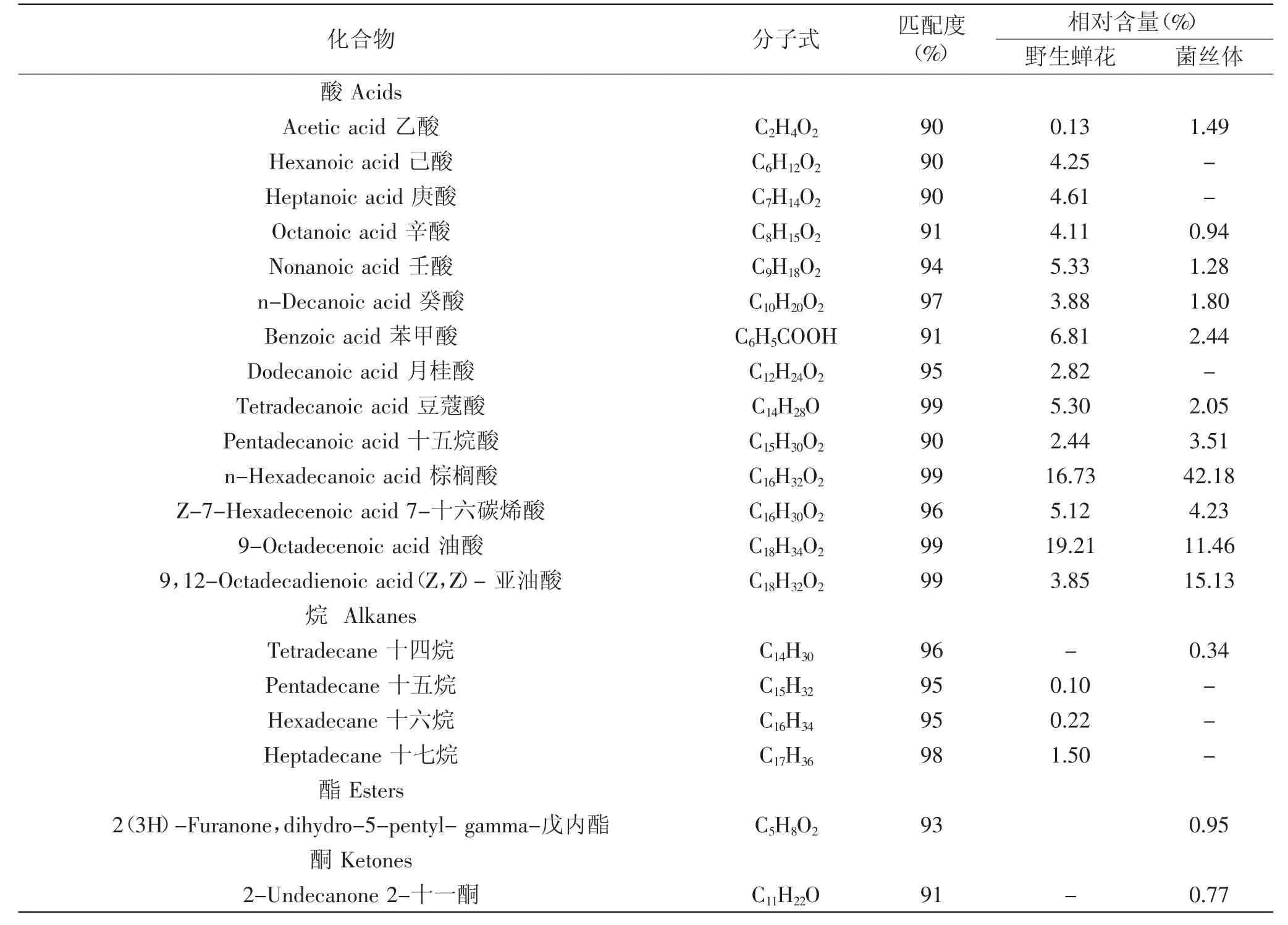
表2 野生蝉花及菌丝体挥发性化合物GC-MS分析(顶空固相微萃取)Table2 Volatile compounds in Cordyceps cicadae Shing and cultured mycelia of Isaria cicadae analysed by GC-MS(HS-SPME)
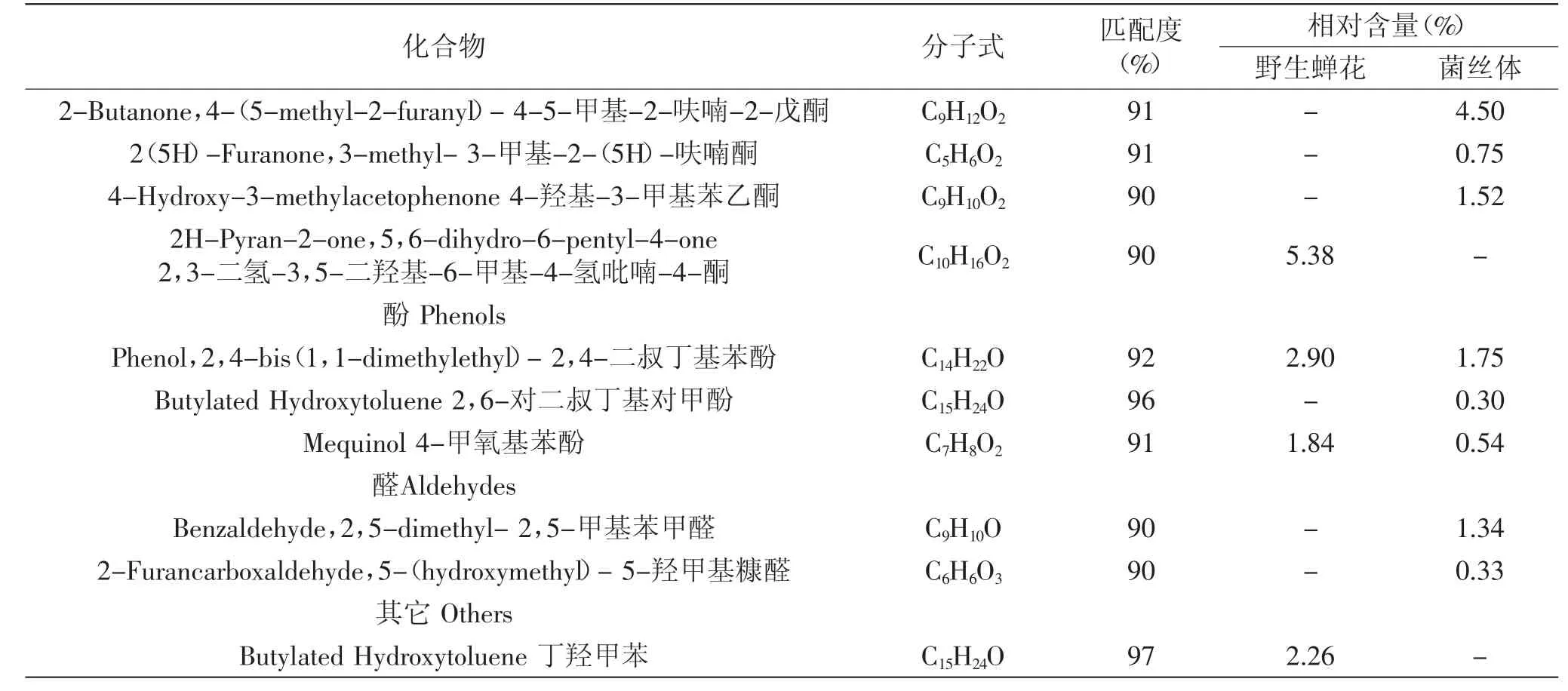
续表
3 讨论
3.1 提取方式对挥发性成分的种类及相对含量的影响
采用水蒸气蒸馏法及顶空固相微萃取获得的野生蝉花及发酵菌丝体的挥发性成分种类及相对含量上有明显差别,水蒸气蒸馏法鉴定出的挥发性的成分较多,而顶空固相微萃取鉴定出的挥发性的成分比较少。可能由于水蒸气蒸馏法温度较高,顶空固相微萃取温度较低,而且萃取的物质种类受萃取头类型的影响较大,理想的固相微萃取头类型还有待于进一步研究。但不论是蒸气蒸馏法还是顶空固相微萃取,野生蝉花及发酵菌丝体其挥发性成分都是以脂肪酸为主。采用水蒸气蒸馏法分析,野生蝉花中脂肪酸类物质占90.08%,发酵菌丝体中脂肪酸类物质相对含量占86.57%;采用顶空固相微萃取分析,野生蝉花中脂肪酸类物质相对含量占83.62%,发酵菌丝体中酸类物质的相对含量占86.51%。这表明两种方法所得提取物的组成及各成分的相对百分含量均存在一定差异,因此,只有将两种方法合起来,才能得到对产品的挥发性物质的综合评价。
3.2 野生蝉花及发酵菌丝体挥发性成分比较
野生蝉花及发酵菌丝体中挥发性成分都以脂肪酸类物质为主,但是脂肪酸的种类及相对含量不同。野生蝉花中油酸的相对含量最高达到了41.48%,其次为棕榈酸、亚油酸、十四酸、棕榈油酸、硬脂酸,相对含量分别为21.18%、9.44%、3.57%、3.20%、2.13%。发酵菌丝体中棕榈酸的相对含量最高达到了38.44%,其次为亚油酸,相对含量为18.58%,油酸的相对含量为12.83%。十五烷酸、肉豆蔻酸、棕榈油酸、硬脂酸的相对含量分别为4.22%、4.19%、3.92%、2.28%。因此,不论是野生蝉花还是发酵菌丝体挥发性成分都是以脂肪酸类物质为主,野生蝉花中不饱和脂肪酸的含量高于发酵菌丝体中不饱和脂肪酸的含量。发酵菌丝挥发性成分的种类及相对含量受培养基种类及培养条件的影响较大,利于不饱和脂肪酸产生的培养基的种类及培养条件还有待于进一步的研究。
脂肪酸特别是不饱和脂肪酸有多种生物活性,不饱和脂肪酸具有降低血脂中的甘油三酯和抗氧化、抗自由基、抗肿瘤、增强免疫的作用,其含量越高越易阻止血栓形成。不论是野生蝉花还是发酵菌丝体挥发性成分中不饱和脂肪酸的含量较高,其与蝉花药理作用之间的相关性有待于进一步研究。除脂肪酸类物质外,在野生蝉花和发酵菌丝体挥发性成分中发现了一些可以作为香料的物质,可能与蝉花的香味有关。这些物质大多为醛类或酮类。例如:2-正戊基呋喃、甲基壬基甲酮、正己醛、壬醛、苯甲醛、反式-2,4-癸二烯醛、丁羟甲苯。苯甲醛为GB2760-2014规定为暂时允许使用的食用香料,主要用于配制杏仁、樱桃、桃子、果仁等型香精,用量可达40%;也可以作为医药、染料、香料的中间体。壬醛用于配制人造玫瑰油和玫瑰型香精等,可用于食品,我国GB 2760-2014规定反式-2,4-癸二烯醛为允许使用的香料,主要用于配制鸡肉香精。关于蝉花香味、生物活性的物质基础及构效关系还有待于进一步的研究。
4 结论
菌株GZU1205241为蝉花的无性型蝉棒束孢。水蒸气蒸馏法及顶空固相微萃取获得的野生蝉花及发酵菌丝体的挥发性成分种类及相对含量上有明显差别,水蒸气蒸馏法鉴定出的挥发性的成分较多,而顶空固相微萃取鉴定出的挥发性的成分比较少。但不论是蒸气蒸馏法还是顶空固相微萃取,野生蝉花及发酵菌丝体的挥发性成分都是以脂肪酸为主。因此,只有将两种方法合起来,才能得到对产品的挥发性物质的综合评价。野生蝉花和发酵菌丝体分别含有56种和58种挥发性物质,其中25种为共有物质,野生蝉花主要以酸类(90.08%)物质为主,其中油酸的相对含量达到了45.09%,棕榈酸的含量为21.18%,亚油酸的含量为9.44%。发酵菌丝体中主要以酸类(86.57%)物质为主,其中棕榈酸的相对含量达到了38.44%,9,12-十八碳二烯酸相对含量的达到了18.58%,油酸的相对含量达到了12.83%。
[1]杨介钻,卓佳,陈柏坤,等.蝉拟青霉多糖对老年大鼠免疫功能的调节作用[J].中国中药杂志,2008,33(3):292-295.
[2]谢炜,郭月芳,盛雨辰.蝉花菌丝体对慢性肾功能衰竭大鼠的治疗作用[J].中国医药工业杂志,2011,42(10):770-772.
[3]刘玉宁,陈以平,王立红,等.蝉花菌丝抗大鼠肾小管间质纤维化的实验研究[J].中国中西医结合肾病杂志,2011,12(3):243-245.
[4]徐红娟,莫志宏,余佳文,等.蝉花抗真菌活性成分的分离纯化研究[J].天然产物研究与开发,2010,22(5):794-797,835.
[5]翁梁.野生蝉花与人工蝉花多糖的提取及抑菌实验[J].农业科技与装备,2011(11):22-24.
[6]闫梅霞,杨元超,侯微,等.药用菌多糖的抗肿瘤作用研究[J].安徽农业科学,2011,39(18):10799-10801.
[7]蔡菊芬,姜志明,卢红阳,等.蝉拟青霉不同纯化组分对体外抗肿瘤作用的基础研究[J].中华中医药学刊,2010,28(4):760-764.
[8]陈安徽,樊美珍,邵颖,等.蝉拟青霉代谢产物抑制单胺氧化酶和抗肿瘤活性研究[J].食品科学,2009,30(11):216-218.
[9]陈安徽,李春如,樊美珍.蝉拟青霉代谢产物清除DPPH自由基和抗真菌活性的研究[J].菌物学报,2008.27(3):405-412.
[10]欧翔,谭艾娟,吕世明.蝉拟青霉酯酶的产酶条件优化[J].贵州农业科学,2013,41(8):144-147.
[11]雷帮星,康冀川,何劲,等.四种虫草菌丝体中腺苷和虫草菌素含量的研究[C].中国菌物学会第五届会员代表大会暨2011年学术年会,2011.
[12]陈安徽,陈宏伟,徐洋,等.蝉花虫草中核苷类成分的分离纯化和鉴定[J].食品科学,2013,34(1):131-134.
[13]Lee YS,KM Choi,MH Choi,et al.Serine palmitoyltransferase inhibitor myriocin induces growth inhibition of B16F10 melanoma cells through G(2)/M phase arrest[J].Cell Prolif,2011,44(4):320-9.
[14]Tamura K,D Peterson,N Peterson,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Molecular biology and evolution,2011,28(10):2731-2739.
Analysis of volatile compounds in Cordyceps cicadae and submergedly cultured mycelia of Isaria cicadae
WEI Ya-li1,2,LIU Ai-ying3,LV Yu1,TANG Hong-min1,*
(1.College of Chemistry and Environmental Science,Guizhou Minzu University,Key laboratory of Development and Using Medicine resources of Ethnic Minority Groups of Guizhou,Guiyang 550025,China;2.Institute of Agriculture,Guizhou University,Guiyang 550025,China;3.Institute of Fungus Resources,Guizhou University,Guiyang 550025,China)
In order to determine the volatile compounds in Cordyceps cicadae and submergedly cultured mycelia of Isaria cicadae,the strain GZU1205241 was identified by the sequence analysis of a rDNAITS fragment and the traditional identification methods(morphological characteristics of the colony and sporulation structure).Then the volatile compounds of wild Cordyceps cicadae mycelium and fermentation volatile compounds were extracted by headspace solid phase microextraction(HS-SPME)and steam distillation and determined by gas chromatography and mass spectrometry.The results showed that the strain GZU1205241was Isaria cicadae.Cordyceps cicadae and mycelia of Isaria cicadae,respectively,contained 56 and 58 volatile compounds.Hereinto,25 compounds in both wild and mycelia.The main volatile compounds of Cordyceps cicadae mainly were acids,and the relative content of oleic acid,hexadecanoic acid and linoleic acid was 45.09%,21.18%and 9.44%,respectively.The main volatile compounds of fermented mycelia were acids,and the relative content of palmitic acid,linoleic acid and oleic acid was 38.44%,18.58%and 12.83%,respectively.The volatile composition and relative content of wild Cordyceps Cicadae and fermented mycelia obtained by steam distillation and headspace solid phase micro extraction had obvious differences.The volatile composition were more by water vapor distillation.Acid were the main volatile compounds of Cordyceps cicadae and fermented mycelia obtained by steam distillation and headspace solid phase micro extraction.
Cordyceps cicadae;volatile compounds;HS-SPME,GC-MS;Isaria cicadae
TS201.1
A
1002-0306(2016)06-0078-08
10.13386/j.issn1002-0306.2016.06.007
2015-07-17
卫亚丽(1977-),女,博士,副教授,研究方向:资源昆虫应用,E-mail:weiyali0012@163.com。
汤洪敏(1969-),女,教授,研究方向:生物化学,E-mail:echoboy99@163.com。
贵州省科技厅贵州民族大学联合项目(黔科合J字LKM[2012]04)。

