负载Ad5-HIVgag/env的DC疫苗在小鼠体内的免疫原性研究
刘超 何小周 刘雪 徐柯 曾毅 冯霞
100124 北京工业大学生命科学与生物医学工程学院病毒与药理室 (刘超、刘雪、曾毅);100052 北京,中国疾病预防控制中心病毒病预防控制所 传染病预防控制国家重点实验室 (何小周、徐柯、冯霞)
·论著·
负载Ad5-HIVgag/env的DC疫苗在小鼠体内的免疫原性研究
刘超何小周刘雪徐柯曾毅冯霞
100124 北京工业大学生命科学与生物医学工程学院病毒与药理室 (刘超、刘雪、曾毅);100052 北京,中国疾病预防控制中心病毒病预防控制所 传染病预防控制国家重点实验室 (何小周、徐柯、冯霞)
目的用Ad5-HIV gag/env负载小鼠树突状细胞(Dendritic cell, DC),探索其在小鼠体内诱导的HIV Gag/Env特异性细胞免疫应答。方法贴壁法分离纯化BALB/c小鼠DCs,并用细胞因子诱导DC细胞成熟,采用流式细胞术鉴定其纯度。利用重组腺病毒Ad5-HIV gag/env感染DC细胞,制备DC疫苗。用所制备DC疫苗免疫小鼠,在免疫后的不同时间点,用ELISPOT方法检测小鼠体内HIV特异性细胞免疫应答水平。结果成功培养出Ad5-HIVgag/env负载的DC疫苗;免疫荧光以及流式细胞术检测到Gag/Env抗原可在DC内有效表达;上述DC疫苗免疫小鼠后能诱导高水平HIV特异性细胞免疫反应。结论Ad5-HIV gag/env负载的树突状细胞疫苗可以在小鼠体内诱导较强的HIV特异性细胞免疫反应。
【主题词】树突状细胞疫苗;细胞治疗;腺病毒;HIV-1
Fund programs: National Scinence and Technology Major Project of China((2012ZX10001-005)
树突状细胞(Dendritic cell, DC)在人体内分布广泛,是功能最强的抗原提呈细胞(Antigen presen-ting cells, APC),其对抗原的提呈能力远高于巨噬细胞等其他免疫细胞,同时,DC也是唯一能激活初始型T细胞的APC,在特异性免疫应答过程中起到重要作用。离体的DCs经抗原刺激后回输到体内,能够迁移到淋巴结并释放出多种细胞因子,同时激活T淋巴细胞的分化和增殖[1],诱导产生抗原特异性的细胞毒性T细胞(CTL),进而对特异性靶细胞进行杀伤,这是将DC疫苗用于细胞治疗的理论基础[2]。使用表达HIV-1抗原的DC疫苗对HIV-1感染者进行免疫治疗的研究已取得了初步进展[3]。本研究中,我们使用表达HIVgag/env基因的腺病毒载体疫苗(Ad5-HIVgag、Ad5-HIVenv)感染小鼠骨髓DCs,获得负载HIV Gag/Env的DCs疫苗(DC-Ad5-HIV gag、DC-Ad5-HIV env),单独或联合免疫小鼠,观察其诱导产生的HIV抗原特异性细胞免疫反应。
1 材料与方法
1.1材料腺病毒载体疫苗rAd5-HIVgag和rAd5-HIVenv均由本实验室构建,委托深圳源兴生物医药科技有限公司生产; P24抗体(由美国NIH AIDS Research and Reference Reagent program惠赠);2G12抗体(购于苏州杰恩公司);生物素标记的抗小鼠IgG、生物素标记的抗人IgG、FITC标记的链酶卵白素IgG均购自北京中杉金桥生物技术有限公司。PE标记的小鼠CD80、CD11c、CD86抗体购自美国Biolegend公司;重组鼠细胞因子rmGM-CSF、rmIL-4、rmTNF-α购自美国Peprotech公司;ELISPOT试剂盒购自瑞典MabTech公司。
1.2小鼠骨髓细胞采集和分离颈椎脱臼法处死小鼠,无菌操作下取股骨和胫骨,用1 ml注射器吸取RPMI-1640培养液,从骨干的一端刺入骨髓腔,将骨髓冲洗到无菌培养皿中。用小鼠淋巴细胞分离液重悬细胞,按说明书离心后吸取中间部分的淋巴细胞层细胞(呈白色薄膜状),计数获得单核细胞的数量,调整细胞浓度接种在培养瓶中,于37℃ 5%CO2培养2 h。
1.3DC的培养与鉴定去除非贴壁细胞,加入细胞因子rmGM-CSF(40 ng/ml)、rmIL-4(20 ng/ml)、rmTNF-α(10 ng/ml),37℃ 5%CO2继续培养7 d后收集悬浮细胞团,即为小鼠的DC。收集贴壁法分离的DCs,按照说明书分别加入PE标记的抗小鼠CD86、CD80和CD11c抗体,利用流式细胞仪检测DC纯度。
1.4DC-Ad5-HIVgag和DC-Ad5-HIVenv制备及鉴定采用100 MOI的Ad5-HIVgag/env分别感染DCs,吸附2 h后,然后在含成熟因子的DC培养基中,其中含rmGM-CSF(40 ng/ml)、rmIL-4(20 ng/ml)、rmTNF-α(20 ng/ml),继续培养48 h,收集培养细胞,即为DC-Ad5-HIVgag、DC-Ad5-HIVenv。利用间接免疫荧光法和流式细胞术检测DC细胞中Gag/Env蛋白的表达情况。
1.5DC疫苗免疫BALB/C小鼠雌性BALB/C小鼠、4-6周龄,随机分为7组,每组20只。将收获的DC-Ad5-HIVgag和DC-Ad5-HIVenv 疫苗单独或联合经肌肉注射免疫,免疫剂量为2×105细胞/只。另外分别设置Ad5-HIVgag组、Ad5-HIVenv组作为阳性对照组,以及DC-Ad5-LMP2组作为表达无关抗原的腺病毒负载的DC对照组,单纯DC作为阴性对照组。分别在免疫后1周、2周、3周、4周检测各组小鼠的细胞免疫应答水平。
1.6酶联免疫斑点(ELISPOT)实验在免疫后不同时间点分离小鼠脾淋巴细胞,分别用HIV Gag和Env特异性多肽刺激脾细胞,按照MabTech试剂盒说明书操作检测小鼠的HIV Gag和Env特异性细胞免疫应答。
1.7统计学方法特异性细胞免疫应答强度用每百万个淋巴细胞中斑点形成细胞数(Spots Forming Cells/million splencytes)计量;利用GraphPad Prism 5统计学软件分析结果并绘制图表。以P<0.05为差异有统计学意义。
2 结果
2.1细胞形态观察贴壁培养法分离、纯化、诱导得到的原代DCs具有典型的树突状细胞形态,细胞表面具有树枝状突起。
2.2成熟DC表面标志的表达利用流式细胞技术检测通过贴壁法纯化DCs的细胞纯度,结果显示,带有CD86、CD80及CD11c表面标记的阳性细胞占总细胞比率的百分数分别为92.1%,94.7%和82.3%,见图1。
2.3目的抗原在树突状细胞中的表达我们分别采用了间接免疫荧光方法和流式细胞技术检测目的基因在DC细胞中的表达,免疫荧光结果显示,目的抗原均在细胞内有表达。见图2。利用流式细胞技术对其进行分析,结果显示,Ad5- HIVgag负载的DCs中表达Gag蛋白的细胞占总细胞比率为88%、Ad5- HIVenv负载的DCs中表达Env蛋白细胞比为85.3%。
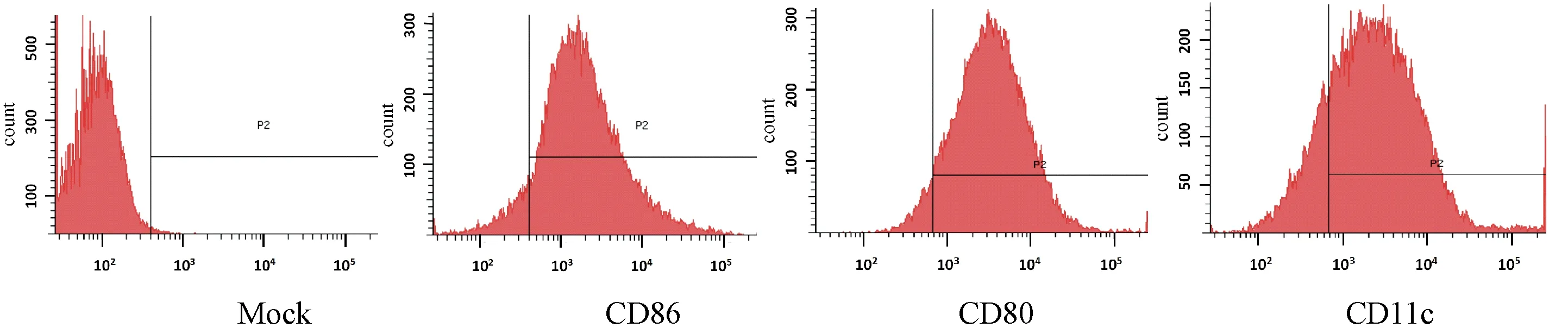
图1 DCs 流式细胞术纯度检测Fig.1 The purity result of DCs by flow cytometry
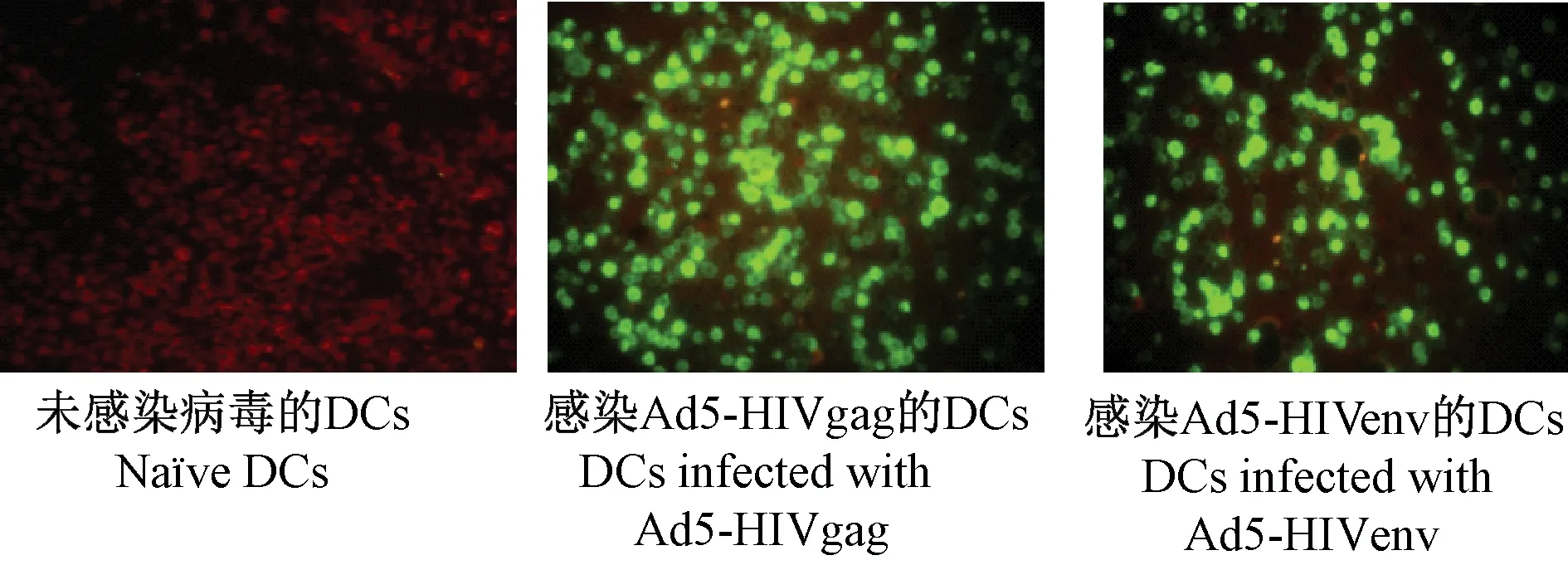
图2 间接免疫荧光检测树突状细胞疫苗中Gag和Env抗原表达(200×)Fig.2 Expression of Gag and Env in DC vaccines detected by indirect immunofluorescencec assay(200×)
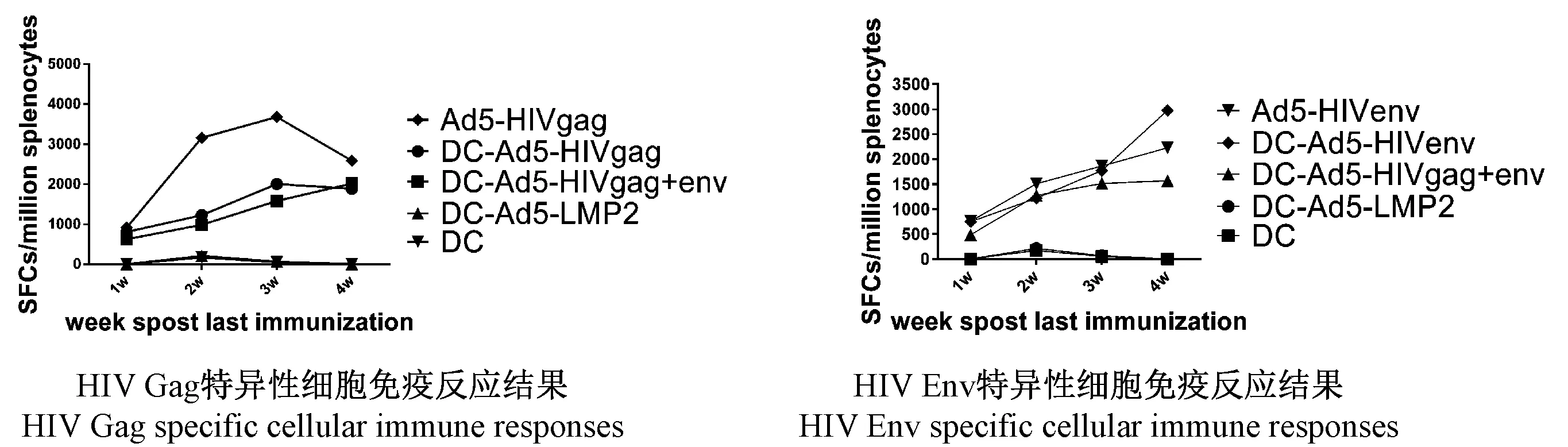
图3 ELISPOT方法检测免疫后不同时间点小鼠体内HIV Gag或Env特异性细胞免疫反应结果Fig.3 HIV Gag or Env specific cellular immune responses in mice at various time points post immunization by ELISPOT assay
2.4ELISPOT方法检测细胞免疫水平DC疫苗以肌肉注射的方式免疫BALB/C小鼠,在免疫后的不同时间点,分别用Gag和Env特异性多肽刺激小鼠脾淋巴细胞,检测小鼠体内Gag和Env特异性细胞免疫水平,见图3。结果显示,DC-Ad5-HIVgag和DC-Ad5-HIVenv单独免疫或联合免疫均能诱导相应的HIV Gag和Env特异性CTL应答。其中DC-Ad5-HIVgag单独免疫组诱导的HIV Gag特异性细胞免疫反应高峰在免疫后3 W,显著高于免疫后2 W 及1 W(P<0.05),之后逐渐下降。DC-Ad5-HIVenv疫苗单独免疫组诱导的Env 特异性细胞免疫反应随着时间的推移逐渐增加至免疫后4 W达高峰,各时间点的免疫反应差异有统计学意义(P<0.05)。DC-Ad5-HIVgag和DC-Ad5-HIVenv联合免疫组诱导的HIV Gag特异性细胞免疫反应水平与DC-Ad5-HIVgag疫苗单独免疫组相当,差异无统计学意义(P> 0.05);联合免疫组诱导的HIV Env特异性细胞免疫反应水平与DC-Ad5-HIVenv疫苗单独免疫组相比,在免疫后第1、2周两者水平相当,免疫后3周开始单独免疫组水平超过联合免疫组,至免疫后4周两者差距最大,且差异有统计学意义(P<0.05)。
3 讨论
DC是已知唯一能够激活初始T 淋巴细胞,也是已知最强的抗原递呈细胞。特异性抗原负载的DC回输到体内后,能够激活T 淋巴细胞反应,诱导产生HIV-1 抗原特异性CTL,并促进其杀伤作用[3]。DC已经在多种病毒性传染病的免疫治疗中进行应用研究并取得一定效果[4]。研究表明,不同的抗原负载方式,对DC 的活化效率不同,产生CLT 的活性不相同。目前抗原负载存在多种手段,常用的策略有抗原肽导入DC[5]及病毒载体携带抗原基因感染DC[6]两种方式。有研究表明,采用抗原肽导入DC存在的问题主要是半衰期较短,而且转导效率较低;病毒载体携带抗原基因感染DC,可使基因在DC内稳定表达,从而使DC获得持续而大量的抗原刺激。而腺病毒具有安全性好、无遗传毒性、转导效率高、可以高水平的表达外源基因,并且还具备载体包装容量大、病毒制备工艺成熟等特点。使用腺病毒为载体,感染DC细胞制备树突状细胞疫苗将是一个很好的策略。
本研究采用贴壁培养法分离、纯化DCs,7 d后获得纯度较高的DCs。腺感染病毒后,通过间接免疫荧光及流式细胞技术可检测到目的抗原Gag和Env在细胞中有较高水平表达。将获得的DC疫苗免疫BALB/c小鼠可以诱导机体产生抗原特异性CTL应答。DC-Ad5-HIVgag疫苗单独或与DC-Ad5-HIVenv疫苗联合免疫诱导的HIVGag特异性细胞免疫反应水平相当,但都明显低于直接用Ad5-HIVgag疫苗免疫的效果。DC-Ad5-HIVenv疫苗单独或与DC-Ad5-HIVgag疫苗联合免疫及直接用Ad5- HIVenv疫苗免疫诱导的HIV Env特异性细胞免疫反应水平在免疫后前3周内差异不大(P> 0.05),但免疫后4周差异显著(P<0.05),以DC-Ad5-HIVenv单独免疫组最高,DC-Ad5-HIVenv与DC-Ad5-HIVgag疫苗联合免疫组最低。以Ad5-HIVgag和Ad5-HIVenv分别负载DC获得的DC疫苗免疫小鼠后跟单独用相应的腺病毒载体疫苗免疫产生的免疫反应相比相分别出现降低和升高的趋势,产生这种差异的原因还不清楚,有必要进一步在小鼠或恒河猴体内进行深入研究,为更合理的应用艾滋病疫苗提供依据。
[1]Wei F, Sun Q, Wong TS, et al. Eliciting cytotoxic T lymphocytes against human laryngeal cancer-derived antigens: evaluation of dendritic cells pulsed with a heat-treated tumor lysate and other antigen-loading strategies for dendritic-cell-based vaccination[J]. J Exp Clin Cancer Res,2016, 35(1): 1-9. doi: 10.1186/s13046-016-0295-1.
[2]Rainone V, Martelli C, Ottobrini L, et al. Immunological Characterization of Whole Tumour Lysate-Loaded Dendritic Cells for Cancer Immunotherapy[J]. PLoS One, 2016,11(1): e0146622. doi: 10.1371/journal.pone.0146622.
[3]Climent N, Munier S, Piquéet N, et al. Loading dendritic cells with PLA-p24 nanoparticles or MVA expressing HIV genes induces HIV-1-specific T cell responses[J]. Vaccine, 2014, 32(47): 6266-6276. doi: 10.1016/j.vaccine.2014.09.010
[4]郭建巍,秦力维,蔡美英.肝癌树突状细胞疫苗诱导细胞毒性T淋巴细胞的效应[J].中华肝脏病杂志,2013,11(7):414-417.
[5]Mosier DE. HIV-1 envelope evolution and vaccine efficacy[J]. Curr Drug Targets Infect Disord, 2005,5(2): 171-177. doi:10.2174/1568005054201553
[6]Lu W, Arraes LC, Ferreira WT, et al. Therapeutic dendritic-cell vaccine for chronic HIV-1 infection[J]. Nat Med. 2004,10(12): 1359-1365. doi: 10.1038/nm1147.
Immunogenicity of dendritic cells pulsed with Ad5-HIVgag/env in mice
LiuChao,HeXiaozhou,LiuXue,XuKe,ZengYi,FengXia
LaboratoryofVirologyandPharmocology,CollegeofLifeScienceandBioengineering,BeijingUniversityoftechnology,Beijing100022,China(LiuC,LiuX,ZengY);StateKeyLaboratoryforInfectiousDiseasePreventionandContral,NationalInstituteforViralDiseaseControlandPrevention,Beijing100052,China(HeXZ,XuK,FengX)
FengXia,Email:fengxia621@126.com;ZengYi,Email:zengy@public.bta.net.cn
Objective To evaluate HIV Gag/Env specific cellular immune responses induced in mice immunized with mouse dendritic cells pulsed with Ad5-HIVgag/env. MethodsBALB/c mouse DCs were generated by culture of adherent bone marrow cells in the presence of several cytokines. The purity of matured DCs was determined by flow cytometry.DCvaccineswere prepared by loading them with replication-deficient recombinant adenovirus Ad5-HIVgag or Ad5-HIVenv. BALB/c mice were immunized by intramuscular injection of above DC vaccines alone or in combination, at different time points post immunization HIV specific cellular immune responses detected by ELISPOT assay.ResultsMouse DC vaccines loaded with Ad5-HIVgag/env were generated successfully. Expression of HIV Gag or Env antigens in DC vaccines could be detected by immunofluorescence assay and flow cytometry; and high levels of HIV-specific cellular immune responses were induced in mice immunized with above DC vaccines ConclusionsDendritic cells loaded with Ad5-HIVgag/env could elicit potent HIV specific cellular immune responses in mice.
Dendritic cell vaccine;Cell therapy;Adenovirus;HIV-1
冯霞,Email: fengxia621@126.com;曾毅,Email: zengyi@public.bta.net.cn
10.3760/cma.j.issn.1003-9279.2016.04.008
国家科技重大专项(2012ZX10001-005)
2016-03-17)

