药用植物单面针中总黄酮的制备
代明龙, 王平, 孙吉康, 夹书珊
(中南林业科技大学 生命科学与技术学院, 湖南 长沙, 410004)
药用植物单面针中总黄酮的制备
代明龙, 王平, 孙吉康, 夹书珊
(中南林业科技大学 生命科学与技术学院, 湖南 长沙, 410004)
为获得纯度较高的单面针总黄酮, 对影响单面针总黄酮制备的工艺条件进行了研究, 采用超声提取法,通过正交试验优化总黄酮提取条件。优选AB-8型大孔树脂用于总黄酮的分离纯化, 并考察静态和动态吸附与解吸附影响因素。结果表明: 采用15倍量(mL/g)的70%乙醇50 ℃超声1.5 h, 提取2次, 可得最大提取量为4.78 mg/g; 上样液质量浓度为1.5 mg/mL, pH值为6.0, 流速为2.0 mL/min, 解吸时采用140 mL 70%乙醇, 2.0 mL/min进行动态解吸附, 得到总黄酮纯度为69.57%。
单面针; 总黄酮; 提取; 分离纯化
单面针(Zanthoxylum dissitum Hemsl), 中药名, 学名蚬壳花椒、山枇杷、大叶花椒、蚌壳花椒等[1], 属芸香科花椒属木质藤本植物。根、茎、叶均可入药, 根具有活血散瘀, 续筋接骨之功效, 用于跌打损伤,扭伤, 骨折; 籽可以理气止痛, 用于疝气痛。目前主要用于治疗妇女月经过多, 产后月经不调等妇科疾病, 民间也用于治疗牙齿和腰腿关节疼痛等症[2]。目前, 有关单面针资源繁育和有效成分方面已有大量研究[3], 但有关单面针总黄酮的提取和分离纯化尚未见报道。黄酮类化合物有清除自由基和抗氧化[4-5]、抗菌消炎[6]、防癌抗癌[7-8]、抗心血管疾病[9]、抗心律失常[10]等多种生理功能。
从植物组织中提取黄酮类化合物有多种技术, 超声技术因其强烈的空化作用, 提高了有效成分的提取率, 缩短了提取时间, 越来越多地应用于黄酮类[11]、生物碱[12]等物质的提取。黄酮类化合物的分离纯化方法有大孔吸附树脂法、超临界CO2萃取法、高效液相色谱法等, 其中, 大孔树脂法具有吸附能力强、选择性好、吸附容量大、解吸容易、再生性好等优点, 广泛用于食品和医药等领域有效物质的分离纯化[13-14]。本文采用超声提取法, 通过正交试验探究了单面针中总黄酮的提取条件, 确定了总黄酮分离纯化的最佳大孔吸附树脂类型, 以及考察了影响树脂静态和动态吸附与解吸附的影响因素, 优化了单面针总黄酮分离纯化的工艺条件, 为单面针药用价值的开发和后续黄酮类化合物生理活性研究奠定了基础。
1 材料与仪器
材料: 单面针, 由株洲千金药业股份有限公司提供(批号: Y004-1407014), 干燥至恒重, 粉碎后过40目筛, 备用; 芦丁对照品, 中国药品生物制品检定所; AB-8型、D101型、DM130型大孔树脂, 天津市光复精细化工研究所; 实验用亚硝酸钠、硝酸铝、氢氧化钠、无水乙醇、浓盐酸均为分析纯。
仪器: UV-5100紫外-可见分光光度计; SB-5200D超声波清洗机; AUY220电子天平; HH-4恒温水浴锅; RH-600A粉碎机; PHSJ-4F雷磁pH计。
2 实验方法
2.1标准曲线的绘制
精密称取芦丁对照品51.3 mg, 置于50 mL容量瓶中, 加入60%乙醇40 mL, 摇匀, 超声10 min, 待芦丁完全溶解后定容, 得1.026 mg/mL芦丁标准品溶液。精密吸取芦丁标准品溶液0、0.2、0.4、0.6、0.8、1.0 mL于6支10 mL容量瓶中, 分别加入5% NaNO2溶液0.4 mL, 摇匀, 静止6 min, 再加10% Al(NO3)3溶液0.4 mL, 摇匀, 静止6 min, 再加4% NaOH溶液4.0 mL, 用60%乙醇定容至刻度, 摇匀, 静止 15 min, 以未加芦丁标准液组作对照, 在 510 nm处测各组溶液吸光度[15]。得线性回归曲线: A = 11.833C - 0.017 8, r = 0.998 9, 其中, A为吸光度, C为芦丁标准品溶液浓度。实验表明, 芦丁标准液在0.02~0.1 mg/mL浓度范围内线性关系良好。
2.2总黄酮提取条件的正交试验
总黄酮提取量定义为提取总黄酮质量(mg)与单面针粉末质量(g)的比值。选择影响总黄酮提取的4个因素: A—乙醇浓度(%), B—单面针质量(g)与乙醇体积(mL)之比(固液比), C—超声时间(h), D—温度(℃)。以总黄酮提取量为评价指标, 按表1进行L9(34)正交试验, 探究总黄酮最佳提取条件。

表1 正交试验因素水平表
2.3大孔树脂的筛选
黄酮类化合物极性较小, 可以和树脂骨架分子形成氢键, 弱极性树脂对黄酮类化合物的吸附量大,分离度好, 解吸容易, 处理量高[16]。因此, 本试验选用AB-8、D101、DM130三种弱极性或极性大孔树脂进行单面针黄酮类化合物的初步分离纯化。
参照文献[17], 先将树脂用95%乙醇浸泡24 h, 充分溶胀后用95%乙醇淋洗至流出液与水混匀(1∶5)不呈白色混浊为止, 蒸馏水洗至无酒精味, 用滤纸吸干备用。

将筛选出的AB-8大孔树脂, 预处理后用滤纸吸干, 精密称取1 g置于50 mL锥形瓶中, 加入总黄酮提取液30 mL, 室温下120 r/min振荡至充分吸附。在12 h内, 前2 h每隔30 min取1 mL溶液, 测定总黄酮质量浓度, 之后每1 h测定一次, 计算AB-8树脂吸附率, 绘制树脂静态吸附动力学曲线[19]。
2.4总黄酮分离纯化工艺
(1) 称取5份吸附饱和的AB-8树脂, 各1 g, 分别置于50 mL锥形瓶中, 加入pH值为3.0、4.0、5.0、6.0、7.0的总黄酮提取液30 mL, 室温下120 r/min振荡6 h, 测定吸附平衡后溶液浓度, 计算吸附率。
(2) 称取5份吸附饱和的AB-8树脂, 各1 g, 用滤纸吸干后置于50 mL锥形瓶, 分别加入30 mL体积分数为50%、60%、70%、80%、90%的乙醇, 室温下120 r/min振荡24 h进行静态解吸附, 测定解吸液中总黄酮浓度, 计算解吸率。
(3) 称取5份吸附饱和的AB-8树脂, 各1 g, 湿法装柱。将总黄酮提取液原液配制成质量浓度分别为0.5、1.0、1.5、2.0、2.5 mg/mL的溶液, pH调节为6.0后上柱, 控制流速为1.0 mL/min进行动态吸附,收集吸附后流出液, 测定总黄酮的质量浓度, 计算吸附率。
(4) 称取5份吸附饱和的AB-8树脂, 各1 g, 湿法装柱。将总黄酮提取液原液配制成质量浓度为1.5 mg/mL, pH调节为6.0后调节流速为1.0、1.5、2.0、2.5、3.0 mL/min进行动态吸附, 收集吸附后流出液,测定总黄酮的质量浓度, 计算吸附率。
(5) 称取5份吸附饱和的AB-8树脂, 各1 g, 湿法装柱。取pH为6.0、浓度为1.5 mg/mL总黄酮提取液, 以流速2.0 mL/min进行动态吸附, 收集吸附后流出液, 测定总黄酮的质量浓度。吸附完成后再用70%乙醇进行动态解吸附, 调节流速为1.0、1.5、2.0、2.5、3.0 mL/min, 至解吸液不含总黄酮为止。收集解吸液, 测定总黄酮的质量浓度, 计算解吸率。
(6) 称取5份吸附饱和的AB-8树脂, 各1 g, 湿法装柱, 取pH值为6.0、质量浓度为1.5 mg/mL总黄酮提取液, 以流速2.0 mL/min进行动态吸附。吸附完成后再用70%乙醇进行动态解吸附, 调节流速为2 mL/min, 收集解吸液, 至解吸液变为无色(此时几乎不含总黄酮), 确定解吸液最佳用量。
3 结果与分析
3.1单面针总黄酮提取工艺优化
对正交试验结果(表2)进行极差分析可知: A、B、C、D 4个因素对单面针总黄酮提取的影响程度不同, R值大小为RA> RC> RB> RD, 说明乙醇浓度体积分数对总黄酮提取影响最大, 超声时间次之, 温度影响最小。最佳提取条件为 A1B2C3D1, 即乙醇体积分数为 70%,乙醇用量(mL)为单面针质量(g)15倍, 50 ℃超声提取1.5 h, 提取2次, 可得到总黄酮最大提取率。
正交试验结果的验证根据正交试验结果选择的最佳提取条件为A1B2C3D1, 称取单面针粉末10 g, 加入150 mL 70%乙醇浸泡24 h, 50 ℃超声提取1.5 h, 抽滤,滤渣再加150 mL 70%乙醇超声提取1.5 h, 合并2次滤液, 测定总黄酮提取率, 试验平行3次重复。3次试验所得总黄酮提取率分别为4.73、4.75、4.76 mg/g。由提取结果可知, 在A1B2C3D1条件下, 3组试验总黄酮提取率均高于正交试验组, 说明该提取条件下总黄酮提取率高, 且较稳定, 适用于单面针总黄酮的提取。
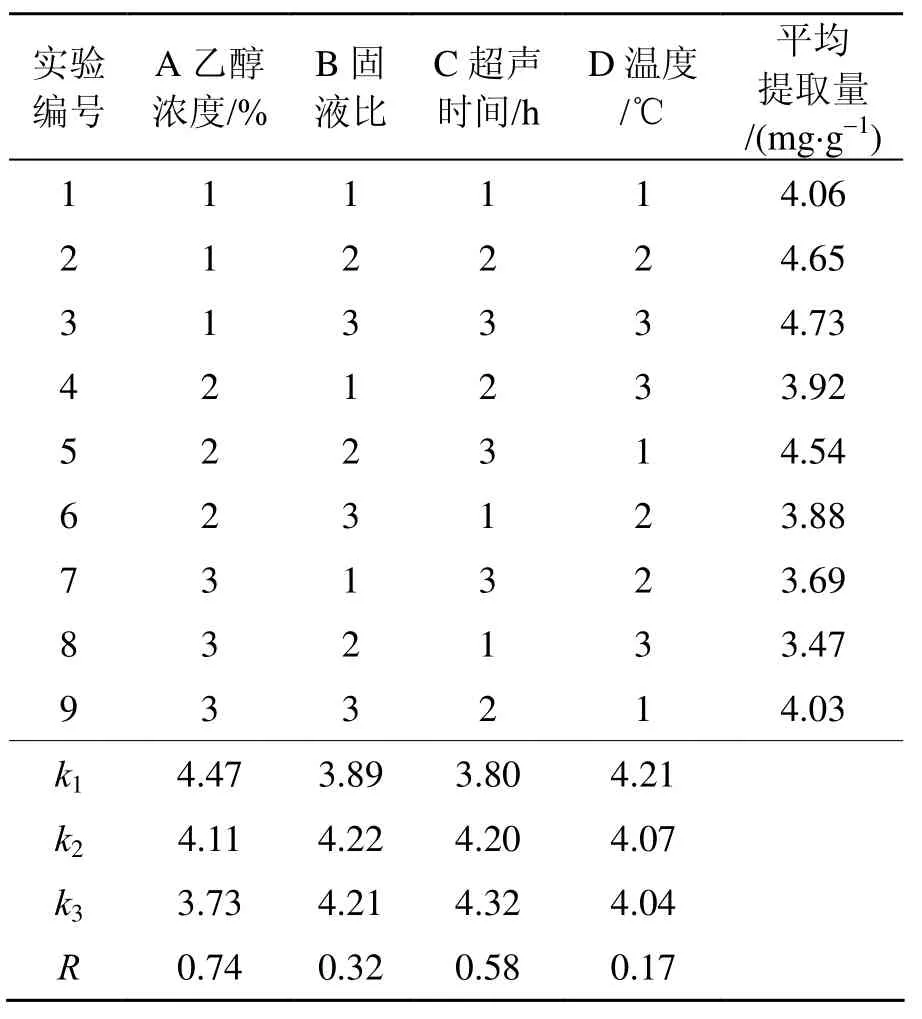
表2 正交实验设计结果
3.2大孔树脂的筛选
大孔树脂由于极性、孔径、比表面积存在差异, 对总黄酮的吸附和解吸附具有很大影响[20]。由表3结果可知, 所选3种树脂对总黄酮均有较大比吸附量, 其中D101型树脂比吸附量最大, 但其解吸能力最弱, DM130型树脂解吸率最高, 但比吸附量最低。故综合比吸附量和解吸率考虑, 选择AB-8型树脂用于单面针总黄酮的分离。
3.3AB-8型树脂静态吸附动力学特性
由图1可知, 在0~2 h内, AB-8型树脂吸附量快速增加, 在2~4 h内, 吸附量进一步增加, 但增速逐渐放缓; 4 h以后, 树脂的吸附达到平衡状态,吸附量趋于稳定。因此, AB-8树脂对单面针总黄酮的吸附为快速吸附型, 平衡时间约4 h, 说明AB-8树脂对单面针总黄酮吸附特性良好, 适于单面针总黄酮的提取。

表3 3种大孔树脂对单面针总黄酮静态吸附和解吸结果
3.4总黄酮分离纯化条件
3.4.1样液pH值对树脂静态吸附的影响
黄酮类化合物由于具有酚羟基而呈现一定的酸性, 在弱酸性环境下以分子状态存在, 可以通过范德华力和树脂发生吸附, 但酸性过强时, 黄酮分子易形成佯盐, 不利于吸附[21]。在碱性条件下, 黄酮类化合物易发生氧化和分解。由图2知, 样液pH值对总黄酮吸附率有显著影响, 在pH值为6.0时吸附率最大, 因此, 样液上样时pH值调节为6.0。
3.4.2解吸液浓度对树脂解吸率的影响
由图3可知, 乙醇体积分数在50%~70%范围内, 解吸率随着乙醇体积分数增大而增加, 当乙醇体积分数大于 70%时, 解吸率变化不明显, 且有下降趋势, 可能是乙醇体积分数过大导致溶液极性减小,影响解吸。因此, 从经济角度考虑, 本实验选择70%乙醇作为解吸液。

图1 AB-8静态吸附动力学曲线

图2 样液pH值对树脂静态吸附的影响

图3 乙醇体积分数对吸附率的影响
3.4.3上样液浓度对树脂动态吸附的影响
由图4可知, 总黄酮吸附率随着上样液的质量浓度增加而逐渐降低, 在0.5~1.5 mg/mL的质量浓度范围内, 总黄酮吸附率降低速率也降低, 质量浓度大于1.5 mg/mL时降低幅度变大。上样液的质量浓度过低, 虽然吸附率高, 但会使生产效率低下; 上样液的质量浓度过大会导致树脂堵塞, 不利于吸附, 因此, 本实验选择1.5 mg/mL为最适上样液质量浓度。
3.4.4上样液流速对树脂动态吸附的影响
由图5可知, 黄酮吸附率随上样液流速增加而降低, 在1~2 mL/min内, 吸附率缓慢降低, 大于2 mL/min时, 吸附率快速下降。流速较低, 虽然吸附率高, 但容易滞留杂质成分, 而且效率低下, 生产周期过长, 不利于工业化生产。因此, 确定上样液流速为2 mL/min。
3.4.5解吸液流速对树脂动态解吸附的影响
由图 6可知, 黄酮解吸率随着解吸液流速增加而降低, 流速过大时, 解吸液不能与树脂充分接触,解吸率降低; 流速越小, 解吸率越高, 但时间越长, 综合解吸率和生产效率2个因素, 解吸液速率应为2 mL/min。

图4 上样液浓度对树脂动态吸附的影响

图5 上样液流速对树脂动态吸附的影响
3.4.6解吸液用量对树脂动态解吸附的影响
由图7可知, 用70%乙醇以2 mL/min进行解吸时, 解吸液用量20 mL时总黄酮浓度最高, 随着乙醇用量的增加, 黄酮浓度快速减小, 当乙醇用量达到 140 mL时, 解吸液变为无色, 紫外分光法测定黄酮浓度已降为0。再进行解吸会造成乙醇用量和时间的浪费, 因此, 解吸液体积选择140 mL。

图6 解吸液流速对树脂动态解吸附的影响

图7 解吸剂用量对树脂动态解吸附的影响
4 小结
采用超声提取法, 通过正交试验, 以单面针中总黄酮的提取率为指标, 确定了单面针中总黄酮的最佳提取工艺: 采用15倍量(mL/g)的70%乙醇浸泡30 min, 50 ℃超声提取1.5 h, 重复提取一次, 最大提取量达到4.78 mg/g, 验证试验表明该提取工艺不仅提取量高, 而且稳定可靠。
采用大孔树脂法对单面针总黄酮进行分离纯化, 以大孔树脂吸附率和解吸率为指标, 通过静态吸附和解吸附实验, 从AB-8型、D101型和DM130型3种树脂中筛选出最适于分离纯化单面针总黄酮的类型, 确定AB-8型为分离纯化单面针总黄酮的最佳树脂。静态吸附动力学研究表明, AB-8型大孔树脂为快速平衡型, 平衡时间约4 h, 用于单面针总黄酮的分离纯化吸附效果好, 且节约时间。
考察了影响单面针总黄酮分离纯化的工艺参数, 分别是上样液质量浓度为1.5 mg/mL, pH值为6.0,流速2.0 mL/min可获得最大吸附率78.61%。解吸时采用140 mL 70%乙醇, 2 mL/min进行动态解吸附,最大解吸率为81.08%。对该工艺条件提取纯化的总黄酮进行纯度鉴定, 纯度平均值为69.57%, 表明大孔树脂法适于单面针总黄酮的分离纯化, 产品纯度高, 可用于开展后续生理活性的研究。
[1] 中国科学院植物研究所. 中国高等植物科属检索表[M]. 北京: 科学出版社, 1979: 1 705.
[2] 全国中草药汇编组. 全国中草药汇编(下册)[M]. 北京: 人民卫生出版社, 1978: 526.
[3] 杨辉, 李猛, 王平, 等. 蚬壳花椒资源繁育与有效成分研究进展[J]. 中国农学通报, 2015, 31(10): 153–157.
[4] 张红雨. 黄酮类抗氧化剂结构-活性关系的理论解释[J]. 中国科学B辑, 1999, 29(1): 91–96.
[5] Leo M D, Abreu M, Pawlowska A M, et al. Profiling the chemical content of Opuntiaficus-indica flowers by HPLC-PDA -ESI-MS and GC/EIMS analyses [J]. Phytoche Lett, 2010, 3(1): 48–52.
[6] 丁存宝, 刘海燕, 李桂秋. 月季果黄酮的提取及抑菌作用研究[J]. 食品工业, 2012(1): 107–110.
[7] 张氽, 阚建全, 陈宗道. 花椒籽的开发利用[J]. 中国食品添加剂, 2003, 83(3): 17.
[8] Montesano R, Schweigerer L. Flavonoids, dietary-derived inhibitors of cell proliferation and in vitro angiogenesis [J]. Cancer Research, 1997, 57(15): 2 916–2 921.
[9] 刘晔峰, 马峥嵘, 吴晓琴, 等. 养心草的有效成分及功能性化合物研究进展[J]. 中华中医药杂志, 2012, 27(8): 2 135–2 138.
[10] 朱学鑫, 李伟平, 俞燕, 等. 山核桃叶总黄酮制备[J]. 中华中医药学刊, 2013, 31(1): 147–149.
[11] 谢建华, 胡小华, 李志明, 等. 超声波提取芦笋皮中黄酮类化合物及其抗氧化活性的研究[J]. 西南师范大学学报(自然科学版), 2012, 37(1): 92–98.
[12] 王忠华, 史姗姗, 陈雨, 等. 浙贝母生物碱提取工艺研究[J]. 中药材, 2010, 33(1): 128–132.
[13] 陈丛瑾. 大孔吸附树脂分离纯化黄酮类化合物的研究进展[J]. 化学与生物工程, 2010, 27(11): 1–3.
[14] Hentze H P, Antonietti M. Porous polymers and resins for biotechnological and biomedical applications [J]. Reviews in Molecular Biotechnology, 2002, 90(1): 27–53.
[15] 刁海鹏, 吕俊杰, 曹晓峰. 蒲公英花中总黄酮含量测定[J]. 山西医科大学学报, 2004, 35(2): 178–179.
[16] 郑洪艳, 苏宁, 霍彤, 等. 蓝莓叶总黄酮的纯化及抗脂质过氧化能力研究[J]. 食品研究与开发, 2015, 36(2): 31–34.
[17] 袁崇均, 王笳, 陈帅, 等. 大孔树脂对槐角总黄酮分离纯化工艺研究[J]. 四川中医, 2008, 26(2): 40–42.
[18] 郁建生, 郁建平. 大孔吸附树脂分离纯化野菊花总黄酮[J]. 中国中药杂志, 2007, 32(20): 2 123-2 127.
[19] 顾采琴, 谢琳琳, 张织芬, 等. 香蕉皮黄酮的分离纯化及抑菌活性研究[J]. 食品科学, 2013, 34(16): 98–102.
[20] 库咏峰, 黄品鲜, 刘雄民, 等. 大孔吸附树脂法分离纯化肉桂总黄酮的工艺优化[J]. 食品科学, 2013, 34(24): 19-24.
[21] 李淑珍, 李进, 杨志江, 等. 大孔树脂分离纯化黑果构祀总黄酮的研究[J]. 食品科学, 2009, 30(1): 19-24.
(责任编校: 刘晓霞)
Preparation process of total flavonoids from Zanthoxylum dissitum Hemsl
Dai Minglong, Wang Ping, Sun Jikang, Jia Shushan
(College of Life Science and Technology, Central South University of Forestry and Technology, Changsha 410004, China)
The relevant process conditions is analyzed in preparation of total flavonoids of Zanthoxylum dissitum and settled foundation for its further physiological research with purer total flavonoids. Ultrasonic extraction and orthogonal experimental design are applied to optimize the total flavonoids extract technology. Static and dynamic adsorptive capacity and flavonoid enriching condition are investigated on AB-8 macroporous resin. The final optimized extraction technology is that Zanthoxylum dissitum powder extracted with 15 times volume of 70% ethanol twice with Ultrasonic time 1.5 h each. The separation and purification conditions are that the consistence reagant is 1.5 mg/mL with pH 6.0, and the flow rate is 2.0 mL/min. After the drastic and dynamic adsorptive process in elution with 70% ethanol (140 mL) at the rate of 2.0 mL/min, the purity of total flavonoids is 69.57%.
Zanthoxylum dissitum Hemsl; total flavonoids; extraction; separation and purification
R 284.2
1672–6146(2016)02–0024–06
10.3969/j.issn.1672–6146.2016.02.006
代明龙, dml4460@163.com; 王平, csfuwp@163.com。
2016-01-04
国家林业公益性行业科研专项(201204606)。

