pH响应性PAA/毒死蜱/氨基化介孔硅缓释体系的制备与性能
林粤顺,周红军,周新华,龚圣,徐华,陈铧耀
pH响应性PAA/毒死蜱/氨基化介孔硅缓释体系的制备与性能
林粤顺,周红军,周新华,龚圣,徐华,陈铧耀
(仲恺农业工程学院化学化工学院,广东广州 510225)
以共缩聚法合成氨基化介孔硅,采用浸渍法制备毒死蜱/氨基化介孔硅,并以带负电荷的聚丙烯酸(PAA)为功能分子,通过静电吸附作用制备了具有pH响应的PAA/毒死蜱/氨基化介孔硅缓释体系。利用XRD、N2吸附-脱附、TEM、SEM、TG、Zeta电位和FTIR对PAA/毒死蜱/氨基化介孔硅的结构进行了表征,并探究了其在不同pH和温度下的释药行为。结果表明,PAA通过静电作用包覆于毒死蜱/氨基化介孔硅的表面。缓释体系的药物释放主要受到PAA的阻碍作用,PAA修饰载药氨基化介孔硅显示出明显的pH响应性,当pH≤7时,其药物释放速率随pH减小而增大,而在偏碱性条件下的释药速率稍大于中性环境。同时,载药体系的释药速率还受到温度的影响。其释药行为可用Korsmeryer-Pappas动力学模型来描述。
氨基化介孔硅;聚丙烯酸;pH响应;毒死蜱;缓释
引 言
介孔硅是一种新型的功能材料,具有材料无毒、比表面积大、孔道结构高度有序、生物相容性好、表面修饰改性方法灵活多变等优点,可作为新型的可控药物缓释载体材料[1-4]。自Vallet-Regi等[5]在2001年率先报道了介孔硅应用于药物缓释领域,并引起了广泛的关注。在后来研究中发现,可以通过改变介孔硅的孔径大小、比表面积、表面有机官能团等手段来调控药物的缓释速率。为了进一步拓展介孔硅的应用,一些环境刺激性的介孔硅缓释药物载体应运而生,其环境刺激因素主要有光[6]、酶[7]、温度[8]、pH[9]等。
近年来,pH响应的药物缓控释体系已发展成为纳米领域研究热点之一。Yuan等[10]将聚丙烯酸嫁接到MSN介孔硅上,通过静电吸附作用将带正电荷的阿霉素药物负载于介孔硅中,并探究了其对药物的负载率和控制释放性能。Bilalis等[11]通过开环聚合反应将聚组氨酸嫁接到氨基化介孔硅中,着重探究了其对阿霉素药物的负载率和控制释放性能。Pourjavadi等[12]通过静电作用和表面质子化将聚乙烯吡啶羧酸基团修饰于磁性介孔硅中,并探究了该载体在酸碱性对阿霉素的控释作用。郭月月等[13]利用二步法制备了具有pH敏感性的聚合物葡聚糖-聚丙烯酸包覆的介孔硅,并考察了其对布洛芬的装载和pH敏感性。上述报道的介孔硅缓释体系均能在pH调控下实现对药物的控释。目前,研究者主要关注pH响应的生物医药缓释体系,虽然介孔硅在农药缓释中的应用已有报道[14-16],但是pH响应的农药缓释体系的研究还鲜见报道。此外,如果农药缓释剂能够根据土壤的酸碱性而表现出不同的药物释放性能,这对于在农业上防治病虫害具有潜在的价值[17]。因此,开展pH响应的农药缓释制剂的研究具有重要的意义。
一般来说,介孔硅的有机功能化修饰方法有后嫁接法和共缩聚法。后嫁接法是先合成具有硅羟基的介孔硅,后与硅烷偶联剂发生缩聚反应而将有机官能团固定在介孔硅上[18]。共缩聚法是指在模板剂溶液中同时加入前体和带有有机官能团的硅源而形成有机/无机杂化的介孔硅[19]。然而,本文以共缩聚法制备氨基化介孔硅,以农药毒死蜱为模型药物,采用浸渍法将毒死蜱负载于氨基化介孔硅,然后选择带负电荷的聚丙烯酸为功能分子,通过静电吸附作用将PAA修饰于载药氨基化介孔硅的表面,制备了PAA/毒死蜱/氨基化介孔硅缓释体系,着重探究了其药物释放行为的pH响应性。
1 实验部分
1.1 材料与设备
十六烷基三甲基溴化铵(CTAB)及氨水,分析纯,天津市大茂化学试剂厂;聚丙烯酸(PAA)与3-氨丙基三乙氧基硅烷(APTES),分析纯,阿拉丁试剂有限公司;正硅酸乙酯(TEOS)和无水乙醇,分析纯,国药集团化学试剂有限公司;毒死蜱原药(Chlorpyrifos),纯度≥98%,江苏景宏化工有限公司;盐酸,分析纯,广州化学试剂厂。
Spectrum100型傅里叶红外光谱仪,美国珀金埃尔默公司;Quadrasorb SI型氮气吸附-脱附仪,美国康塔仪器公司;D8 Advance型X射线衍射仪,德国布鲁克仪器公司;Zetasizer Nano ZS型Zeta电位仪,英国马尔文仪器有限公司;Q600型热重分析仪,美国TA仪器有限公司;SU8020型扫描电子显微镜,日本日立有限公司;Tecnai G2 20型透射电子显微镜,美国FEI公司;T6新世纪紫外可见分光光度计,北京普析通用仪器有限公司;HX-901A型注射泵,广州华玺医疗科技有限公司。
1.2 试样制备
1.2.1 氨基化介孔硅的制备 参考文献[20],采用共缩聚法制备氨基化介孔硅。典型的制备方法如下:将1 g 模板剂CTAB加入100 ml去离子水和70 ml氨水中,在60℃下搅拌至完全溶解。向混合液中缓慢滴加5 g TEOS,1 h后,再向体系滴加1 g APTES,继续搅拌6 h后停止反应,室温晶化,过滤,洗涤,干燥。用质量比为2.5%的盐酸乙醇溶液去除氨基化介孔硅上的模板剂,洗涤至中性,真空干燥,备用,记为NH2-MCM-41。
1.2.2 NH2-MCM-41对药物的负载 先将NH2-MCM-41在60℃真空干燥6 h,取100 mg NH2-MCM-41分散于20 ml 10 mg·ml-1的毒死蜱乙醇溶液中,置于35℃恒温水浴振荡器中振荡24 h使NH2-MCM-41吸附饱和,过滤,洗涤,干燥,制得负载毒死蜱的氨基化介孔硅,记为CH/NH2-MCM-41。
1.2.3 PAA修饰载药介孔硅的制备 将100 mg CH/NH2-MCM-41置于装有20 ml去离子水的烧杯中,磁力搅拌均匀,后用注射泵向体系中滴加10 ml质量分数为4%的PAA溶液,继续搅拌3 h,过滤,洗涤,干燥,得到PAA修饰的载药氨基化介孔硅缓释体系,记为PAA/CH/NH2-MCM-41。
1.3 结构和性能表征
1.3.1 介孔硅的结构表征 利用红外光谱分析其结构,样品采用KBr压片法;利用氮气吸附-脱附仪测试比表面积和孔径分布、孔容积等结构参数,方法:测试前样品先在200℃脱气12 h,然后在-196℃测试,并分别采用BET法和BJH法(脱附分支)计算相关参数;运用X射线衍射仪测试晶体结构,方法:使用铜靶Kα射线;利用扫描电子显微镜和透射电子显微镜观察CH/NH2-MCM-41和PAA/CH/NH2-MCM-41的形貌;采用热重仪和Zeta电位仪分别测量失重率和Zeta电位的变化。
1.3.2 吸附性能测试 采用UV测量NH2-MCM-41对毒死蜱药物的吸附量。收集NH2-MCM-41吸附毒死蜱后的滤液,测量毒死蜱乙醇溶液在吸附前后的吸光度,通过标准工作曲线61.3560.0613,20.9997,按照式(1)和式(2)分别计算NH2-MCM-41的吸附量AC(adsorption capacity)和载药量LC(loading content)。
式中,0为原毒死蜱乙醇浓度,mg·L-1;1为吸附后毒死蜱乙醇浓度,mg·L-1;为液体体积,L;为氨基化介孔硅的质量,g。
1.3.3 缓释性能测试 载药氨基化介孔硅体系的缓释性能根据文献[21]测定。称取(1,mg)载药体系,放置透析袋中并置于不同的pH和温度下的50 ml 40%乙醇水溶液的锥形瓶中,间隔一定时间(),移取1 ml样品液,同时向锥形瓶补加原缓释介质,用UV扫描测量其吸光度,毒死蜱随时间的累积释放率为R,绘制-R曲线作为毒死蜱的缓释动力学曲线,详见式(3)。
2 结果与讨论
2.1 介孔硅的结构表征
2.1.1 XRD分析 图1为氨基化介孔硅、载药介孔硅和PAA修饰载药介孔硅的XRD谱图。从图可见,氨基化介孔硅在20.5°~10°之间出现了3个特征衍射峰,分别属于(100)、(110)和(200)晶面,为典型的MCM-41型的XRD谱图,表明其具有有序的六方相孔道结构[22]。载药介孔硅和PAA修饰载药介孔硅,仍具有类似MCM-41的特征峰,这说明毒死蜱的负载和PAA的修饰并未破坏氨基化介孔硅的介孔结构。
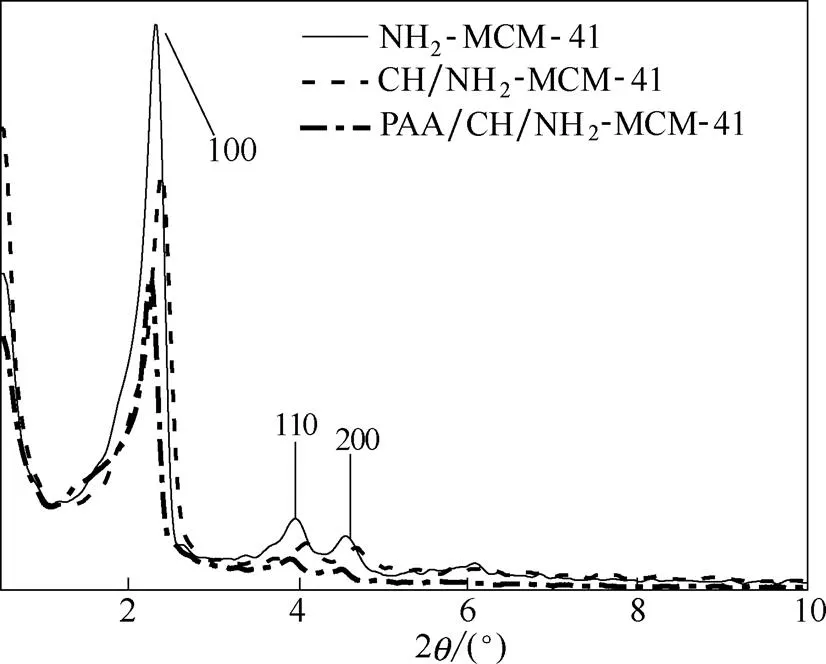
图1 氨基化介孔硅、载药介孔硅和PAA修饰载药介孔硅的XRD谱图
2.1.2 氮气吸附-脱附分析 图2为氨基化介孔硅、载药介孔硅和PAA修饰载药介孔硅的N2吸附-脱附等温线以及相应的孔径分布图。从图2(a)可知,三者的N2吸附-脱附等温线均为Langmuir Ⅳ型,且明显具有H4型滞后环,表明它们都属于介孔体系。由表1可知,氨基化介孔硅的比表面积为338 m2·g-1,比一般文献报道的MCM-41的比表面积小得多,这是因为共沉淀单体APTES的参与而导致其比表面积相对MCM-41有所下降。Hartono等[23]在制备氨基功能化介孔硅中也有类似的结果。此外,图2(b)和表1可见,氨基化介孔硅负载毒死蜱和PAA修饰载药介孔硅,其孔径()变化不大且分布集中,但其比表面积(BET)和孔容积(P)显著下降,说明毒死蜱已负载于氨基化介孔硅和PAA已修饰于载药氨基化介孔硅。
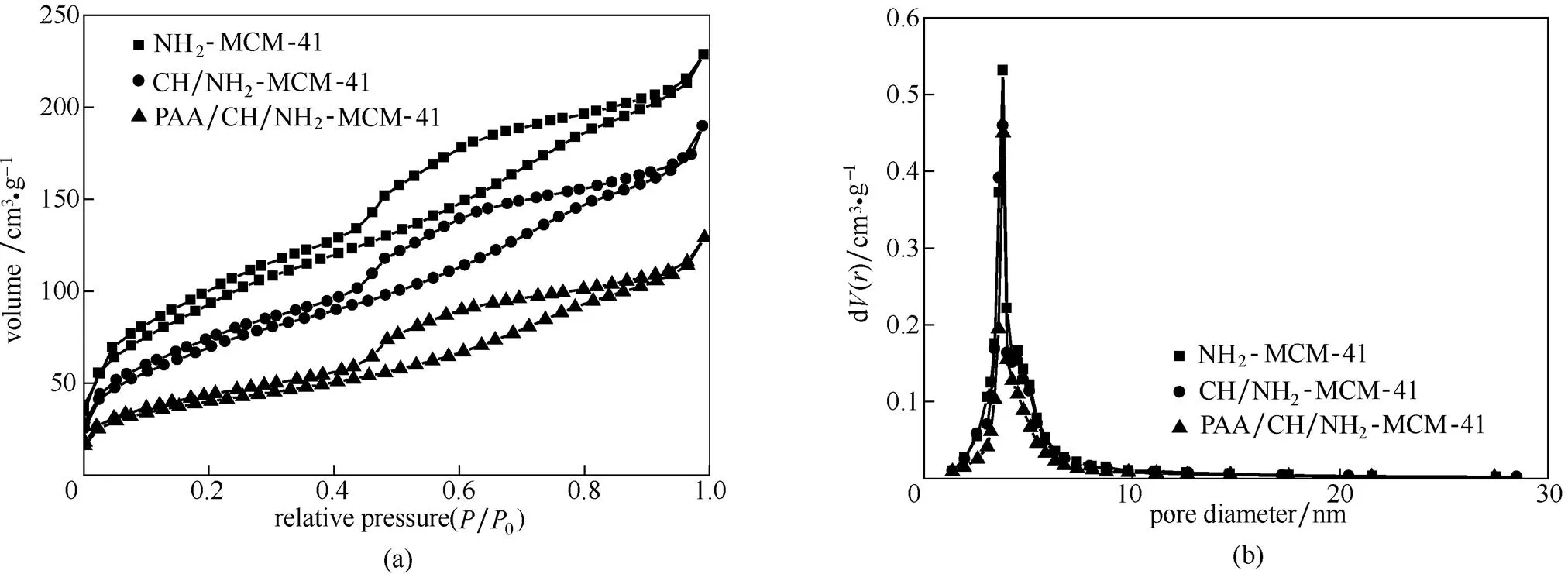
图2 氨基化介孔硅、载药介孔硅和PAA修饰载药介孔硅的N2吸附-脱附等温线和孔径分布

表1 氨基化介孔硅、载药介孔硅和PAA修饰载药介孔硅的孔结构参数
2.1.3 TEM分析 图3为PAA修饰前后载药介孔硅的TEM图。由图3(a)可见,当电子束垂直于圆柱体的主轴时,可观察到载药介孔硅显示出排列规整的六方相孔道结构,这与XRD分析结果相吻合。PAA修饰载药介孔硅也显示出规整的孔道结构,且其边缘较光滑,同时看到有一层薄薄的物质覆盖在载药介孔硅的表面[图3(b)],这是由于带有负电荷的PAA与氨基化介孔硅产生静电作用而将PAA包覆在载药介孔硅的表面。
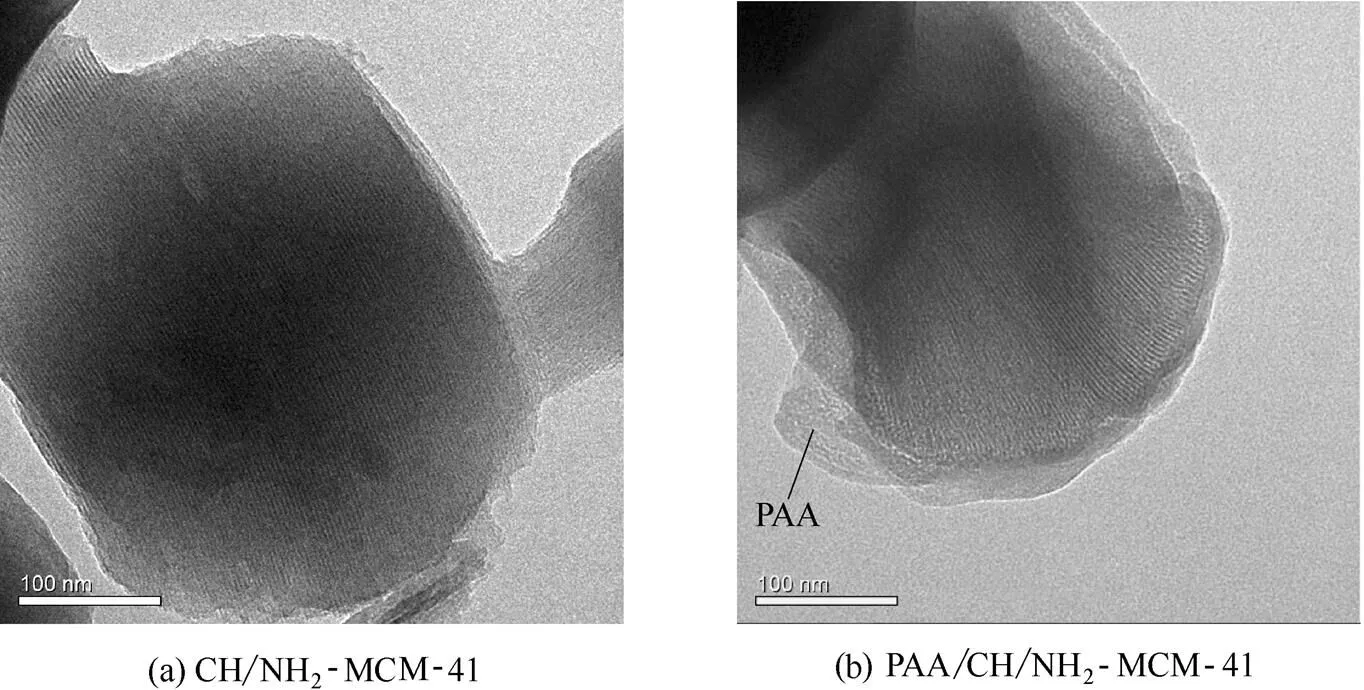
图3 载药介孔硅和PAA修饰载药介孔硅的TEM图
2.1.4 SEM分析 图4为PAA修饰前后载药介孔硅的SEM图。图4(a)显示出载药介孔硅为六方的颗粒形状,表面较为光滑,平均粒径约为340 nm,且颗粒的尺寸分布相对均匀。经过PAA修饰的载药介孔硅[图4(b)],明显看出载药颗粒的表面被一层薄薄的物质所覆盖,且颗粒间相互黏结,表面也变得更光滑,说明载药介孔硅已被PAA所包覆,再结合前面氮气吸附-脱附分析以及TEM分析,这些都证明了载药氨基化介孔硅的表面被PAA包覆。

图4 载药介孔硅和PAA修饰载药介孔硅的SEM图
2.1.5 FTIR分析 图5为NH2-MCM-41、CH/NH2- MCM-41和PAA/CH/NH2-MCM-41的FTIR谱图。谱线a代表氨基化介孔硅,在1080、800和460 cm-1出现了二氧化硅骨架上SiOSi的特征振动峰,960 cm-1为SiOH的弯曲振动峰。谱线b代表载药介孔硅,在1413和1548 cm-1出现毒死蜱的特征吸收峰,说明毒死蜱已经负载于氨基化介孔硅中。谱线c代表PAA修饰载药介孔硅,在1721 cm-1出现新的吸收峰,为羧基中CO的伸缩振动峰,且在1413和1548 cm-1仍存在毒死蜱的特征峰,表明了PAA已修饰于载药介孔硅的表面,且对毒死蜱药物无影响。
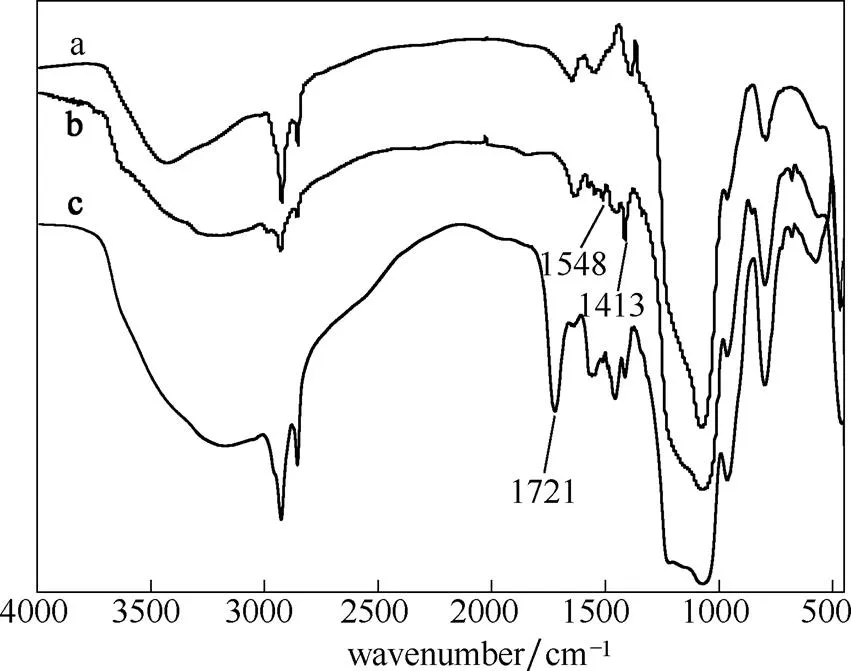
图5 氨基化介孔硅、载药介孔硅和PAA修饰载药介孔硅的FTIR谱图
2.1.6 TG分析 图6为NH2-MCM-41、CH/NH2- MCM-41和PAA/CH/NH2-MCM-41的热重曲线。如图所示,NH2-MCM-41和CH/NH2-MCM-41的热失重曲线大致相同,且两者在100℃以下都存在失重,这是因为样品中少量水分的挥发。载药介孔硅的失重率大于氨基化介孔硅,由于载药介孔硅中毒死蜱的分解所致,这也说明介孔硅确实负载了毒死蜱药物。曲线c为PAA修饰载药介孔硅,其呈现出4个阶段。阶段Ⅰ为30~165℃,失重率为3%,主要是介孔硅中水分的挥发;阶段Ⅱ为165~290℃,失重率为22%,主要是毒死蜱的分解;阶段Ⅲ为290~455℃,失重率为15%,主要是PAA分子链上的羧基脱羧生成酸酐;阶段Ⅳ为455~800℃,失重率为14%,主要是PAA主链的分解[24]。PAA修饰载药介孔硅总失重率大于载药介孔硅的失重率,进一步说明PAA已修饰于载药介孔硅的表面。
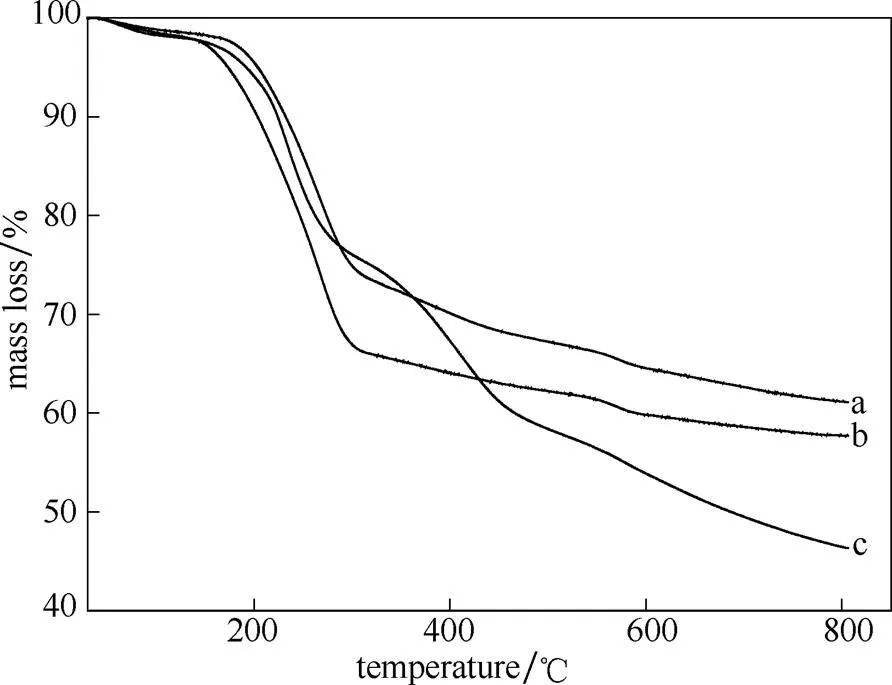
图6 氨基化介孔硅、载药介孔硅和PAA修饰载药介孔硅的TG曲线
2.1.7 Zeta电位分析 表2为氨基化介孔硅和PAA修饰前后载药介孔硅的Zeta电位。从表可知,氨基化介孔硅的Zeta值为34.4 mV,因为氨基在水溶液中呈现正电荷,这利于与负电荷的PAA发生静电作用。载药介孔硅的Zeta值进一步增大,变为42.7 mV,说明氨基化介孔硅负载毒死蜱后有利于提高其在水溶液中的稳定性[25]。但PAA修饰载药介孔硅的Zeta值则为-46.2 mV,这是由于PAA分子中带有负电荷的羧基,从而导致其Zeta值的下降。此外,还表明了PAA修饰载药介孔硅的等电点p<7。综上所述,PAA已通过静电作用包覆在载药氨基化介孔硅的表面。
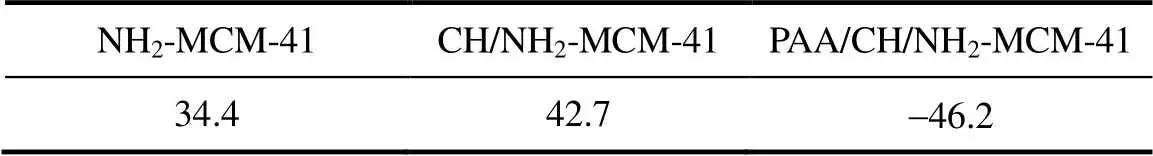
表2 氨基化介孔硅、载药介孔硅和PAA修饰载药介孔硅的Zeta电位
2.2 吸附性能分析
配制一系列已知浓度的毒死蜱乙醇溶液,通过紫外-可见分光光度计测量并绘制毒死蜱乙醇溶液的标准工作曲线,根据氨基化介孔硅在吸附毒死蜱乙醇溶液前后的吸光度,并依据式(1)计算其吸附量,得到PAA修饰载药介孔硅的吸附量为156 mg·g-1,载药量为13.8%。
2.3 缓释性能分析
2.3.1 PAA的修饰对缓释性能的影响 图7为PAA修饰前后的载药介孔硅在pH7下的药物释放曲线图。从图中可见,PAA修饰载药介孔硅,其缓释效果明显变优。因为PAA通过静电作用包覆在载药氨基化介孔硅的表面,可能也会有少部分的PAA进入介孔硅的孔道中,致使PAA在载药介孔硅药物释放中起到位阻效应,增加药物从孔道中释放的阻力,从而展示出良好的缓释性能。
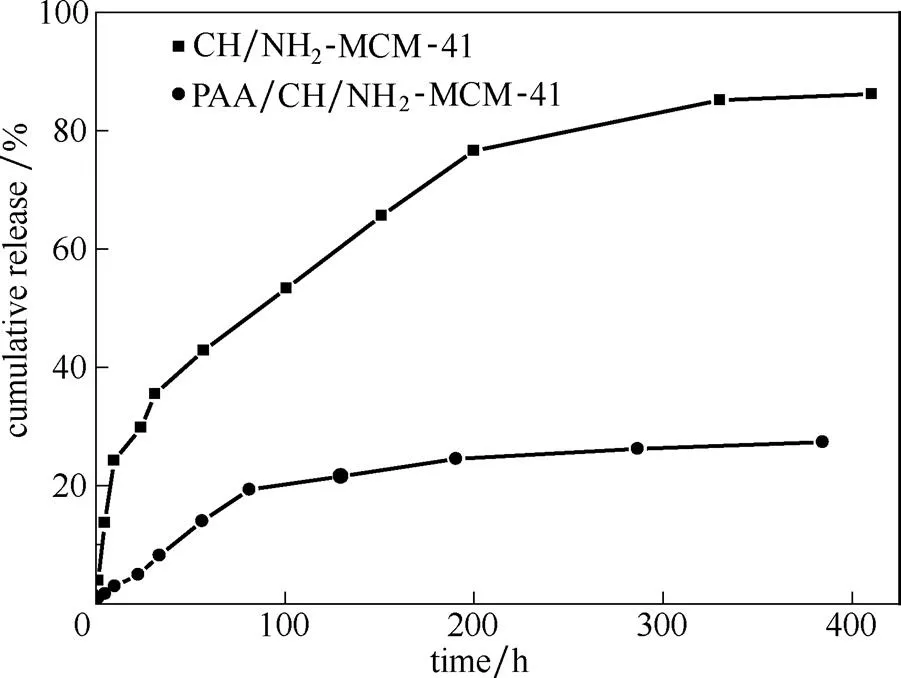
图7 PAA修饰前后载药介孔硅的药物释放曲线
为了进一步探究PAA修饰前后的载药介孔硅的释药行为,对其药物释放数据分别进行零级、一级、Higuchi、Korsmeyer-Peppas动力学模型方程拟合,其结果如表3所示。上述PAA修饰前后的载药氨基化介孔硅的释药规律比较符合Korsmeyer-Peppas动力学模型。此外,载药介孔硅和PAA修饰载药介孔硅的药物释放指数分别为0.4443和0.6486,表明前者的药物释放是以Fick扩散机理进行,而后者的药物释放是以扩散为主,溶蚀为辅的机理进行[26]。因为载药介孔硅中的药物向缓释介质释放仅是通过分子的运动来完成,而PAA修饰载药介孔硅在药物释放过程中不仅存在毒死蜱分子的运动,而且还存在对载药介孔硅起到位阻效应的PAA在释药过程中所发生的溶蚀现象,从而导致其两者的药物释放机理的差异。
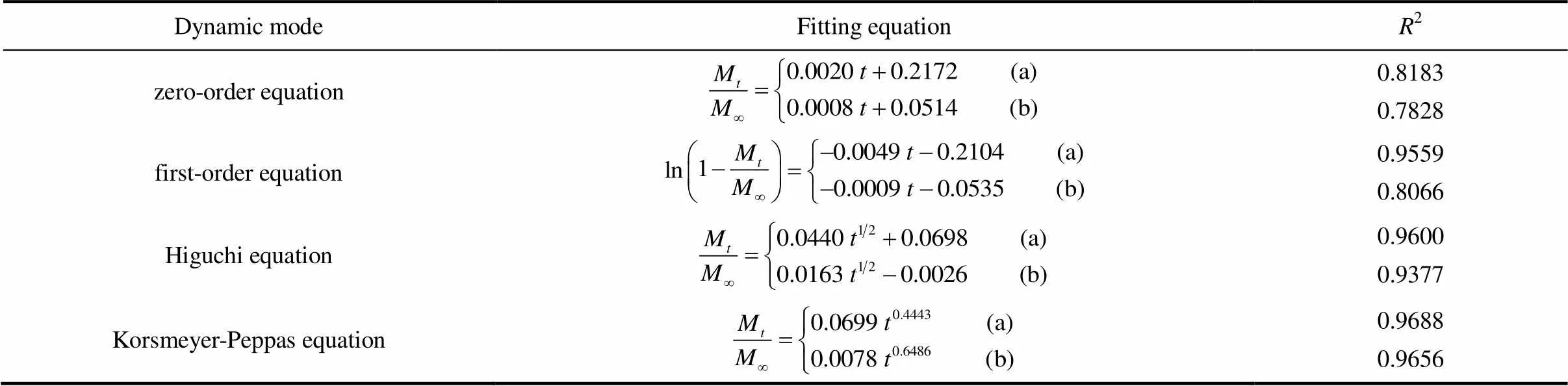
表3 PAA修饰前后载药介孔硅的药物释放曲线拟合结果
2.3.2 pH对缓释性能的影响 如图8所示,PAA修饰载药氨基化介孔硅在不同pH下的缓释效果:pH7>pH9>pH5>pH3。在释放384 h后,pH3时,释放率为87.5%,在pH7时,其释放率则仅有27.3%。在酸性条件下,氨基化介孔硅中的氨基以存在,PAA中的羧基以COOH存在,两者之间的静电作用力减弱;同时,过低的pH下,PAA的溶解度下降,也导致PAA与氨基化介孔硅作用力降低,从而减少药物从介孔硅中释放的阻力,故其药物释放速率增大。因此,在酸性条件下的pH越小,其缓释效果越差。然而,在偏碱性条件下(pH9),载药体系的释药速率相对较快(相对于pH7)。这是因为碱性条件下,PAA的溶解性提高,易于与介孔硅脱离;碱性条件下,PAA中的羧基以COO-存在,氨基化介孔硅中的氨基相对酸性和中性环境其正电性下降,造成两者的作用力减弱,故其位阻效应减弱,释药速率相对较快。Hong等[27]在研究PAA作为药物释放阀门时也发现在碱性条件下有利于药物的释放。
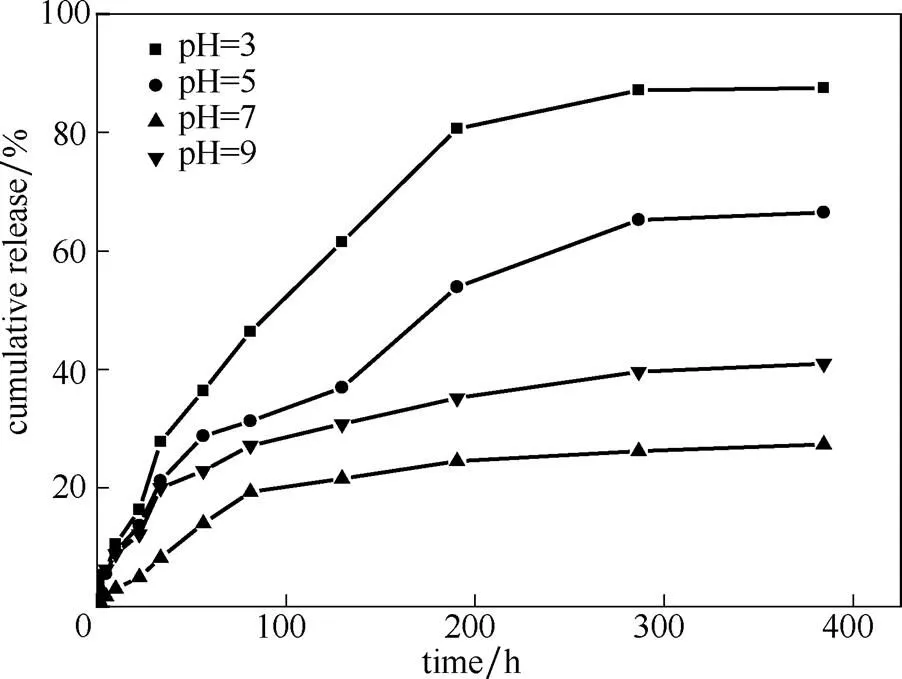
图8 不同pH下PAA修饰载药介孔硅的药物释放曲线
2.3.3 温度对缓释性能的影响 如图9所示,随着温度升高,PAA修饰载药氨基化介孔硅的释放速率增大,缓释效果变差。这是因为温度的升高,一方面,增大了PAA的溶解度,导致PAA从介孔表面脱落,降低了药物在扩散中所受到的阻力;另一方面,温度升高加速了氨基化介孔硅孔道中的药物分子的扩散速率,导致药物更容易释放。
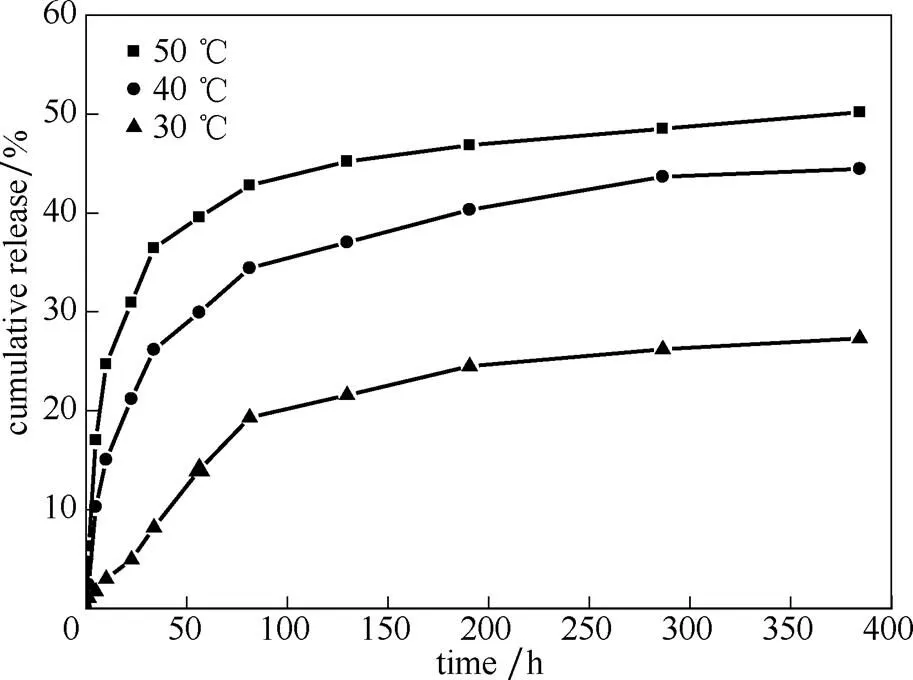
图9 不同温度下PAA修饰载药介孔硅的药物释放曲线
3 结 论
采用共缩聚法制备氨基化介孔硅,并通过静电吸附作用将PAA修饰于毒死蜱/氨基介孔硅的表面,制备了具有pH响应的毒死蜱/氨基化介孔硅缓释体系。该缓释体系对毒死蜱的吸附量为156 mg·g-1,其释药曲线符合Korsmeyer-Peppas动力学模型,其药物释放是以扩散为主,溶蚀为辅的机理进行。PAA修饰载药氨基化介孔硅在释药过程中表现出极强的pH响应性,在酸性条件易于释放,而在中性条件下,缓释效果最好,通过pH调控能有效控制药物的释放。同时,载药体系的释药速率还受到温度的影响。
References
[1] ZHAO D Y, HUO Q S, FENG J L,. Correction to “Nonionic triblock and star diblock copolymer and oligomeric surfactant syntheses of highly ordered, hydrothermally stable, mesoporous silica structures” [J]. Journal of the American Chemical Society, 2014, 136 (29): 10546.
[2] WANG Y, HAN N, ZHAO Q F,. Redox-responsive mesoporous silica as carriers for controlled drug delivery: a comparative study based on silica and PEG gatekeepers [J]. European Journal of Pharmaceutical Sciences, 2015, 72 (2): 12-20.
[3] PAPAT A, HARTONO S B, STAHR F,. Mesoporous silica nanoparticles for bioadsorption, enzyme immobilisation and delivery carriers [J]. Nanoscale, 2011, 3 (7): 2801-2718.
[4] TROJER M A, NORDSTIERNA L, NORDIN M,. Encapsulation of actives for sustained release [J]. Physical Chemistry Chemical Physics, 2013, 15: 17727-17741.
[5] VALLET-REGI M, RAMILA A, DEL R R P,. A new property of MCM-41: drug delivery system [J]. Chemistry of Materials, 2001, 13 (2): 308-311.
[6] TIANABC Y, KONGD Y, LIG X,. Light and pH-activated intracellular drug release from polymeric mesoporous silica nanoparticles [J]. Colloids and Surfaces B Biointerfaces, 2015, 134: 147-155.
[7] GUO W, YANG C, CUI L,. An enzyme-responsive controlled release system of mesoporous silica coated with Konjac oligosaccharide [J]. Langmuir, 2014, 30 (1): 243-249.
[8] ALBERTI S, SOLER I G J A A, AZZARONI O. Gated supramolecular chemistry in hybrid mesoporous silica nanoarchitectures: controlled delivery and molecular transport in response to chemical, physical and biological stimuli [J]. Chemical Communications, 2015, 51 (28): 6050-6075.
[9] CHEN F, JIANG, X P, KUAN T R,. Polyelectrolyte/mesoporous silica hybrid materials for the high performance multiple-detection of pH value and temperature [J]. Polymer Chemistry, 2015, 6 (18):3529-3536.
[10] YUAN L, TANG Q, YANG D,. Preparation of pH-responsive mesoporous silica nanoparticles and their application in controlled drug delivery [J]. The Journal of Physical Chemistry C, 2011, 115 (20): 9926-9932.
[11] BILALIS P, TZIBELEKA L, VARLASA S,. pH-Sensitive nanogates based on poly(L-histidine) for controlled drug release from mesoporous silica nanoparticles [J]. Polymer Chemistry, 2016, 7 (7): 1475-1485.
[12] POURJAVADI A, TEHRANI Z M, BENNETT C. PEG--polyvinyl pyridine coated magnetic mesoporous silica nanoparticles for pH-responsive controlled release of doxorubicin [J]. International Journal of Polymeric Materials, 2015, 64 (11): 570-577.
[13] 郭月月, 白诗扬, 孙继红. pH敏感型双模型介孔SiO2的制备及其对布洛芬的缓控释性能 [J]. 石油学报(石油加工), 2014, 30 (1): 181-186. GUO Y Y, BAI S Y, SUN J H. Preparation of pH-responsive bimodal mesoporous silicas and their performances in controlled ibuprofen delivery [J]. Acta Petrolei Sinica(Petroleum Processing Section), 2014, 30 (1): 181-186.
[14] WIBOWO D, ZHA C X, PETERS B C,. Sustained release of fipronil insecticideandfrom biocompatible silica nanocapsules [J]. Journal of Agricultural and Food Chemistry, 2014, 62 (52): 12504-12511.
[15] PRADO A G S, MOURA A O, NUNES A R. Nanosized silica modified with carboxylic acid as support for controlled release of herbicides [J]. Journal of Agricultural and Food Chemistry, 2011, 59 (16): 8847-8852.
[16] WAN M M, YANG J Y, QIU Y,. Sustained release of heparin on enlarged-pore and functionalized MCM-41 [J]. Applied Materials & Interfaces, 2012, 4 (8): 4113-4122.
[17] 彭仁忠. 控制释放技术在植物病虫害防治中的应用 [J]. 北京农业, 2014, (15): 112. PENG R Z. Application of controlled release technology in the control of plant diseases and insect pests [J]. Beijing Agriculture, 2014, (15): 112.
[18] GAURAV J, ANOOP N, ABDUR R,. Fluoride ion sensing in aqueous medium by employing nitrobenzoxadiazole-postgrafted mesoporous silica nanoparticles (MCM-41) [J].Physical Chemistry Chemical Physics, 2015, 17 (5): 3525-3533.
[19] GU J, FAN W, SHIMOJIMA A,. Organic-inorganic mesoporous nanocarriers integrated with biogenic ligands [J]. Small, 2007, 3 (10): 1740-1744.
[20] ROSTAMIZADEH S, NOJAVAN M. An environmentally benign multicomponent synthesis of some novel 2-methylthio pyrimidine derivatives using MCM-41-NH2as nanoreactor and nanocatalyst [J]. Journal of Heterocyclic Chemistry, 2014, 51 (2): 418-422.
[21] 林粤顺, 周新华, 周红军, 等. 毒死蜱/羽毛蛋白/海藻酸钠复合微球的制备及其缓释性能) [J]. 农药, 2014, 30 (12): 892-896, 911. LIN Y S, ZHOU X H, ZHOU H J,. Preparation and slow-release performance of chlorpyrifos/feather keratin/sodium alginate microspheres [J]. Agrochemicals, 2014, 30 (12): 892-896, 911.
[22] ZENG W, QIAN X, YIN J,. The drug delivery system of MCM-41 materialsco-condensation synthesis [J]. Materials Chemistry and Physics, 2006, 97 (2/3): 437-441.
[23] HARTONO S B, QIAO S Z, JACK K,. Improving adsorbent properties of cage-like ordered amine functionalized mesoporous silica with very large pores for bioadsorption [J]. Langmuir, 2009, 25 (11): 6413-6424.
[24] 岳林海, 金达莱. 两亲PS--PAA共聚物水溶液中球形碳酸钙复合物的合成及其热分解性质 [J]. 科学通报, 2004, 49 (1): 61-64. YUE L H, JIN D L. Synthesis and thermal decomposition properties of spherical calcium carbonate complex in aqueous solution of amphiphilic PS--PAA [J]. Chinese Science Bulletin, 2004, 49 (1): 61-64.
[25] 周细应, 李卫红, 何亮. 纳米颗粒的分散稳定性及其评估方法 [J]. 材料保护, 2006, 39 (6): 51-54. ZHOU X Y, LI W H, HE L. Dispersion stability of nanoparticles and its evaluation methods [J]. Materials Protection, 2006, 39 (6): 51-54.
[26] DASH S, MURTHY P N, NATH L,. Kinetic modeling on drug release from controlled drug delivery systems [J]. Acta Poloniae Pharmaceutica-Drug Research, 2010, 67 (3): 217-223.
[27] HONG C Y, LI X, PAN C Y. Fabrication of smart nanocontainers with a mesoporous core and a pH-responsive shell for controlled uptake and release [J]. Journal of Materials Chemistry, 2009, 19 (29): 5155-5160.
Preparation and properties of pH-responsive control release system of PAA/chlorpyrifos/amino functionalized mesoporous silica
LIN Yueshun, ZHOU Hongjun, ZHOU Xinhua, GONG Sheng, XU Hua, CHEN Huayao
(College of Chemistry and Chemical Engineering, Zhongkai University of Agriculture and Engineering, Guangzhou 510225, Guangdong, China)
A pH-responsive control release system of PAA/chlorpyrifos/mesoporous silica was prepared by using negative charged polyacrylic acid (PAA) to encapsulate amino functionalized mesoporous silica (NH2-MCM-41) with chlorpyrifos loaded in the pores. The PAA/chlorpyrifos/NH2-MCM-41 system were systematically characterized using X-ray diffraction (XRD), N2adsorption-desorption, transmission electron microscopy (TEM), scanning electron microscopy (SEM), thermogravimetric analysis (TGA), Zeta potential and Fourier transform infrared spectroscopy (FTIR). The release behavior of chlorpyrifos was studied at various pH and temperature conditions. The experimental results showed that PAA was coated on the surface of chlorpyrifos/amino functionalized mesoporous silica as a result of electrostatic interaction. The chlorpyrifos release from the PAA/chlorpyrifos/NH2-MCM-41 system was inhibited mainly by PAA blockage with significant pH sensitivity, which increased with pH decrease at pH≤7 and was slightly higher in weak base condition than that in neutral condition. The release also exhibited some temperature dependence and generally followed the Korsmeyer-Peppas kinetic model.
amino functionalized mesoporous silica; PAA; pH-responsive; chlorpyrifos; control release
2016-04-05.
ZHOU Xinhua, cexinhuazhou@163.com
10.11949/j.issn.0438-1157.20160417
TQ 450.6
A
0438—1157(2016)10—4500—08
国家自然科学基金项目(21576303);广东省自然科学基金项目(2016A030313375);广东省科技计划项目(2014A020208126);广州市科技计划项目(201510010150)。
2016-04-05收到初稿,2016-07-24收到修改稿。
联系人:周新华。第一作者:林粤顺(1989—),男,硕士研究生。
supported by the National Natural Science Foundation of China (21576303) and the Natural Science Foundation of Guangdong Province (2016A030313375).

