海洋葡甘聚糖酶菌株的分离鉴定及酶学性质研究
王强,李旭,窦少华,张庆芳,魏计东,金连豆,迟乃玉*
(1.大连大学生命科学与技术学院,辽宁大连116622;2.辽宁省海洋微生物工程技术研究中心,辽宁大连116622;3.大连市生产力促进中心,辽宁大连116025)
海洋葡甘聚糖酶菌株的分离鉴定及酶学性质研究
王强1,2,李旭3,窦少华1,2,张庆芳1,2,魏计东1,2,金连豆1,2,迟乃玉1,2*
(1.大连大学生命科学与技术学院,辽宁大连116622;2.辽宁省海洋微生物工程技术研究中心,辽宁大连116622;3.大连市生产力促进中心,辽宁大连116025)
以海泥和海水为样品,采用稀释涂布平板法初筛、摇瓶发酵复筛,得到一株葡甘聚糖酶高产菌Q1,测得酶活为187.68 U/mL。通过形态学、生理生化特征及16S rDNA序列分析,鉴定菌株Q1为枯草芽孢杆菌(Bacillus subtilis),其所产酶最适作用温度为35℃,热稳定性较差;最适作用pH值为6.0,碱性条件下,pH稳定性较差;Cu2+、Fe2+、乙二胺四乙酸(EDTA)对该酶抑制性较强,Mg2+对该酶抑制性较弱,NH4+对该酶的活性影响不明显,Na+对该酶激活作用较弱,Mn2+对该酶激活作用较强。该酶只在外源诱导物存在时,才能大量合成,说明该酶是诱导酶。
海洋;葡甘聚糖酶;鉴定;枯草芽孢杆菌;酶学性质
葡甘聚糖酶(glucomannanase)是一种能将葡甘聚糖降解为葡甘低聚糖的外泌酶。葡甘低聚糖属于功能性低聚糖,功能性低聚糖因其具有独特的生理功能而受到广泛关注[1-2]。葡甘低聚糖具有极其显著的降脂作用,可以作为高血脂、糖尿病辅助治疗产品[3-5];能提高体内超氧化物岐化酶活性,增强机体抗氧化能力[6];具有排毒和增强免疫功能的作用[7];促进肠道内有益微生物的生长,特别是耐氧双歧杆菌的生长[8]。获得葡甘低聚糖的方法主要有:从魔芋中提取,但是工艺复杂且产率极低;通过人工化学合成,但步骤繁琐,成本太高;利用酸水解葡甘聚糖,但这样生产的低聚糖性质不稳定,副产品多;利用物理方法降解,但是实验设备要求太高,无法用于大量生产[9];酶解葡甘聚糖,反应效率高且方法简单,后期分离也容易[10]。目前有关葡甘低聚糖产品,只有少量出现在国外市场,国内基本无此类产品[11]。
海洋微生物发酵生产低温葡甘聚糖酶与中高温葡甘聚糖酶相比具有很大优势,低温葡甘聚糖酶在低温下具有高酶活力及高催化效率,可大大缩短处理时间并省却昂贵的加热或冷却费用。本实验从海洋样品中分离筛选出一株葡甘聚糖酶产生菌Q1,对其进行形态学、生理生化特征及16S rDNA序列分析,进而确定其种属,并研究其产生的葡甘聚糖酶酶学性质,为研究海洋微生物发酵生产葡甘聚糖酶奠定基础。
1 材料与方法
1.1材料与试剂
1.1.1菌株
试验菌株枯草芽孢杆菌(Bacillus subtilis)Q1筛选自黄海海域(123.396°E,36.7014°N)海水和海泥样品,现由辽宁省海洋微生物工程技术研究中心保藏。
1.1.2培养基
初筛培养基:蛋白胨0.1%,牛肉膏0.3%,NaCl 0.5%,魔芋粉0.5%,琼脂2%,刚果红适量,pH7.0,121℃灭菌20min。
种子培养基:蛋白胨1%,牛肉膏0.3%,NaCl 0.5%,pH 7.0,121℃灭菌20 min。
发酵培养基:蛋白胨0.1%,牛肉膏0.3%,NaCl 0.5%,魔芋粉0.5%,pH 7.0,121℃灭菌20 min。
保藏培养基:蛋白胨1%,牛肉膏0.3%,NaCl 0.5%,琼脂2%,pH 7.0,121℃灭菌20 min。
1.1.3主要试剂
魔芋粉:大连凯美化工工程配套有限公司;葡甘聚糖:合肥博美生物科技有限责任公司;核酸Marker:加拿大Fermentas MBI公司;其余试剂均为国产分析纯。
1.2仪器与设备
LDZX-40BI立式压力蒸汽灭菌器:上海申安医疗器械厂;LTI-700恒温培养箱:上海爱朗仪器有限公司;HZP-250全温振荡培养箱:上海精宏实验设备有限公司;HD-1360超净工作台:北京东联哈尔仪器制造有限公司;AL-204电子天平:梅特勒-托利多仪器有限公司;A200型基因扩增仪:杭州朗基科学仪器有限公司;RDY-SP1Z型核酸电泳仪:北京荣阳经典科技有限公司。
1.3方法
1.3.1菌株的分离鉴定
(1)初筛
取10 mL海水和10 g海泥分别加入90 mL带有玻璃珠的无菌水中,振荡30 min。用无菌水从10-1依次梯度稀释至10-8,分别取10-5、10-6、10-7、10-8稀释度样品各0.1 mL,均匀涂布于初筛培养基上,28℃倒置培养48 h,观察菌落周围有无透明圈,筛选透明圈大的菌株进行后续实验。
(2)复筛
将初筛得到的菌株接种到装液量为100 mL/250 mL的种子培养基中,28℃、150 r/min振荡培养24 h,作为一级种子液;
将一级种子液以5%接种量接种到装液量为100 mL/ 250 mL的种子培养基中,28℃、150 r/min振荡培养24 h,作为二级种子液。
将二级种子液以5%接种量接种到装液量为100 mL/ 250 mL的发酵培养基中,28℃、150 r/min振荡培养48 h。通过3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)法测定发酵液酶活,筛选出酶活高的菌株。
(3)形态学特征
在初筛培养基上观察菌落的形状、颜色等形态学特征,通过革兰氏染色在光学显微镜(10×100)下观察菌体形态。
(4)生理生化特征
参照《常见细菌系统鉴定手册》(第8版)[12]相关内容,对该菌株进行淀粉水解、明胶液化、V-P试验、甲基红试验、接触酶试验、糖发酵试验、脲酶试验、石蕊牛奶试验、柠檬酸盐试验、硝酸盐试验。
(5)菌株16S rDNA序列分析
采用Ezup柱式细菌基因组DNA抽提试剂盒提取菌株DNA。以提取到的菌株Q1 DNA为模板,以16S rDNA基因通用引物对16S rDNA序列片段进行聚合酶链反应(poly merase chain reaction,PCR)。其引物如下:正向引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和反向引物1492R(5′-GGTTACCTTGTTACGACTT-3′)。扩增反应体系模板(基因组DNA 20~50 ng/μL)0.5 μL,10×Buffer(含Mg2+)2.5 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(各2.5 mmol/L)1 μL,Taq酶0.2 μL,正向引物27F(10 μmol/L)0.5 μL,反向引物1492R(10 μmol/L)0.5 μL,补加ddH2O至25 μL。扩增反应条件为94℃、4 min;94℃、45s,55℃、45s,72℃、1min,30个循环;72℃、10min。将PCR扩增产物送交上海生工生物有限公司测序,将测序结果提交到GenBank数据库中,经基本局部比对搜索工具(basic lacal aliqnment search tood,BLAST)序列比对,利用MEGA软件构建系统发育树。
1.3.2葡甘聚糖酶酶活测定
DNS法测葡甘聚糖酶酶活[13]:0.9 mL 0.4%葡甘聚糖底物中,加入适当稀释的葡甘聚糖酶酶液0.1 mL,30℃水浴10 min,立即放入100℃水浴5 min,终止反应,然后加入2.0mLDNS,100℃显色5min,冷却至室温用蒸馏水定容至20 mL,于波长540 nm处测定吸光度值,根据酶活公式计算酶活。葡甘聚糖酶活单位定义:在上述反应条件下,葡甘聚糖每分钟释放1 μmol甘露糖的酶量为1个酶活单位(U)[14-15]。相对酶活以同组最高酶活为100%。
1.3.3粗酶液的制备
将二级种子液以5%接种量,接种到发酵培养基中,28℃、150 r/min振荡培养48 h。发酵液经6 000 r/min、4℃离心20 min,所得上清液即为粗酶液。
1.3.4酶学性质研究
(1)酶最适作用温度
取一定量酶液,分别在20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃条件下,测定葡甘聚糖酶相对酶活,每次做3组平行实验。
(2)酶的热稳定性
将酶液分别置于35℃、40℃、50℃、60℃、70℃水浴中,分别保存10 min、20 min、30 min、40 min、50 min、60 min,立即冷却,并测定葡甘聚糖酶相对酶活,每次做3组平行实验。
(3)酶最适作用pH
在酶最适作用温度下,分别在pH 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0磷酸钾缓冲液反应体系中测定葡甘聚糖酶相对酶活,每次做3组平行实验。
(4)酶的pH稳定性
将酶液分别置于pH 5.0、6.0、7.0、8.0、9.0磷酸钾缓冲液中,分别保存10min、20min、30min、40min、50min、60min,测定葡甘聚糖酶相对酶活,每次做3组平行实验。
(5)金属离子与EDTA对酶活影响
在酶最适作用条件下,加入Cu2+、Mg2+、Fe2+、NH4+、Na+、Mn2+及乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),使各反应体系中金属离子终浓度为10 mmol/L,测定葡甘聚糖酶相对酶活,每次做3组平行实验。
(6)判断葡甘聚糖酶是否为诱导酶
第一步:将菌株Q1接种到发酵培养基中,26℃、160r/min培养55 h,将发酵液经6 000 r/min、4℃离心20 min,取上清液测定酶活。
第二步:收集发酵液中离心菌体,用磷酸钾缓冲液悬浮菌体,6 000 r/min,4℃离心5 min,收集菌体,再次用磷酸钾缓冲液将菌体悬浮,重复3次,将洗好菌体接种到种子培养基(无葡甘聚糖类物质)中,26℃、160 r/min培养55 h,将种子液经6 000 r/min、4℃离心20 min,取上清液测定酶活。
第三步:收集种子液中离心菌体,用磷酸钾缓冲液悬浮菌体,6 000 r/min、4℃离心5 min,收集菌体,再次用磷酸钾缓冲液将菌体悬浮,重复3次,将洗好菌体接种到发酵培养基中,26℃、160 r/min培养55 h,将发酵液经6 000 r/min、4℃离心20 min,取上清液测定酶活。
2 结果与分析
2.1菌株的筛选
对黄海海域海水和海泥样品进行初筛和复筛,得到10株具有葡甘聚糖酶活性的菌株,其酶活如表1所示。

表1 菌株产酶活性比较Table 1 Comparison of enzyme activity produced by strains
由表1可知,葡甘聚糖酶酶活最高的是菌株Q1,酶活为187.68 U/mL,与国内一些研究报道相比,菌株Q1所产葡甘聚糖酶酶活高于董桂清[16]报道的菌株DK3所产酶酶活58.54 U/mL、吴华伟等[17]报道的菌株MAN所产酶酶活101 U/mL、程爱芳等[18]报道的菌株HD-1所产酶酶活72.6 U/mL。利用甘油保藏法将菌株Q1保藏于-20℃冰箱中,用于后续实验。
2.2菌株Q1形态学特征
菌株Q1的菌落特征及革兰氏染色结果见图1。由图1A可知,菌株Q1菌落边缘不规则,乳白色,不透明,表面干燥,呈褶皱状,用接种环易于挑取。由图1B可知,菌株Q1为革兰氏阳性菌,杆状,菌体两端生有芽孢。

图1 菌株Q1菌落形态(A)及显微形态(B)Fig.1 Colonial morphology(A)and microscopic morphology(B)of strain Q1
2.3生理生化特征
按照《常见细菌系统鉴定手册》(第8版)对菌株进行生理生化试验,结果如表2所示。

表2 菌株Q1的生理生化特征Table 2 Physiological and biochemical characteristics of strain Q1
由表2可知,菌株Q1生理生化特征为:淀粉水解试验、明胶液化试验、石蕊牛奶试验、V-P试验、接触酶试验、柠檬酸盐试验、硝酸盐试验结果均为阳性,脲酶试验、糖发酵试验、甲基红试验结果均为阴性。由生理生化试验结果可初步鉴定其为芽孢杆菌属。
2.416S rDNA序列分析与系统发育树的构建
选择产葡甘聚糖酶酶活最高的菌株Q1进行16S rDNA序列鉴定,用细菌基因组DNA提取试剂盒提取基因组DNA,将得到的基因组作为模板进行PCR扩增。PCR扩增产物进行琼脂糖凝胶电泳检测,结果见图2。由图2可知,PCR扩增产物序列长度为1 486 bp。
以菌株Q1的16SrDNA序列为基基,将序列与GenBank数据库中同源性最高的己知分类菌株序列进行比较,以软件构建菌株Q1系统发育树如图3所示。由图3可知,菌株Q1与枯草芽孢杆菌同源性最高为100%,因此可以鉴定菌株Q1为枯草芽孢杆菌(Bacillus subtilis)。

图2 菌株Q1 16S rDNA PCR扩增电泳图Fig.2 PCR amplification products electrophoresis of 16S rDNA ofstrain Q1

图3 菌株Q1 16S rDNA序列系统发育树Fig.3 Phylogenetic tree of strain Q1 based on 16S rDNA sequence
2.5酶学性质研究
2.5.1酶最适作用温度
由图4可知,酶的最适作用温度为35℃,40℃以后酶活迅速下降,在20~35℃下酶活能保持在80%以上,这符合低温酶的特性。在低温条件下,相对嗜温型酶而言,低温酶反应所需时间更短,这是低温酶的应用优势[19]。

图4 葡甘聚糖酶最适作用温度Fig.4 The optimum temperature of the glucomannanase
2.5.2酶的热稳定性
由图5可知,该葡甘聚糖酶热稳定性比较差,经60℃处理30 min,酶活不足20%,70℃处理30 min,酶活不足10%。原因可能是低温酶结构的高度柔顺性可能造成蛋白的离子配位松散,并且由于缺乏二硫键及刚性的二级结构,导致低温酶对热变性和化学变性敏感,稳定性降低[20]。
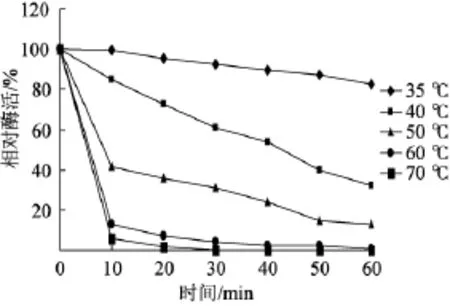
图5 葡甘聚糖酶的热稳定性Fig.5 The thermostability of the glucomannanase
2.5.3酶最适作用pH
在同一温度下,不同的pH对于相对酶活会产生不同的影响。由图6可知,该葡甘聚糖酶最适反应pH为6.0,pH值为5.0~6.0时,葡甘聚糖酶相对酶活均在80%以上,pH值为7.0~11.0时,相对酶活呈下降趋势;pH达到11.0时,相对酶活几乎为零。

图6 葡甘聚糖酶最适作用pHFig.6 The optimum pH of glucomannanase
2.5.4酶的pH稳定性
由图7可知,该葡甘聚糖酶最适作用pH为6.0,经pH 5.0处理30 min,相对酶活仍为80%以上;pH 8.0处理30 min,相对酶活仅为20%;pH 9.0处理30 min,相对酶活不足10%,故该酶具有一定耐酸性,碱性条件下,pH稳定性较差,这是由于酶分子中所含的酸性氨基酸比率偏高导致的。
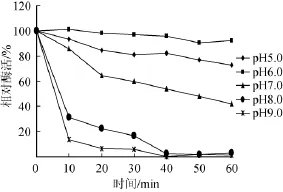
图7 葡甘聚糖酶的pH稳定性Fig.7 pH stability of the glucomannanase
2.5.5金属离子和EDTA对酶活的影响
由表3可知,Cu2+、Fe2+、EDTA对酶的抑制性较强,Mg2+对酶的抑制性较弱,NH4+对酶作用不明显,Na+对酶有较弱的激活作用,Mn2+对酶有较强的激活作用。该酶能被EDTA强烈抑制,可以推测该酶的活性中心构象的维持与金属离子有关[21]。

表3 金属离子与EDTA对葡甘聚糖酶活性的影响Table 3 Effects of metal ions and EDTA on the activity of glucomannanase
2.5.6判断葡甘聚糖酶是否为诱导酶
在没有外源诱导物(葡甘聚糖类物质)时,没有葡甘聚糖酶合成,即在种子液中检测不到葡甘聚糖酶活性,只有在以葡甘聚糖类物质为唯一碳源时,葡甘聚糖酶大量合成,即在发酵液中测得葡甘聚糖酶活性,说明该酶为诱导酶。
3 结论
本实验是从黄海海域的海泥和海水样品中,初筛得到10株葡甘聚糖酶菌株,DNS法测定酶活进行复筛,得到一株酶活较高的菌株Q1,并对其进行形态学、生理生化特征、16SrDNA序列分析,鉴定菌株Q1为枯草芽孢杆菌(Bacillus subtilis)。对其所产的葡甘聚糖酶酶学性质进行初步研究,结果表明,该酶的最适作用温度为35℃,酶的热稳定性较差,属于低温酶类;酶的最适作用pH为6.0,该酶在碱性条件下稳定性较差;Cu2+、Fe2+、EDTA对酶的抑制性较强,Mg2+对酶的抑制性较弱,NH4+对酶作用不明显,Na+对酶有较弱的激活作用,Mn2+对酶有较强的激活作用;葡甘聚糖酶只在以葡甘聚糖类物质为唯一碳源的条件下才能合成,说明该酶为诱导酶。
[1]张雪云.功能性低聚糖的研究开发[J].饮料工业,2013,16(1):5-8.
[2]钟燕,索化夷.魔芋葡甘聚糖的功能及在食品领域的应用[J].中国酿造,2014,33(8):6-9.
[3]何丹,郭熊,杨双莲,等.酶法制备魔芋甘露寡糖和产物分析[J].中国酿造,2013,32(5):85-88.
[4]陈黎,杨艳燕,闫达中.魔芋低聚糖降脂作用的初步探究[J].中国生化药物杂志,2002,23(4):181-182.
[5]FUKUMORI Y,TAKEDA H,FUJISAWA T,et al.Blood glucose and insulin concentrations are reduced in humans administered sucrose with inosine or adenosine[J].J Nutr,2000,130(8):1946-1949.
[6]杨艳燕,李小明,李顺意,等.魔芋低聚糖对小鼠血糖含量和抗氧化能力的影响[J].中草药,2001,32(2):142-145.
[7]冯莉,刘瑞雪,张波,等.魔芋低聚糖作为新食品原料的应用研究[J].中国食品添加剂,2014(7):153-157.
[8]吴拥军,王嘉福,蔡金藤,等.魔芋葡萄甘露低聚糖的提取及其产物对耐氧双歧杆菌的促生长作用[J].食品科学,2002,23(6):42-44.
[9]周海燕,杨三东,周大寨,等.发酵生产魔芋葡甘聚糖酶[J].中国生物工程杂志,2005,25(3):65-68.
[10]郁蓉,王岁楼.酶法制备功能性低聚糖的研究进展[J].中国食品与营养,2009(12):32-35.
[11]陈坚.微生物重要代谢产物—发酵生产与过程分析[M].北京:化学工业出版社,2005:6.
[12]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:43-65.
[13]冯娜,赵君,赵敏.β-甘露聚糖酶产生菌DY-14的发酵条件及分离纯化[J].黑龙江医药,2011(3):397-401.
[14]李江华,房俊,邬显章.黑曲霉酸性β-甘露聚糖酶的摇瓶发酵条件[J].江苏食品与发酵,2002,12(4):16-18.
[15]陈思洋.发酵法生产魔芋葡甘聚糖酶[D].长沙:湖南农业大学,2012.
[16]董桂清.产葡甘聚糖酶菌株的筛选及酶的分离纯化[D].南宁:广西大学,2007.
[17]吴华伟,蔚鑫鑫,陈雪秋,等.产甘露聚糖酶细菌的分离鉴定、酶的部分纯化及酶学性质研究[J].湖北农业科学,2014,53(15):3601-3605.
[18]程爱芳,邓政东,黄芳一,等.多黏芽孢杆菌HD-1产β-甘露聚糖酶的条件优化[J].湖北农业科学,2015(1):164-167.
[19]司马义·萨依木.极端环境中的低温微生物及其应用[J].生物学通报,2002,37(8):15-17.
[20]曾胤新,蔡明宏,余勇,等.微生物低温酶适冷机制研究进展[J].中国生物工程杂志,2003,23(10):52-56.
[21]张金伟,曾润颖.南极产低温脂肪酶菌株Psychrobactersp.7195的选育、发酵条件及酶学性质研究[J].生物磁学,2006,6(1):6-10.
WANG Qiang1,2,LI Xu3,DOU Shaohua1,2,ZHANG Qingfang1,2,WEI Jidong1,2,JIN Liandou1,2,CHI Naiyu1,2*
(1.College of Life Science and Technology,Dalian University,Dalian 116622,China;2.Liaoning Marine Microbial Engineering and Technology Center,Dalian 116622,China;3.Dalian Productivity Promote Center,Dalian 116025,China)
Using sea mud and seawater as samples,a high glucomannanase-producing strain Q1 was obtained by spread plate method preliminary screening and shake flask fermentation secondary screening,and the enzyme activity was 187.68 U/ml.The strain Q1 was identified asBacillus subtilisby morphological,physiological and biochemical characteristics and 16S rDNA sequence analysis.The optimum temperature of glucomannanase production was 35℃and the thermostability was weaker.The optimum pH was 6.0,pH stability was weaker in alkaline condition.The glucomannanase activity was strongly inhibited by Cu2+、Fe2+and EDTA,slightly inhibited by Mg2+.The effect of NH4+on the glucomannanase activity was not obvious.The glucomannanase activity was slightly activated by Na+,strongly activated by Mn2+.Only in the exogenous inducer condition,the glucomannanase could be synthesized in quantity,which indicated that the glucomannanase was inducible enzyme.
marine;glucomannanase;identification;Bacillus subtilis;enzymatic properties
Q93
0254-5071(2016)06-0065-05
10.11882/j.issn.0254-5071.2016.06.014

2016-04-01
国家高技术研究发展计划‘863计划’项目(2007AA021306)
王强(1990-),女,硕士研究生,研究方向为微生物酶制剂研究。
迟乃玉(1965-),男,教授,博士,研究方向为微生物酶制剂研究。

