催化氮化制备氮化硅粉体
赵万国,古亚军,李发亮,王军凯,张海军,张少伟
(武汉科技大学省部共建耐火材料与冶金国家重点实验室,武汉 430081)
催化氮化制备氮化硅粉体
赵万国,古亚军,李发亮,王军凯,张海军,张少伟
(武汉科技大学省部共建耐火材料与冶金国家重点实验室,武汉430081)
氮化硅陶瓷由于具有优良的机械性能、化学性能和物理性能而被广泛应用于化工、冶金及航天等领域。催化氮化法制备氮化硅可以有效避免 “硅芯”及“流硅”等不完全氮化形为的发生;并促进氮化硅晶须的原位反应合成,改善氮化硅基材料界面的显微结构,提高最终制品的力学性能。本文综述了金属及金属氧化物催化剂催化氮化反应生成氮化硅的最新进展及一维氮化硅的原位生成机理,并在此基础上展望了催化氮化制备氮化硅工艺今后的发展方向。
氮化硅; 一维纳米材料; 催化氮化; 反应机理
1 引 言
氮化硅(Si3N4)陶瓷以其优良的抗氧化性、良好的热、化学稳定性、高的强度和硬度及优异的自润滑性等,被广泛用做高温耐腐耐磨零部件、高速切削刀具和雷达天线罩等,其应用领域涉及机械、化工、电子和军工等行业[1-3]。
Si3N4属六方晶系,可分为α-Si3N4和β-Si3N4两种晶型,一般认为α-Si3N4在1400~1600 ℃时发生不可逆相变,转变为β-Si3N4。常见的Si3N4粉体制备方法有直接氮化法[4,5]、碳热还原法[6]、气相法[7]、自蔓延法[8,9]、热分解法[10]和溶胶-凝胶法等[11,12]。采用这些方法合成Si3N4粉体的优缺点如表1所示。和其他方法相比,硅(Si)粉直接氮化法具有生产工艺简单、适合工业化生产的优点,是制备Si3N4粉体最常用的方法。但该方法存在着氮化温度高,氮化周期长等问题,一般需要在1400 ℃以上长时间保温,导致能源浪费严重[13-16]。
催化氮化法可以降低Si粉氮化的起始反应温度和完全氮化温度,并有效避免制品中“硅芯”的出现,实现制品在较低温度下的完全氮化。同时,催化氮化还可以促进Si3N4晶须的原位合成,改善材料的界面显微结构,提高最终Si3N4基复合材料的力学性能。因此,近年来通过催化氮化法制备Si3N4粉体[17-20]及Si3N4基复合材料逐渐成为研究的热点。
本文综述了近年来催化氮化法制备Si3N4粉体的最新研究进展以及一维Si3N4原位生成机理的研究状况。

表1 不同Si3N4制备方法的优缺点对比
2 金属单质催化氮化制备Si3N4粉体
近年来,利用金属单质及金属氧化物催化氮化Si粉制备Si3N4粉体及其复合材料的研究逐渐成为本领域的一个研究热点,其主要研究成果如下。
2.1Fe单质为催化剂
上世纪70年代Boyer等[21]就研究了掺杂Fe对Si粉氮化的影响,他们认为:(1)在O2分压低于4 Torr时,Fe可以快速破坏Si粉表面的氧化物薄膜,从而提高氮化效率。Fe对Si粉氮化的作用机理如图1所示,Fe的存在加快了Si粉表面SiO2薄膜的开裂,促进Si粉与SiO2反应生成SiO(g),通过SiO(g)与N2间的气相反应提高了氮化效率;(2)高温下Fe与Si会形成液相合金FeSix,FeSix的存在会同时促进α-Si3N4及β-Si3N4的生成;(3)α-Si3N4主要是通过FeSix液相合金中挥发出来的Si(g)氮化生成的,生成的α-Si3N4会覆盖在未反应的Si粉表面,阻碍氮化反应的进一步发生,因此α-Si3N4的产量主要取决于液相合金FeSix暴露出的表面积;(4)β-Si3N4主要从FeSix的液相中生成,其生成速率取决于N2在FeSix液相中的溶解和扩散速率。换言之,β-Si3N4的生成量取决于液相合金FeSix的含量,即取决于Fe的含量。
Mitomo等[22]也以Fe粉为催化剂,在1420 ℃,氧气分压为1.2×10-12~1.5×10-15atm 的条件下研究了Si粉的氮化形为。结果表明:(1)虽然相对高的O2分压有助于α-Si3N4的生成,但是也会在Si粉表面会形成一层致密的SiO2保护层,进而降低了氮化反应的进行;(2)1350 ℃下,热力学计算结果表明反应体系中不可能形成Fe的氮化物,相反Fe会与Si反应生成低熔点的Si-Fe合金;(3)Si-Fe合金在高温下熔化为液相,液相的存在增大了N2与Si粉的接触面积,不仅提高Si粉的氮化反应速率,同时也促进了α-Si3N4的生成。
Pavarajarn等[23]的研究结果表明:以Si粉(2 μm)为原料且氮化温度为1300 ℃时,产物中β-Si3N4的含量随着Fe添加量的增加而逐渐增加,最大可达到纯Si粉氮化产物中的2倍。当Fe的添加量大于1wt%时,将更有利于β-Si3N4的生成。
我们课题组[24]以Si粉为原料,采用原位还原Fe3+离子的方法先制备负载了有纳米Fe单质催化剂的Si粉,而后再研究该粉体的氮化形为。研究结果表明:(1)加入2wt% Fe纳米催化剂的Si粉,在1350 ℃下氮化2 h后,试样中残余硅的含量小于5wt%;而相同条件下无催化剂的试样中,单质硅的残余率高达50wt%;(2)催化氮化制得的试样中存在大量的Si3N4晶须,其直径在20~200 nm,长度可达几微米至十几微米。
2.2Co单质为催化剂
Co也具有很好的催化氮化Si粉的性能。我们课题组[25]的研究结果表明:(1)纳米Co催化剂的加入显著降低了Si粉的氮化温度。1300 ℃时,加入2wt%的Co催化剂即可导致Si粉的完全氮化;而在不加催化剂的情况下,1400 ℃时Si粉仍不能完全氮化;(2)催化氮化后产物中生成了大量直径在80~320 nm,长度为数十微米的沿[101]方向生长的Si3N4晶须;(3)Co的催化氮化作用机理可归因于荷电转移效应,Co原子可将其外层价电子转移至N2分子的反键轨道,削弱了N≡N三键的结合力,降低了氮化反应的活化能,进而促进了氮化反应的进行。DFT的计算(图2及表2)结果表明:(1)Co催化剂的(111)面及(100)面的吸附能分别为28.32和30.32 kJ/mol,说明N2分子更易吸附于Co的(111)面;(2)吸附于Co纳米颗粒(111)面及(100)面上的N2分子的键长分别为0.1313和0.1310 nm,均大于N2分子的原始键长(0.1295 nm),且吸附后的键级也较单独的N2分子的键级有所降低;(3)当N2分子吸附于Co纳米颗粒表面时,Co纳米颗粒表面带正电,其(111)面的电荷由原始的0.003~0.012 e变化为0.024~0.045 e;(100)面的电荷由原始的0.001~0.012 e变化为0.011~0.044 e;同时N2分子却带负电,其吸附在(111)面时的电荷由原始的0 e变化为-0.111~-0.144 e;而吸附在(100)面上时的电荷由原始的0 e变化为-0.112 e。
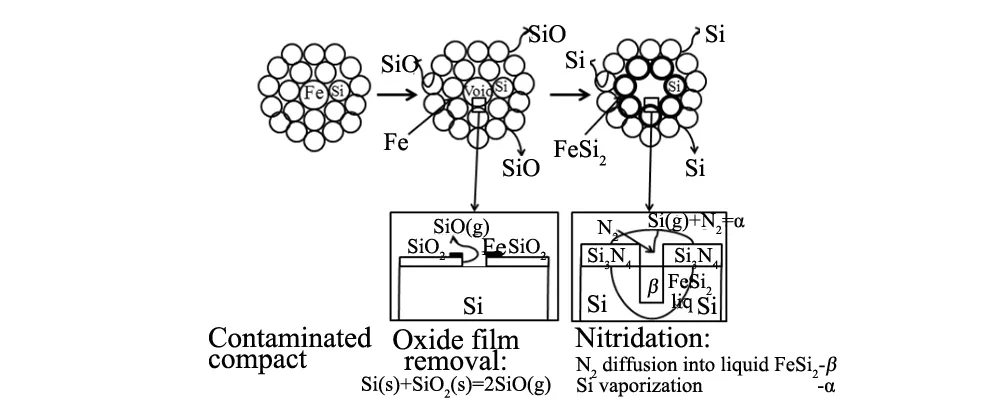
图1 Fe对Si粉氮化的作用机理Fig.1 A suggested mechanism for the enhancement nitridation of Si powders with Fe as catalyst
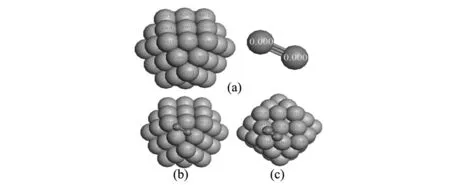
图2 Co55和吸附于其上的N2分子的荷电状态计算Fig. Electronic structures of Co55 NPs and adsorbed N2 molecule based on the DFT calculations
Huang等[26]以Si粉为原料,Co为催化剂,采用直接氮化法制备了Si3N4纳米棒。研究结果表明:不加催化剂时,当反应温度升高至1350 ℃,Si粉的氮化效率仅为54%;而当加入1.25wt%的Co催化剂时,其氮化效率可达90%以上,产物的主晶相为α-Si3N4,此外还有部分β-Si3N4相和Si2N2O相。当催化剂含量增加到2.5wt%时,Si粉完全氮化,产物为完全的Si3N4。进一步增加Co的用量至5wt%时,产物主要为Si3N4,同时还有部分CoxSiy;当催化剂加入量大于7wt%时,产物以Si3N4纳米棒为主。
Pavarajarn[23]等的研究结果表明:Si粉的催化氮化效率随着Co用量的增加而增加。1200 ℃,加入0.125wt%的Co催化剂,可将Si粉的氮化率提高2倍。值得强调的是Co催化剂的使用会抑制β-Si3N4生成。
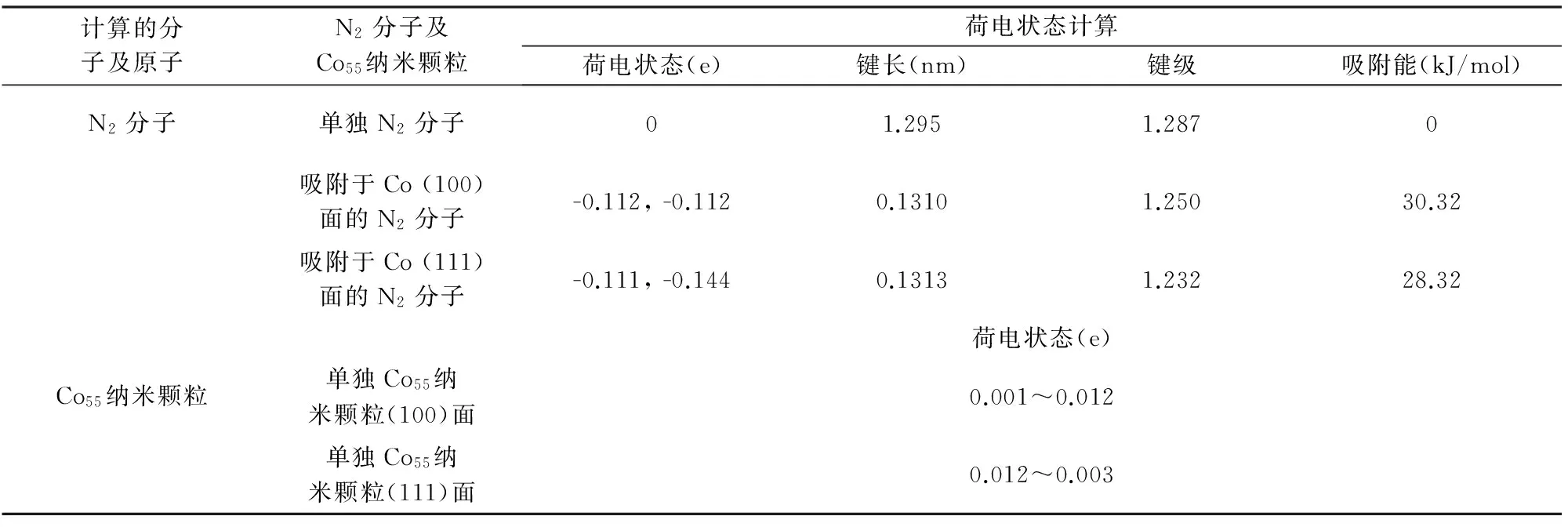
表2 Co55和吸附于其上的N2分子的键长,键级,吸附能及荷电状态计算
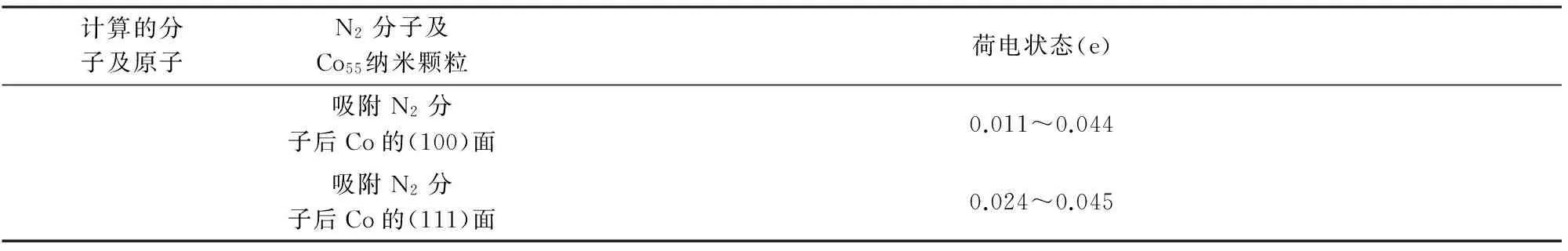
续表
2.3Cr单质为催化剂
Cofer等[27]先采用浸渍法将Cr催化剂负载在Si粉表面,再研究该粉体的催化氮化形为。结果表明:(1)在1150 ℃保温3 h、不加催化剂的情况下,Si粉的氮化效率只有8 %;随着催化剂用量的增加,Si粉的氮化效率显著提高;Cr催化剂的用量为3wt%时,可使Si粉完全氮化。所得产物的主晶相为α-Si3N4,同时还存在少量的β-Si3N4以及部分的中间产物CrSi2。CrSi2的生成有利于Si粉与N2的接触,进而提高Si粉的氮化效率;(2)随着Cr用量的增加,β-Si3N4的生成量逐渐减少(当Cr催化剂的用量为5wt%时,产物中α-Si3N4的含量可达到95wt%)。当加入5wt%的Cr催化剂时,1200 ℃保温2 h可以使Si粉完全氮化;进一步降低氮化温度则需延长保温时间方可实现Si粉的完全氮化。但是,Pavarajarn等[23]的研究结果却表明:Cr作为催化剂时,其催化氮化效率随催化剂用量及氮化温度的增加变化不大。增加Cr催化剂的用量或升高温度,都会抑制α-Si3N4的生成。因此,关于Cr催化剂催化Si粉氮化的形为及机理仍需进一步深入地研究。
2.4其他金属单质为催化剂
Pavarajarn等[23]研究了Ca、Y、Cu、Ag、和W等催化剂对Si粉氮化形为的影响,结果如图3所示。从中可以看出:(1)Ca和Y对α-Si3N4的形成具有明显的促进作用。当Ca作为催化剂时,仅添加0.125wt%的Ca就能使Si粉完全转变为α-Si3N4。而相同实验条件下,Y的添加量为1wt%时才能使氮化产物中α-Si3N4的含量超过95wt%;(2)W、Ag的催化氮化效率随着温度的升高及催化剂含量的增加变化并不明显;(3)Cu的催化氮化效果非常复杂;当氮化温度为1250 ℃时,较低含量的Cu即可有效地促进氮化反应的进行;但是当温度升至1300 ℃时,Cu的引入反而抑制了氮化反应的进行。

图3 不同温度各金属对α-Si3N4生成的影响(a)1250 ℃;(b)1300 ℃Fig.3 Effect of different metals on the formation of α-Si3N4(a)1250 ℃;(b)1300 ℃
Pavarajarn等[28]此后又研究了Mg、Ce、Lu和Yb对Si粉氮化行为的影响,结果如图4所示。从中可以看出:(1)Mg、Ce、Lu和Yb等对Si粉的氮化促进作用并不明显,其原因可能是由于这些金属微粉包覆在Si粉表面,阻碍了N2与Si粉的接触,导致其氮化效率在大多时候都低于纯Si粉的氮化效率;(2)当其用量超过0.5wt%时Mg、Ce、Lu和Yb都对Si粉的氮化起抑制作用;(3)Mg、Ce、Lu和Yb这几种金属都可以有效地促进α-Si3N4的生成。加入2wt%的Yb可以生成几乎纯相的α-Si3N4,而其余几种金属也能使产物中α-Si3N4的含量达到90wt%以上。
总之,金属单质对Si粉催化氮化的主要原因可归纳如下:(1)掺杂的金属和Si在高温下形成液相合金,增加了N2与Si粉的接触面积,从而提高氮化效率[29,30];(2)金属的存在削弱了N≡N三键的结合力,使N原子更易于和Si发生反应,进而提高氮化效率[20,24,31]。

图4 在1300 ℃下不同金属对Si粉氮化的影响(a)总氮化率;(b)氮化产物中α-Si3N4含量Fig.4 Effect of different metals on the nitridation of silicon at 1300 ℃(a)overall conversion;(b)fraction of α-Si3N4 in product
3 金属氧化物催化氮化制备Si3N4粉体
研究表明以金属氧化物微粉作为催化剂可以有效改善金属催化剂活性较高而出现的团聚现象,进而有效提高Si粉的氮化效率。
我们课题组[32]以Si粉为原料,先采用液相原位沉淀法制备负载有纳米Cr2O3催化剂的Si粉,而后再研究该粉体的氮化形为。结果如图5所示。从中可知:(1)当Cr2O3的加入量为5wt%时, 1350 ℃氮化反应2 h后,Si粉即可完全氮化;而相同条件下无催化剂的试样中,单质Si的残余率高达70wt%;(2)不同的沉淀剂对所得Cr2O3的催化氮化效果影响较大,以尿素为沉淀剂时,所得Cr2O3的氮化效果最好;氨水次之;水合肼最差;(3)催化氮化后制得的试样中存在大量的Si3N4晶须,长度可达几微米至十几微米;且随着Cr2O3用量的增加,晶须的数量增多,直径增粗。
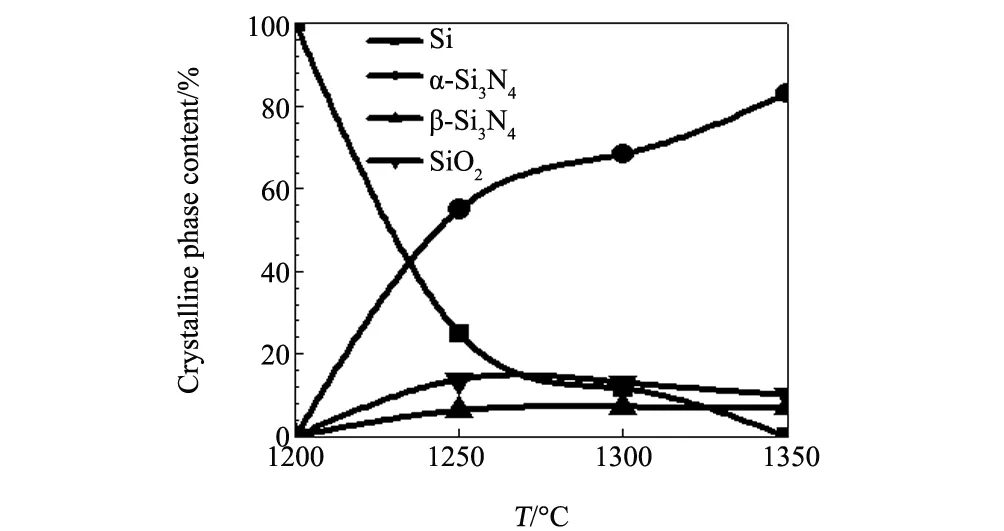
图5 添加5wt%Cr2O3纳米颗粒催化剂在1200~1350 ℃氮化2 h后所得试样中各物相含量Fig.5 Relative contents of crystalline phases in the final products resultant from 2 h nitridation at 1200-1350 ℃ with 5wt% Cr2O3 nanoparticles as catalysts

图6 纯Si粉与掺杂10%ZrO2的硅粉氮化热重曲线Fig.6 Typical weight gain behavior of pure Si powder and Si with 10wt% ZrO2 added (Si10Z)powders during TG analysis
Hyuga等[33]研究了ZrO2对Si粉氮化的影响。结果如图6所示。从中可知:(1)纯Si粉和添加ZrO2的Si粉的起始氮化温度基本相同,分别为957 ℃和952 ℃;都在1150~1400 ℃之间发生剧烈的氮化反应,掺杂ZrO2的Si粉的增重量明显大于纯Si粉的增重量,说明ZrO2的引入对Si粉的氮化具有促进作用;(2)但即使ZrO2的添加量为30wt%时,Si粉在1400 ℃时仍然无法完全氮化。随着ZrO2的加入量从5wt%增加到20wt%,Si粉氮化反应的起始温度及氮化效率并没有明显的变化,这说明增加ZrO2的加入量对Si粉氮化的促进作用并不明显。1400 ℃时氮化后产物中除了残余少量的Si粉,还有部分的ZrSi2和ZrN等中间产物,这些中间产物的形成应该有助于Si粉的氮化。
Hu等[34]也研究了ZrO2对Si粉氮化的影响,结果表明;当不添加催化剂时,Si粉氮化效率为83%;而当ZrO2的加入量为5wt%时,其氮化效率可提高到94%,但随着ZrO2用量的继续增加,Si粉的氮化效率反而降低,其氮化产物主要为Si3N4以及部分ZrN和Si2N2O。Hu等认为在不加入ZrO2时,Si粉氮化过程中会放出大量的热,局部集热的发生会使Si熔化产生“流硅”现象;而ZrO2的加入则可以吸收氮化反应释放出的热量,有效阻止Si粉的熔化,进而提高了其氮化效率。
Yang等[35]采用低纯度Si粉为原料,研究了3Y-ZrO2对Si粉氮化的行为。结果表明: 1150~1450 ℃保温4 h后,不加3Y-ZrO2的试样中只有43%的氮化率,且产物中不含有α-Si3N4;其原因可能是Si粉氮化过程中释放出的热量促进了α-Si3N4相→β-Si3N4相的转变。当试样中加入3Y-ZrO2时,Si粉的氮化率增加为96%,产物的主晶相为α-Si3N4和β-Si3N4,且含有部分Si2N2O和ZrN。作者认为Si2N2O和ZrN的生成对Si粉氮化有促进作用。
此外,Yang等[35]还采用低纯度Si粉为原料,分别以Fe2O3和MgO为催化剂通过催化氮化工艺来制备Si3N4粉体。研究表明,以Fe2O3为催化剂时可显著提高Si粉的氮化效率,其原因可能是中间相FeSi的形成促进了Si粉的氮化。相反,当以MgO做催化剂时,Si粉的氮化效果较差,其氮化效率只有70%左右。原因可能是MgO的引入使得Si粉表面形成了一层MgSiO3,从而阻碍了Si粉的进一步氮化。
综上所述,金属氧化物的引入也可以有效地提高Si粉的氮化效率。但金属氧化物促进Si粉氮化的机理尚需深入研究,其效率也需进一步提高。
4 一维Si3N4的催化氮化制备及机理
一维Si3N4(纳米线,纳米带及晶须等)具有高强度、高模量、低膨胀和良好的化学稳定性,是一种重要的高温陶瓷材料。催化氮化可以有效地促进一维Si3N4的生成。按照其生长方式的不同,一维Si3N4的生长机理可以分为气相-液相-固相(VLS)、固相-液相-气相-固相(SLGS)以及气相-固相(VS) 生长机理等。
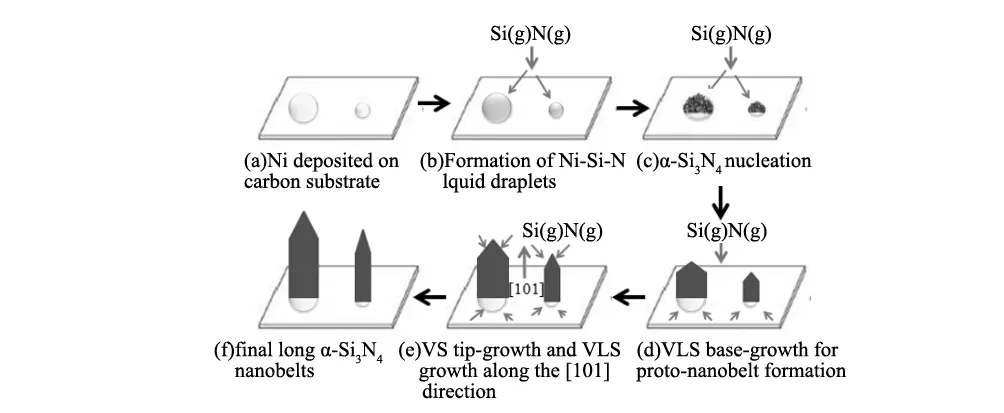
图7 VLS生长α-Si3N4纳米带的机理Fig.7 A proposed VLS mechanism for the growth of α-Si3N4 nanobelts
Huang等[17-20]分别以Fe、Ni和Ni(NO3)2为催化剂,采用化学沉积法制备了α-Si3N4纳米带。他们认为Si3N4纳米带的形成过程是由VLS机理控制的,其合成示意图如图7所示。首先Ni沉积在碳毡上,然后与Si形成共熔小液滴。当液滴过饱和后,Si3N4晶体开始成核生长,形成纳米带的晶核,继而气相中的Si元素与N元素不断沉积在晶核上,最终生成Si3N4纳米带。
Zheng[36]等以Fe为催化剂,合成了Si3N4纳米线,纳米线的显微结构照片如图8所示。图8a的FE-SEM结果表明纳米线的顶端存在着球形颗粒。EDS的表征结果表明纳米线尖端的微球中含有元素Fe,因此可以推测Si3N4纳米线的生长机制为VLS[35-37]机理。其具体过程如下:高温时,Fe催化剂首先与反应物Si/C反应,生成Fe-Si-C液相合金;而后液相合金中的Si和气相中N2反应,生成Si3N4晶核;当晶核生长到一定程度后会从液相合金中析出,随后,晶核不断从气相中吸收Si,最终生成Si3N4纳米线,而Fe-Si-C液相合金最后则在晶须顶端凝固形成一个微球。
我们课题组[25]以Co为催化剂,采用催化氮化的方法制备了Si3N4晶须,其显微结构形貌及EDS的表征如图9所示。由EDS结果可知,晶须尖端的微球中含有Co和Si元素,这表明Si3N4晶须的生成可以用VLS机理来解释。首先是Co与Si形成液相Co-Si合金,而后液相合金中的Si原子与N2在液-气界面反应生成Si3N4晶核,随着晶核的逐渐长大,液相合金被托起,最终在晶须的端部形成含有催化剂的小液滴。
除VLS机理外,Zheng等[36]认为Si3N4纳米线的生成还存在另一种机制,此时生成的Si3N4晶须的尖端不存在有催化剂液滴,即SLGS[40,41]生长机理。其生长过程如下:高温下,Fe颗粒与反应物Si/C反应形成Fe-Si-C液相合金,随着反应的进一步进行,液相合金形成过饱和溶液,其中的Si在气-液界面与N2反应形成Si3N4晶须。在SLGS反应过程中,Si原子主要通过液相扩散的方式为Si3N4的生成提供原料。类似的现象在我们以Co纳米颗粒为催化剂制备Si3N4晶须的研究中也同样出现过[25]。

图8 Si3N4纳米线FE-SEM图像及相应的EDS结果Fig.8 FE-SEM images and EDS spectrum of Si3N4 nanowires
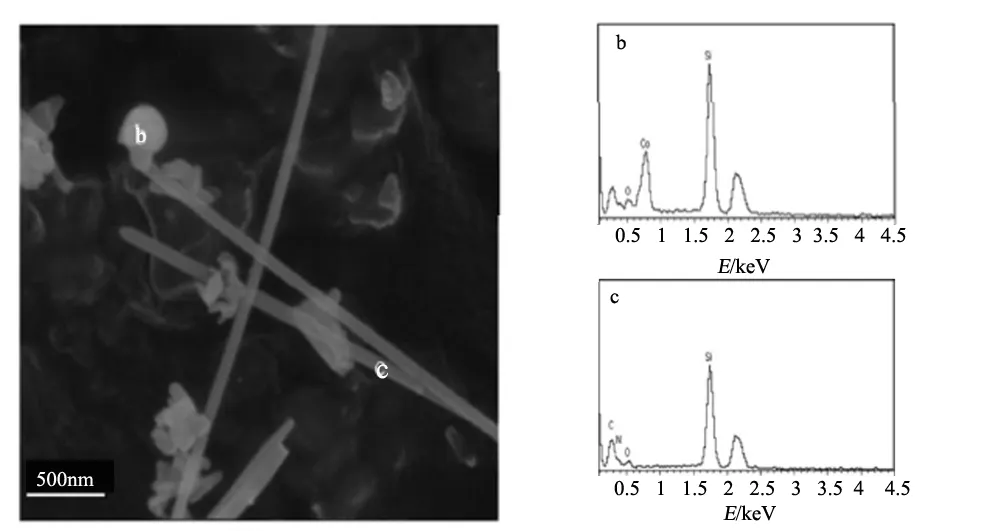
图9 Si3N4晶须的扫描电镜图片和电子能谱Fig.9 SEM image and EDS spectrum of Si3N4 whiskers
除此之外,一维Si3N4的生长还可通过VS机理进行,Huang[17-20]等以Fe、Ni和Ni(NO3)2为催化剂,采用化学沉积法制备了α-Si3N4纳米带。他们认为VS生长机理的前面几个步骤与VLS机理相同,只是在后来的阶段形成纳米带晶核之后,气相反应物直接在固相上沉积,催化液滴没有直接起作用,故该阶段受VS机理控制。VS机理形成Si3N4纳米带的过程如图7e所示。

表3 Si3N4晶须的生长机理
一维Si3N4的三种生长机理的生长区域、生长方式及所得产物晶相对比如表3所示。
5 结 语
Si3N4陶瓷以其优良的机械性能、化学性能和物理性能而广泛应用在化工、冶金、航天等领域。通过研究催化氮化制备Si3N4陶瓷粉体的工艺因素,可以为高性能Si3N4陶瓷的制备提供便捷途径。
鉴于国内外催化氮化制备Si3N4及原位生成一维Si3N4的研究状况,我们认为,今后Si3N4的制备研究应考虑如下几点:
(1)由于直接添加微纳米级金属单质、金属氧化物为催化剂的方法,往往存在着分散不均匀,催化效果不理想等问题。因此,催化剂的原位制备及原位催化氮化将成为研究的重点;
(2)Fe、Co、Ni及其氧化物等微纳米级催化剂的引入可以有效避免制品中“硅芯”的出现,实现制品在较低温度下的完全氮化。同时,还可以促进Si3N4晶须的原位合成,改善材料的界面显微结构。但高温下易在材料内部形成低熔点液相进而会显著降低Si3N4基复合材料的高温力学性能,因此,研究开发不影响Si3N4基复合材料高温性能的催化剂也将是一个重点;
(3)Cr、Zr、Y、W等金属单质及金属氧化物催化剂虽然在高温下不会产生低熔点液相而影响最终制品的高温性能,但目前该方面报道的多为微米级催化剂,其催化过程中还存在分散不均匀、催化效率不高等问题。
(4)催化剂的催化氮化机理尚需进一步深入地研究,金属催化剂和其氧化物催化剂的作用机理是否相同也是一个需要解决的问题;
(5) 一维Si3N4可以广泛用于复合材料的增强、增韧,显著提高材料的强度、弹性模量、抗侵蚀等特性。因此,如何大量原位生成长径比较大的一维Si3N4也是一个研究热点。
[1] Heinyich J.氮化硅[J].国外耐火材料,1988,13(7):10-21.
[2] Deng Z Y,Fukasawa T,Ando M,et al.Microstructure and mechanical properties of prous alumina ceramics fabricated by partial sintering[J].JAmCeramSoc.,2002,85(8):1961-1964.
[3] Santos C,Riberio S,Strecker K,et al.The importance of Si3N4characterization by SEM at the different sintering stages[J].JMaterProcessTech.,2001,120:73-76.
[4] 王华,戴永年.氮化硅及其微粉的制备[J].耐火材料,1996,30(2):113-115.
[5] 李亚伟,张忻,田海兵,等.硅粉直接氮化反应合成氮化硅研究[J].硅酸盐通报,2003,22(1):30-34.
[6] 李虹,黄丽萍,蒋薪,等.碳热还原法制备氮化硅粉体的反应过程分析[J].无机材料学报,1996,11(2):241-246.
[7] Chen L,Goto T,Hirai T.Preparation of SiC-W2C nano-composite powders by chemical vapor deposition of the SiH4-CH4-WF6-H2system[J].JMaterSciTechnol.,1993,20(28):5543-5547.
[8] 徐协文.自蔓延法制备氮化硅粉时的氮气压力[J].中南工业大学学报,2003,34(1):58-62.
[9] 徐协文,钱瑞芬,谢建国,等.低氮气压下燃烧合成氮化硅粉[J].陶瓷工程,1999,33(4):4-9.
[10] 邓宗武,张克,袁正,等.SiCl4氨解法制备高纯度的Si3N4粉的研究[J].无机材料学报,1995,10(1):37-42.
[11] Hatakryama F,Kanzaki S.Synthesis of monodispersed spherical β-SiC powder by a sol-gel process[J].JAmCeramSoc.,1990,73(7):2107-2110.
[12] 刘启德.利用木质素-二氧化硅溶胶-凝胶合成纳米氮化硅的研究[J].材料导报,2000,14(11):57-58.
[13] Liu Y D,Kimura S.Huidized-bed nitridation of fine silicon powder[J].PowderTechnol.,1996,106(3):160-167.
[14] Koike J,Kimura S.Mechanism of nitridation of silicon powder in a fluidized-bed reactor[J].J.Am.Ceram.Soc.,1996,79(2):365-370.
[15] 吕秀玮.流态化合成氮化硅的鼓泡床热模实验与CFD模拟研究[D].南京:南京工业大学硕士学位论文,2004.
[16] 高晓云,郭广生,安志棠,等.超微硅粉的氮化[J] .无机材料学报,1992,7(3):289-293.
[17] Huang J T,Zhang S W,Huang Z H,et al.Growth of α-Si3N4nanobelts via Ni-catalyzed thermal chemical vapour deposition and their violet-blue luminescent properties[J].Cryst.Eng.Comm..,2013,15(4):785-790.
[18] Huang J T,Huang Z H,Yi S,et al.Fe-catalyzed growth of one-dimensional α-Si3N4nanostructures and their cathodoluminescence properties[J].Sci.Rep.,2013,3:3054-3063.
[19] Huang J T,Liu Y G,Huang Z H,et al.Ni(NO3)2-assisted catalytic synthesis and photoluminescence property of ultralong single crystal Sialon Nanobelts[J].Cryst.GrowthDes.,2013,13(1):10-14.
[20] Huang J T,Zhang S W,Huang Z H,et al.Catalyst-assisted synthesis and growth mechanism of ultra-long single crystal α-Si3N4nanobelts with strong violet-blue luminescent properties[J].Cryst.EngComm.,2012,14(21):7301-7305.
[21] Boyer S M,A J Moulson.A mechanism for the nitridation of Fe-contaminated silicon[J].J.Mater.Sci.,1978,13(8):1637-1646.
[22] Mitomo M.Effect of Fe and Al of silicon additions on nitridation[J].JMaterSci.,1977,12(2):273-276.
[23] Pavarajarn V,Kimura S.Catalytic effects of metals on direct nitridation of silicon[J].J.Am.Ceram.Soc.,2001,84(8):1669-1674.
[24] 古亚军,曹迎楠,李发亮,等.铁纳米颗粒催化氮化硅粉[J].硅酸盐学报,2014,42(12):1585-1590.
[25] Gu Y J,Lu L L,Zhang H J,et al.Nitridation of silicon powders catalyzed by cobalt nanoparticles[J].J.Am.Ceram.Soc.,2015,98(6):1762-1768.
[26] Huang J T,Zhang S Z,Huang Z H,et al.Co-catalyzed nitridation of silicon and in-situ growth of α-Si3N4nanorods[J].Ceram.Int.,2014,40(7):11063-11070.
[27] Cofer C G,Lewis J A.Chromium catalysed silicon nitridation[J].J.Mater.Sci.,1994,29(22):5880-5886.
[28] Pavarajarn V,Vongthavorn T,Praserthdam P.Enhancement of direct nitridation of silicon by commonmetals in silicon nitride processing[J].Ceram.Int.,2007,33(4):675-680.
[29] Pigeon R G,Varma A,Miller A E.Some factors influencing the formation of reaction-bonded silicon nitride[J].JMaterSci,1993,28(7):1919-1936.
[30] Mukerji J,Biswas S K.Effect of iron,titanium,and hafnium on second-stage nitriding of silicon[J].JAmCeramSoc.,1981,64(9):549-552.
[31] Paola R A de,Hoffman F M,Heskett D,et al.Adsorption of molecular nitrogen on clean and modified Ru (001) surfaces:The role of σ bonding[J].Phys.Rev.B.,1987,35(9):4236-4249.
[32] 张海军,邓先功,张少伟,等.一种基于催化氮化的氮化硅粉体及其制备方法[P].中国专利:CN 104261360A,2015-01-07.
[33] Hyuga H,YoShida K,Kondo N,et al.Nitridation enhancing effect of ZrO2on silicon powder[J].Mater.Lett.,2008,62(20):3475-3477.
[34] Hu H L,Zeng Y P,Xia Y F,et al.Rapid fabrication of porous Si3N4/SiC ceramics via nitridation of silicon powder with ZrO2as catalyst[J].Ceram.Int.,2014,40(5):7579-7582.
[35] Yang W L,Shi Z Q,Jin Z H,et al.Effect of oxide additiveson catalysis and microstructure of RBSN using low-purity silicon powder as raw materials[J].Mater.Sci.Forum.,2011,695:409-412.
[36] Zheng C S,Yan Q Z,Xia M,et al.In situ preparation of SiC/Si3N4-NW composite powders by combustion synthesis[J].Ceram.Int.,2012,38(1):487-493.
[37] Wang F,Jin G Q,Guo X Y.Formation mechanism of Si3N4nanowires via carbothermal reduction of carbonaceous silica xerogels[J].J.Phys.Chem.B.,2006,110 (30):14546-14549.
[38] Wang F,Jin G Q,Guo X Y.Sol-gel synthesis of Si3N4nanowires and nanotubes[J].Mater.Lett.,2006,60(3):330-333.
[39] Wagner R S,Ellis W C,Vapor-liquid-solid mechanism of single crystal growth[J].Appl.Phys.Lett., 1964,4(5):89-90.
[40] Yang W,Zhang L,Xie Z,et al.Growth and optical properties of ultra-long single-crystalline α-Si3N4nanobelts[J].Appl.Phys.A.,2005,80(7):1419-1423.
[41] Yang W,Xie Z,Li J,et al.Ultra-long singlecrystalline α-Si3N4nanowires:derived from a polymeric precursor[J].J.Am.Ceram.Soc.,2005,88(6):1647-1650.
Catalytic Nitridation Preparation of Silicon Nitride Powders
ZHAOWan-guo,GUYa-jun,LIFa-liang,WANGJun-kai,ZHANGHai-jun,ZHANGShao-wei
(The State Key Laboratory of Refractories and Metallurgy,Wuhan University of Science and Technology,Wuhan 430081,China)
Silicon nitride ceramics which possess excellent mechanical properties, chemical properties and physical properties have been widely used in chemical industry, metallurgy, aerospace and other fields. Catalytic nitridation method can effectively lower the nitridation temperature and enhance the conversion rate of Si powders. At the same time, it also can promote the in-situ formation of 1-dimensional silicon nitride which could increase the mechanical properties of the final silicon nitride products. This article reviews the effect of metal and metal oxide catalysts on the catalytic nitridation of silicon powders and the in situ formation mechanism of the 1-dimensional nitride silicon. At last, the future research direction on preparation of silicon nitride via the catalytic nitridation method is also pointed out.
silicon nitride;1-dimensional nano-materials;catalytic nitridation;reaction mechanism
国家自然科学基金面上项目(51472184,51472185);湖北省自然科学基金重点项目(2013CFA086);湖北省科技支撑计划对外科技合作项目(2013BHE002)资助;973计划前期研究专项(2014CB660802).
赵万国(1991-),男,硕士研究生.主要从事硅粉催化氮化方向研究.
张海军,教授,博导.
TQ175
A
1001-1625(2016)04-1106-08

