商品鸭H9亚型禽流感病毒与鸭疫里默氏杆菌混合感染的诊断
闫艳新 孙月萍 刘文华


摘要[目的]对某肉鸭场病死鸭进行病原学诊断。[方法]通过细菌分离培养等常规细菌学鉴定方法,并结合PCR、RTPCR等分子生物学手段对病死鸭的病原体进行分离与鉴定,并对分离到的细菌进行药敏试验。[结果]该批病死鸭的发病原因确定为H9亚型禽流感病毒与鸭疫里默氏杆菌混合感染。药敏试验结果表明,分离的鸭疫里默氏杆菌只对多西环素、头孢他啶以及环丙沙星、诺氟沙星等喹诺酮类药物敏感。[结论]该药敏试验结果可为临床预防和治疗鸭疫里默氏杆菌感染的用药选择提供一定的参考依据。
关键词 H9亚型禽流感病毒;鸭疫里默氏杆菌;药敏试验
中图分类号 S851.34+7.2 文献标识码 A 文章编号 0517-6611(2016)09-128-03
Abstract[Objective]Pathogenic diagnosis of dead ducks from a duck farm was carried out.
[Method]By using the conventional bacteriological identification method, combined with PCR, RT-PCR and other molecular biological methods, the pathogenic bacteria of dead ducks was seperated and identified, sensitivity test was conducted on the isolated bacteria.[Result]The disease was confirmed to be caused by H9 AIV and Riemerella anatipestifer. Drug susceptibility test revealed that the isolated Riemerella anatipestifer was sensitive to the drug of Doxycycline, Ceftazidime, Ciprofloxacin and Norfloxacin.[Conclusion]The results can provide a certain reference for clinical prevention and treatment of Riemerella anatipestifer infection.
Key words H9 subtype of AIV; Riemerella anatipestifer; Sensitivity test
鴨疫里默氏杆菌(Riemerella anatipestifer)和H9亚型禽流感病毒是长期以来对养鸭业造成重大危害的2种病原体。鸭传染性浆膜炎是由鸭疫里默氏杆菌引起鸭的一种急性或慢性败血病,雏鸭最易感,临床主要表现神经症状,剖检最典型病变表现为纤维素性心包炎、肝周炎和气囊炎。自然感染发病率为20%~40%,饲养管理条件差时可使死亡率达50%以上,耐过鸭和病愈鸭常出现生长发育不良,甚至成为僵鸭,淘汰率极高,给养鸭业造成了巨大的经济损失,已经成为危害商品肉鸭养殖最主要的细菌性传染病之一[1-2]。鸭疫里默氏杆菌的血清型众多[3],我国已发现的血清型就达16种之多,且各个血清型之间几乎无交叉保护作用[4],因而通过疫苗预防该病往往达不到良好的预防效果,临床上主要还是以药物治疗为主。H9亚型禽流感病毒作为低致病性禽流感病毒,可感染不同日龄的禽类,以前水禽被认为是流感病毒的载体,只携带病毒而不表现感染症状,但近年来流感病毒引起的水禽感染有不少报道,而与其他病原的混合感染还会引起较高的发病率和死亡率。
山东省潍坊市某商品肉鸭养殖场的28日龄樱桃谷鸭出现大批发病。发病鸭普遍具有呼吸道症状,部分出现神经症状。剖检病死鸭心包膜增厚、心包积液且浑浊,气囊有白色干酪样物渗出,气管出血,胸腺肿大,胰腺出血,脾脏肿大,十二指肠和直肠均有不同程度出血。笔者通过常规细菌学鉴定方法并结合一些常用的分子生物学手段对病死鸭的病原体进行了分离与鉴定,并通过药敏试验寻找该病菌的敏感药物,旨在为其临床用药提供技术指导。
1 材料与方法
1.1 病料
采自病死鸭的心、肝、脑、脾、肺和气管等组织。
1.2 试剂
常规培养基,购自北京路桥技术有限责任公司;犊牛血清,购自浙江天杭生物科技有限公司;TSB,购自BD公司;High Pure Viral RNA Kit Version 18,购自Roche 公司;Prime Script One Step RTPCR Kit Version 2试剂盒,购自TaKaRa公司;引物由华大基因公司合成。药敏纸片按照CLSI标准自制。
1.3 细菌学检测
1.3.1 细菌的分离培养与形态学观察。
无菌挑取病死鸭的心、肝、脑和脾等组织,分别划线接种于TSA平板、SS琼脂平板、麦康凯琼脂平板和普通琼脂平板上,其中TSA平板进行烛缸培养,将所有平板置于37 ℃下培养24 h观察。根据各种平板上细菌的生长情况,挑取单菌落进行纯化、革兰染色和瑞氏染色,观察细菌形态。
1.3.2 鸭疫里默氏杆菌的PCR鉴定。
为了进一步鉴定分离到的细菌是否为鸭疫里默氏杆菌,利用实验室已建立的针对鸭疫里默氏杆菌外膜蛋白基因的特异性PCR方法进行验证[5],上游引物为5′TGGAGCCAACTATTTGAGAC3′;下游引物为5′CCTTTAATGCTCCTGTTGCT3′,预期扩增片段的长度为660 bp,PCR产物经过1.0%琼脂糖凝胶电泳检验后送交擎科生物公司测序。
1.3.3 药敏试验。
将浓度调整为108 CFU/mL的新鲜鸭疫里默氏杆菌菌液涂布TSA平板,放置5 min后,按照常规方法将氟苯尼考和头孢噻肟等21种临床常用抗生素药敏纸片贴于平板表面,37 ℃下作用20 h后观察结果。按照CLSI标准,进行药物敏感性评价。
1.4 H5亚型和H9亚型禽流感病毒的RTPCR检测
1.4.1 引物的选择。
结合临床症状与病理变化,对流感病毒进行检测,根据文献[6-7]分别合成H5亚型和H9亚型禽流感病毒的特异性引物,H5f:5′ACCCAGCCAATGACCTCT3′,H5r:5′CACTTTGCCCGTTTACTT3′;H9f:5′ CAACAAACTCCACAGAAACT 3′,H9r:
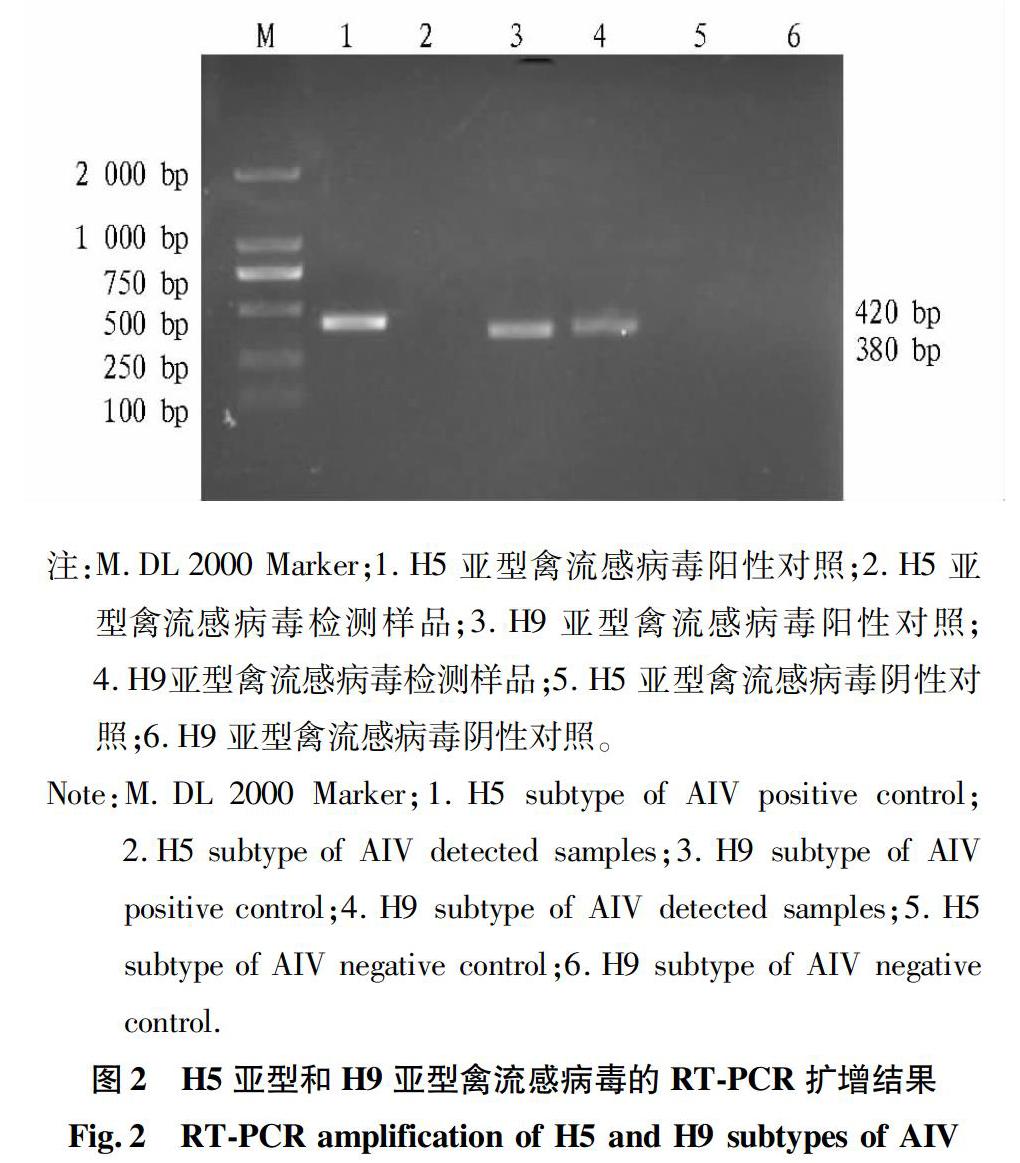
5′ ATCTGAACATGCTTTGCTTTG 3′。 H5亚型和H9亚型禽流感病毒的预期扩增片段长度分别为420和380 bp。
1.4.2 RNA提取。
无菌取病死鸭肺脏和气管,剪碎,按1∶5的比例加入灭菌PBS匀浆,将匀浆液反复冻融2次,12 000 r/min 离心20 min,抽取上层清亮液体,用0.22 μm 滤器过滤除菌,取滤液按照High Pure Viral RNA Kit说明书要求提取病毒RNA。
1.4.3 RTPCR扩增及其产物检测。
使用一步法RTPCR 试剂盒(PrimeScript One Step RTPCR Kit Ver.2)扩增H5亚型和H9亚型禽流感病毒基因片段。采用25 μL 反应体系:上下游引物(10 μmol/L)各1 μL,RNA模板5 μL,超纯水4.5 μL,PrimeScript One Step Buffer 12.5 μL,PrimeScript One Step Enzyme Mix 1 μL,混匀后置于PCR 仪中进行PCR扩增。PCR扩增程序为:50 ℃反转录45 min;94 ℃预变性2 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,30 个循环;最后72 ℃终延伸5 min。扩增产物通过1%琼脂糖凝胶电泳观察,将PCR产物送交擎科生物公司测序。
2 结果与分析
2.1 细菌学检测结果
2.1.1 细菌的分离培养与形态学观察。
普通培养基、麦康凯培养基和SS培养基上均没有细菌生长,肝组织在TSA平板上长出无色透明菌落,菌落呈圆形,表面光滑、隆起,边缘整齐,斜对光观察有蓝光。经过革兰染色镜检可见阴性小短杆状细菌;经过瑞氏染色镜检可见两极着色。
2.1.2 鸭疫里默氏杆菌外膜蛋白基因片段的PCR鉴定结果。
对鸭疫里默氏杆菌的外膜蛋白基因片段进行PCR扩增,通过1.0%琼脂糖凝胶电泳对其PCR产物进行观察,在660 bp处得到1条明亮的条带(图1),与预期片段大小相同,对测序结果进行BLAST比对,确定分离菌为鸭疫里默氏杆菌。
2.2 鸭疫里默氏杆菌的药敏试验结果 根据CLSI标准,判定RA对所用抗生素的敏感程度。由表1可知,分离到的鸭疫里默氏杆菌对大多数临床常用抗生素耐药,仅对多西环素、头孢他啶、环丙沙星和诺氟沙星等喹诺酮类药物敏感。
2.3 病毒学检测结果
RTPCR扩增H5亚型和H9亚型禽流感病毒,通过1.0%琼脂糖凝胶电泳观察,H5亚型禽流感病毒没有扩增到目的条带,在380 bp处得到1条明亮的条带(图2),与H9亚型禽流感病毒预期目的条带大小相同,测序结果经Blast比对与H9亚型禽流感病毒的同源性达100%,因此确定该批鸭受 H9亚型禽流感病毒的感染。通过细菌学和病毒学检测,可诊断为该批病死鸭为鸭疫里默氏杆菌和H9亚型禽流感病毒混合感染。
3 讨论与结论
鸭疫里默氏杆菌、大肠杆菌和沙门氏菌是临床最常见的感染鸭的细菌性病原体。大肠杆菌和鸭疫里默氏杆菌感染鸭均可引起纤维素性心包炎、肝周炎和气囊炎,易于混淆。其中,鸭疫里默氏杆菌对营养条件要求较高,一般在普通培养基、麦康凯培养基和SS培养基上不能生长,而在添加小牛血清的TSA培养基上生长良好。大肠杆菌和沙门氏菌对营养要求不高,大肠杆菌在麦康凯培养基上形成红色菌落,绝大多数沙门氏菌因产生硫化氢在SS培养基上会形成黑色菌落,因此可根据菌株在不同培养基上的生长特性不同进行初步鉴定。近年来,随着抗菌药在畜牧养殖领域中的广泛、大量甚至盲目使用,细菌的耐药性问题越来越严重。很多国家及地区相继报道出现了对多种抗菌药物耐药的鸭疫里默氏杆菌菌株[8-9]。笔者分离到的鸭疫里默氏杆菌也表现出对大多数常用抗菌药的耐药性。这要求在临床用药选择上应根据药敏试验有针对性地选择,并按照联合、轮换、交叉用药原则进行药物配伍。
目前,绝大多数养鸭场都会进行H5亚型和H9亚型禽流感的免疫预防,但由于流感病毒易变异,当流行株和疫苗株不一致时,免疫鸭仍然存在感染的風险。该试验中检测到的H9亚型禽流感病毒与鸭疫里默氏杆菌的混合感染并非个例,由于饲养管理不到位和环境卫生条件差所导致的多病原混合感染非常普遍。据报道,H9亚型禽流感病毒与大肠杆菌、传染性支气管炎病毒等其他病原体混合感染的协同作用是导致目前H9亚型禽流感流行的主要原因[10]。鸭疫里默氏杆菌出现与多种病原体混合感染的现象,与鸭疫里默氏杆菌混合感染的细菌种类有大肠杆菌、多杀性巴氏杆菌[11-13];与鸭疫里默氏杆菌混合感染的真菌种类有黄曲霉菌[14];与鸭疫里默氏杆菌混合感染的病毒有鸭肝炎病毒、鸭圆环病毒、新城疫病毒以及法氏囊病毒[15-16];鸭疫里默氏杆菌还可以与球虫等寄生虫混合感染。混合感染的现象给临床诊断带来很大的困难,容易造成误诊或只判断出某一病原,导致治疗不及时,造成巨大的经济损失。其中,鸭疫里默氏杆菌在商品肉鸭上的感染近几年也出现了新的流行特点,不再集中于低日龄鸭的感染,临近出栏的鸭子也开始频频发病,这给肉鸭养殖造成的经济损失更大。为了预防病毒与细菌等多病原混合感染,养殖场首先应注意加强饲养管理和环境卫生工作,建立良好的生物安全措施;其次,对病毒病的预防除了根据本地区疾病的流行情况制订合理的免疫程序外,还应注意所选用疫苗或卵黄抗体与流行毒株的一致性。
参考文献
[1]孙革新,董航,程荣华,等.鸭疫里默氏杆菌病防制[J].吉林畜牧兽医,2015(6):47.
[2]李春芬,李郁,魏建忠,等.鸭疫里氏杆菌病研究进展[J].动物医学进展,2007(8):64-67.
[3]程安春,汪铭书,陈孝跃,等.我国鸭疫里默氏杆菌血清型调查及新血清型的发现和病原特性[J].中国兽医学报,2003(4):320-323.
[4]PATHANASOPHON P,SAWADA T,TANTICHAROENYOS T.New serotypes of Riemerella anatipestifer isolated from ducks in Thailand[J].Avian pathology,1995,24(1):195-199.
[5]刘文华,苏敬良,刘颖,等.16S rRNA基因及外膜蛋白基因分析在鸭疫里默氏菌鉴定中的应用[J].中国预防兽医学报,2006(6):691-696.
[6]TANG Q D,WANG J L,BAO J N, et al.A multiplex RT-PCR assay for detection and differentiation of avian H3,H5,and H9 subtype influenza viruses and Newcastle disease viruses[J].Journal of virological methods,2012,181(2):164-169.
[7]徐守振,尹燕博.H9亚型禽流感病毒、新城疫病毒和传染性支气管炎病毒多重RT-PCR检测方法的建立[J].动物医学进展,2014(1):12-16.
[8]傅心亮,嵇辛勤,文明,等.贵州鸭疫里默氏杆菌的分离鉴定及耐药性分析[J].中国畜牧兽医,2013(8):155-158.
[9]楊瑞锋.山东潍坊地区鸭疫里默氏杆菌的分离鉴定及耐药性分析[D].泰安:山东农业大学,2012.
[10]刘东,刘红祥,王群义,等.规模化肉鸡场H9N2亚型禽流感与传染性支气管炎流行病学调查[J].中国家禽,2014(6):62-64.
[11]肖丰庆.番鸭鸭疫里默氏杆菌和大肠杆菌混合感染的诊治[J].水禽世界,2015(1):24-25.
[12]任湘莲.鸭疫里默氏杆菌与大肠杆菌混合感染的流行特点与防治[J].水禽世界,2014(4):26-27.
[13]吴登才,李珂,林正权,等.鸭疫里默氏杆菌与大肠杆菌混合感染的诊治[J].云南畜牧兽医,2015(3):13-14.
[14]吴海港,刘锦妮,易先国.雏鸭疫里默氏杆菌与曲霉菌混合感染的诊治[J].中兽医医药杂志,2012 (1):63-64.
[15]刘全忠,史玉颖,刘玉山.1例鸭病毒性肝炎与鸭疫里默氏杆菌混合感染的诊疗[J].养禽与禽病防治,2013(5):43-44.
[16]段志强,嵇辛勤,赵佳福,等.新城疫病毒和鸭疫里默氏杆菌混合感染三穗鸭的诊治[J].中国家禽,2015(17):57-59.

