美洲大蠊浸膏对大鼠HSC和SEC增殖及细胞外基质分泌的影响
胡建鹏,宋正己,寻琳婷,李玉莲,赵雪茹,李 霆,张 镕
·论著·
美洲大蠊浸膏对大鼠HSC和SEC增殖及细胞外基质分泌的影响
胡建鹏1,宋正己2*,寻琳婷2,李玉莲2,赵雪茹2,李霆2,张镕1
目的探究美洲大蠊浸膏(APE)对体外培养大鼠肝星状细胞株(HSC-T6)和肝窦内皮细胞(SEC)增殖及分泌细胞外基质的影响。方法用稀释不同倍数的美洲大蠊浸膏干预大鼠肝星状细胞株(HSC-T6)和肝窦内皮细胞(SEC)。MTT法测定HSC-T6和SEC的增殖情况;ELISA测定药物干预后细胞培养上清液中α-SMA、Ⅳ型胶原和层粘连蛋白(LN)的含量。结果美洲大蠊浸膏叮抑制HSC-T6和SEC的增殖,并在一定范围内呈剂量效应关系。美洲大蠊浸膏组细胞上清中α-SMA、Ⅳ型胶原和层粘连蛋白(LN)的含量低于对照组。结论美洲大蠊浸膏可抑制HSC-T6和SEC增殖,并不同程度抑制α-SMA、Ⅳ-C和LN的分泌,有可能成为防治肝纤维化的临床用药。
美洲大蠊浸膏;肝星状细胞;肝窦内皮细胞;细胞增殖;细胞外基质
0 引言
肝纤维化(Liver fibrosis)是慢性肝损伤的共同结果[1-3],是慢性肝病发展至肝硬化甚至原发性肝细胞癌的必经阶段[4-5]。肝纤维化发生的主要机制是肝损伤引起实质细胞再生,间质细胞活化增殖并分泌大量细胞外基质(Extracellular matrix,ECM),ECM沉积于肝组织中,形成纤维化。肝星状细胞(Hepatic stellate cell,HSC-T6)和肝窦内皮细胞(Sinusoidal endothelial cells,SEC)是肝脏中最主要的促纤维化间质细胞,是细胞外基质的主要来源[6-8]。抑制HSC和SEC激活、增殖以及分泌细胞外基质是抗肝纤维化的治疗靶点[9]。本研究通过不同浓度的美洲大蠊浸膏干预体外培养的大鼠HSC-T6和SEC,检测该药物对大鼠HSC-T6和SEC增殖及分泌细胞外基质的影响,在细胞水平探索美洲大蠊提取浸膏的抗肝纤维化药用价值,同时为临床抗纤维化治疗提供新途径。
1 材料和方法
1.1材料
1.1.1主要仪器倒置相差显微镜(德国莱卡);CO2细胞培养箱、小型台式离心机(美国Thermo);Epoch连续波长酶标仪(美国Bio-Tek);上海琪特漩涡混合仪(QT-1);SW-CJ-2F标准化超净工作台;高压灭菌锅(日本sanyo)。
1.1.2主要试剂特级胎牛血清、DMEM高糖培养基(Gibco,USA);PBS、青-链霉素(北京,Hyclone);四甲基偶氮唑蓝(MTT)(Sigma);二甲基亚砜(DMSO)(Solavbia);ELISA试剂盒R&B公司进口分装,0.25%胰蛋白酶(Solarbio)。
1.1.3细胞大鼠HSC-T6购自中国科学院昆明动物所细胞库;大鼠SEC购自上海诺辰生物技术有限公司。
1.1.4药物美洲大蠊提取浸膏由云南大理大学云南省昆虫生物医药研发重点实验室提供。浸膏样品保存于-20 ℃冰箱,临用前夜转入4 ℃冰箱缓慢解冻,用含10%胎牛血清的DMEM高糖培养基稀释10倍后,0.22 μm微孔滤器过滤,再继续用上述培养基分别稀释至25、50、100、200、400倍。
1.2方法
1.2.1细胞培养与美洲大蠊干预对数生长期的HSC-T6和SEC分别用含10%胎牛血清的DMEM高糖培养基稀释成5×104cells/mL的浓度,接种于96孔板中,每孔100 μL,放入37 ℃、5% 浓度CO2无菌恒温培养箱中过夜培养。次日待细胞贴壁后,加入上述美洲大蠊浸膏稀释液(稀释倍数为10、25、50、100、200、400倍),每孔100 μL,设置6个复孔,对照组加入100 μL含10%胎牛血清的DMEM高糖培养基。放入37 ℃、5% CO2培养箱继续培养。
1.2.2MTT法检测HSC-T6和SEC增殖情况待上述细胞培养48 h后,每孔加5 mg/mL MTT溶液20 μL,37 ℃继续孵育2 h后弃上清,每孔加入DMSO 150 μL,溶解细胞内蓝紫色结晶,避光振荡10 min,用全自动酶标仪在570 nm波长处测定各孔OD值,测得的各复孔OD值取平均数,计算抑制率。
1.2.3酶联免疫吸附法检测收集上述美洲大蠊浸膏干预48 h的HSC-T6和SEC复孔中的培养液,3 500 r/min离心10 min后取上清,用ELISA检测上清液中α-平滑肌肌动蛋白(α-SMA)、Ⅳ型胶原蛋白(Ⅳ-Col)和层粘连蛋白(LN)的含量。参考R& B ELISA试剂盒操作方法,分别取各组细胞培养液和标准品50 μL加入试剂盒自带96孔板内,每孔加入辣根过氧化物酶(HRP)标记的检测抗体100 μL,37 ℃温育60 min后洗板5次,拍干后每孔加入底物A、B各50 μL,37 ℃避光温育15 min,每孔加终止液50 μL,15 min内450 nm波长处测定各孔OD值。根据标准曲线求出各样品中α-SMA、Ⅳ-Col和LN含量。
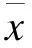
2 结果
2.1结果处理美洲大蠊浸膏对HSC-T6和SEC增殖抑制率按如下公式计算:抑制率(IE)=(对照孔OD570-实验孔OD570)/对照孔OD570×100%。
2.2美洲大蠊浸膏对HSC-T6和SEC增殖的抑制作用与对照组比较,干预培养48 h后,不同浓度美洲大蠊浸膏对HSC-T6和SEC增殖都有明显的抑制作用(P<0.05),抑制率随稀释倍数的增加而降低,当稀释倍数≤100倍时,美洲大蠊浸膏对HSC-T6和SEC增殖均有极显著抑制作用(P<0.01)。见表1、图1。
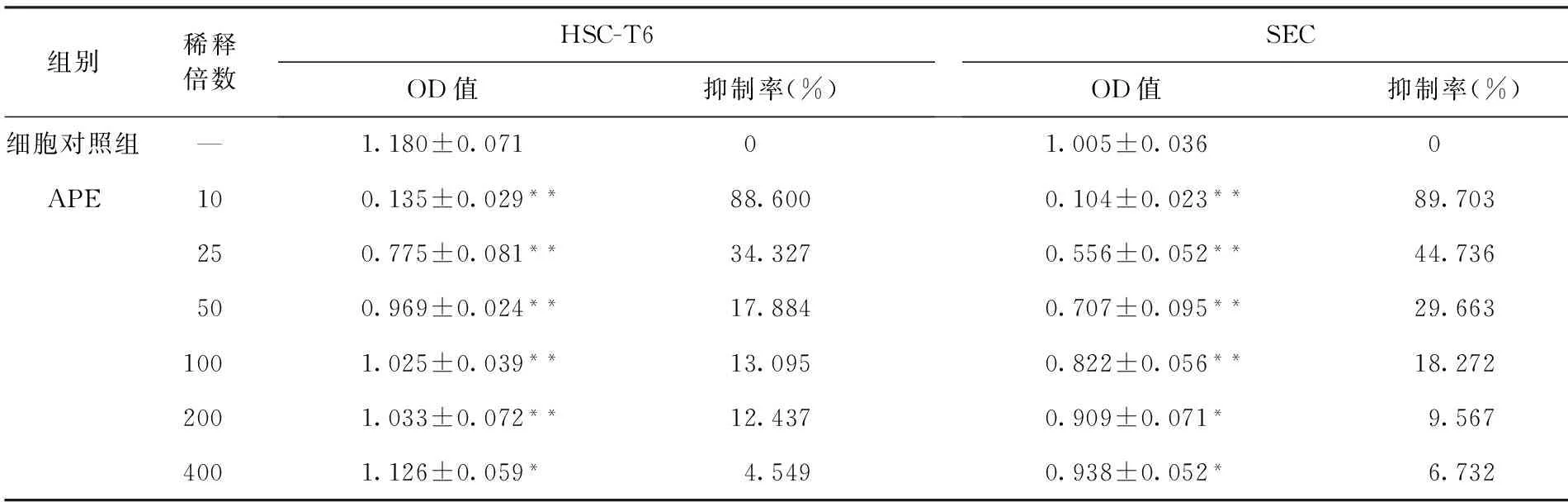
表1 美洲大蠊浸膏对HSC-T6和SEC增殖的抑制作用(n=6)
注:与对照组比较,*P<0.05,**P<0.01
2.3美洲大蠊浸膏对HSC-T6分泌α-SMA、Ⅳ-Col和LN的影响美洲大蠊浸膏干预细胞培养48 h后,可不同程度抑制HSC-T6分泌细胞外基质α-SMA、Ⅳ-Col和LN。当美洲大蠊浸膏稀释倍数≤100倍时,HSC-T6培养上清液中α-SMA、Ⅳ-Col和LN含量均呈现出极显著下降趋势(P<0.01);当稀释倍数=200倍时,α-SMA、Ⅳ-Col和LN含量均下降(P<0.05);而当稀释倍数=400倍时,美洲大蠊浸膏抑制HSC-T6分泌Ⅳ-Col(P<0.05),而对α-SMA和LN分泌的影响无统计学意义。见表2。
2.4美洲大蠊浸膏对SEC分泌α-SMA、Ⅳ-Col和LN的影响美洲大蠊浸膏干预细胞培养48 h后,可有效抑制SEC分泌细胞外基质。其中对LN(P<0.01)和Ⅳ-Col(P<0.05)的分泌抑制效果最为明显,各浓度均有显著性差异;当美洲大蠊浸膏稀释倍数≤100倍时,对α-SMA分泌的抑制作用也有统计学意义(P<0.05)。见表3。

图1 美洲大蠊浸膏对HSC-T6和SEC增殖抑制率随稀释倍数的变化

组别稀释倍数α-SMA(μg/L)Ⅳ-Col(μg/L)LN(μg/L)HSC-T6对照组-0.296±0.00843.686±5.12353.115±5.280APE100.208±0.002**29.742±6.114**31.493±6.173**250.221±0.003**32.261±3.150**38.255±5.318**500.247±0.009**34.105±2.048**44.371±2.592**1000.265±0.005**35.905±3.815**45.293±3.479**2000.274±0.009*38.285±3.165*48.398±2.074*4000.289±0.01140.192±5.547*50.005±3.082
注:与对照组比较,*P<0.05,**P<0.01

表3 美洲大蠊浸膏对SEC分泌细胞外基质α-SMA、Ⅳ-Col和LN的影响(n=6)
注:与对照组比较,*P<0.05,**P<0.01
3 讨论
在临床病例中,引起慢性肝损伤的原因很多,其中病毒感染(乙型和丙型肝炎病毒)、寄生虫感染(血吸虫、华支睾吸虫和并殖吸虫)、长期饮酒、自身免疫和不当用药是最常见的引起肝损伤进而导致肝纤维化、肝硬化甚至原发性肝细胞癌的原因[10]。肝硬化常常是不同慢性肝病进展的共同结局,在此基础上引发的如食管静脉曲张破裂出血、门静脉高压、肝性脑病、腹水、肝肾综合征等并发症,给患者的生活带来极大痛苦甚至威胁生命[8]。抗肝纤维化治疗能延缓疾病进程,减少并发症的发生,是目前慢性肝病除针对病因治疗外,最积极的干预手段[11]。
在目前治疗肝纤维化的众多中西药中,动植物来源的药物占有重要地位。昆虫类药物资源的利用在我国历史悠久,有很广泛的开发和利用价值。蜚蠊科昆虫美洲大蠊提取物含有多元醇类、肽类、表皮生长因子以及多种氨基酸等活性物质,对多种癌细胞生长有明显的抑制作用,同时具有提高机体免疫力、保肝、抗炎、抗菌、抗病毒、消炎镇痛及促进血管新生、肉芽组织增生、创伤愈合、胃肠黏膜损伤修复、改善危重症患者肠道营养、治疗消化道溃疡等作用[12]。
肝纤维化的病理特征是ECM在肝脏Dish间隙间的过度沉积,引起肝细胞营养代谢发生障碍。ECM包括α-SMA、胶原纤维蛋白、蛋白多糖、黏连蛋白和基质细胞蛋白等,其中胶原蛋白是ECM最主要的成分[4,13-16]。活化的HSCs是ECM产生的主要来源,促纤维化因子可刺激HSCs分泌ECM,其表现为α-SMA表达上调[17]。因此,α-SMA被视为HSC活化的标志物。Ⅳ-Col是构成基底膜的主要成分,在肝纤维发生时出现最早,其合成与降解水平反映基底膜胶原蛋白更新率,其含量增高是早期肝纤维化发生的主要标志之一。LN是基底膜主要的多糖之一,由干细胞和肝血窦内皮细胞合成,细胞培养上清中LN水平可反映肝纤维化进程与严重程度,与肝纤维化活动程度及门静脉压力呈正相关。血清中Ⅳ-Col和LN联合检测对肝纤维化程度的判断以及早期肝硬化的诊断具有一定的临床意义[18]。
肝实质细胞再生,间质细胞激活、增殖是肝纤维化间质重建的细胞学基础。当肝脏受到损伤时,通过激活免疫细胞、库普弗细胞和内皮细胞产生TGF-β1、PDGF、VEGF、肿瘤坏死因子(TNF)等细胞因子以及炎性介质和活性氧,可促使静止HSC与SEC激活,活化的HSC具有血管平滑肌细胞特性,能促进新生血管的构建[19-21]。在肝纤维发生早期,作为一种代偿反应,肝窦内皮失窗孔在一定程度上能缓解肝细胞损伤。但是肝窦毛细血管内皮窗孔关闭及内皮下基底膜的形成阻碍了肝细胞从Diss间隙摄取营养物质,同时影响肝细胞和肝星状细胞的血氧供给,导致肝星状细胞缺氧[4],缺氧可刺激肝星状细胞迅速活化。此外,内皮下基底膜的形成阻碍了视黄酸类物质从肝窦弥散进入Diss间隙,由肝细胞摄取再转入星状细胞贮存,这使得肝星状细胞转变成肌成纤维细胞[22]。活化后的HSC增殖性、迁移性和收缩性明显增加,HSC内维生素A脂滴丢失,同时表达特征性的α-SMA,细胞同时合成和分泌的胶原蛋白、层粘连蛋白、透明质酸等ECM积聚于肝脏内,导致肝纤维化[23]。因此,活化HSC在肝纤维化的发生和进展中起到核心作用,其数量增多和ECM积聚是肝纤维化中组织结构重建的表现[4,24-25]。抑制HSC激活或者促进活化的HSC凋亡成为抗肝纤维化治疗的有效途径。本研究结果显示,与对照组比较,美洲大蠊浸膏能不同程度抑制大鼠HSC和SEC增殖,其抑制作用在一定范围内呈剂量依赖性;同时美洲大蠊浸膏还能抑制HSC和SEC分泌α-SMA、Ⅳ-Col和LN等细胞外基质。
综上所述,美洲大蠊浸膏能抑制HSC和SEC活化及增殖,并抑制ECM的合成、促进其降解,对延缓肝纤维化进程有一定作用,为临床应用提供新的理论支持。但是具体通过何种途径或分子机制发生抗肝纤维化作用,还需进一步研究和验证。
[1]Hong IH,Park SJ,Goo MJ,et al.JNK1 and JNK2 regulate α-SMA in hepatic stellate cells during CCl 4 -induced fibrosis in the rat liver[J].Pathol Int,2013,63(10):483-491.
[2]Wei Z,Niu M,Yan K,et al.Stat3 pathway correlates with the roles of leptin in mouse liver fibrosis and sterol regulatory element binding protein-1c expression of rat hepatic stellate cells[J].Int J Biochem Cell Biol,2013,45(3):736-744.
[3]Yoon H,Lee JG,Yoo JH,et al.Effects of metabolic syndrome on fibrosis in chronic viral hepatitis[J].Gut Liver,2013,7(4):469-474.
[4]Hernandez-Gea V,Friedman SL.Pathogenesis of liver fibrosis[J].Annu Rev Pathol,2011,6(6):425-456.
[5]Bracht T,Schweinsberg V,Trippler M,et al.Analysis of disease-associated protein expression using quantitative proteomics-fibulin-5 is expressed in association with hepatic fibrosis[J].J Proteome Res,2015,14(5):2278-2286.
[6]Henderson NC,Iredale JP.Liver fibrosis:cellular mechanisms of progression and resolution[J].Clin Sci (Lond),2007,112(5):265-280.
[7]Lee YA,Wallace MC,Friedman SL.Pathobiology of liver fibrosis:a translational success story[J].Gut,2015,64(5):830.
[8]Ismail MH,Pinzani M.Reversal of liver fibrosis[J].Saudi J Gastroenterol,2009,15(1):72-79.
[9]Ahmad A,Ahmad R.Understanding the mechanism of hepatic fibrosis and potential therapeutic approaches[J].Saudi J Gastroenterol,2012,18(3):155-167.
[10]Chen MS,Zhang JH,Wang JL,et al.Anti-fibrotic effects of neferine on carbon tetrachloride-induced hepatic fibrosis in mice[J].Am J Chin Med,2015,43(2):1-10.
[11]Jiao J,Friedman SL,Aloman C.Liver fibrosis[J].Curr Opin Gastroenterol,2009,25(3):223-229.
[12]张宏伟,魏立友,杨亚静,等.美洲大蠊提取物改善危重症患者肠内营养的胃肠道不良反应[J].中国新药与临床杂志,2015,34(7):548-551.
[13]Roderburg C,Luedde M,Cardenas DV,et al.miR-133a mediates TGF-β-dependent derepression of collagen synthesis in hepatic stellate cells during liver fibrosis[J].J Hepatol,2013,58(4):736-742.
[14]Bosselut N,Taibi L,Guéchot J,et al.Including osteoprotegerin and collagen IV in a score-based blood test for liver fibrosis increases diagnostic accuracy[J].Clin Chim Acta,2012,415:63-68.
[15]Madsen DH,Jürgensen HJ,Ingvarsen S,et al.Endocytic collagen degradation:a novel mechanism involved in protection against liver fibrosis[J].J Pathol,2012,227(1):94-105.
[16]Veidal SS,Nielsen MJ,Leeming DJ,et al.Phosphodiesterase inhibition mediates matrix metalloproteinase activity and the level of collagen degradation fragments in a liver fibrosis ex vivo rat model[J].Bmc Res Notes,2012,5(1):1-9.
[17]Su TH,Kao JH,Liu CJ.Molecular mechanism and treatment of viral hepatitis-related liver fibrosis[J].Int J Mol Sci,2014,15(6):10578-10604.
[18]刘晓强,周海中,吴靖珍.肝病患者血清HA、PC-Ⅲ、C-Ⅳ、LN测定的临床意义[J].实用临床医药杂志,2009,13(11):40-42.
[19]Nath B,Szabo G.Hypoxia and hypoxia inducible factors:diverse roles in liver diseases[J].Hepatology,2012,55(2):622-633.
[20]Rosmorduc O,Housset C.Hypoxia:a link between fibrogenesis,angiogenesis,and carcinogenesis in liver disease[J].Semin Liver Dis,2010,30(3):258-270.
[21]Taura K,De Minicis S,Seki E,et al.Hepatic stellate cells secrete angiopoietin 1 that induces angiogenesis in liver fibrosis[J].Gastroenterology,2008,135(5):1729-1738.
[22]陆雄,刘平,刘成海,等.肝窦内皮细胞损伤在大鼠肝纤维化形成中的作用[J].中华肝脏病杂志,2002,10(6):441-444.
[23]Friedman SL.Molecular regulation of hepatic fibrosis,an integrated cellular response to tissue injury[J].Biol Chem,2000,275(4):2247-2250.
[24]Moreira K.Hepatic stellate cells and hepatic fibrosis[J].Arch Pathol Lab Med,2007,131(11):1728-1734.
[25]Lee UE,Friedman SL.Mechanisms of hepatic fibrogenesis[J].Best Pract Res Clin Gastroenterol,2011,25(2):195-206.
Effect of periplaneta americana extract on the proliferation and extracellular matrix secretion of rat HSC-T6 and SECinvitro
HU Jian-peng1,SONG Zheng-ji2*,XUN Lin-ting2,LI Yu-lian2,ZHAO Xue-ru2,LI Ting2,ZHANG Rong1
(1.Medical School,Kunming University of Science and Technology,Kunming 650500,China;2.Department of Gastroenterology,the First People′s Hospital of Yunnan Province,Kunming 650032,China)
ObjectiveTo investigate the effect of periplaneta americana extract on the proliferation and extracellular matrix secretion of rat hepatic stellate cells (HSC-T6) and sinusoidal endothelial cells (SEC )invitro.MethodsHepatic stellate cell line (HSC-T6) and sinusoidal endothelial cells (SEC) were treated with different concentrations of periplaneta americana extract.MTT assay was employed to determine the proliferation of HSC-T6 and SEC.Enzyme-linked immunosorbent assays (ELISA) was performed to measure the content of α-SMA,Ⅳ collagen and laminin (LN) in the culture of HSC-T6′s and SEC′s supernatants.ResultsMTT test showed that,compared with control group,the proliferations of HSC-T6 and SEC were significantly inhibited by the treatment of periplaneta americana extract with concentration dependence within a certain range.Moreover,the periplaneta americana extract also inhibited α-SMA,Ⅳ collagen and LN secretion both in the culture of HSC-T6′s and SEC′s supernatants in differents degrees by ELISA assay.ConclusionPeriplaneta americana extract mediates anti-hepatic fibrosis by inhibiting the proliferations of HSC-T6 and SEC,and preventing the secretions of α-SMA,Ⅳ collagen and LN.Therefore,it may be the potential drug for preventing and treating liver fibrosis.
Periplaneta americana extract;Hepatic stellate cells;Sinusoidal endothelial cell;Cell proliferation;Extracellular matrix
2016-04-21
1.昆明理工大学医学院,昆明 650500;2.云南省第一人民医院消化科,昆明 650032
国家自然科学基金(81560107);云南省应用基础研究项目(昆医联合专项)(2014FB091)
10.14053/j.cnki.ppcr.201609001

