绿叶甘姜色素提取工艺及其稳定性研究
陈宝宏,郑铁松,吴晓红,郑萍
(1.江苏经贸职业技术学院,江苏南京211168;2.南京师范大学金陵女子学院,江苏南京210097)
绿叶甘姜色素提取工艺及其稳定性研究
陈宝宏1,郑铁松2,吴晓红1,郑萍1
(1.江苏经贸职业技术学院,江苏南京211168;2.南京师范大学金陵女子学院,江苏南京210097)
以栖霞山绿叶甘姜为原料,提取其色素并进行稳定性分析,为天然食用色素的研究和应用提供一定基础数据。以提取溶剂浓度、时间、温度、固液比为分析因素,通过单因素试验和正交试验对提取工艺进行优化,确定绿叶甘姜中色素提取的最佳条件,并分析光照和温度变化对色素稳定性的影响。结果表明,绿叶甘姜中色素提取的最佳条件为:乙醇浓度60%、提取时间120min、固液比1∶12(g/mL)、提取温度60℃,绿叶甘姜耐光性和耐热性较好。
绿叶甘姜;色素;提取工艺;稳定性
绿叶甘姜(Lindera erythrocarpa)又称红果钓章、铁钉树,为落叶乔木,小枝无毛或幼时稍被柔毛,叶纸质,倒披针形或倒披针状长圆形。多生于山谷林中,长江以南各省区均有广泛分布。绿叶甘姜作为一味中药,有祛风杀虫、敛疮止血的功效,但在食品中的目前应用处于空白,其价值没有被最大化利用。目前,我国允许使用的天然色素种类不多,主要有姜黄、红花黄色素、辣椒红色素、虫胶色素、红曲米、酱色、甜菜红、叶绿素铜钠盐和β-胡萝卜素[1],植物色素大多为花青素类、类胡萝卜素类、黄酮类化合物,是一类生物活性物质,是植物药和保健食品中的功能性有效成分。然而大部分植物色素对光、热、氧、微生物和金属离子及pH变化敏感。绿叶甘姜果实呈鲜红色,可以提取其中色素物质,经过纯化后应用在食品、药品等产品中,本试验旨在初步研究绿叶甘姜色素的提取方法和影响稳定性的因素,为绿叶甘姜色素资源的全面高效利用提供基础数据。
1材料与仪器
1.1试验原材料所用原材料绿叶甘姜果实均采自南京市栖霞山。甲醇、乙醇、正丁醇、柠檬酸、氢氧化钠、盐酸均为分析纯。
1.2试验仪器
V-1100型可见分光光度计:上海美谱达仪器有限公司;80-IB型台式低速离心机:湖南新科科学仪器有限公司;HH-420型数显恒温水浴锅:上海梅香仪器有限公司;FA2104N型电子天平:上海菁海仪器有限公司;DGP30/23-ⅢA型电热鼓风干燥箱:南京试验仪器厂;SHB-Ⅲ型循环水多用真空泵:上海比朗仪器有限公司;RE-5203型旋转蒸发器:上海亚荣生化仪器厂。
2试验方法
2.1原料预处理
采集的新鲜绿叶甘姜果实洗净、低温烘至安全水分后,放入粉碎机中粉碎,得到绿叶甘姜果实粉末,密封备用,以防受潮。
2.2提取剂选择
精密称取1.000 0 g(本试验使用的万分之一电子天平有效数字即为小数点后四位)绿叶甘姜细粉4份,在温度50℃、提取时间30 min、固液比1∶10(g/mL)的条件下分别用70%甲醇、70%乙醇、70%正丁醇、0.8%柠檬酸作为提取剂进行提取,从而得到色素粗提液[2]。将色素粗提液放入离心机,2 000 r/min离心15 min取出并冷却至室温,同时用2.0 mL蒸馏水做空白试验,380 nm测定其吸光值,确定最佳提取剂。
2.3(λmax)选择
最大吸收波长精密称取1.000 0 g绿叶甘姜细粉,在温度50℃、提取时间30 min、固液比1∶10(g/mL)及70%乙醇的条件下进行提取,得到色素粗提液。将色素粗提液放入离心机,2 000 r/min离心15 min取出并冷却至室温,同时用2.0 mL70%乙醇做参比试剂,用可见分光光度计测定其吸收光谱,确定λmax[3]。
2.4色素提取优化工艺确定
精确称取质量为1.000 0 g绿叶甘姜果实细粉,分析影响色素提取主要影响因素,分别以提取剂浓度、提取时间、固液比和提取温度为因素,以色素提取液的吸光度值为评价指标,分别进行单因素试验和正交试验,确定色素最佳提取工艺。
2.5稳定性研究
精确称取20.000 0 g绿叶甘姜果实粉末,在最佳提取工艺的条件下提取。将提取液放入棕色试剂瓶作为母液,分别对光照和温度影响因素进行分析,研究绿叶甘姜色素在以上因素影响下的稳定性。
3结果与分析
3.1提取剂确定
根据文献资料和分析色素的溶解性等多方面因素,分别以甲醇、乙醇、正丁醇、柠檬酸为提取剂提取绿叶甘姜色素[4],4种溶剂筛选结果见表1。

表1 绿叶甘姜色素提取剂确定Table 1Determination of Lindera erythrocarpa pigment extraction agent
从表1可知,绿叶甘姜色素微溶于正丁醇,可溶于甲醇、乙醇、柠檬酸,其中乙醇溶解度最好,同时从成本和安全的角度考虑,选择乙醇为提取剂。
3.2λmax的确定
用70%乙醇提取绿叶甘姜中色素,在适当浓度范围内确定最大吸收波长,具体数据见图1。
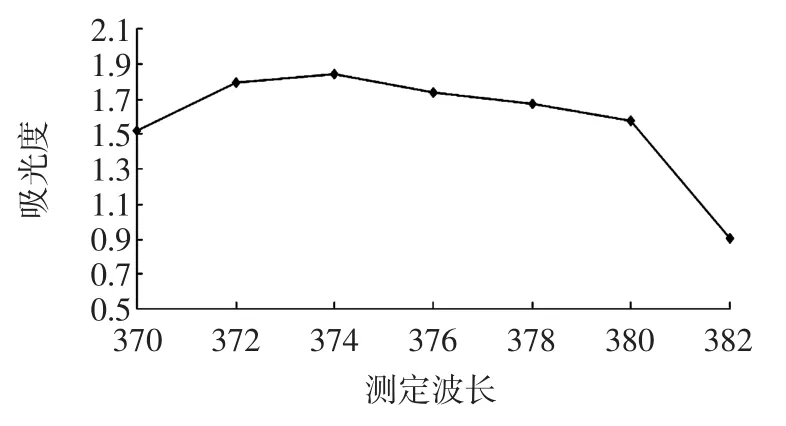
图1 绿叶甘姜色素乙醇提取液吸收光谱图Fig.1Lindera erythrocarpa pigment ethanol extract absorption spectrum of FIG
从图1清晰可见,当波长在370 nm~374 nm时,吸光度值呈上升趋势,当波长在374 nm~400 nm时,吸光度值逐渐下降,绿叶甘姜色素70%乙醇提取液的λmax为374 nm。因此在后面单因素和正交试验以及稳定性分析试验中均以374 nm为吸收波长。
3.3单因素试验结果与分析
通过单因素试验数据和分析,最终确定各因素水平范围,提取剂浓度40%~60%,提取时间100 min~140 min,固液比1∶12(g/mL)~1∶18(g/mL),提取温度50℃~70℃[5-8]。
3.4正交试验结果分析
考虑交互作用,选用正交表L9(34)进行试验分析,具体试验结果和分析如表2所示。

表2 正交试验设计及结果表Table 2Orthogonal experimental design and results table

续表2正交试验设计及结果表Continue table 2Orthogonal experimental design and results table
精确称取9份质量为1.000 0 g的绿叶甘姜果实细粉,按照每组不同的试验条件进行试验。试验条件及试验结果见表2。
由表2中正交试验数据,以色素吸光度大小作为评价指标,得出最优提取工艺为提取溶剂浓度60%,提取时间为120 min,固液比1∶12(g/mL),提取温度70℃。通过极差分析可知,各因素对色素提取的影响分别为D>C>B>A。结合k值分析表明,最佳提取工艺条件为提取溶剂浓度60%、提取时间120 min,固液比1∶12(g/mL)以及提取温度60℃。因最佳提取工艺条件不在9个试验范围内,故需进行验证试验。
3.5验证试验
通过进行3次验证试验,得到绿叶甘姜果实中色素提取液的吸光度值平均值为1.842,结果大于正交试验中最佳提取工艺吸光值1.830,结果证实,通过正交试验的数据推算正确,所以最佳提取工艺条件为提取溶剂浓度60%,提取时间为120 min,固液比为1∶12(g/mL)以及提取温度60℃。
3.6色素提取物稳定性研究
3.6.1光照对绿叶甘姜色素稳定性的影响[9]
取绿叶甘姜色素母液4份,每份体积为20 mL,分别置于室内自然光、室内灯光、紫外灯光及黑暗处放置不同时间后,进行光稳定性试验。在室温下374 nm处测定不同光照条件下色素提取液的吸光度值,结果见图2。

图2 光照对绿叶甘姜色素稳定性的影响Fig.2The effect of light on the stability of Lindera erythrocarpa
由图2可知,绿叶甘姜色素提取液在室内自然光条件下和黑暗处基本不变,耐光性较好;在紫外灯和室内灯光照射下,吸光度稍有降低,可能因为在强光照射下,溶液中色素结构被破坏[10]。
3.6.2温度对绿叶甘姜色素稳定性的影响[11-12]
取绿叶甘姜色素母液4份,每份20 mL,分别置于30、50、70、90℃的水浴锅中静置,分别在6、12、18、24 h后,将不同处理温度的样液冷却至室温,测定其在波长374 nm条件下的吸光度,分析色素提取物热稳定性,结果见图3。

图3 温度对绿叶甘姜色素稳定性的影响Fig.3The effect of temperature on the stability of Lindera erythrocarpa
由图3可知,绿叶甘姜色素在高温条件下不稳定,当温度在70℃~90℃范围内时,吸光度稍有降低,其原因可能是温度过高,色素提取液发生氧化反应导致提取液稳定性差;在30℃和50℃温度下,吸光度无变化[13]。
4结论
通过单因素试验和正交试验数据结果及分析,从绿叶甘姜果实中提取色素的最佳提取工艺是:乙醇浓度60%、提取时间120 min、固液比1∶12(g/mL)、温度60℃。绿叶甘姜果实中色素提取液具有一定的耐光性和耐热性。
[1]朱玉芬,彭方仁.食品中食用天然色素的作用[J].广州食品工业科技,2001,3(3):63-65
[2]张瑞宇.玫瑰红色素的提取方法与工艺学特性研究[J].重庆工商大学学报(自然科学版),2011,28(3):60-62
[3]赵海军,王朝阳,侯晓娜,等.天然红色素的提取研究进展[J].广州化学,2008,33(3):131-133
[4]李昌辉,徐贤东,万小荣,等.火龙果果皮红色素的微波提取工艺[J].中国农学通报,2008,24(4):5-6
[5]吴宇宽,刘章武.红枣红色素提取方法的优化研究[J].现代食品科技,2008,24(3):163-165
[6]徐启洪,吴巧玲.胭脂虫红色素提取方法的研究进展[J].食品与机械,2008(9):35-37
[7]章斌,侯小桢,郭丽莎.山竹壳色素稳定性研究[J].食品与机械,2011,27(3):37-39
[8]郭艳华.荸荠皮色素的提取和稳定性研究[J].食品科学,2004,25(12):15-21
[9]李健,张猛,李祖明,等.类球红细菌红色素稳定性研究[J].中国食品学报,2014,14(1):80-85
[10]Robert L Jackman,Rickey Y Yada,Marvin A Rung,et al.Anthocyanins as Food Colorants[J].Food Biochem,1987,11(3):201-247
[11]涂行浩,张秀梅,刘玉革,等.澳洲坚果壳色素的理化性质及稳定性研究[J].食品科学,2015,36(15):35-39
[12]李行任,刘珊,罗杨合,等.荸荠皮天然色素的纯化及其稳定性和抗氧化活性[J].食品与发酵工业,2014,40(8):89-95
[13]洪海龙,贺文智,索全伶,等.红辣椒中辣椒红色素的提取工艺研究[J].中国食品添加剂,2004(6):21-23
Study on the Extraction Process and Stability of Lindera erythrocarpa Pigment
CHEN Bao-hong1,ZHENG Tie-song2,WU Xiao-hong1,ZHENG Ping1
(1.Jiangsu Institute of Commerce,Nanjing 211168,Jiangsu,China;2.Ginling College,Nanjing Normal University,Nanjing 210097,Jiangsu,China)
The pigment is extracted from the Tindera erythrocarpa of Qixia mountain and the stability analysis is studied.It can offer basic data for the study of natural edible pigment.There were four analysis factors including extract concentration,time,temperature and solid-liquid ratio.Extraction process was optimized by single factor experiments and orthogonal experiments.It determined the best conditions of extracting the Lindera erythrocarpa pigment.And it analyzed the effects of changing light and heat on the stability of the pigment.The results showed that the Lindera erythrocarpa pigment extraction conditions:ethanol concentration 60%,extraction time 120 min,solid-liquid ratio 1∶12(g/mL)and extraction temperature 60℃.Light resistance and heat resistance of Lindera erythrocarpa pigment is better.
Lindera erythrocarpa;pigment;extraction process;stability
10.3969/j.issn.1005-6521.2016.19.012
2015-11-09
江苏省高等职业院校国内高级访问学者计划资助项目(2015FX023)
陈宝宏(1975—),女(汉),副教授,硕士研究生,研究方向:食品安全和食品营养。

