响应面法优化木瓜蛋白酶提取工艺
王田林,梁新红,孙俊良,莫海珍,周蒙
(河南科技学院食品学院,河南新乡453003)
响应面法优化木瓜蛋白酶提取工艺
王田林,梁新红,孙俊良*,莫海珍,周蒙
(河南科技学院食品学院,河南新乡453003)
采用新鲜的番木瓜为原料,探究超滤法提取木瓜蛋白酶的最佳工艺条件,选定L-cys、EDTA、温度、压力、时间、物料浓度6个因素进行单因素试验,确定超滤法提取木瓜蛋白酶的较佳工艺条件,其中L-cys和EDTA为木瓜蛋白酶的保护剂,其浓度分别在0.04 mol/L和0.002 mol/L时对木瓜蛋白酶的酶活性保护最强。选定超滤过程中的温度、压力、时间、物料浓度4个条件进行响应面试验,建立数学模型,然后回归分析,模型评价,结果表明超滤法提取木瓜蛋白酶的最佳条件为:温度55℃,压力0.25 MPa,时间3.7 min,物料浓度30%,此时酶活性大小为(9.31±0.27)万单位/mg,与模型验证的酶活性9.355万单位/mg非常接近。说明响应面法能较好的用于木瓜蛋白酶提取工艺的优化。
木瓜蛋白酶;超滤;响应面分析
木瓜蛋白酶是一类半胱氨酸蛋白酶,又可以称为木瓜酶,储藏在番木瓜的果实和根、茎、叶内,在未成熟的乳汁中含量最为丰富[1-2]。它也属于一种蛋白水解酶,分子量为27 000 u,由一种单肽链组成,含有212个氨基酸残基,至少有3个氨基酸残基存在于酶的活性中心部位,他们分别是Cys25、His159和Asp158,六个半胱氨酸残基形成了三对二硫键,但都不存在酶活性部位[3]。木瓜蛋白酶的结构组成决定了其有较强的合成能力和蛋白酶水解能力,具有稳定性好、耐高温、活性强的特点[4],此外还具有溶菌活力、解脂和凝乳等优点。由于木瓜蛋白酶可以进行酶促反应,利用这一特性,可把大分子的蛋白质水解成容易消化吸收的小分子多肽或氨基酸,因此在食品(豆类、肉类食品、啤酒工业)、轻纺、医学等领域有着广泛的应用。
木瓜蛋白酶的粗提,是指在种植的番木瓜未成熟果实中割取乳液去杂,在室温(20℃~25℃)下加入半胱氨酸溶液,放在研钵里研磨均匀,静置一段时间取上清液即为粗制酶,它的水溶液呈混浊状,然后在离心去杂的上清液中加入(NH4)2SO4分级分离得沉淀,加入半胱氨酸溶液后经盐析重结晶干燥得精制酶。木瓜蛋白酶室温贮存活力稳定性与活力高低呈反比,活力越高下降越快。在正常情况下,酶使用时活力有时会下降的主要因素为干燥失重、温度和空气氧化。粗制酶酶活比精制酶酶活稳定,热风吹干和喷雾干燥的酶酶活比冷冻干燥的酶酶活稳定,因此酶的储存应放在低于10℃的环境中[5-13]。为了防止木瓜蛋白酶失活,可以加入适量保护剂如EDTA、L-cys、亚硫酸氢钠、焦亚硫酸钠等,如果用于医药行业,则需进一步纯化,一般采用(NH4)2SO4、Spsephade×柱层析,齐杰等[14]采用的Spsephade×G100凝胶层析则效果更为明显。
天然的木瓜蛋白酶在极端pH、重金属离子、高温等条件下,易遭到破坏,使酶在生产和使用遭到极大的限制。人们对如何提高酶的活性及其稳定性越来越重视。近年来,人们经过努力找到了许多木瓜蛋白酶酶的提取方法。如今木瓜蛋白酶提取分离技术主要有超滤法、盐析法、亲和层析法、絮凝法和有机溶剂法等。盐析法提取的木瓜蛋白酶活性较低;有机溶剂法提取的木瓜蛋白酶易变性以及有机溶剂残留问题;絮凝法提取专一性不强,制得的木瓜蛋白酶纯度不高;亲和层析法提取的酶纯度虽然较高,但是操作复杂,不易在工业上放大生产,且用于亲和层析的前处理液需是经过初步纯化的酶液[15-20]。相对来说,超滤法能有效分离提取高纯度木瓜蛋白酶。其原因是由于超滤法易于连续化操作,目标产物有较高的收率,分离过程经济等优势,因此被广泛应用[21]。本试验首先验证了两种保护剂(L-cys和EDTA)在超滤法提取木瓜蛋白酶工艺中的作用,然后采用响应面法优化超滤法提取木瓜蛋白酶工艺的参数(提取时间、提取温度、物料浓度、压力),为木瓜蛋白酶提取产量的提高奠定基础。
1材料与方法
1.1材料与试剂
番木瓜由水果超市买入(品种:青番木瓜);木瓜蛋白酶(酶活10 U/mg):美国Sigma公司;L-半胱氨酸盐酸盐、L-酪氨酸:上海宝曼生物科技有限公司;其他均为国产分析纯。
1.2仪器与设备
Vivaflow型切向流超滤机:德国STRTORIOUS公司;全波长多功能酶标仪:美国赛非默世尔公司;DZKW-4型恒温水浴锅:北京中兴伟业仪器有限公司;PHS-3C型精密pH计:上海精密科学仪器有限公司;FA124型电子天平:上海舜宇恒平科学仪器有限公司。
1.3超滤法提取木瓜蛋白酶的工艺
新鲜青番木瓜→取皮切碎→加冰水捣碎→过滤→取滤液离心10 min(10 000 r/min)→取上清液→加入酶活保护剂→调pH→静置预处理3 h→预处理液真空抽滤→超滤。
1.4测定酶的活性
酶活力单位定义:在规定条件下,1 min内酶水解酪蛋白释放出相当于1 μg/mL酪氨酸在275 nm波长处的吸收度为1个活力单位。以0.1 mol/L盐酸溶液作空白,在275 nm波长处测定空白溶液,待测定液,对照品溶液的吸光度。
酶活力计算[22]:
按下式计算酶活力:
每1 mg木瓜蛋白酶活力单位=A/As×Cs×12/2×稀释倍数/W(1)
式中:A为待测定液的吸光度减去空白溶液的吸光度;As为对照品溶液的吸光度;Cs为酪氨酸对照品溶液的浓度,μg/mL;W为样品重量,mg。
木瓜蛋白酶1个活力单位相当于释放1 μg的酪氨酸。规定酶浓度为1 mL测定液释放40 μg的酪氨酸。
1.5试验设计
首先对木瓜蛋白酶的两种酶保护剂L-cys和EDTA的浓度大小设计单因素试验,然后再设计单因素试验分别对木瓜蛋白酶提取条件:超滤时间、压力、pH、物料浓度(物料质量和加水量的百分比)进行考察,探究其对木瓜蛋白酶活性的影响。然后采用响应面法优化以上4个因素,在单因素试验基础上设计响应面参数表,试验因素水平表见表1。应用Design Expert 7.0软件对结果进行分析。

表1 响应面试验因素水平编码表Table 1Factors and levels of response surface experiment
2结果与分析
2.1预处理过程中酶活保护剂L-cys和EDTA添加量对木瓜蛋白酶活性的影响
准确量取一定量的浓度为0.02、0.04、0.06、0.08、0.10 mol/L的L-cys及浓度为0.001、0.002、0.003、0.004、0.005 mol/L的EDTA分别加入到离心后的滤液中,用0.1 mol/L HCl或0.1 mol/L NaOH调pH至7.0后静置3 h,抽滤后进行超滤,用多功能酶标仪在260 nm波长下测吸光值按(1)式求酶活。
提取中添加不同浓度L-cys对木瓜蛋白酶活性的影响见图1,提取中添加不同浓度EDTA对木瓜蛋白酶活性的影响见图2。
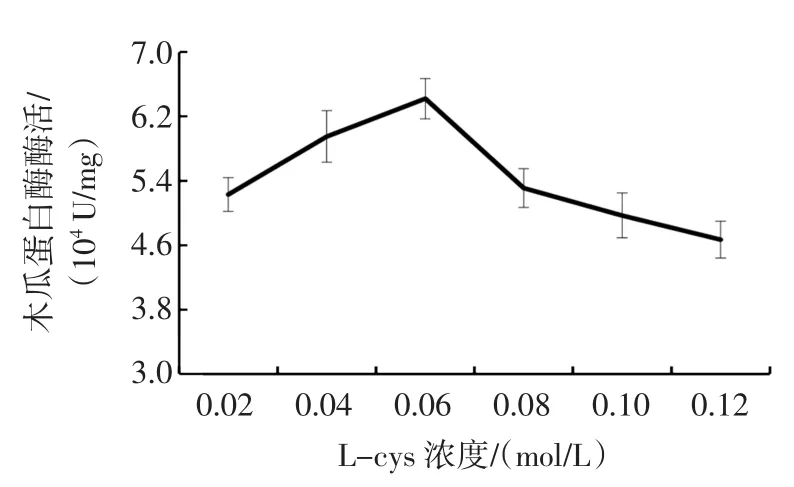
图1 提取中添加不同浓度L-cys对木瓜蛋白酶活性的影响Fig.1Extraction of adding different concentration of L-cys effect on the activity of papain

图2 提取中添加不同浓度EDTA对木瓜蛋白酶活性的影响Fig.2Extracting of adding different concentration of EDTA effect on the activity of papain
从图1可以看出在预处理过程中,L-cys浓度为0.04 mol/L,pH为7.0的情况下,EDTA浓度为0.002 mol/L时对木瓜蛋白酶活性能起到很好的保护作用。从图2可以看出,在预处理过程中,EDTA浓度0.002 mol/L、pH为7.0的情况下,L-cys添加量为0.04 mol/L时对木瓜蛋白酶活性能起到较好的保护作用。
2.2超滤过程中压力对木瓜蛋白酶活性的影响
试验研究超滤过程中预处理液体积100 mL,其中物料浓度为30%,温度为50℃,操作压力分别为0.1、0.15、0.2、0.25、0.3、0.35 MPa,反应时间为5 min时对木瓜蛋白酶活性的影响。提取中不同压强对木瓜蛋白酶活性的影响见图3。
由图3可知,随着压力的增大,木瓜蛋白酶的活性明显上升,但到了0.25 MPa以后,随着压力的继续增加,木瓜蛋白酶的活性呈现下降趋势。操作压力对超滤结果影响很大,所以压力控制在0.25 MPa左右酶的活性最大。

图3 提取中不同压强对木瓜蛋白酶活性的影响Fig.3Extraction in different pressure effect on the activity of papain
2.3超滤过程中温度对木瓜蛋白酶活性的影响
试验研究超滤过程中预处理液体积100 mL,其中物料浓度为30%,操作压力为0.25 MPa,反应温度分别为35、45、55、65、75、85℃,反应时间为5.5 min时对木瓜蛋白酶活性的影响。提取中不同温度对木瓜蛋白酶活性的影响见图4。

图4 提取中不同温度对木瓜蛋白酶活性的影响Fig.4Extract in different temperature effect on the activity of papain
由图4可知,在超滤过程中,木瓜蛋白酶活性随着温度的升高而有所增大,温度的升高减少了溶剂的粘度从而加大了溶液的渗透能力,但当温度高于55℃,由于过高的温度能使酶失活,木瓜蛋白酶的活性开始下降。所以温度控制在55℃左右时酶的活性最大。
2.4超滤过程中时间对木瓜蛋白酶活性的影响
试验研究超滤过程中预处理液体积100 mL,其中物料浓度为30%,反应温度55℃,操作压力0.25 MPa,反应时间分别为1.5、2.5、3.5、4.5、5.5、6.5 min时对木瓜蛋白酶活性的影响,提取中不同时间对木瓜蛋白酶活性的影响见图5。
由图5可知,在一定压力、温度和物料浓度的情况下,1.5 min~3.5 min之间随着提取时间的增加酶活性逐渐增加,3.5 min后随着时间的增加酶活缓慢的下降,由此可得超滤时间控制在3.5 min左右比较合适。
2.4超滤过程中物料浓度对木瓜蛋白酶活性的影响

图5 提取中不同时间对木瓜蛋白酶活性的影响Fig.5Extraction effect on the activity of papain in a different time
试验研究超滤过程中预处理液体积100 mL,其中反应温度55℃,操作压力0.25MPa,反应时间为3.5 min,木瓜蛋白酶液的质量分数分别为10%、20%、30%、40%、50%时对木瓜蛋白酶活性的影响,不同浓度的木瓜蛋白对酶活性的影响见图6。
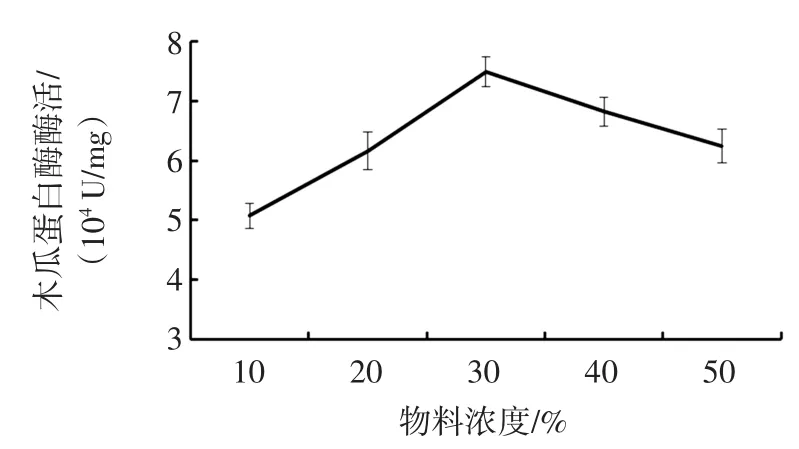
图6 不同浓度的木瓜蛋白对酶活性的影响Fig.6Different concentrations of papaya protein effect on enzyme activity
由图6可知,木瓜蛋白酶的活性随着木瓜滤液的浓度增大而增大,当物料浓度为30%时,木瓜蛋白酶的活性最大,随着滤液浓度的增加,浓度差显著,酶的提取速率减慢,酶的活性逐渐降低。因此,超滤过程中木瓜滤液的物料浓度控制在30%时,酶的活性最高。
2.5响应面试验优化木瓜蛋白酶的工艺参数
根据单因素试验结果,综合比较影响提取木瓜蛋白酶过程中酶活的较大的4个条件的最优值,超滤温度55℃,压力0.25 MPa,时间3.5 min,物料浓度30%。以木瓜蛋白酶的活性大小为指标,采用Design Expert 7.0软件设计分析。结果见表2。
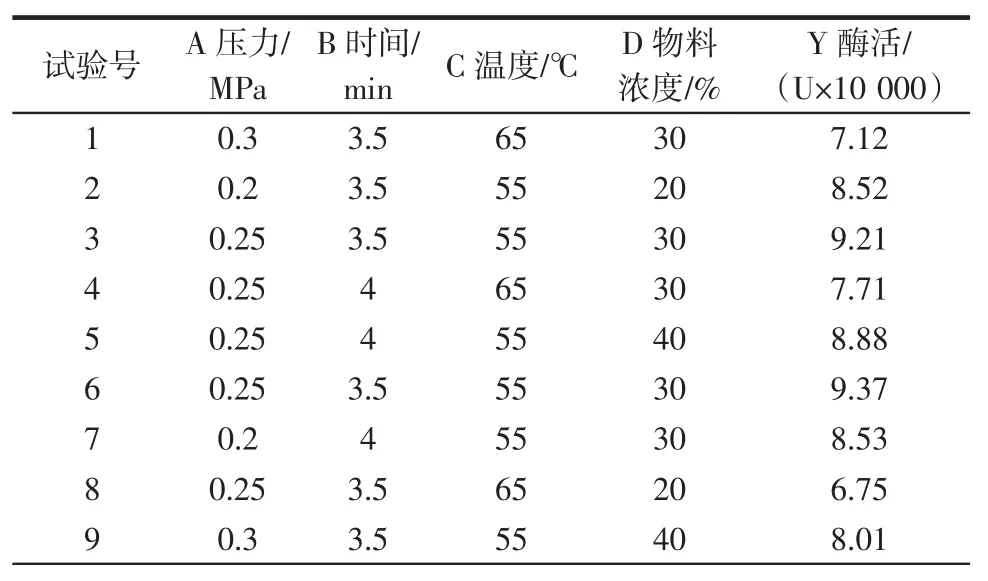
表2 Box-Behnken试验设计与结果Table 2Experimental design and results of Box-Behnken

续表2Box-Behnken试验设计与结果Continue table 2Experimental design and results of Box-Behnken
根据试验数据,用Desgin Expert 7.0程序进行二次多项式回归,回归模型方程为:Y=9.25-0.25A+0.15B+ 0.79C+0.02D+0.14AB+0.44AC+0.037AD+0.18BC+ 0.045BD+0.043CD-0.7A2-0.2B2-2.62C2-0.4D2
回归方程的方差分析结果见表3。

表3 响应面回归方程方差分析Table 3ANOVA for response surface quadratic model
由表3可知,回归模型P<0.000 1极其显著,失拟项P=0.136 1不显著,表明回归方程拟合程度良好,实验误差较小。R2=0.991 2表明响应值酶活大小实际值与预测值之间具有较好的拟合度,该试验方案是可行的,C.V.=2.45%进一步说明,回归模型也能较好的反应真实实验值。以显著水平(P<0.05)为基础条件,基于回归方程的因素显著性分析,影响木瓜蛋白酶酶活的回归模型中的一次项(A、B、C),二次项(A2、B2、C2、D2),交互项AC均表现显著,由F值可得,影响酶活力大小的条件的顺序为:C(温度)>A(压力)>B(时间)>D(物料浓度)。综合分析比较得出,响应面分析能较好地预测超滤法提取木瓜蛋白酶的酶活性大小。
通过Design Expert 7.0软件对响应面优化工艺结果分析得到超滤法提取木瓜蛋白酶的最有条件为:压力0.25 MPa,时间3.71 min,温度55.8℃,物料浓度31%时。理论上木瓜蛋白酶的最大活性可达到9.355万单位/mg。为验证响应面法所得预测值的准确性,综合考虑试验中实际操作的客观性,将最佳的条件修正为压力0.25 MPa,时间3.7 min,温度55℃,物料浓度30%,根据修正后的条件,做3次平行试验验证测得的酶活性大小为(9.31±0.27)万单位/mg,证明了响应面优化超滤法提取木瓜蛋白酶的准确性和有效性,表明建立并优化模型的可靠性。
3结论
通过比较不同浓度的酶保护剂对提取木瓜蛋白酶活性大小的影响,结果显示L-cys、EDTA浓度分别为0.04、0.002 mol/L时木瓜蛋白酶提取效果更好。在单因素试验的基础上,采用响应面法对该酶提取过程中的主要影响因子进行优化,建立了较合理有效的酶活与温度、压力、时间、物料浓度的数学模型,该模型能较好的测算提取出来的木瓜蛋白酶的酶活性大小。
应用响应面法优化得到的木瓜蛋白酶提取最佳条件为:压力0.25 MPa,时间3.7 min,温度55℃,物料浓度30%,此时酶活性大小为(9.31±0.27)万单位/mg,与模型验证的酶活性9.355万单位/mg非常接近。说明响应面法能较好的用于木瓜蛋白酶提取工艺的优化,为木瓜蛋白酶提取产量的提高奠定基础。
[1]Azarkan M,Moussaoui A E,Wuytswinkel D V,et al.Ractionation and purification of the enzymes stored in the latex of Carica papaya[J].Journal of Chromatography B,2003,790(1/2):229-238
[2]SUMNER IG.Factors affecting the thermostability of cysteine proteinases from Carica papaya[J].European Journal of Bio-chemistry,1993,214(1):129-134
[3]熊华.木瓜蛋白酶的应用研究进展[J].四川食品与发酵,2005(4):9-10
[4]王晟,崔洁,顾欣,等.木瓜蛋白酶制备山杏源降糖肽工艺优化研究[J].食品工业科技,2014,35(9):169-173
[5]Huang X L,Catignani G L,Swaisgood H E.Comparison of the properties of trypsin immobilized on 2 CeliteTM derivatives[J].Journal of Biotechnology,1997,53(1):21-27
[6]Feller G,Narinx E,Aprigny J L,et al.Enzymes from psychrophilic organisms[J].FEMS Microbiology Reviews,1996,18(2/3):189-202
[7]吴建中,赵谋明,宁正祥,等.木瓜蛋白酶水解大豆分离蛋白研究[J].大豆科学,2002,8(21):187-190
[8]巫庆华.木瓜蛋白酶凝固大豆蛋白机理[J].乳业科学与技术,2002(1):6-9
[9]刘登勇.食品添加剂在肉类嫩化中的作用[J].肉类工业,2003(3):26-30
[10]解蕊,张根生,范俊杰,等.木瓜蛋白酶水解鸡骨泥工艺条件的研究[J].食品工业,2002(1):40-42
[11]Tucker G A,Woods L F G.酶在食品加工中的应用[M].2版.北京:中国轻工业出版社,2002:127-133
[12]宋常欣,陈玲.啤酒非生物稳定剂的应用和比较[J].食品与发酵工业,2001,3(27):79-81
[13]乙引,陈平,王茜,等.木瓜蛋白酶改良啤酒品质的研究[J].贵州农业科学,2000,28(4):14-16
[14]邓静,吴华昌,周健.木瓜蛋白酶研究进展[J].广西轻工业,2003(3):5-7
[15]牟利辉.木瓜蛋白酶的应用研究[J].广东化工,2008,35(10):96-98
[16]涂绍勇,李路,杨爱华,等.双相萃取法提取木瓜蛋白酶的研究[J].食品工业科技,2010,19(9):220-222
[17]刘叶青,周勤.用絮凝和超滤技术纯化木瓜蛋白酶[J].华东理工大学学报,1996,22(1):43-46
[18]任国梅,陈孜.高质量木瓜蛋白酶纯化工艺研制探讨[J].药物生物技术,1997,4(4):232-235
[19]D’Souza F,Lali A.Purification of papain by immobilized metal affinity chromatography(IMAC)on chelating carboxymethyl cellulose[J].Biotechnology Techniques,1999,13(1):59-63
[20]Nitsawang S,Hatti-Kaul R,Kanasawnd P.Putification of papain from Carica papaya latex:Aqueous two-phase extraction versus twosteps salt precipitation[J].Enzyme and Microbial Technology,2006,39(5):1103-1107
[21]万婧,张海德,曹贵兰.超滤法在番木瓜提取木瓜蛋白酶工艺中的应用研究[J].粮食与食品工业,2012,4(19):33-37
[22]陈德梅,符秀娟.木瓜酶酶活力测定方法在实际生产中的适用性[J].广东药学院学报,2003,20(3):244-245
Response Surface Method Optimization Papain Extraction Process
WANG Tian-lin,LIANG Xin-hong,SUN Jun-liang*,MO Hai-zhen,ZHOU Meng
(College of Food,Henan Institute of Science and Technology,Xinxiang 453003,Henan,China)
Using fresh papaya as raw material.Extraction of papain on ultrafiltration choicing the L-cys,EDTA,pressure,temperature,time,solid-liquid ratio,six factors as single factor experiment,the extraction of papain by ultrafiltration to determine the optimum process conditions,the L-cys and EDTA for the enzyme protective agent optimal concentrations were:0.04 mol/L and 0.002 mol/L.The selected temperature,pressure,time and ratio of material to liquid four conditions by response surface experiments,mathematical model,and regression analysis,evaluation model,the results showed that the optimum conditions of ultrafiltration extraction of Papain is:temperature 55℃,pressure 0.25 MPa,time 3.7 min,material density 30%,the enzyme activity is(9.31±0.27)(U×10 000)/mg,it is close with the model validation activity of 9.355(U×10 000)/mg. That response surface method can be used to optimize the extraction process of papain better.
papain;ultrafiltration;responsesurfacemethodology
10.3969/j.issn.1005-6521.2016.19.021
2015-11-22
河南省科技计划项目(142102110127);河南省教育厅自然科学研究资助计划项目(14A550010);河南省高校科技创新团队支持计划项目(16IRTSTHN007)
王田林(1991—),男(汉),硕士研究生,研究方向:食品生物技术。
孙俊良(1964—),男,教授,博士,研究方向:食品生物技术。

