免疫亲和柱-高效液相法测定牛奶中呕吐毒素
邵珍美
(山东商务职业学院,山东烟台264670)
免疫亲和柱-高效液相法测定牛奶中呕吐毒素
邵珍美
(山东商务职业学院,山东烟台264670)
建立一种快速、高效测定牛奶中的呕吐毒素的免疫亲和柱-高效液相方法。样品前处理采用乙腈溶剂沉淀蛋白,用PBS缓冲液淋洗,乙腈洗脱后,洗脱液在40℃下氮吹干后,流动相复溶后检测。采用Waters RP C18色谱柱(4.6 mm×250 mm,5 μm)分离,以乙腈-水(90∶10)作为流动相,用二极管阵列检测器检测,外标法峰面积定量。结果表明,呕吐毒素在0.2 μg/mL~2.0 μg/mL浓度范围内线性良好,相关系数r2为0.999 8,检出限为0.12 mg/kg,定量限为0.40 mg/kg,加标回收率达到82.2%~98.5%。
免疫亲和柱;高效液相;牛奶;呕吐毒素
呕吐毒素(vomitoxin)又称脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON),属于单端孢霉烯族B类,主要是由镰孢属中的禾谷镰孢(玉米赤霉)和黄色镰孢产生[1](见图1)。呕吐毒素广泛存在于全球,主要污染小麦、大麦、玉米、燕麦、大米、裸麦、高粱等谷类作物[2],人和动物在误食被该毒素污染的粮谷类后可以产生广泛的毒性效应。奶牛在食用了污染的谷物饲料后,在乳汁中也可检测到相应的霉菌毒素[3-6],霉菌毒素种类与污染水平主要由谷物饲料被霉菌毒素污染的程度决定。近年来调查结果显示[7-8],我国部分饲料和原料污染霉菌毒素超标的比例高达60%~70%,而呕吐毒素的超标比例接近70%。然而文献中检测牛奶中的呕吐毒素的研究比较少,而且标准中没有牛奶这一类物质的前处理方法[9-10],所以本文对这一类物质进行研究,以便对标准进行补充和辅助参考。

图1 呕吐毒素结构图Fig.1Structure of vomitoxin
目前呕吐毒素的分析测定一般采用薄层色谱法(TLC)[11]、酶联吸附免疫法(ELISA)[12]和高效液相色谱法(HPLC)[13-14]。TLC法繁琐费时,且灵敏度、特异性较差,提取过程中所需有机溶剂品种多且量大,易污染环境,对人体有较大危害。而ELISA法测定结果受试剂盒差异、实验温度、仪器灵敏度等条件影响较大,重复性差,假阳性率高,难以达到相关技术要求。常规的HPLC法虽然比TLC灵敏度高,但由于样品前处理手续繁琐,操作复杂,也难以推广。本文经试验摸索研究,建立了免疫亲和净化-反相高效液相-二极管阵列检测器的方法,该方法回收率高、重复性好、操作简便、快速灵敏,可作为牛奶中呕吐毒素的测定方法参考。
1材料与方法
1.1仪器与试剂
2695高效液相色谱系统(配2998二极管阵列检测器):Waters;RV10旋转蒸发仪:IKA。
呕吐毒素溶液标准物质(200 μg/mL):购于中国计量科学研究院;甲醇、乙腈为色谱纯。
脱氧雪腐镰刀菌烯醇免疫亲和柱:华安麦科。
1.2样品制备
样品均为市场上随机购买牛奶。
1.3色谱条件
色谱柱:Waters RP C18(4.6 mm×250 mm,5 μm);流速:1.0 mL/min;进样量:20 μL。
柱温:30℃;检测波长:218 nm。
1.4方法
1.4.1不同流动相体系对DON色谱行为的影响
参考相关文献和标准,固定流动相洗脱速度1.0 mL/min,选择不同的流动相体系(体积比),流动相组成Ⅰ:甲醇-水(90∶10);流动相组成Ⅱ:甲醇-水(80∶20);流动相组成Ⅲ:乙腈-水(90∶10);流动相组成Ⅳ:乙腈-水(80∶20);考察对呕吐毒素分析效果和出峰时间的影响,确定最佳流动相体系。
1.4.2标准曲线的制作
吸取适量的呕吐毒素标准品,配制成0.2、0.4、0.8、1.0、1.5、2.0 μg/mL一系列标准溶液,进液相色谱仪进行分析,以峰面积为纵坐标,浓度为横坐标绘制标准曲线。
1.4.3样品前处理条件的优化
在相关呕吐毒素的检测方法[9-10]中,未提及牛奶相关的前处理方法,若按酒类或者酱及酱制品处理后[10],通过免疫亲和柱时容易堵塞小柱,造成试验结果不准确,所以本试验要设计初步提取牛奶中的呕吐毒素的前处理方案,再进行下步的免疫亲和柱的富集和净化。
在富集和净化步骤选用的是脱氧雪腐镰刀菌烯醇免疫亲和柱,它基于抗原、抗体反应的基础上,抗体连接在柱体内,样品经过提取、过滤后,缓慢的通过柱体,在免疫亲和柱内毒素与抗体结合,之后洗涤免疫亲和柱除去没有被结合的其他无关物质。用有机溶剂洗脱呕吐毒素,经氮吹干复溶后注入到仪器中检测。但是在实际试验中效果并不理想,杂质干扰峰较多,加标回收率不高,所以本试验也要优化相关的富集和净化过程的条件,结果都以样品加标平均回收率为比较依据,来制定较优的前处理条件。
1.4.4加标回收试验
以未检出呕吐毒素的牛奶为空白基质,加入标准溶液浓度在0.5 mg/kg~2.0 mg/kg之间,选择优化后的前处理条件操作,氮吹近干后再用流动相定容至2.0mL,过0.22 μm滤膜后上机检测,计算回收率。
2结果与分析
2.1流动相体系对呕吐毒素色谱行为的影响
为了了解流动相体系对呕吐毒素色谱行为的影响,本研究固定流动相洗脱速度,改变流动相体系的组成和比例,流动相组成Ⅰ:甲醇-水(90∶10);流动相组成Ⅱ:甲醇-水(80∶20);流动相组成Ⅲ:乙腈-水(90∶10);流动相组成Ⅳ:乙腈-水(80∶20),考察对呕吐毒素色谱行为的影响。结果表明:流动相组成Ⅰ~Ⅳ都能有效的分离出目标峰,且峰型良好;但出峰时间有所差别,流动相组成Ⅰ出峰时间为22.3 min;流动相组成Ⅱ出峰时间为16.8 min;流动相组成Ⅲ出峰时间为12.0 min;流动相组成Ⅳ出峰时间为7.6 min。考虑到时间因素的影响,时间太长会浪费流动相,时间太短的目标峰杂质峰会分不开,所以综合考虑选择流动相组成Ⅲ作为本试验的流动相体系,色谱图如图2所示。
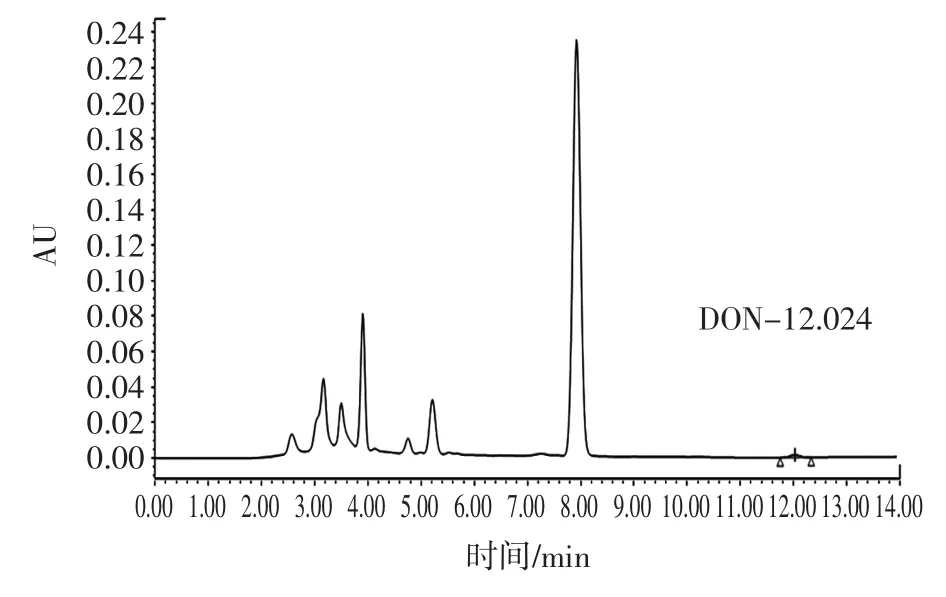
图2 呕吐毒素标准物质色谱图Fig.2Chromatogram of vomitoxin standard substance
2.2标准曲线、检出限和定量限
为了验证呕吐毒素在乙腈-水(90∶10)溶液流动相体系中的线性关系,配制了浓度为0.2、0.4、0.8、1.0、1.5、2.0μg/mL的系列标准溶液。每个浓度重复测定3次,试验结果表明,呕吐毒素在0.2 μg/mL~2.0 μg/mL内均具有良好的线性关系(r2>0.999);采用在空白基质中添加目标组分的方法,依据色谱峰的信噪比(S/N)大于3倍确定检出限(LOD),S/N大于10倍确定定量限(LOQ),得到目标组分的LOD和LOQ分别为0.12 mg/kg和0.40 mg/kg,结果见表1。

表1 呕吐毒素的保留时间、标准曲线、相关系数、检出限与定量限Table 1Retention time,standard curve,correlation coefficient,detection limit and quantitative limit of vomitoxin
2.3提取溶液的选择
考虑到呕吐毒素易溶于极性的溶剂如水、甲醇、乙醇、乙腈、丙酮和乙酸乙酯,以及牛奶主要含蛋白质的特性,提取溶液分别选择甲醇、乙醇、乙腈、乙酸乙酯以及乙酸锌-亚铁氰化钾沉淀体系进行比较,主要目的就是沉淀牛奶中的蛋白质将样品中呕吐毒素提取到溶剂中来。在有机溶剂甲醇、乙醇、乙腈、乙酸乙酯沉淀牛奶中的蛋白质后,上清液若直接过免疫亲和柱会破坏柱子中的抗体活性,所以先将沉淀后的上清液旋蒸干后,用水复溶后过柱;而乙酸锌-亚铁氰化钾沉淀后上清液需要调节pH值至中性后上柱。试验结果以呕吐毒素的回收率为比较依据。
结果显示:在牛奶样品中加入提取溶剂后,样品中的蛋白质都会得到沉淀,但是沉淀的效果不同,导致过滤后样液澄清度不一样,沉淀效果从差到好依次是:乙酸乙酯、甲醇、乙醇、乙腈,乙酸锌-亚铁氰化钾沉淀体系与乙腈沉淀效果差不多;所以我们选择乙酸锌-亚铁氰化钾沉淀体系与乙腈沉淀后的上清液进行比较,发现乙腈作为提取溶液样液上机后的色谱图中杂质干扰峰减少,样品的加标回收率高于乙酸锌-亚铁氰化钾沉淀体系作为提取溶液的结果,所以以下实验都选择乙腈作为呕吐毒素的提取溶液,加入样品沉淀蛋白质后,上清液旋蒸干后,用水复溶后过柱。
2.4免疫亲和柱淋洗液、洗脱液以及加标方式的选择
参考相关标准和产品资料,在样液上柱后,对牛奶样品的淋洗液分别选择水和PBS缓冲液进行比较;洗脱液选择甲醇、乙腈两种溶剂进行比较。
对于加标回收试验,由于标准品是溶于甲醇-乙酸乙酯混合溶液里的,考虑到乙酸乙酯溶剂峰干扰的问题,比较两种加标方式Ⅰ:将标准品直接加入到样品里,Ⅱ:将标准品加入容器氮吹干后,用甲醇溶解后加入。
结果显示:在免疫亲和柱淋洗步骤,水的淋洗速度比PBS缓冲液快,但是对于有颜色的调制牛奶样品来说,PBS缓冲液能淋洗的更干净,综合考虑还是PBS缓冲液作为淋洗液;在免疫亲和柱洗脱步骤,甲醇和乙腈的洗脱效果差不多,但是考虑到流动相的组成中含有乙腈,所以选择乙腈作为洗脱液;对于加标回收试验,加标方式Ⅰ的色谱图明显有一个很大的溶剂峰,而加标方式Ⅱ则没有溶剂峰的干扰,所以加标方式Ⅱ明显优于加标方式Ⅰ,谱图结果如图3所示。

图3 加标方式对呕吐毒素色谱图的影响Fig.3The effect of adding standard method on the vomitoxin chromatogram
2.5样品的测定及加标回收
在我们随机购买的40个批次的牛奶样品中,根据上述试验结果选用乙腈提取,PBS缓冲液淋洗,乙腈洗脱后,洗脱液在40℃下氮吹干后,2 mL流动相复溶后,上机检测。结果表明:优化后的试验条件,前处理简单、净化效果好、灵敏度高和检测速度快,样品上机后的色谱图中杂质峰对目标峰的干扰少。在所检测的牛奶制品中,呕吐毒素结果均未检出,加标回收率82.2%~98.5%,符合检测要求。
3结论
本文建立了一种免疫亲和柱-高效液相法检测牛奶制品中呕吐毒素的分析方法。结果表明,在乙腈-水(90∶10)体系中,乙腈比例对于溶质的色谱保留行为具有较强的调节能力,呕吐毒素得到了良好的基线分离。牛奶样品用乙腈溶剂提取后,上清液氮吹干后,用水复溶后上免疫亲和柱,用PBS缓冲液淋洗,乙腈洗脱后,洗脱液在40℃下氮吹干后,2 mL流动相复溶后,上机检测后色谱谱图中可有效去除牛奶制品中的复杂基质对目标峰的影响,实现对呕吐毒素的净化与富集。
[1]杨万颖,曾国清,赖心田,等.大豆加工食品中呕吐毒素污染水平调查与分析[J].检验检疫科学,2008,18(4):51-54
[2]Kotal F,Radova Z,Czech J.Worldwidecontamination of cereals by the Fusarium mycotoxins Nivalenol,Deoxynivalenol,and Zearalenone.1.Survey of 19 Countries[J].Food Sci,2002,20(2):63
[3]Diekman M A,Green M L.Mycotoxins and reproduction in domesticlivestock[J].Journal of Animal Science,1992,70:1615-1627
[4]Srensen L K,Elbk T H.Determination of mycotoxins in bovine milk by liquid chromatography tandem mass spectrometry[J].Journal of Chromatography B,2005,820:183-196
[5]Monaci L,Palmisano F.Determination of ochratoxin A infoods:Stateof-the-art and analytical challenges[J].Analytical and Bioanalytical Chemistry,2004,378:96-103
[6]Cavret S,Lecoeur S.Fusariotoxin transfer in animal[J].Food and Chemical Toxicology,2006,44:444-453
[7]甄阳光,柏凡,张克英,等.我国主要饲料原料及产品中呕吐毒素污染分布规律研究[J].中国畜牧杂志,2009,48(9):51-54
[8]敖志刚,陈代文.2006-2007年中国饲料及饲料原料霉菌毒素污染调查报告[J].中国畜牧兽医,2008,35(1):251-255
[9]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 5009.111-2003谷物及其制品中脱氧雪腐镰刀菌烯醇的测定[S].北京:中国标准出版社,2003
[10]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 23503-2009食品中脱氧雪腐镰刀菌烯醇的测定免疫亲和层析净化高效液相色谱法[S].北京:中国标准出版社,2009
[11]王俊双,许定花,孙秀兰.食品中脱氧雪腐镰刀菌烯醇三种检测方法的比较研究[J].分析检测,2008,29(2):287-290
[12]袁克,龚燕,王俊双,等.金标试纸法和酶联免疫法检测呕吐毒素的对比研究[J].安徽农业科学,2007,35(18):5341-5360
[13]Lisa M C,Scott C K,Brian T M,et al.Quantification of deoxynivalenol in wheat using an immunoaffinity column and liquid chromatography[J].J Chromatography A,1999,859:23-28
[14]隋凯,李军,卫锋,等.谷物中脱氧雪腐镰刀菌烯醇的高效液相色谱检测及质谱确证[J].分析化学,2005,33(11):1643-1646
Determination of Vomitoxin in Milk by Highperformance Liquid Chromatography with Immunoaffinity Column
SHAO Zhen-mei
(Shandong Business Institute,Yantai 264670,Shandong,China)
A rapid and effective method was established for the determination of vomitoxin in milk.The samples were precipitated protein with acetonitrile,washing in PBS buffer and acetonitrile as eluent.The elution liquid was dried at 40℃under nitrogen,and detected after redissolved with mobile phase.The separation of target compound was performed on a Waters RP C18chromatographic column(4.6 mm×250 mm,5 μm)using acetonitrile-water(90∶10)as mobile phase,with diode array detector and external standard method peak area quantification.The linear range of vomitoxin was in the range of 0.2 μg/mL-2.0 μg/mL with a correlation coefficient of 0.999 8.The detection limit was 0.12 mg/kg and the quantitative limit was 0.40 mg/kg.The recovery rate was 82.2%-98.5%.
immunoaffinitycolumn;highperformanceliquidchromatography;milk;vomitoxin
10.3969/j.issn.1005-6521.2016.19.040
2016-05-24
邵珍美(1980—),女(汉),讲师,硕士,主要从事粮油食品研究工作。

