壳聚糖纳米磁性微球固定脂肪氧合酶的研究
夏云空 魏炜 杨帆
(1.四川大学生命科学学院 四川成都 610000)
壳聚糖纳米磁性微球固定脂肪氧合酶的研究
夏云空 魏炜 杨帆2
(1.四川大学生命科学学院 四川成都 610000)
实验采用溶胶凝胶法制备了纳米磁性Fe3O4,并用壳聚糖对颗粒2四川大学,生命科学学院,四川成都表面进行了表面修饰得到壳聚糖纳米磁性微球复合载体,再以戊二醛为交联剂将脂肪氧合酶固定在复合载体上,并测定了不同因素对游离酶和固定化酶活性的影响;实验表明,微粒在电镜观察下呈亮黑色球状,直径约为150nm,并具有良好的磁性,固定在载体上酶的含量约为7.6%,游离酶的最适温度为30℃,最适pH8.0,而固定化酶的最适温度为30℃,最适pH9.0,当H2O2浓度为12.0 g/L时,游离酶和固定化酶的活性最强;实验结果表明通过交联的方法成功将脂肪氧合酶固定在了纳米磁性四氧化三铁颗粒上,并表现出了较好的活性。
纳米磁性Fe3O4固定酶 脂肪氧合酶 酶活
酶的固定化过程是指以化学或物理的手段,将酶束缚在一定区域内,限制酶分子在此区域内的催化作用,在应用过程中,固定化酶能够克服游离酶无法回收的缺点,可以提高酶的利用率,减低生产成本。目前用于固定化酶的载体种类很多,磁性物质作为一种绿色材料是近年来研究较多的材料。目前,用于固定化酶的主要载体之一是纳米Fe3O4,其制备方法也有多种,如水热法,溶胶凝胶法和共沉淀法等[6],磁性微球固定化酶的研究成为许多研究者青睐的课题。
脂肪氧合酶是一类较为常见的酶,应用前景广阔,可用于染料、涂料和洗涤剂等工业化生产。然而,脂肪氧合酶的稳定性差、回收困难等缺点限制了其在工业领域的应用,酶的固定化可以显著改善酶的热稳定性,因此,对寻找一种适宜与脂肪氧合酶的固定化载体和方法的研究是一项令人感兴趣的工作。
本研究通过溶胶凝胶法制备纳米磁性Fe3O4,并用壳聚糖对粒子进行了表面修饰得到纳米磁性载体,然后用交联法固定脂肪氧合酶,研究了影响酶活的因素,以期获得一种较好的酶固定化方法,并为固定化脂肪氧合酶的进一步应用奠定基础。

图1 Fe3O4纳米粒子电镜图Fig.1 TEM image of naked Fe3O4nanoparticles

图2 Fe3O4载体及固定化酶的的磁滞回线Fig.2 Magnetic curves of Fe3O4composite carrier and immobilized enzyme
1 材料与方法
1.1 材料及仪器
1.1.1 材料与试剂
实验所用七水合硫酸亚铁、氢氧化钾、硝酸钾、氨水、无水乙醇、亚油酸等都为分析纯,壳聚糖为生化试剂,购自国药集团化学试剂有限公司。
1.1.2 主要仪器设备
电热恒温水浴锅,DK-S28,上海森信仪器有限公司;pH计,PHS-25CW,上海般特仪器制造有限公司;双光束紫外可见分光光度计,TU-1901,北京普析通用仪器有限责任公司。
1.2 方法
1.2.1 纳米磁性载体的制备
向圆底烧瓶中加入180mL浓度为3.0moL/L KNO3溶液和100 mL浓度为1.5moL/L KOH溶液,混匀后将溶液置于90℃的水浴中,在不断搅拌和N2的保护下向溶液中滴加1.0mol/L FeSO4·7H2O溶液100mL;滴加完毕后,停止搅拌并静置4 h,然后用磁铁分离悬浮液,并将得到的黑色物质用去离子水充分洗涤3次。之后,室温下,将2%的乙酸溶液、300mL水、0.15mL Tween-80、1.5 g壳聚糖、12 g硫酸钠、5.5 g纳米Fe3O4加入到500mL三口烧瓶,冰水浴超声10 min后,置于40℃水浴中,并通入N2保护2h,将47g硫酸钠加入到100 mL40℃水中,快速滴加入三口烧瓶中沉降4h后,磁铁分离壳聚糖包裹纳米Fe3O4,保存备用。
1.2.2 脂肪氧合酶的固定化
大豆经粉碎去皮并以石油醚浸提得到脱脂大豆粉后,取一定质量脱脂大豆粉,加水(固液比为1:5(w/v))搅拌1 h后,在4000r/min条件下,离心20min,取上清液即为粗酶液;将1.5g纳米磁性载体和50 mL粗酶液加入到烧瓶中,超声使其分散后,加入1.0 g戊二醛(占体系总量2%),常温搅拌2 h后,磁铁分离洗涤后获得固定化脂肪氧合酶微粒,然后密封冷藏保存备用。
1.2.3 底物溶液配制及酶活测定
酶活测定方法遵循有关文献的基本步骤进行。
1.2.4 酶活影响因素的测定
pH值影响:将粗酶液(或固定化酶)加入到不同pH的反应体系中,恒温反应后,进行酶活测定;温度的影响:将粗酶液(或固定化酶)置于不同温度的水浴环境中反应后,进行酶活测定;双氧水浓度的影响:将粗酶液(或固定化酶)加入含有一定浓度的双氧水反应体系中,恒温反应后进行酶活测定。
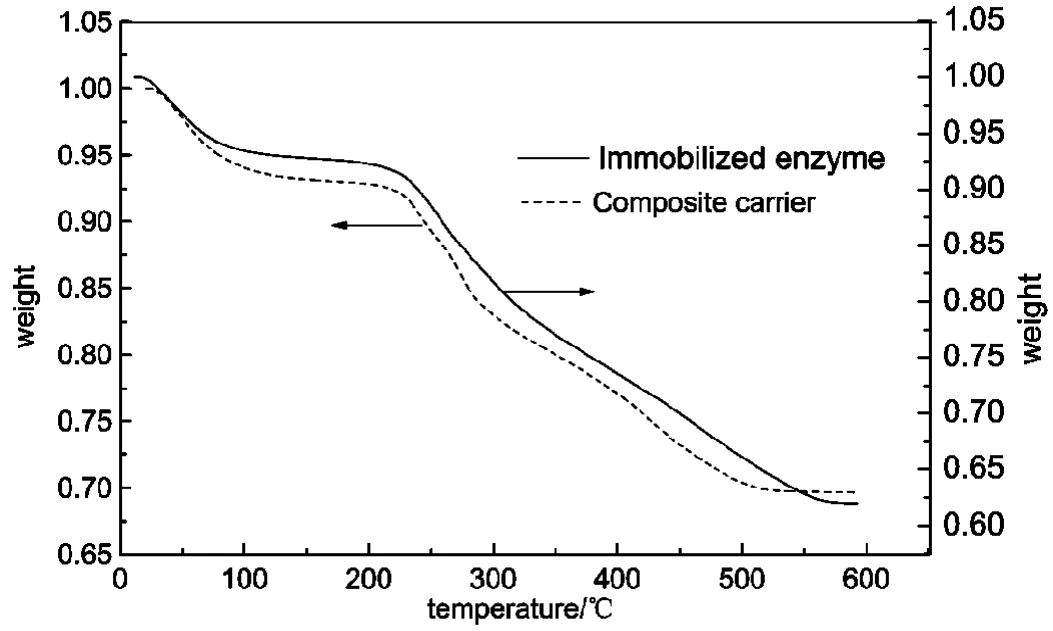
图3 固定化酶的热失重分析Fig.3 TGA of immobilized enzyme

图4 pH对游离酶和固定化酶的活性影响Fig.4 Effect of pH on free and immobilized enzyme activity
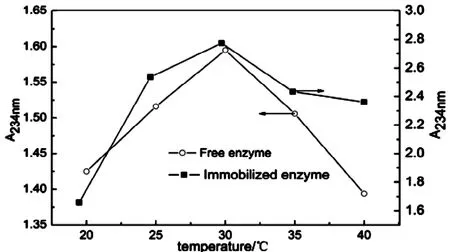
图5 温度对游离酶和固定化酶的活性影响Fig.5 Effect of temperature on free and immobilized enzyme activity

图6 H2O2浓度对游离酶和固定化酶的活性影响Fig.6 Effect of H2O2concentration on free and immobilized enzyme activity
2 结果与分析
2.1 纳米Fe3O4形貌分析
用于固定化酶的材料以及性质对酶活和酶的应用具有非常重要的意义,好的固定化酶材料可以减少传质传热的影响,提高酶的催化效率。实验制备的纳米Fe3O4形貌如图1所示。从图中可以看出,所制备的纳米Fe3O4为亮黑色球状粒子,平均直径约为150nm,粒子呈现出一定的团聚现象,这可能是由于粒子的磁性较强,且粒子的粒径在纳米范围,具有很大的比表面积而拥有很高的表面自由能,因此需要团聚以降低降低表面自由能从而使体系趋于稳定。
2.2 纳米磁性颗粒的磁性能表征
Fe3O4载体及固定化酶的磁滞回线分别通过振动样品磁强计测定得到,如图2所示。Fe3O4载体的饱和磁强度为61.2 emu/g,固定化酶的饱和磁强度为53.4emu/g。固定化酶的饱和强度和Fe3O4载体相比有所下降,这是由于饱和磁强度与物质的含量有关,随着酶的固定化,Fe3O4的含量相对减少,从而使其饱和磁强度有所下降;另一方面,固定在在Fe3O4载体表面的酶等物质,也阻碍了磁场对粒子的取向作用而导致了其饱和磁强度的下降。
2.3 热失重分析
固定化酶的热失重分析如图3所示。由图可以看出,温度在0-200℃时,磁性载体和固定化酶的曲线都有所下降,表示这两种样品都有失重,其值分别大约为7.2%和7.4%,这部分失重是由载体上的水分和可挥发物损失造成的,随着加热温度的进一步升高,曲线进一步下降,表示载体上的包裹物和固定上去的酶逐渐被烧掉,两种样品在这一阶段的失重分别为22.8%和30.6%,当温度达到600℃左右时,曲线逐渐趋向水平,表示剩下不能被烧掉的Fe3O4,由此可以计算出,载体上固定的脂肪氧合酶的量约为固定化酶样品质量的7.6%。
2.4 pH对酶活性能的影响
pH值通过影响酶分子活部位上的有关基团而对酶活产生影响,从而进一步对酶与底物的结合与催化产生影响。如图4所示,固定化酶的最适pH为9.0,游离酶的最适pH为8.0,脂肪氧合酶经固定化后,其最适pH值向碱性方向发生了移动,出现这种现象的原因可能是纳米磁性微粒作为一种复合的碱性氧化物,对酸的耐受性较差,需要在更的碱性环境下对酶的活性中心构想产生一定影响。
2.5 温度对酶活性能的影响
温度对酶活的影响由图5所示,由图可知温度对酶活影响较大,游离酶和固定化酶的最适温度为都为30℃。从图中可以看到,固定化酶的酶活变化比游离酶要平缓,说明载体对酶有一定的保护作用,降低了其对温度的敏感性,而且固定化酶在25℃-35℃内都保持了较
高的活力,扩大温度应用范围,这可能是因为交联后酶活中心部分活化降低了反应所需的活化能所致,因此将脂肪氧合酶固定化有利于降低酶对温度的要求而有利于其进一步应用。
2.6 双氧水对酶活性能的影响
过氧化物对脂肪氧合酶的活性可以起到诱发的作用,在反应液中添加适量的过氧化物有利于脂肪氧合酶活性的提高。因此,实验测定了H2O2对脂肪氧合酶活性的影响,结果如图6所示。由图可以看出,当H2O2的浓度达到12g/L时,游离酶和固定化酶的活性达到了最大,而且游离酶和固定化酶的活性都随着H2O2浓度的增加而增加,酶的活性达到最高后,H2O2浓度继续增加时,酶的活性反而开始下降,出现这种现象是原因可能是,反应液中过多的H2O2会改变酶的结构而抑制了酶的活性。
3 结论
实验采用溶胶凝胶法制备了纳米磁性四氧化三铁,然后用壳聚糖对纳米颗粒表面进行了修饰得到了复合载体,再以戊二醛为交联剂,将脂肪氧合酶固定了在复合载体上;合成的纳米磁性四氧化三铁呈亮黑色球状粒子,酶固定化载体仍表现出较好磁性,载体上酶的含量占载体质量的7.6%;当温度为30℃、pH8.0、H2O2浓度达到12.0g/L时,游离酶的酶活达到最大;当温度30℃、pH9.0、H2O2浓度达到12.0g/L时,固定化酶的酶活达到最大;实验结果表明通过交联的方法成功将脂肪氧合酶固定在了纳米磁性四氧化三铁颗粒上,并表现出了较好的活性。
[1]蒋珍菊,朱亮,林国秀,等.交联壳聚糖固定α-淀粉酶的研究[J].西华大学学报(自然科学版),2008,27(4):88-90.
[2]程仕伟,梁会会,崔海洋.交联纤维素酶聚集体制备及其催化特性研究[J].西华大学学报(自然科学版),2012,31(2):81-84.
[3]季俊红,季生福,杨伟,李成岳.磁性Fe3O4纳米晶制备及应用[J].化学进展,2010,22(8):1566-1574.
[4]张媛媛,张晖,王立,等.磁性壳聚糖微球固定化米糠内源酶的研究[J].食品与机械, 2013, 29(3):51-54.
[5]宋艳艳,孔维宝,宋昊,等.磁性壳聚糖微球的制备及其用于甲酸脱氢酶的固定化[J].工业催化, 2012, 20(8):20-25.
[6]Gardner H W. Recent investigations into the lipoxygenase pathway of plants[J]. Biochimica et Biophysica Acta, 1991,1084(3):221-239.
[7]钟芳,王璋,许时婴.3种脂肪氧合酶酶活测定方法[J].无锡轻工大学学报,2001,20(1):77-80.
[8]李丹丹,江连洲,李杨,等.磁性壳聚糖微球固定化碱性蛋白酶的酶学性质[J].食品科学,2012,33(21):249-252.
Immobilization of Lipoxygenase onto Chitosan Nanometer Magnetic Microspheres
Nanometer Fe3O4was prepared by sol-gel method and modified with chitosan to obtained composite carriers of magnetic microspheres. Lipoxygenase was immobilized onto the composite carriers by glutaraldehyde. The influence factors on enzyme activity for free and immobilized enzyme were studied. The TEM results showed that the nanoparticles were black and the shape of sphere. The diameters of the nanoparticles were about 150 nm. The mass of enzyme immobilized on the composite carriers was about 7.6% of the immobilized enzyme mass. The optimum temperature and pH of free enzyme were 30℃and 8.0 while the parameters of immobilized enzyme were 30℃ and 9.0. The free and immobilized enzyme exhibited the highest enzyme activity when H2O2concentration reached 12.0 g/L. The results indicated that the lipoxygenase was successfully immobilized onto the nanoparticles and showed higher activity.
nanometer magnetic Fe3O4, immobilized enzyme, lipoxygenase, enzyme activity
Q5
A
1674-2060(2016)02-0003-03
夏云空(1982—),男,汉族,河北邯郸人。现从事于血液制品行业,就职于成都蓉生药业有限责任公司,具有9年的生产工作经验,同时为四川大学生命科学学院2012级在职研究生。

