昆虫共生真菌Fusariumoxysporum BM2的代谢产物及其抗肝癌活性研究
杨新洲,吕静南,郝 吉,黄 密,徐 婵,林亲雄
(中南民族大学 药学院,武汉 430074)
昆虫共生真菌FusariumoxysporumBM2的代谢产物及其抗肝癌活性研究
杨新洲,吕静南,郝吉,黄密,徐婵,林亲雄*
(中南民族大学 药学院,武汉 430074)
从斑蝥(Lyttavesicatoria)体内分离得一株具有显著抗肝癌活性的真菌菌株,通过菌株形态与18S rDNA序列分析,鉴定为尖孢镰刀菌(Fusariumoxysporum,BM2). 运用中压柱色谱和制备高效制备液相方法对BM2发酵液提取物乙酸乙酯部位的化学成分进行了分离纯化,利用现代波谱技术鉴定所分离化合物的结构,并采用MTT法对所得到的化合物进行了体外抗肝癌活性测试.结果表明:从发酵液提取物乙酸乙酯部位中分离得到的6个单体化合物,分别鉴定为麦角甾醇(1)、cyclo(R-Pro-S-Phe)(2)、(R)-2-羟基-3-苯基丙酸甲酯(3),4-氧代-乙酰丙酸(4),N-(4-氧代戊基)-乙酰胺(5),(R)-2-羟基-3-(4′-羟基苯基)丙酸甲酯(6). 化合物2对2个肝癌细胞株HepG2和SMMC-7721均有抑制作用,其IC50值分别为44.1和47.6 μg/mL.
斑蝥;内生真菌;化学成分;抗肝癌活性
昆虫的生物多样性非常丰富,目前已报道的昆虫有100多万种,是植物种类的3倍;并且其分布极广,地球上的各个角落几乎都有它们的足迹[1].共生真菌广泛分布于昆虫体内,几乎所有的昆虫都有共生真菌[2]. 昆虫共生菌同时也是重要的活性次生代谢产物的源泉,与昆虫种类研究相比,目前对昆虫共生菌研究偏少,对其代谢产物研究更少[3]. 共生菌的生物多样性并非单一因素所决定,而与宿主的生物多样性有关,这就决定了其天然代谢产物的多样性[4]. 目前从共生菌代谢产物中分离得到的活性成分多为抗肿瘤活性成分,其次为抗菌活性成分,此外还有免疫抑制活性,杀虫、抗氧化活性[3],以及促植物种子萌发等活性[5]. 因此,昆虫内生真菌被认为是可产生活性次生代谢产物和寻找新颖生物活性物质的重要来源.
本研究小组在研究共生菌的活性次生代谢产物的过程中,从斑蝥成虫体内分离到的一株内生真菌,经鉴定为尖孢镰刀菌(Fusariumoxysporum,BM2). 对其发酵液提取物的乙酸乙酯部位化学成分进行了系统的分离和纯化,得到6个单体化合物(见图1),分别为麦角甾醇(1)、cyclo(R-Pro-S-Phe)(2)、(R)-2-羟基-3-苯基丙酸甲酯(3),4-氧代-乙酰丙酸(4),N-(4-氧代戊基)-乙酰胺(5),(R)-2-羟基-3-(4′-羟基苯基)丙酸甲酯(6).采用MTT法对化合物1~6进行体外细胞毒活性测试,结果显示化合物2对2个肝癌细胞株HepG2和SMMC-7721有一定的抑制作用,它的IC50值分别为44.1和47.6 μg/mL.
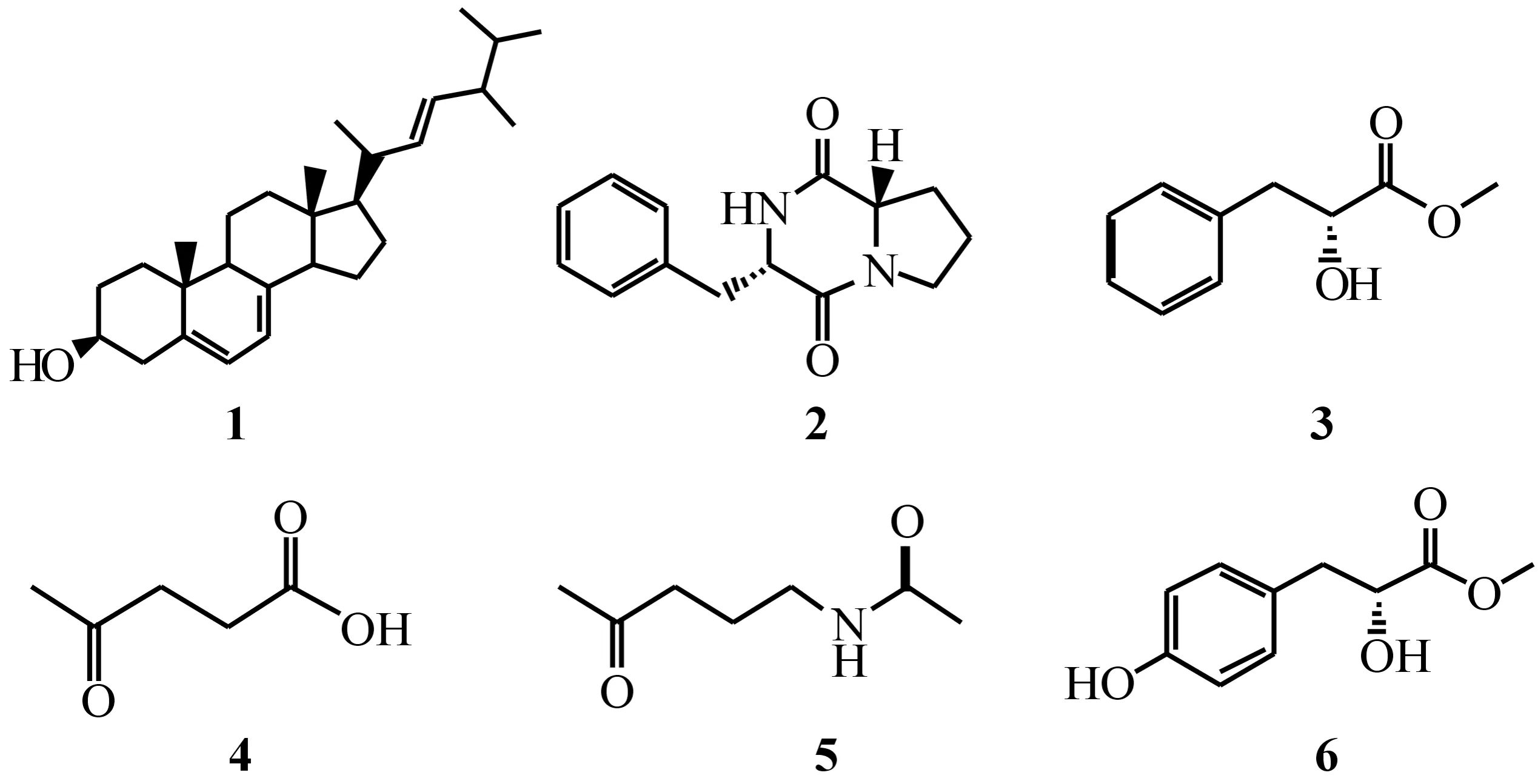
图1 化合物1~6的化学结构Fig.1 Chemical structures of compounds 1-6
1 材料与方法
1.1材料与仪器
肝癌细胞株HepG2和SMMC-7721(American Type Culture Collection,Rockville,MD,USA),RPMI1640培养基(GibcoInc,美国),胎牛血清(四季青公司,杭州),吖啶橙、溴化乙啶(Sigma,美国),薄层色谱硅胶和柱色谱硅胶(青岛海洋化工厂),HPLC级甲醇和乙腈(Merck). 引物合成,PCR扩增产物的纯化和测序(上海生工).
显微熔点仪(Kofler HB型,温度未校正),紫外光谱仪(Shimadzu UV-250型),质谱仪(Finnigan MAT-95型),质谱仪(Q-TOF Micro LC-MS),核磁共振仪(Bruker DRX-500 MHz),中压色谱制备系统(HP P050,Alga公司),半制备制备型高效液相(Waters 2535,2998二极管阵列检测器,2707自动进样器),Sunfire C18半制备柱(Waters,250 mm×19 mm,5 μm),活性测试用显微镜(B202型,Olympus),酶标仪(Spectra Max 340PC型,Molecular Devices),旋转蒸发器(RV10型,IKA公司),PCR仪(C1000 touch,Bio-Rad公司),凝胶成像系统(ChemiDoc XRS型,Bio-Rad公司).
1.2昆虫材料收集与共生真菌的分离纯化
斑蝥于2013年8月捕捉于武汉市马鞍山森林公园,经湖北省林业科学研究院陈京元研究员鉴定为斑蝥(Lyttavesicatoria). 将无菌处理后的昆虫组织块移接在含100 mg/L氨苄青霉素和链霉素的PDA平板上,28℃培养4 d,待菌丝长出后将菌丝顶端移接到PDA培养基上,连续重复纯化3次[6]. 同时将表面消毒处理过的材料不做剪切直接植于PDA平板上作为对照检查表面消毒是否彻底,确保分离得到的菌是为斑蝥的内生真菌,编号为BM2,菌种保存于中南民族大学药学院微生物菌种库.
1.3内生真菌BM2的菌种鉴定
菌体的培养与制备:将BM2菌株在PDA培养基上培养5 d,从菌落边缘挑取适量的菌丝,转接于装有150 mL马铃薯蔗糖液体培养基的三角瓶中,28℃震荡(130 r/min)培养7 d.待菌丝长到适量时,过滤发酵液得到菌丝团,用体积分数25%乙醇漂洗3~4 min,再用灭菌的去离子水冲洗2次,离心去除上清液,冷冻干燥后,低温保存备用.
菌落形态(见图2):菌落在 28℃的PDA 培养基上培养4 d,菌落初期白色,逐渐生长为粉红色,但菌落边缘仍然为白色.小型分生孢子串生,呈披针形;大型分生孢子呈镰刀形,两端较尖,多隔.这些特征与镰刀菌属真菌特征相似[7],因此将BM2菌株初步鉴定为镰刀菌属真菌.

图2 BM2菌落形态特征Fig.2 Morphological characteristics of strain BM2
NS1/NS6 的DNA序列的测定:BM2菌株总DNA的提取方法参照参照文献[8]进行,提取总DNA经琼脂糖电泳检测合格后进行目的片段的PCR 扩增与测序.NS1:5′-GTAGTCATATGCTTGTCTC-3′,NS6:5′-GCATCACAGACCTGTTATTGCCTC-3′.PCR反应体系总体积50 μL,包括2 μL的2.5 mM dNTP,0.4 μL的5U/μL Taq酶,25 mM MgCl2,5μL的10×PCR Buffer,25 μmol/L的NS1和NS6各1 μL,10 ng的DNA模板,补足去离子水使总体积达到50 μL,进行PCR扩增.
BM2菌株的18S rDNA序列为:

将该序列利用BLAST 软件(http://www.ncbi.nlm.nih.gov/blast/Blast.cgi)在GenBank数据库中的序列进行比对分析,获得最相近菌株的18S rDNA序列,用Clustalx1.8按照最大同源性的原则进行排序,采用Kimura2计算核苷酸差异值,利用Mega6.0软件Neighbor-joining构建系统进化树.经过18S rDNA序列比对分析,BM2的18S rDNA 序列与FusariumoxysporumKR611565的同源性高达98%(见图3),根据菌落形态与18S rDNA序列的分析结果,可初步判定菌株BM2为尖孢镰刀菌(Fusariumoxysporum).

图3 基于18S rDNA基因片段序列构建的系统发育树Fig.3 Phylogenetic tree based on 18S rDNA gene segment sequences
1.4菌种的发酵及代谢产物的提取分离
将得到的共生菌BM2接种至PDA培养基中,28℃恒温箱中培养4 d.挑取边缘菌丝琼脂块接种至装有150 mL马铃薯蔗糖液体培养基的锥形瓶中,28℃恒温摇床(130 r/min)培养3 d,作为种子液.向每个装有150 mL马铃薯蔗糖液体培养基500 mL锥形瓶巾接种上述种子液20 mL,28℃恒温摇床(130 r/min)培养10 d.将发酵液用纱布过滤,滤液用等体积乙酸乙酯萃取3次,得浸膏10 g.浸膏采取中压硅胶柱层析(200~300目)进行分离后,依次以石油醚-两酮(体积比100∶1~ 0∶100)梯度洗脱得到8个组分(Fr.1~Fr.8).Fr.3(3 g)采用中压硅胶柱层析(200~300目)进行分离,采用二氯甲烷-甲醇(体积比80∶1~ 40∶1)梯度洗脱,TLC检测合并相应的洗脱液,减压回收得4个组分Fr.3.1~Fr.3.4.600 mg的Fr.3.2采用制备性薄层层析法以混合展开剂[φ(二氯甲烷∶甲醇∶甲酸)=100∶2∶0.1]展开分离得到纯的化合物1(150.0 mg)和2(8.0 mg);500 mg的Fr.3.4经反相半制备柱Sunfire C18以水-甲醇(体积比90.0∶1~0∶100)梯度洗脱30 min得化合物3(7.0 mg);Fr.5(1g)经Sephadex LH-20(甲醇)洗脱,再经制备性薄层层析法以混合展开剂[φ(二氯甲烷∶甲醇∶甲酸)=100∶2∶0.1]展开分离得到纯的化合物4(7.2 mg)和5(11.5 mg);Fr.8(1.5 g)经Sephadex LH-20(甲醇)洗脱,再经反向半制备柱Sunfire C18以水-甲醇(体积比90∶1~ 0∶100)梯度洗脱30 min得化合物6(13.0 mg).
1.5单体化合物的抗肝癌活性测定
[9,10],将HepG2、SMMC-7721两种细胞株接种于DMEM培养基(含10%胎牛血清),在37℃、5% CO2培养箱中培养,每2~3d传代1次.将BM2乙酸乙酯部位分离得到的6种单体化合物,分别溶于20 μL的DMSO中,配成母液浓度为400 mg/mL的样品,用0.22 μm无菌滤膜过滤除菌,精密吸取适量样本母液和不含血清的培养基稀释到所需给药浓度.取对数生长期HepG2、SMMC-7721两种细胞株,制备单细胞悬液,调节细胞浓度为5×104个/mL,每孔100 μL接种至96孔培养板,培养24 h后,吸取培养基,每孔分别添加无小牛血清DMEM培养基配制成的待测样品0.2 mL,使各给药化合物终浓度为预设给药浓度,每个浓度设3复孔,同时设不加样品的和不加样品和细胞的空白对照,继续培养48 h后,分别加入5 mg/mL的MTT 20 mL继续培养4 h后,吸去培养液,每孔加入150 μL DMSO充分溶解结晶.于570 nm下测定每孔吸光度,计算各样品对肝癌细胞的生长抑制率和半数抑制浓度(IC50).
2 结果与分析
2.1结构鉴定
化合物1:无色针状结晶(CH3OH);ESIMSm/z:397[M+H]+;1H NMR(CDCl3,500MHz)δH:5.57(1H,dd,J=5.8,2.5 Hz,H-6),5.38(1H,dt,J=5.6,2.7 Hz,H-7),5.20(2H,m,H-22,23),3.63(1H,m,H-3),1.03(3H,d,J=6.7 Hz,H-21),0.94(3H,s,H-19),0.92(3H,d,J=7.0 Hz,H-28),0.84(6H,d,J=6.4 Hz,H-26,27),0.63(3H,s,H-18);13C NMR(CDCl3,125MHz)δC:38.3(C-1),32.0(C-2),70.5(C-3),40.8(C-4),139.8(C-5),119.6(C-6),116.3(C-7),141.4(C-8),46.3(C-9),37.0(C-10),21.1(C-11),39.0(C-12),54.6(C-14),23.0(C-15),28.3(C-16),55.7(C-17),12.0(C-18),16.3(C-19),40.4(C-20),135.6(C-22),132.0(C-23),42.8(C-24),33.1(C-25),19.7(C-26),120.0(C-27),7.6(C-28).其波谱数据与文献报道的化合物一致[11],故鉴定化合物1为麦角甾醇(ergosterol).
化合物2:无色针状结晶(CH3OH),[α]D25+62.8(0.1,MeOH);m.p.130~132℃;ESIMSm/z:245[M+H]+;1H NMR(CD3OD,500 MHz)δH:7.32(2H,m,ArH-3′,5′),7.31(1H,m,ArH-4′),7.19(2H,m,ArH-2′,6′),4.21(1H,m,H-9),3.54(1H,m,H-3),3.29~3.39(1H,m,H-3),3.20(1H,dd,J=13.7,4.9 Hz,H-10),3.00(1H,dd,J=13.7,4.7 Hz,H-10),2.50~2.75(1H,m,H-6),1.65~2.05(1H,m,H-5),1.65~1.91(1H,m,H-4);13C NMR(CD3OD,125 MHz)δC:166.0(C-1),44.7(C-3),21.1(C-4),28.4(C-5),57.7(C-6),169.9(C-7),58.4(C-9),39.6(C-10),135.3(C-1′),129.9(C-2′,6′),128.2(C-3′,5′),127.1(C-4′).其波谱数据与文献报道的化合物一致[12],故鉴定化合物2为cyclo(R-Pro-S-Phe).
化合物3:无色油状物(CH3OH);ESIMSm/z:203 [M+Na]+,181[M+H]+;1H NMR(CD3OD,500MHz)δH:7.28(2H,m,ArH-3′,5′),7.23(H,m,ArH-4),7.20(2H,m,ArH-2′,6′),4.36(1H,dd,J=7.8,4.9 Hz,H-2),3.68(3H,s,1-OCH3),3.05(1H,dd,J=13.8,4.9 Hz,H-3α),2.91(1H,dd,J=13.8,7.8 Hz,H-3β);13C NMR(CD3OD,125MHz)δC:174.5(C-1),71.7(C-2),40.2(C-3),137.1(C-1′),127.9(C-2′),129.1(C-3′),126.2(C-4′),129.1(C-5′),127.9(C-6′),50.9(1-OCH3). 其波谱数据与文献报道的化合物一致[13],故鉴定化合物3为(R)-2-羟基-3-苯基丙酸甲酯[methyl(R)-2-hydroxy-3-phenyl-propionate].
化合物4:无色油状物;ESIMSm/z:117[M+H]+;1H NMR(CDCl3,500MHz)δH:2.76(2H,t,J=6.4 Hz,H-3),2.53(2H,t,J=6.4 Hz,H-2),2.20(3H,s,CH3);13C NMR(CDCl3,125 MHz)δC:175.1(C-1),27.4(C-2),37.4(C-3),208.4(C-4),29.7(C-5).其波谱数据与文献报道的化合物一致[14],故鉴定化合物4为4-氧代-乙酰丙酸(4-oxopentanoic acid).
化合物5:红色固体;ESIMSm/z:144[M+H]+;1H NMR(CD3OD,500MHz)δH:3.14(2H,t,J=7.0 Hz,H-4),2.52(2H,t,J=7.2 Hz,H-6),2.13(3H,d,J=3.2 Hz,H-8),1.92(3H,d,J=3.3 Hz,H-1),1.72(2H,t,J=7.1 Hz,H-5);13C NMR(CDCl3,125 MHz)δC:21.1(C-1),172.0(C-2),38.3(C-4),23.1(C-5),39.9(C-6),209.6(C-7),28.4(C-8). 其波谱数据与文献报道的化合物一致[15],故鉴定化合物5为N-(4-氧代戊基)-乙酰胺[N-(4-oxopentyl)-acetamide].
化合物6:无色油状物(CH3OH);ESIMSm/z:197[M+H]+;1H NMR(CD3OD,500MHz)δH:6.99(2H,m,ArH-3′,5′),6.63(2H,m,ArH-2′,6′),5.46(1H,m,4-ArOH),4.14(1H,dt,J=7.7,5.5 Hz,H-2),3.57(3H,s,1-OCH3),2.87(1H,m,H-3α),2.66(1H,m,H-3β);13C NMR(CD3OD,125 MHz)δC: 176.6(C-1),73.3(C-2),41.5(C-3),129.8(C-1′),132.5(C-2′),117.3(C-3′),156.2(C-4′),117.3(C-5′),132.5(C-6′),54.4(1-OCH3). 其波谱数据与文献报道的化合物一致[16],故鉴定化合物6为(R)-2-羟基-3-(4′-羟基苯基)丙酸甲酯[methyl(R)-2-hydroxy-3-(4′-hydroxyphenyl)propanoate].
2.2细胞毒活性结果
采用MTT法,检测6种化合物对HepG2细胞体外抗肿瘤活性,结果见图4. 图4a显示化合物2在50~200 μg/mL的浓度范围内,对HepG2细胞显示一定的抗肿瘤活性,具有明显的量效关系,而其他化合物则并无明显抑制活性. 图4b显示化合物2对不同肝细胞的抑制活性及对正常细胞的影响,发现化合物2对两种不同肝癌细胞均具有一定活性,在给药浓度达到200 μg/mL时候对正常肝细胞并无影响,说明其对正常肝细胞无明显毒性.

a) 6个化合物对HepG2的体外抑制活性;b) 化合物2对不同肝细胞的体外抑制活性图4 化合物对不同细胞的体外抑制活性Fig.4 Antiproliferative activity of compounds against different cell lines in vitro
采用MTT法分别检测化合物2对HepG2和SMMC-7721的抑制率,结果见图5,设置不同剂量浓度分别给药,检测化合物在不同浓度下对细胞的抑制率,通过计算得出IC50值,得出化合物2对HepG2和SMMC-7721的IC50值分别为44.1和47.62 μg/mL.
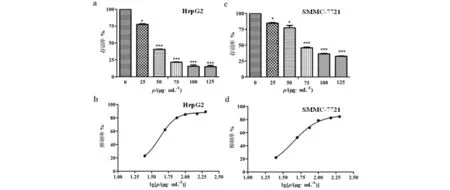
a,b) 化合物2不同给药浓度对HepG2和SMMC-7721细胞株存活率的影响;c,d) 化合物2对HepG2和SMMC-7721细胞株抑制活性量效曲线图5 化合物2对HepG2和SMMC-7721细胞株存活率的影响和抑制活性量效曲线.Fig.5 Effects of compound 2 of cell survival rate on HepG2 and SMMC-7721 and dose-effect curves of its inhibitory activity
3 结语
从斑蝥共生真菌BM2乙酸乙酯提取物中分离得到6个化合物,分别鉴定为麦角甾醇(1)、cyclo(R-Pro-S-Phe)(2)、(R)-2-羟基-3-苯基丙酸甲酯(3),4-氧代-乙酰丙酸(4),N-(4-氧代戊基)-乙酰胺(5),(R)-2-羟基-3-(4′-羟基苯基)丙酸甲酯(6).其中化合物2对HepG2和SMMC-7721两个细胞株显示出一定的细胞毒活性,其抗肝癌IC50值分别为44.1和47.6 μg/mL,而在200 μg/mL的浓度下对对正常肝细胞LO-2未显示出明显的毒性.本文对斑蝥共生菌BM2代谢产物的分离纯化及抗肝癌活性研究将为进一步发掘斑蝥共生真菌代谢产物的药用价值奠定一定的基础.
参考文献
[1]黄大卫.新世纪的中国昆虫系统学[J].昆虫学报,2003,46(1): 90-95.
[2]郑燕丽,邹坤,徐帮,等.昆虫内生真菌Peniciliumoxalicum次级代谢产物的研究[J].华中师范大学学报(自然科学版),2014,48(5):689-692.
[3]戈惠明,谭仁祥.共生菌: 新活性天然产物的重要来源[J].化学进展,2009,21(1):30-46.
[4]杨颖,陈华红,徐丽华.植物内生放线菌多样性研究[J].云南大学学报(自然科学版),2008,30(S1): 403-405.
[5]宋发军,于鹏飞,刘佳,等.促进种子萌发的重楼内生菌的筛选[J].中南民族大学学报(自然科学版), 2015, 34(3): 29-32.
[6]姜国银,杨本寿,虞泓.两种植物内生菌分离的影响因素研究[J].云南大学学报(自然科学版),2011,33(5):610-614.
[7]Booth C.镰孢菌属[M].陈其煐,译.北京:农业出版社,1988.
[8]Guo L D,Hyde K D,Liew E C Y. Detection andtaxono-
micplacement of endophyticfungi within frond tissues ofLivistonachinensisbased on rDNA sequences [J]. Mol Phylogenet Evol, 2001, 20(1): 1-13.
[9]Song P, Yang X Z, Yuan J Q. Cytotoxic constituents fromPsoraleacorylifolia[J]. J Asian Nat Prod Res, 2013, 15(6): 624-630.
[10]Song P, Wang Q, Lv J N, et al. HPLC-based activity profiling of anti-hepatocellular carcinoma constituents from the tibetan medicine,Caraganatibetica[J]. J Huazhong Univ Sci Technolog Med Sci, 2015, 35(3): 450-455.
[11]陈艳梅,杨银河,赵沛基,等.蛇足石杉内生真菌Neofusicoccumsp. F483的化学成份研究[J].广西植物,2015,35(4): 574-579.
[12]Wang G G, Dai S K, Chen M J, et al. Two diketopipe-
razinecyclo(pro-phe)isomers from marine bacteriaBacillussubtilissp.13-2 [J]. Chem Nat Compd, 2010, 46(4): 583-585.
[13]Ley S V, Diez E, Dixon D J, et al. Preparation of enantiopure butane-2,3-diacetals of glycolic acid and alkylation reactions leading to a-hydroxyacid and amide derivatives [J]. Cheminform, 2005, 36(15): 3608-3617.
[14]Paju A, Kanger T, Pehk T, et al. Asymmetric oxidation of 3-alkyl-1,2-cyclopentanediones. Part 2: Oxidative ring cleavage of 3-alkyl-1,2-cyclopentanediones:synthesis of 2-alkyl-g-lactone acids [J]. Tetrahedron: Asymmetry, 2003, 14(11): 1565-1573.
[15]Nenajdenko V G, Zakurdaev E P, Prusov E V, et al. Convenient synthesis of melatonin analogues: 2-and 3-substituted-N-acetylindolylalkylamines [J].Cheminform,2005,36(14):11719-11724.
[16]Uchida R, Shiomi K, Inokoshi J, et al. Kurasoins A and B, new protein farnesyltransferase inhibitors produced byPaecilomycessp. FO-3684.I. Producing strain, fermentation, isolation, and biological activities [J]. J Antibiot, 1996, 49(9): 932-934.
Study on Metabolites and Their Anti-Hepatoma Activity from Insect Derived Endophytic FungusFusariumoxysporum(BM2)
YangXinzhou,LüJingnan,HaoJi,HuangMi,XuChan,LinQinxiong
(College of Pharmacy, South-Central University for Nationalities, Wuhan 430074)
In this study, an endophytic fungus with appreciable anti-hepatomacarcinoma activity was isolated fromLyttavesicatoriaand determined asFusariumoxysporum(BM2), based on the fungus′s morphology and 18S rDNA sequence analysis. The isolation and purification of the ethyl acetate extract of BM2 fermentation was performed with medium-pressure column chromatography and preparative HPLC. The structures of the separated compounds were identified by modern spectroscopic techniques.Invitroanti-hepatomacarcinoma activity of the compounds was also evaluated using MTT method. Six pure compounds were obtained and their structures were elucidated as ergosterol (1), cyclo(R-Pro-S-Phe) (2), methyl(R)-2-hydroxy-3-phenyl-propionate (3), 4-oxopentanoic acid (4),N-(4-oxopentyl)-acetamide (5), and methyl(R)-2-hydroxy-3-(4′-hydroxyphenyl)propanoate (6) based on detailed spectral analysis. Compound 2 exhibited cytotoxic activity against HepG2 and SMMC-7721cell lines, with an IC50value of 44.1 and 47.6 μg/mL, respectively.
Lyttavesicatoria; Endophytic fungi; chemical constituents; anti-hepatomacarcinoma activity
2016-01-18*通讯作者林亲雄,研究方向:微生物药学,E-mail:linqinxiong@mail.scuec.edu.cn
杨新洲(1977-) ,男,副教授,博士,研究方向:天然药物化学,E-mail:yxzyxz01@163.com
国家自然科学基金资助项目(81573561); 中央高校基本科研业务费专项资金项目(GZY11073)
R284.1
A
1672-4321(2016)03-0042-06

