分子印迹固相萃取联用高效液相色谱分离测定海水中的膝沟藻毒素GTX1,4
梅晓颀 何秀平 王江涛
(中国海洋大学海洋化学理论与工程技术教育部重点实验室,青岛 266100)
分子印迹固相萃取联用高效液相色谱分离测定海水中的膝沟藻毒素GTX1,4
梅晓颀 何秀平 王江涛*
(中国海洋大学海洋化学理论与工程技术教育部重点实验室,青岛 266100)
采用分子印迹技术,以鸟嘌呤核苷为虚拟模板,本体聚合,合成GTX1,4的分子印迹聚合物(MIP)。傅里叶红外变换光谱(FT-IR)和扫描电子显微镜(SEM)的结果显示,MIP具有分布均匀、大小均一的孔穴。平衡吸附实验表明,分子印迹聚合物(MIP)比非分子印迹聚合物(NIP)具有更高的结合容量,对膝沟藻毒素GTX1,4有更好的选择性。用MIP填充固相萃取小柱(MISPE),以0.1 mol/L乙酸溶液为淋洗液,甲醇-水(95∶5,V/V)溶液为洗脱液时回收率最高,达到85.0%。用优化后的淋洗洗脱条件测定微小亚历山大藻和塔玛亚历山大藻藻液中的GTX1,4,分别为1.10和0.99 μg/L,RSD分别为3.3%和4.4%,说明本方法具有较好的检测限和较高的测定精密度。
膝沟藻毒素GTX1,4;分子印迹固相萃取;分离富集;微小亚历山大藻;塔玛亚历山大藻
1 引言
麻痹性贝毒(Paralytic shellfish poisoning,PSP)是一类以石房蛤毒素(Saxitoxin,STX)为骨架,具有四氢嘌呤结构的生物碱分子。根据取代基的不同,可将其分为四类化合物[1]:氨基甲酸酯类毒素(Carbamate toxins)、N-磺酰胺甲酰基类毒素(N-Sulfocarbamoyl toxins)、脱氨甲酰基类毒素(Decarbamoyl toxins)以及脱氧脱氨甲酰基类毒素(Deoxydecarbamoyl toxins)。膝沟藻毒素1,4(GTX1,4)就是一类氨基甲酸酯类毒素,是赤潮发生时海水中存在的主要藻毒素之一,其产毒藻种主要有亚历山大藻属(Alexandrium)的A.tamarense、A.minutum,膝沟藻属(Gonyaulax)的G.tamarensis,裸甲藻属(Gymnodinium)的G.catenatum,以及旋沟藻属(Prodinium)的P.bahamense var.compressum等属种[2~5]。同时,由于PSP在贝类中大量富集,人类误食后易中毒,其毒性机理是:PSP的活性部位与神经细胞膜上Na+通道位点1的氨基酸残基高度结合,阻断了Na+通道,从而产生麻痹作用[6,7],使人头疼、头晕,呼吸困难,甚至死亡[8],因此研究一种快速高效测定PSP的方法非常重要。
目前,检测PSP的方法主要有生物检测法和色谱法等,其中色谱法是现在最普遍的方法。生物检测法包括小鼠生物测试法(Mouse bioassay,MBA)[9,10]和酶联免疫法(Enzyme linked immunosorbent assay,ELISA)[11,12];色谱分析法主要是高效液相色谱-质谱联用法(HPLC-MS)[13],包括柱前衍生[14]和柱后衍生[15]。虽然HPLC-MS具有高选择性和灵敏度、检测限低等优点,但存在费时、成本高且技术要求高等缺点,限制了其广泛应用。
分子印迹固相萃取技术(MISPE)作为一种常见的分离富集技术,能够选择性地吸附目标物质,再通过合适的淋洗、洗脱步骤,使目标物质分离富集。该技术具有高选择性、高特异性结合能力、高灵敏度和高回收率等优势,且成本低,耗时少,技术要求不高,已逐渐成为分离富集及检测微量、痕量物质的普遍方法。
本研究采用本体聚合法,以GTX1,4结构类似物鸟嘌呤核苷为模板,甲基丙烯酸(MAA)为功能单体,乙二醇二甲基丙烯酸酯(EGDMA)为交联剂,偶氮二异丁腈(AIBN)为引发剂,合成了分子印迹聚合物,对该聚合物的性质进行了相关分析,并测定了塔玛亚历山大藻和微小亚历山大藻藻液中GTX1,4的浓度。
2 实验方法
2.1 仪器、试剂与材料
日立Hitachi D-2000 Elite高效液相色谱,L-2485荧光检测器;Nicolet Avatar-360傅里叶变换红外光谱(FT-IR);日立Hitachi S-4800冷场发射扫描电镜(SEM);Millipore Milli-Q超纯水仪。
GTX1,4标准品(GTX1浓度为(60.4±3.1)μmol/L,GTX4浓度为(19.7±1.6)μmol/L,加拿大国家海洋研究所);鸟嘌呤核苷(99%,上海阿拉丁生化科技);MAA(99%,天津博迪化工);EGDMA(98%,上海阿拉丁生化科技);AIBN(分析纯,天津市大茂化学试剂厂);高碘酸(电泳纯,Sigma-Aldrich公司);甲酸铵(HPLC纯,Sigma-Aldrich公司);冰醋酸(HPLC纯,天津市科密欧化学试剂公司),甲醇、乙腈(HPLC纯,Merck公司);塔玛亚历山大藻、微小亚历山大藻(国家海洋局第一海洋研究所)。
2.2 分子印迹聚合物(Molecular imprinted polymer,MIP)的合成
参照文献[16]的方法合成MIP:将0.1416 g(0.5 mmol)鸟嘌呤核苷溶于15 mL二甲基亚砜(DMSO),加入170.5 μL(2 mmol)MAA,超声15 min,进行预聚合;加入1.8824 mL(10 mmol)EGDMA和30 mg AIBN,搅拌溶解;将得到的溶液倒入250 mL三口烧瓶中,通N2气15 min,60℃下,在恒温电磁搅拌器中本体聚合24 h,得到白色块状固体;将固体研碎,以150 mL甲醇-乙酸(9∶1,V/V)溶液为提取液,索氏提取48 h,去除模板分子,每隔一段时间用液相色谱检测洗脱液中的模板分子,直至色谱图中无模板分子峰出现,说明洗脱已完全;用甲醇和水反复洗涤固体3次,烘干,研磨过筛,收集40~75目(200 ~450μm)之间的固体。非分子印迹聚合物(Non-molecular imprinted polymer,NIP)在相同条件下合成,只是没有加入模板分子。
2.3 聚合物形态结构表征
聚合物的分子结构通过傅里叶变换红外光谱测定(KBr压片法),聚合物形态通过扫描电镜表征,表征之前需要喷金处理。
2.4 平衡吸附实验
称取20 mg MIP和NIP各5份,分别加入到含2 mL GTX1,4标准品溶液的离心管中(浓度分别为0,25,50,100和200 μg/L)。将离心管置于恒温振荡器中,25℃下避光振荡24 h。用注射器取上层液体,过0.22μm滤膜,再取100 μL过滤后的溶液于液相瓶中待测。
2.5 分子印迹固相萃取柱(Molecular imprinted solid-phase extraction,MISPE)
MISPE的装柱过程参考文献[17]的方法。称取50 mg MIP或NIP进行湿法装柱,氮气吹干备用。过柱前先用5 mL甲醇和5 mL水活化柱子,然后分别进行上柱、淋洗和洗脱,探索最佳淋洗与洗脱条件,每两步之间都须氮气吹干。分别收集上柱液、淋洗液和洗脱液,进液相色谱测定。
2.6 柱前衍生条件及液相色谱条件
2.6.1 衍生剂的制备及衍生过程 参考文献[18]的衍生方法,分别配制0.03 mol/L高碘酸溶液、0.3 mol/L甲酸铵溶液和0.3 mol/L磷酸氢二钠溶液。分别取上述溶液各5 mL混合于烧杯中,用1 mol/L NaOH调至pH 8.2,备用。衍生过程中在100 μL待测溶液中加入500 μL衍生试剂,室温下反应至少1 min。随后加入5 μL冰醋酸终止反应。
2.6.2 液相色谱条件 参考文献[19]的液相色谱条件:流动相为0.1 mol/L甲酸铵溶液(含2%乙腈),流速为1.1 mL/min;色谱柱为Agela TechnologiesVenusil XBP C18(2)(250 mm×4.6 mm),柱温为30℃;荧光检测器激发波长为340 nm,发射波长为390 nm。
2.6.3 海水中GTX1,4的测定 取进入稳定期的微小亚历山大藻和塔玛亚历山大藻藻液,经0.45μm滤膜过滤,各取50 mL通过MISPE,在最佳淋洗条件下进行淋洗、洗脱,进液相色谱测定。
3 结果与讨论
3.1 聚合物形态结构表征
FT-IR用于观察聚合物的分子结构并确定模板分子是否成功被洗脱下来(图1)。图1为未经过索氏提取的MIP、索氏提取后的MIP及NIP的红外光谱图。在图1a中,1540 cm-1有一个峰,这是C==N的特征吸收峰,证明模板分子已经成功印迹到MIP中;而图1b和1c几乎没有区别,说明经过索氏提取后,MIP中已经没有模板分子残余。3550~3400 cm-1是O—H和N—H的伸缩振动,3000和2958 cm-1分别为 C==C—H和C—H的伸缩振动,1732 cm-1为C==O的伸缩振动,1640 cm-1为 C==C的伸缩振动,1265 cm-1为羧基中C—O的伸缩振动,证明聚合物中存在MAA,1158 cm-1为酯基中C—O的伸缩振动,证明聚合物中存在EGDMA。
SEM用于观察聚合物的表面及内部结构(图2)。图2a和2c是 MIP的表面和内部结构,图2b和2d是NIP的表面和内部结构。从图2a可见,MIP具有较多分布均匀紧密、孔径大小均一的孔穴,而NIP不仅孔穴少,且分布不均,这是由于NIP缺少模板分子,而多孔结构的形成与致孔剂和模板分子的作用有关,且在索氏提取中也能形成大量孔穴。这种多孔结构提高了目标分子进入MIP的速率,也增大了MIP的吸附容量。同时,从图2c与2d中也可见MIP比NIP具有更多分布均匀的孔穴。

图2 MIP和NIP的表面及内部SEM图Fig.2 SEM images of MIP(a.surface structure;c,inner stracture)and NIP(b,surface structure;d,inner structure)
3.2 平衡吸附实验
准确移取适量GTX1,4标准储备液,用水稀释。按照2.5节的方法。采用HPLC测定吸附后溶液中剩余的GTX1,4的浓度,根据吸附前后溶液中GTX1, 4的浓度计算MIP和NIP对GTX1,4的结合量Q(ng/g),其计算公式如下:

其中,C0为吸附前的初始浓度(μg/L);Ce为吸附后的平衡浓度(μg/L);V为标准溶液的体积(mL);M为聚合物的质量(g)。
以峰面积(y)对GTX1,4浓度(x)绘制标准曲线,曲线方程式为y=230.25x-1220.5,R2=0.9980。以溶液中GTX1,4的初始浓度为横坐标,相应的结合量Q为纵坐标,绘制平衡吸附曲线(图3)。从图3可见,随着GTX1,4初始浓度增加,MIP和NIP对GTX1,4的吸附量都呈现不断增加的趋势,但MIP的吸附量远大于NIP,且随着浓度的增加效果更明显,说明MIP比NIP具有更高的吸附容量和对GTX1,4更强的结合能力。当初始浓度达到最大(200 μg/L)时,MIP的吸附量为8560 ng/g,远大于 NIP (6293 ng/g),这是由于模板分子的存在,形成的印迹聚合物内部具有与GTX1,4在空间结构上相互匹配的结合位点,使MIP的结合量远大于NIP。
3.3 标准溶液的MISPE
以50 μg/L GTX1,4标准溶液为上柱液,淋洗液和洗脱液的选择参考文献[17]的方法。以1 mL标准溶液为上柱液,当1 mL 0.1 mol/L乙酸溶液通过MISPE或NISPE时,溶液中几乎没有GTX1,4被洗下来(图4a),说明经过淋洗过程后,大部分杂质被洗了下来,而绝大部分GTX1,4被保留了下来。而当1 mL不同比例的甲醇-水溶液通过固相萃取柱时,可观察到GTX1,4的液相色谱峰(图4b)。本研究以0.1 mol/L乙酸溶液为淋洗剂,探讨不同比例的甲醇-水溶液作为洗脱剂的洗脱效果见表1。从表1可以看出,随着甲醇-水比例的上升,MISPE和NISPE的回收率都呈先下降后上升的趋势,在甲醇∶水体积比为5∶5时,达到最小(分别为63.4%和45.5%),在甲醇-水体积比为95∶5时达到最大(分别为85.0%和59.9%)。因此,本研究选择0.1 mol/L乙酸溶液为淋洗剂,甲醇-水(95∶5,V/V)溶液为洗脱剂。同时,从表1可见,在相同的洗脱条件下,MISPE的回收率都远大于NISPE,也验证了MIP比NIP具有更高的结合容量和选择性。
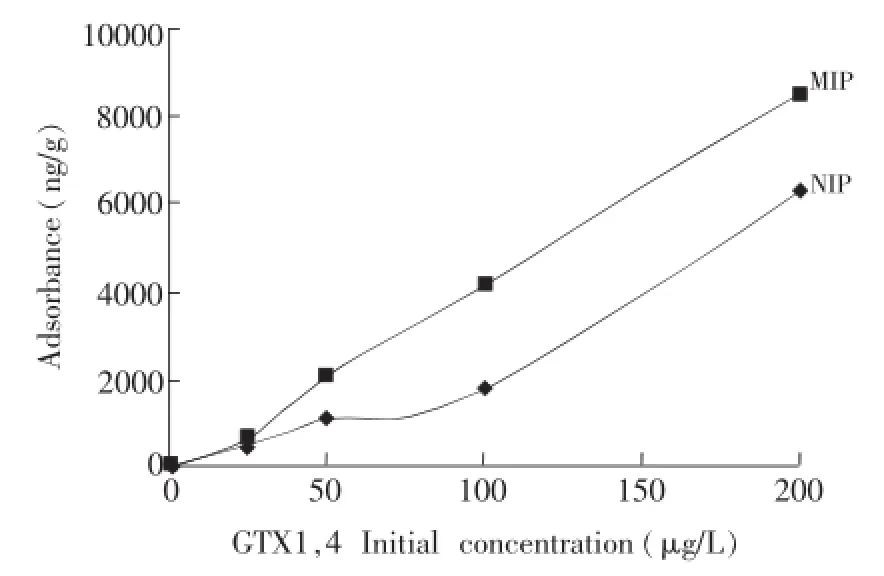
图3 MIP和NIP的平衡吸附曲线Fig.3 Static equilibrium adsorption curve of MIP and NIP
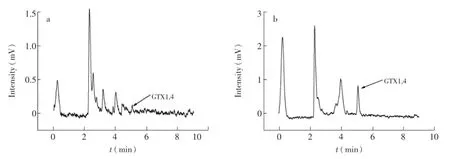
图4 0.1 mol/L乙酸溶液淋洗液(a)和甲醇-水(95∶5,V/V)洗脱液(b)色谱图(50 μg/L)Fig.4 Chromatogram of gonyautoxins 1,4(GTX1,4)washed by 0.1 mol/L acetic acid(50 μg/L)(a)and methanol-water(95∶5,V/V)(50 μg/L)(b)
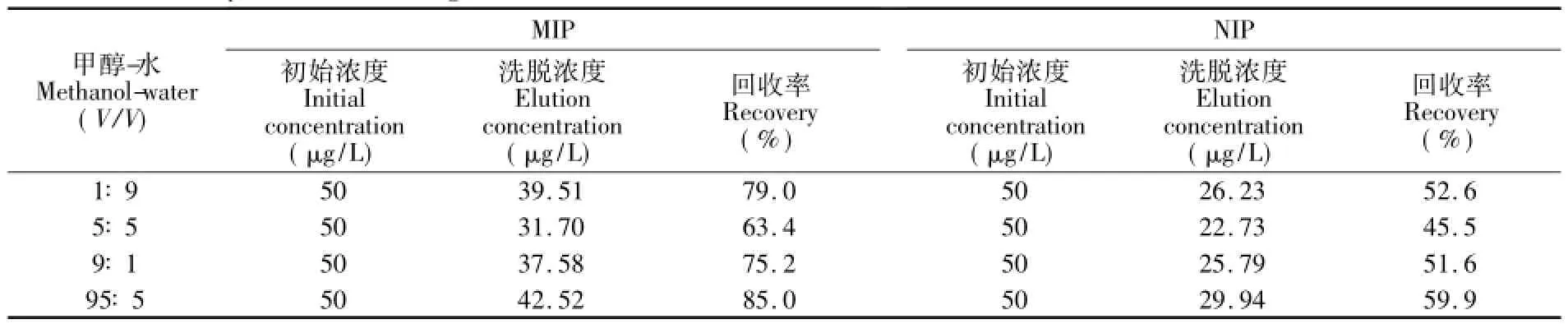
表1 不同比例甲醇-水作为洗脱液的GTX1,4回收率Table 1 Recovery of GTX1,4 using different ratio of methanol and water as elution solution
3.4 MISPE对海水中GTX1,4的富集作用
将培养到稳定期的微小亚历山大藻和塔玛亚历山大藻(藻密度分别为2.4×104和2.2×104)的藻液过滤后,通过MISPE富集50倍,即将50 mL藻液通过MISPE后,分别用1mL淋洗液和洗脱液进行处理,收集洗脱液通过HPLC进行检测,得到的色谱图见图5a和图5b,在微小亚历山大藻和塔玛亚历山大藻藻液中都检测到了GTX1,4,其浓度分别为1.10和0.99 μg/L,RSD分别为3.3%和4.4%,说明HPLC的精密度良好,可用于GTX1,4的测定。
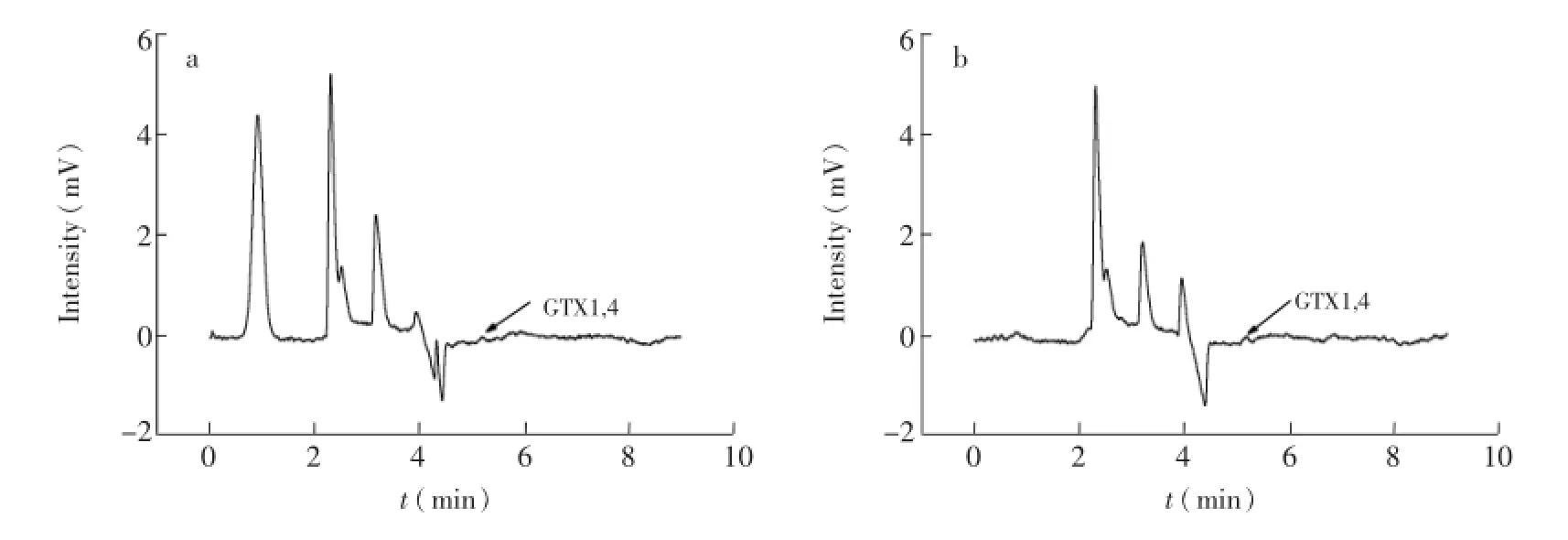
图5 微小亚历山大藻(a)和塔玛亚历山大藻(b)洗脱液色谱图Fig.5 Elution chromatograms of Alexandrium minutum(a)and Alexandrium tamarense(b)
4 结论
利用本体聚合法,以DMSO为溶剂,鸟嘌呤核苷为模板,MAA为功能单体,EGDMA为交联剂,AIBN为引发剂60℃下热引发合成了分子印迹聚合物。通过FT-IR和SEM发现MIP具有较多分布均匀紧密、孔径大小均一的孔穴。平衡吸附实验表明,MIP比NIP具有更高的结合容量和对GTX1,4的选择性。以0.1 mol/L乙酸溶液为淋洗液,甲醇-水(95∶5,V/V)溶液为洗脱液,可以有效分离富集GTX1,4,回收率达到85.05%。同时,在此淋洗条件成功的检测出了微小亚历山大藻和塔玛亚历山大藻藻液中的GTX1,4,说明此方法可有效用于分离富集海水中的GTX1,4,为检测海水中的GTX1,4提供了一种新思路。
1 ZHOU Ming-Jiang,LI Jun.Chinese Journal of Marine Drugs,1999,18(3):48-54
周名江,李钧.中国海洋药物,1999,18(3):48-54
2 Asakawa M,Miyazawa K,Takayama H,Noguchi T.Toxicon,1995,33(5):691-697
3 Lim P T,Ogata T.Toxicon,2005,45(6):699-710
4Vale P,Rangel I,Silva B,Coelho P,Vilar A.Toxicon,2009,53(1):176-183
5 Hakanen P,Suikkanen S,Franzén J,Franzén H,Kankaanpää H,Kremp A.Harmful Algae,2012,15:91-99
6 Zhou M,Li J,Luckas B,Yu R,Yan T,Hummert C,Kastrup S.Marine Pollut.Bull.,1999,39(1):331-334
7 de Carvalho M,Jacinto J,Ramos N,OliveiraV,Melo T,Sá J.J.Neurol.,1998,245(8):551-554
8 Benton B J,Keller S A,Spriggs D L,Capacio B R,Chang F C T.Toxicon,1998,36(4):571-588
9 HU Hao-Yan,TANG Jing-Liang,WANG Yi-Ming,HUANG Bei,CHEN Yi-Hua,MAO Hong-Yue.Environmental Pollution and Control,2006,27(6):470-472
胡颢琰,唐静亮,王益鸣,黄备,陈逸华,毛宏跃.环境污染与防治,2006,27(6):470-472
10Velez P,Sierralta J,Alcayaga C,Fonseca M,Loyola H,Johns D C,Tomaselli G F,Marbán E,Suárez-Isla B A. Toxicon,2001,39(7):929-935
11 ZHANGWen,WANG Jun,SU Yong-Quan.Marine Sciences,2005:6
张纹,王军,苏永全.海洋科学,2005:6
12 Usleber E,Dietrich R,Bürk C,Schneider E,Martlbäuer E.J.AOAC Inter.,2001,84(5):1649-1656
13 SUN Xing-Quan,ZHENG Qiu-Yue,PANG Yan-Hua,LI Yi-Chen,XIAO Shan-Shan,XU Jing,CAO Ji-Juan.Chinese J.Anal.Chem.,2013,41(9):1423-1427
孙兴权,郑秋月,庞艳华,李一尘,肖珊珊,徐静,曹际娟.分析化学,2013,41(9):1423-1427
14 Lawrence J F,Niedzwiadek B,Menard C.J.AOAC Inter.,2005,88(6):1714-1732
15 Oshima Y.J.AOAC Inter.,1995,78(2):528-532
16 ZHANGShao-wen,GAO Ya-Hui.Chinese Journal of Analysis Laboratory,2012,31(9):106-109
张少文,高亚辉.分析实验室,2012,31(9):106-109
17 LIANZi-Ru,PhD Thesis,Ocean University of China,2013
连子如.博士论文,中国海洋大学,2013
18 Rodríguez P,Alfonso A,Botana A M,Vieytes M R,Botana L M.Toxicon,2010,56(3):448-457
19 Lian Z R,Wang J T.Environ.Pollut.,2013,182:385-391
Separation and Determination of Gonyautoxins 1,4 in Seawater by Molecularly Imprinted Solid Phase Extraction Coupled with High Performance Liquid Chromatography
MEI Xiao-Qi,HE Xiu-Ping,WANG Jiang-Tao*
(Key Laboratory of Marine Chemistry Theory and Technology Ministry of Education,Ocean University of China,Qingdao 266100,China)
A kind of molecular imprinted polymer(MIP)was synthesized by bulk polymerization using guanosine as dummy template molecule.The results of Fourier transform infrared spectrometer(FT-IR)and scanning electron microscope showed that MIP had homogenous and uniform-sized cavities.It was confirmed that MIP had higher binding affinity and selectivity towards gonyautoxins 1,4(GTX1,4)than NIP according to the static equilibrium adsorption.The solid phase extraction columns were packed with MIP.The maximum recovery(85.05%)of MISPE was achieved using 0.1 mol/L acetic acid as washing solution and ethanolwater(95∶5,V/V)as elution solution.Then the concentrations of GTX1,4 from culture solution of Alexandrium minutum and Alexandrium tamarense were determined to be 1.10 and 0.99 μg/L,respectively,under the optimum conditions of washing and elution,and RSD was 3.3%and 4.4%,respectively,indicated good LOD and higher precision.
Gonyautoxins 1,4; Molecularly imprinted solid phase extraction; Separation and preconcentration;Alexandrium minutum;Alexandrium tamarense
19 September 2015;accepted 4 December 2015)
10.11895/j.issn.0253-3820.150744
2015-09-19收稿;2015-12-04接受
* E-mail:jtwang@ouc.edu.cn

