基于高分辨质谱技术的农药与生物大分子相互作用的分析方法
李康丽 王玲玲 暴雅静 熊 博王震宇
(华中师范大学农药与化学生物学教育部重点实验室,武汉 430079)
基于高分辨质谱技术的农药与生物大分子相互作用的分析方法
李康丽 王玲玲 暴雅静 熊 博*王震宇*
(华中师范大学农药与化学生物学教育部重点实验室,武汉 430079)
建立了检测农药小分子与生物大分子(BSA蛋白,SOD酶)相互作用的高分辨质谱分析方法。对相应结合产物进行质谱检测,结果表明,BSA蛋白与甲基对硫磷分子在开始相互作用30 min后达到饱和,且每个蛋白分子最多与5个甲基对硫磷分子结合;BSA蛋白与甲维盐不存在相互作用。通过对SOD酶与敌敌畏,阿维菌素及噻呋酰胺结合产物的质谱检测发现每个SOD酶最多结合2个敌敌畏分子,1个阿维菌素分子,且不与噻呋酰胺相互作用。此外,实验表明,SOD酶与阿维菌素分子作用30 min后达到平衡,与敌敌畏分子作用20 min后达到平衡。通过对两种蛋白结合农药小分子过程的时间分辨分析发现,两种生物大分子结合农药小分子的机理过程存在差异。本方法与相关标准方法(荧光光谱法,NBT试剂盒法)及分子模拟对接结果比对说明,本方法切实可靠。本方法具有耗样量少、检测速度快、可提供多方面信息等优点,在新农药的研发及其安全性评价方面具有实用价值。
高分辨质谱;分子相互作用;农药;牛血清白蛋白;超氧化物歧化酶
1 引言
农药在确保粮食安全、农业稳产增收等方面发挥着重要作用,新农药的研发具有相当的社会价值和现实意义[1]。大部分农药为有机小分子,多通过特异性结合对应靶标蛋白抑制生物体的生理功能[2,3],进而达到除草、杀虫等目的。因此,研究农药与生物大分子的相互作用不仅对相关药理研究具有重要意义[4,5],而且有望为新农药的研发提供理论基础和技术支撑。目前,基于核磁共振[6,7]、光谱[8~10]、圆二色谱[8]、分子模拟对接[9,10]等技术检测小分子与生物大分子相互作用已见诸报道,这些方法不同程度地存在样品消耗量大、耗费时间长等不足。鉴于此,本实验建立了用于监测农药-生物大分子相互作用的高分辨质谱分析方法。通过对质谱检测条件的充分优化,实现了对农药-生物大分子结合产物的质谱分析[11,12],基于蛋白结合农药前后的质量数位移,确定单个蛋白分子所结合的最大农药分子个数,并最终区分是否存在相互作用。此外,还探索了农药与生物大分子相互作用的时间分辨分析,将所测结果与荧光光谱法[8~10],NBT试剂盒法[13]及分子模拟对接[9,10]等方法的结果进行了比对,本方法的可靠性获得了确证。
2 实验部分
2.1 仪器与试剂
Agilent 1260高效液相色谱仪(USA);6224 TOF-ESI-MS质谱仪(USA)。荧光光谱仪,酶标仪(BioTek,USA),96孔板,移液枪。牛血清白蛋白(BSA,纯度>98%,MW≈66 kDa);超氧化物歧化酶(SOD,纯度>90%,MW≈32 kDa);甲基对硫磷,甲维盐,阿维菌素,噻呋酰胺,敌敌畏(标准品);NBT试剂盒;乙腈,甲醇(德国默克公司);甲酸(分析纯);实验室用水为纯水仪(美国Millipore公司,USA)制备的二次蒸馏水。
2.2 溶液的配制
准确称取1.98 mg BSA于离心管,加入1.5 mL二次蒸馏水进行溶解(20 mmol/L),于4℃存放备用;称取1.15 mg SOD于离心管,加入1.15 mL二次蒸馏水溶解(30μmol/L),然后分别稀释成3和6μmol/L的样品液,分装,于-20℃存放备用。
2.3 质谱检测条件
BSA检测浓度:20μmol/L,质荷比采集范围:m/z 900~2400;SOD检测浓度:3μmol/L(样品先加0.1%甲酸酸化),质荷比采集范围:m/z 800~1800。离子源:ESI,流动相:50%乙腈-50%二次蒸馏水(含0.1%甲酸),进样量:2 μL,流速:0.200 mL/min。
3 结果与讨论
3.1 BSA蛋白和SOD酶的质谱检测
在优化的高分辨质谱条件下,实现了对BSA蛋白和SOD酶的较好检测。由图1a可见,带+32到+64电荷的BSA分子离子,带+9到+19电荷的SOD分子离子都能被检测到(图1b)。
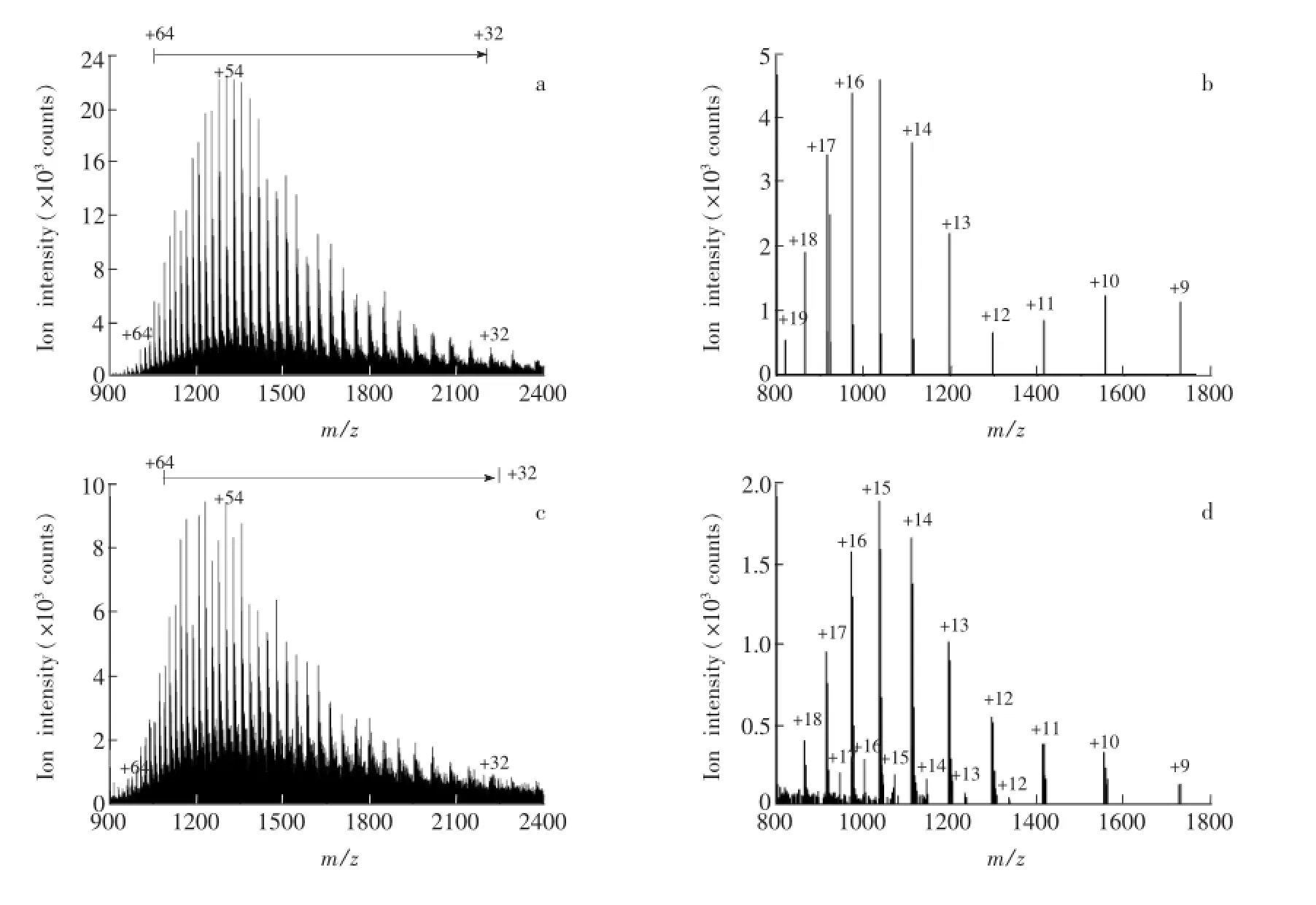
图1 BSA(a)和SOD(b)的质谱图,BSA结合甲基对硫磷的质谱图(c),SOD结合敌敌畏的质谱图(d)Fig.1 MS spectra of BSA(a),superoxide dismutase(SOD)(b),BSA interacted with Parathion-methyl (c)and SOD interacted with dichlorvos(DDVP)(d)
3.2 BSA蛋白和SOD酶与农药小分子的相互作用
使用前述质谱方法对不同浓度的甲基对硫磷、甲维盐与BSA蛋白之间的相互作用进行了评价。如图2a所示,当BSA蛋白与甲基对硫磷作用30 min后,可见其带有相应电荷碎片的质量数皆存在一定的位移,此位移值即对应所结合甲基对硫磷的质量数[14]。该位移值与所带电荷数的乘积与甲基对硫磷分子量的比值即为此状态下单个BSA蛋白分子上所结合的甲基对硫磷的分子个数,约5个。另一方面,BSA蛋白与甲维盐充分孵育后,并未发生任何质量数的位移(图2b)。由此可判定BSA蛋白与甲维盐不存在相互作用。
评价了SOD酶与阿维菌素、敌敌畏、噻呋酰胺的相互作用,相关数据参见表1,SOD酶与阿维菌素、敌敌畏结合后,检测出了带有十余个电荷的新的碎片离子,根据相应碎片质量数位移值最终确定此状态下单个SOD酶分子结合1个阿维菌素分子,2个敌敌畏分子,SOD酶与噻呋酰胺不存在相互作用。
综上所述,基于所建立之方法可通过检测蛋白与农药结合前后的质量数位移对是否存在相互作用进行判断,继而根据位移值以及相应农药分子的精确分子量计算得到单个蛋白分子所结合的农药分子个数,相关农药的质谱检测结果见表2。

图2 BSA分别于甲基对硫磷(a)和甲维盐(b)相互作用Fig.2 MS spectra of BSA interacted with parathion-methyl(a)and emamectin benzoate(b)

表1 SOD酶与阿维菌素、敌敌畏作用产物的质谱数据总结Table 1 MS data summarization of SOD interacted with avermectin and DDVP

表2 与SOD及BSA作用的5种农药Table 2 Informations for five pesticides bonded with SOD or BSA
3.3 BSA和SOD与农药小分子相互作用的时间分辨分析
基于所建立的质谱方法探索了SOD酶与阿维菌素、敌敌畏结合过程的时间分辨分析。由图3a可见,将浓度比为1∶5的SOD酶与阿维菌素的混合液于25℃分别孵育5,10,15,20,30和40 min后,结合农药的SOD酶的新的碎片峰离子强度不断变化,并于30 min后趋于稳定。由此可见,SOD酶结合阿维菌素的过程在30 min后趋于平衡。在对应的条件下SOD酶和敌敌畏的检测结果(图3b)可见,两者结合产物对应的离子强度于20 min左右趋于稳定。由此判定,SOD酶与敌敌畏的结合于20 min左右趋于平衡。实验表明,SOD酶与阿维菌素、敌敌畏的相互作用过程中皆存在一个逐步趋近于饱和平衡的过程,此过程具有相对渐进发生、逐步达到平衡的特点。
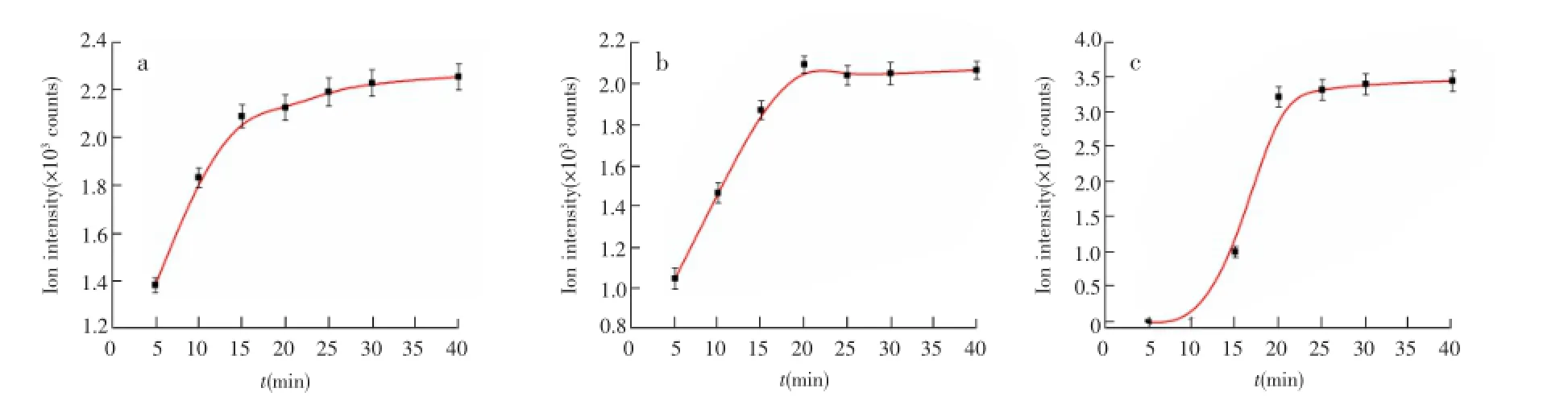
图3 农药与生物大分子结合的时间分辨分析Fig.3 Time-resolved result of biological macromolecules bonded with pesticide
BSA蛋白-甲基对硫磷混合液(1∶5,V/V)于37℃孵育后,通过检测结合产物的强度对此相互作用过程进行时间分辨分析。由图3c可见,当孵育时间小于15 min,检测到BSA蛋白与甲基对硫磷的结合产物离子强度为零,即稳定的相互作用产物尚未完全生成;随着孵育时间增长至15 min,产生位移;孵育时间继续增长,位移值保持不变。由图3c可见,新的碎片峰的离子强度于20 min趋于稳定,即BSA蛋白与甲基对硫磷的结合于20 min趋于平衡。结果表明,BSA与甲基对硫磷的的结合与SOD结合相应农药分子的过程存在显著区别。由该曲线推测BSA与甲基对硫磷结合过程中可能存在着某种协同准备阶段,当该过程结束后农药小分子会在较短时间内结合到对应蛋白的作用位点。这主要可能由于BSA蛋白与SOD酶的分子空间结构的差异以及蛋白空腔作用位点个数的不同所致。
3.4 检测方法可靠性评价
为评价本方法的可靠性,选用荧光光谱法[8]和NBT试剂盒法[13]对前述的分子间相互作用进行了检测。首先,将甲基对硫磷、甲维盐与BSA蛋白以及阿维菌素、敌敌畏、噻呋酰胺与SOD酶分别混合。由图4a可见,甲维盐的加入与否对BSA的荧光强度以及位移均没有影响,但混合了甲基对硫磷的BSA荧光强度下降;且随着甲基对硫磷含量的增加,荧光强度下降显著。由此可知,甲基对硫磷与BSA蛋白有很强的相互作用,但甲维盐与其不存在相互作用。同样地,加入了阿维菌素、敌敌畏的SOD酶的荧光强度及位移均发生了变化,而加入了噻呋酰胺的SOD酶荧光强度及位移不受影响(图4b)。由此推断,阿维菌素,敌敌畏与SOD酶存在明显相互作用,但噻呋酰胺与SOD酶不存在相互作用。此外,对BSA与甲基对硫磷的相互作用进行了分子模拟对接,结果见图4c。结果表明,二者之间有很强的氢键作用力,进一步证明两者存在较强的相互作用。采用NBT试剂盒对SOD酶的活力进行检测,与噻呋酰胺混合的SOD酶活力并没有发生变化。由此可见,二者不存在相互作用,检测结果见图4d。混合了敌敌畏和阿维菌素的SOD活力有所上升,这与文献[14]一致。图4揭示了BSA与甲基对硫磷之间存在相互作用,与甲维盐不存在相互作用;SOD与阿维菌素,敌敌畏之间存在相互作用,与噻呋酰胺不存在相互作用。此结论与前述建立的方法所得结果一致,从而证明本方法切实可靠。
4 结论
本实验探索了一种基于高分辨质谱技术的农药-生物大分子相互作用的分析方法。根据相应大分子碎片质量数位移能快速判定农药与生物大分子是否存在相互作用,并根据位移数值的大小准确得出结合的农药小分子个数,同时该方法还能对结合过程进行时间分辨分析。依据前述过程分析的相应结果,所研究之农药与生物大分子的结合相对较为缓慢,不符合静电吸引结合的基本特征。此外,结合分子对接结果,初步推断此相互作用方式有可能为小分子嵌入大分子的结合模式。本方法具有消耗样品少、可靠性高、可提供多方面信息的优势,有望广泛应用于潜在农药分子的前期筛选及其安全性评价工作中。
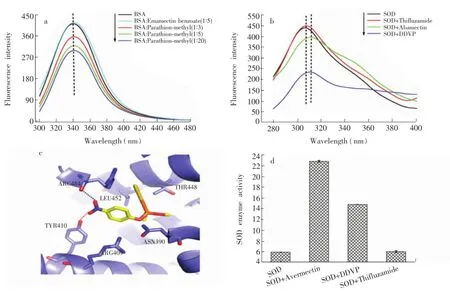
图4 标准方法检测结果:BSA的荧光光谱图(a),BSA分子对接图(c),SOD的荧光光谱图(b),SOD的NBT试剂盒检测结果图(d)Fig.4 Detection results of standard method:Fluorescence spectra of BSA(a),gold docking results of BSA(c),fluorescence spectra of SOD(b),NBT method result of SOD(d)
1 Carvalho F P.Environ.Sci.Policy,2006,9(7-8):685-692
2 Carter W G,Tarhoni M H,Ray D E.J.Chromatogr.B,2010,878(17-18):1312-1319
3 Lockridge O.Adv.Molec.Toxicol.,2013,7:179-205
4 Zhu Z F,Cheng J,Lu X L,Li X,Ge L Q,Fang J C,Wu J C.Pestic.Biochem.Physiol.,2014,114:97-101
5 Mesomya W,Sutthivaiyakit P,Cuptapun Y,Hengsawadi D.Maejo Int.J.Sci.Tech.,2012,6(3):470-482
6 Goodall S C,Spooner P,Middleton D,Howe P,Watts A.Biophys.J.,2002,82(1 Part 2):333a
7 Thompson P M,Beck Moriah R,Campbell Sharon L.Method.Mol.Biol.,2015,1278:267-279
8 WANG Qun,SHI Jing,ZHANG Huan,NI Jia-Zuan.Chinese J.Anal.Chem.,2005,33(7):909-912
王群,石晶,张焕,倪嘉缵.分析化学,2005,33(7):909-912
9 XU Qian,DENG Dan-Dan,CAO Zhi-Juan,XIE Qiong,LIANG Jian-Ying,LU Jian-Zhong.Chinese J.Anal.Chem.,2010,38(4):483-487
徐倩,邓丹丹,曹志娟,谢琼,梁建英,卢建忠.分析化学,2010,38(4):483-487
10 Yue Y Y,Zhang Y H,Li Y,Zhu J H,Qin J,Chen X G.J.Lumin.,2008,128(3):513-520
11 Kurahashi T,Miyazaki A,Suwan S,Isobe M.J.Am.Chem.Soc.,2001,123(38):9268-9278
12 Liu L L,Ma Y J,Chen X Q,Xiong X,Shi S.Y.J.Chromatogr.B,2012,887:55-60
13 Mehta JV,Gajera S B,Patel M N.Spectrochim.Acta A,2015,136:1881-1892
14 ZHA li-Chun,HU Chun-Xiang,CAO Chuan-Wang,WANG Zhi-Ying,LIANG Chen.J.Northeast Forestry Uni.,2011,5(39):105-107
查黎春,胡春祥,曹传旺,王志英,梁臣.东北林业大学学报,2011,5(39):105-107
15 Svedendahl M,Verre R,Käll M.Light Sci.Appl.,2014,3(11):e220-e226
This work was supported by the National Natural Science Foundation of China(Nos.21205044,21302060)and self-determined research funds of CCNU from the colleges'basic research and operation of MOE(Nos.CCNU14A05005,CCNU15KFY004 )
Analysis of Interaction between Pesticide and Biological Macromolecules Based on High Resolution Mass Spectrometry
LI Kang-Li,WANG Ling-Ling,BAO Ya-Jing,XIONG Bo*,WANG Zhen-Yu*
(The MOE Key Laboratory of Pesticide&Chemical Biology,Central China Normal University,Wuhan 430079,China)
An analytical method for the determination of interaction between pesticide and biological macromolecules(bovine serum albumin(BSA)protein,superoxide dismutase(SOD)enzyme)was developed based on high resolution mass spectrometry.All results revealed that each BSA bonded with maximum five Parathion-methyls after 30 min,and it would not interact with emamectin benzoate.Moreover,each SOD after mixing with corresponding pesticides could bond with two dichlorvos(DDVPs)and one avermectin after 30 min.In addition,there is no interaction between SOD and thifluzamide.The interaction between SOD and avermectin trended stable after 30 min,and similar phenomenon was observed between SOD and DDVP after 20 min.There were certain obvious some differences in the pathway of interactions for BSA and SOD,both of which were bonded with the pesticides,based on time resolved determinations for their bonding process. Finally,we compared the proposed method with standard methods(fluorescence spectrometry,NBT kit method)and molecular docking results,and the reliability of the proposed method was supported.It owned preponderances in less sample consumption,high detection speed,and more capacities compared with traditional strategies.Therefore,the proposed mothed would own certain practical values in either researches and developments or safety evaluations for new pesticides.
High resolution mass spectrometry;Molecular interactions;Pesticides;Bovine serum albumin;Superoxide dismutase
14 September 2015;accepted 5 November 2015)
10.11895/j.issn.0253-3820.150725
2015-09-14收稿;2015-11-05接受
本文系国家自然科学基金(Nos.21205044,21302060)和高校教育部基础研究经费(Nos.CCNU14A05005,CCNU15KFY004)的资助
* E-mail:bx@mail.ccnu.edu.cn,zywang@mail.ccnu.edu.cn

