桑色素分子印迹传感器的制备与应用
刘蓉龙立平雷存喜吴朝阳刘煜李思佳(湖南城市学院化学与环境工程学院,益阳43000)(湖南大学化学生物传感与计量学国家重点实验室,长沙4008)
桑色素分子印迹传感器的制备与应用
刘蓉1,2龙立平*1雷存喜1吴朝阳2刘煜1李思佳1
1(湖南城市学院化学与环境工程学院,益阳413000)2(湖南大学化学生物传感与计量学国家重点实验室,长沙410082)
以邻氨基酚(o-AP)为功能单体,桑色素为模板分子,基于分子间的相互作用力,在金电极表面电聚合制备具有特异性识别孔穴的桑色素分子印迹传感器膜。采用循环伏安法(CV)、差分脉冲伏安法(DPV)等研究了分子印迹膜的性能和分子印迹效应。探索了聚合膜配比及聚合扫描圈数对传感器性能的影响,优化了洗脱时间和印迹时间。比较了此传感器对其结构相似物的选择性响应,发现其对桑色素检测具有良好的选择性。在最佳实验条件下,此传感器对桑色素浓度定量测定范围为0.05~1.70μmol/L,线性方程为I(μA)= 1.0800lg c(mol/L)+9.3599,R=0.9934,检出限为0.01μmol/L。用此传感器测定黑茶样品中桑色素的含量,加标回收率为104.0%~108.0%。
分子印迹;桑色素;电化学传感器;电聚合
1 引言
安化黑茶[1]产于湖南省益阳市安化县,含有丰富的黄酮类物质——桑色素。桑色素不仅具有抗癌、抗炎和抗氧化等药理作用[2],还是一种应用广泛的显色剂[3,4]。测定黑茶中桑色素的含量具有重要的实际意义。
目前,测定桑色素的方法并不多,贾小燕等[5]用反相高效液相色谱同时测定复方鱼腥草片中的桑色素与槲皮素,杨莉等[6]用荧光法同时测定绞股蓝中桑色素的含量。但是这些方法使用的仪器价格较高。电化学分析具有快速、简便、灵敏的特点,而被广泛应用。张君才等[7]建立了通过流动注射双安培法直接检测桑色素的电化学新方法,黄菲等[8]用L-半胱氨酸自组装膜修金电极对桑色素的电化学行为进行了初步研究。Liu等[9]用石墨烯修玻碳电极测定桑色素含量。近年来,具有特异选择性的分子印迹膜的应用越来越广泛[10,11],Behzad等[12]采用多壁碳纳米管电极修分子印迹膜测定了黄酮类物质芦丁的含量。Sun等[13]通过氧化石墨烯修分子印迹膜测定了黄酮类物质槲皮素。本研究组[14,15]利用分子印迹传感器测定了氯丙嗪和菊酯。目前,利用邻氨基酚分子印迹膜测定桑色素尚未见文献报道。
本研究以邻氨基酚为功能单体,桑色素为模板分子,在金电极表面电聚合制备具有特异性识别孔穴的桑色素分子印迹膜。采用循环伏安法,差分脉冲伏安法等研究分子印迹膜的性能,分子印迹效应。优化制备分子印迹膜的各种条件,绘制测定桑色素分子传感器的标准曲线图,考察与其相似结构物质的干扰情况。结果表明,制备的传感器具有较好的选择性与灵敏性。
2 实验部分
2.1仪器与试剂
CHI660D电化学工作站(上海辰华仪器有限公司);三电极系统(分子印迹膜电极为工作电极,Ag/AgCl为参比电极,铂电极为对电极);pHS-3E型精密pH计(上海日岛科学仪器有限公司);FA2004型电子天平(上海舜宇恒平科学仪器有限公司);KQ-250DB型数控超声波清洗器和SYZ-550型石英亚沸高纯水蒸馏器(金坛市节能分析仪器厂)。
桑色素(98%)、槲皮素(98%)、芦丁(95%)均购于南京泽朗医药科技有限公司;邻氨基酚(分析纯,湖南汇虹试剂有限公司);无水乙醇、K3Fe(CN)6、K4Fe(CN)6、KCl、HClO4和HNO3均为分析纯试剂,且不再提纯;实验用水为二次蒸馏水。黑茶(800 g茯砖,湖南益阳茶厂有限公司)。
2.2金电极的预处理
将金电极(Gold electrode,GE)依次用1.0,0.3和0.05μm氧化铝粉抛光,并依次于HNO3、无水乙醇、纯水中泡洗5 min,取出后超声洗涤5 min。在0.5mol/L H2SO4中于-0.2~1.5 V进行循环伏安(CV)处理,直到得到稳定的伏安响应曲线。
2.3分子印迹电聚合膜电极的制备
将预处理好的金电极置于含0.1 mmol/L桑色素和1.33 mmol/L邻氨基酚(o-AP)电聚合液(pH 5.5)中,在扫描速度为50 mV/s,扫描范围-0.1~0.8 V条件下,用循环伏安法扫描30圈,得到含桑色素模板分子的不导电聚合膜电极,再在无水乙醇中浸泡14 min,完全除去在聚合膜中的桑色素分子,得到了桑色素印迹的聚邻氨基酚印迹聚合物传感器。
2.4实验方法
循环伏安法(CV)的电压测量范围为-0.1~0.5 V,速率为0.05 V/s;差分脉冲伏安法(DPV)的电压检测范围为-0.1~0.5 V,电位增量0.004 V,振幅0.05 V,脉冲周期0.5 s,脉冲宽度0.2 s,采样宽度0.0167 s,静置时间2 s。本实验均以0.5 mol/L KCl为电解质在5.0 mmol/L溶液中进行电化学表征。
3 结果与讨论
3.1电聚合分子印迹膜
图1为电聚合分子印迹电聚合膜电极的制备过程的CV图。从图1可知,氧化峰的峰电流(Ip)强度随着扫描圈数的增加而逐渐减少,表明功能单体(邻氨基酚)和模板分子(桑色素)在金电极表面上的电化学聚合过程是单向不可逆的,且电聚合膜不具有导电性。当扫描30圈时,Ip几乎为零,金电极表面被电聚合膜覆盖,阻断了电子的传输,从而得到了以桑色素为模板分子的非导电电聚合膜。

图1 电聚合分子印迹膜的CV图Fig.1 Cyclic voltammogram of molecular imprinted membrane based on electropolymerization

图2 不同电极的循环伏安图Fig.2 Cyclic voltammograms of different electrodes (a)GE,(b)MIP/GE,(c)移去模板分子的 MIP/GE,(d)重新印迹桑色素的MIP/GE。(a)GE,(b)MIP/GE,(c)MIP/GE after template removal,(d)MIP/GE after rebindingmorin.
3.2分子印迹膜的表征
3.2.1循环伏安法图2为循环伏安法表征桑色素分子印迹膜的CV图,裸金电极(曲线a)表面在电聚合溶液中形成了非导电分子印迹聚合膜(曲线b)后,使探针的无法进入到金电极的表面发生氧化还原反应,Ip快速降低,几乎为零;当非导电分子印迹电聚合膜浸入无水乙醇中洗脱14min后,形成了带有特异性识别孔穴的电聚合膜(曲线c),可以通过孔穴进入到金电极表面,发生氧化还原反应,Ip急剧增加;当带有孔穴的印迹电聚合膜再次对1.0μmol/L桑色素进行特异性识别16 min后,聚合膜上部分孔穴被桑色素占据,供探针离子进入金电极表面的通道再次被堵塞,形成了非导电印迹聚合膜(曲线d),Ip再次明显降低。
3.2.2差分脉冲伏安法采用了DPV法对分子印迹电聚合膜电极进行表征(图3)。在K3Fe(CN)6、K4Fe(CN)6表征溶液中,探针离子直接与裸金电极表面发生了电化学氧化还原反应,Ip为-54.97μA(曲线a);在电聚合液中镀膜后,裸金电极表面形成了一层致密的非导电电聚合膜,阻碍了探针离子进入裸金电极,无法发生氧化还原反应,峰电流急剧降低,Ip减小至-2.00μA(曲线b);而用无水乙醇洗脱后的电聚合膜,形成了带有特异性孔穴的分子电聚合膜,探针离子可以通过孔穴进入裸金电极,发生氧化还原反应,Ip逐渐增大至-40.10μA(曲线c),但是Ip明显小于裸金电极(曲线a)的Ip,很明显,电极表面仍留存有邻氨基酚形成的非导电聚合膜;当带有特异性孔穴的电聚合膜再次吸附模板分子后,电聚合膜上的孔穴完全被模板分子(桑色素)占据,探针离子无法与裸金电极反应,Ip又减小至-9.35μA(曲线d)。带有特异性孔穴后的电聚合膜(曲线c)与裸金电极(曲线a)的Ip存在明显差别,说明带有孔穴的电聚合膜中只有孔穴是探针离子进入裸金电极通道,而电聚合膜是几乎不导电的致密膜。在电聚合液中镀膜后形成的非导电电聚合膜(曲线b)和吸附后的分子印迹膜(曲线d)的Ip相差不大,进一步表明电聚合膜的非导电性与致密性。

图3 裸金电极和不同修电极的差分脉冲伏安图(曲线a~d同图2)Fig.3 DPV ofbare gold electrode andmodified electrode (Curves a-d are the same as in Fig.2)
3.3实验条件的优化
3.3.1邻氨基酚和桑色素摩尔比的优化配制邻氨基酚和桑色素摩尔比分别为16.7∶1,15.0∶1,14.1∶1,13.3∶1,12.5∶1,11.7∶1和10.0∶1的电聚合液;调节其pH≈5.5,分别在金电极上用循环伏安法电聚合(条件见2.3节);得到非导电电聚合膜后,用无水乙醇洗脱模板分子14 min,再用差分脉冲伏安法进行测定,得到洗脱后的峰电流;用相同浓度的桑色素溶液浸泡吸附,得到分子印迹膜,再次用差分脉冲伏安法测定,得到印迹后的Ip。以摩尔比为横坐标,两次测定的Ip之差为纵坐标作图,由图4可知,Ip越大,说明印迹膜上能够识别印迹的桑色素分子越多,因此,邻氨基酚和桑色素的最佳摩尔比为13.3∶1。

图4 不同比例的邻氨基酚与桑色素对峰电流差值的影响Fig.4 Effect of different concentration ratio between o-aminophenol and morin to peak current
3.3.2扫描圈数的优化邻氨基酚与桑色素电聚合液在金电极表面形成的非导电电聚合膜厚度直接影响分子印迹膜的印迹性能和效率。若电聚合膜太薄,形成的孔穴能够识别的印迹分子的活性位点较少,使带有特异性孔穴的电聚合膜印迹效率过低;聚合膜太厚,则会影响电子的传递和镀膜后模板分子的洗脱,因此有必要对扫描圈数进行优化。
将预处理好的金电极置于邻氨基酚与桑色素的摩尔比为13.3∶1的邻氨基酚电聚合液中(pH 5.5),在扫描速率为50mV/s,扫描范围-0.1~0.8 V的条件下,分别扫描25,30,35,40和45圈。用无水乙醇分别洗脱14 min后,用差分脉冲伏安法测定Ip;用相同浓度的桑色素溶液浸泡吸附,再次测定,得到稳定的Ip。以扫描圈数为横坐标,以两次测得的Ip为纵坐标作图(图5)。扫描25圈时,印迹桑色素后峰电流较大,导致膜过薄,印迹上去的模板分子太少,影响了印迹效率;扫描圈数由25圈增加到30圈,洗脱模板分子后的Ip减小,但是印迹效率却明显增大,形成了比较稳定的带特异性识别孔穴的电聚合膜;扫描35~45圈,洗脱后的电流太低,模板分子难以被洗脱,电聚合膜过厚,直接影响到了模板分子的洗脱,影响印迹效率。因此,最佳扫描圈数为30圈。
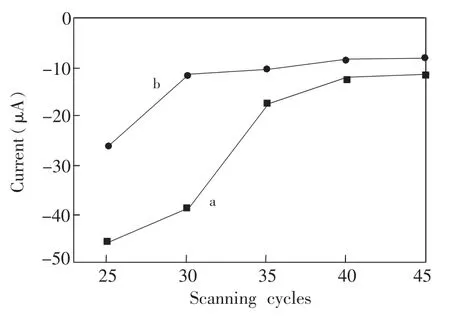
图5 不同扫描圈数对峰电流的影响Fig.5 Influence of differentscanning cycles on peak current (a)移去模板分子的MIP/GE,(b)重新印迹桑色素的MIP/ GE。(a)MIP/GE after template removal,(b)MIP/GE after rebindingmorin.
3.3.3洗脱时间的优化将制得的电聚合膜在无水乙醇中浸泡以洗脱模板分子,洗脱时间在2~16 min范围内(间隔2 min),再用DPV测定Ip。由图6可知,洗脱时间在2~14 min内,随着洗脱时间的延长,Ip逐渐增大;继续洗脱到 14~16 min后,Ip不再增加。因此,在14 min已经洗脱完全,故最佳洗脱时间选取14 min。

图6 洗脱时间对峰电流的影响(插图为洗脱时间及相对应的电流图)Fig.6 The effect of elution time on peak current(Insert is the plot of peak current vs elution time)洗脱时间a~h:2,4,6,8,10,12,14,16 min。Elution time a-h:2,4,6,8,10,12,14,16 min.
3.3.4印迹的最佳pH值的优化将除去模板分子的聚合膜,分别放在不同pH值(3.5,4.5,5.0,5.5,6.0,6.5和7.5)的1.0μmol/L桑色素下印迹16 min,再制得其DPV图。以pH值为横坐标,洗脱后的Ip与印迹后的Ip之差为纵坐标,制得图7。由图7可见,在 pH 3.5~7.5,Ip之差先增大后减少;在pH 5.5时,Ip达到最大,此时印迹效果最佳。因此最佳pH≈5.5。

图7 不同pH值对相应电流的影响Fig.7 Influence of different pH values on response current of the sensor
3.3.5最佳印迹时间的优化将洗脱模板分子后的膜放在1.0μmol/L桑色素溶液(pH 5.5)中进行吸附,吸附时间为6~18 min(间隔2 min),用差分脉冲伏安法测定Ip,从图8可见,吸附时间在6~16 min范围内,Ip逐渐减小;当吸附时间继续延长到 18 min,Ip值变化不大,趋向稳定。故吸附时间选取16 min。
3.4桑色素分子印迹膜工作曲线
将制备的电聚合膜在无水乙醇中浸泡14 min后,得到带有特异识别孔穴的电聚合膜。配制桑色素溶液为0.05,0.10,0.12,0.17,0.25,0.50,1.0,1.2和1.7μmol/L,调节pH≈5.5。将带有特异识别孔穴的电聚合膜分别置于上述溶液中吸附16 min,在表征溶液中用差分脉冲伏安法测定,得到DPV曲线(图9)。以浓度对数lg c为横坐标,Ip为纵坐标,线性回归方程为I(μA)=1.0800lg c(mol/L)+9.3599,线性相关系数R=0.9934,检出限为0.01μmol/L。
3.5分子印迹传感器的稳定性和重现性
在相同的实验条件下,用印迹后的修电极对1.0μmol/L桑色素溶液进行响应电流的测定,重复测定7次,算得其相对标准偏差为5.3%,说明此电极的分子印迹传感器有较好的重复性。将此分子印迹传感器在4℃保存7天后,在同样的环境和实验条件下,再次测定1.0μmol/L桑色素的Ip,发现其响应值下降到约95.6%(RSD=3.2%);14天后测定,响应值下降到约90.2%(RSD=4.1%),说明此分子印迹传感器具有很好的稳定性和良好的使用寿命。
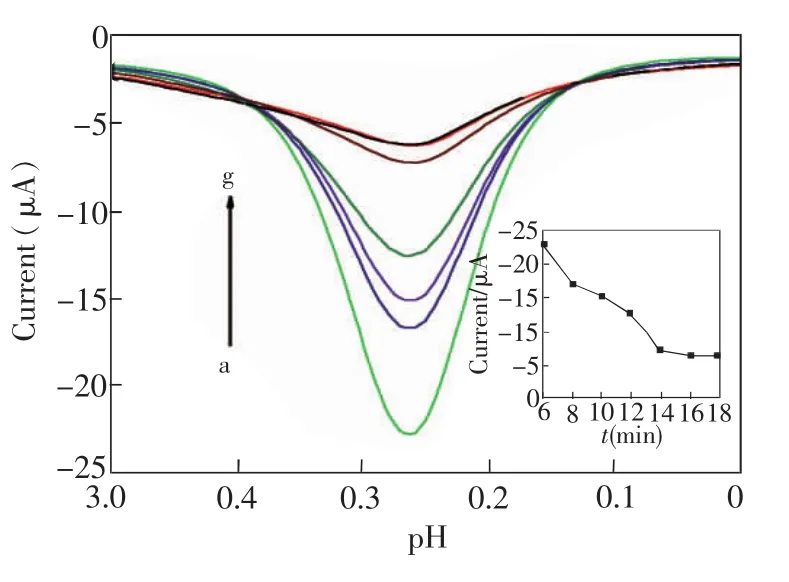
图8 吸附时间对峰电流的影响(插图为吸附时间及相对应的电流图)吸附时间a~g:6,8,10,12,14,16,18 minFig.8 Effect of adsorption time on peak current(Insert is the plot of peak current vs adsorption time).Adsorption time a-g:6,8,10,12,14,16,18 min

图9 印迹不同浓度桑色素MIP/GE差分脉冲伏安曲线(插图为标准曲线)Fig.9 DPV curves of MIP/GE rebinding with morin of different concentration(Insert is the calibration curves of peak current vs morin concentration)
3.6干扰实验
本实验选取了与桑色素结构相似的芦丁和槲皮素分子作为干扰物质,研究分子印迹膜对桑色素分子的选择特异性。将洗脱好的分子印迹膜在1.0μmol/L桑色素溶液中浸泡14 min后,Ip明显减小,表明桑色素能够被印迹膜的分子空穴识别;再将此电极先后放入10μmol/L的芦丁和槲皮素溶液中,Ip基本不再变化,根据电流误差为±5%进行计算,10倍槲皮素和50倍芦丁不干扰测定。表明此传感器对桑色素具有较高的特异识别性。
3.7样品分析
称取3.0 g黑茶3份,分别放置于圆底烧瓶中,加95%无水乙醇100 mL,回流90 min,过滤,离心取上清液,稀释10倍,调至pH≈5.5。再按上述条件测定Ip值,通过标准曲线计算出桑色素含量。采用加标回收法测定方法准确度,在3份5 mL黑茶样品中加入桑色素标准液,按上述操作进行桑色素的回收率的测定,结果见表1。
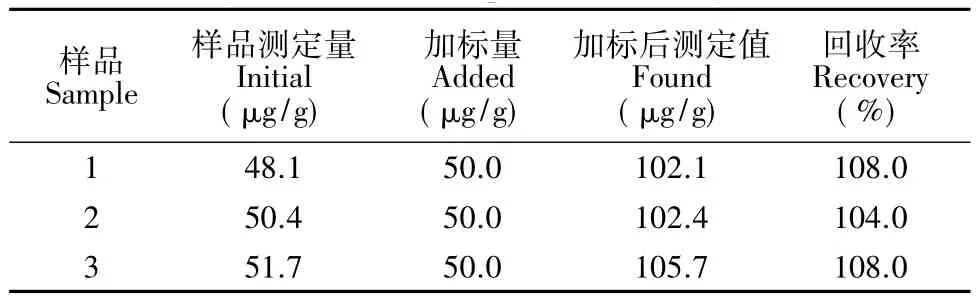
表1 样品测定和加标回收率实验Table 1 Analysis result of sample and recovery test
4 结论
利用电化学聚合的方法制备了对桑色素具有特异性识别的分子印迹膜传感器。研究结果表明,此传感器对桑色素具有响应快速、线性范围较宽(0.05~1.70 mol/L)、灵敏度高、选择性及重复性均较好。
References
1WU Xiang-An.Anhua Black Tea.Changsha:Hunan Publishing House of Science and Technology.2008:16伍湘安.安化黑茶.长沙:湖南科学技术出版社,2008:16
2Gopal JV.Pharm J.,2013,5(3):123-126
3WANG Xiu-Lin.Metaluragicall Anaysis,1992,12(3):36-40王修林.治金分析,1992,12(3):36-40
4Naso L G,Lezama L,Rojo T,Etcheverry SB,ValcarcelM,Roura M,Salado C,Ferrer EG,Williams P A M.Chemico-Biological Interactions,2013,206(2):289-301
5JIA Xiao-Yan,LINian-Bing,LUO Hong-Qun.Chinese J.Pharm.Anal.,2010,30(2):266-270贾小燕,李念兵,罗红群.药物分析杂志,2010,30(2):266-270
6YANG Li,LIU De-Long,WEIYong-Ju.Journal of Instrumental Analysis,2014,33(9):1038-1043杨莉,刘德龙,魏永巨.分析测试学报,2014,33(9):1038-1043
7ZHANG Jun-Cai.Journal of Instrumental Analysis,2006,25(1):112-114张君才.分析测试学报,2006,25(1):112-114
8HUANG Fei,ZENG Bai-Zhao,ZHAO Fa-Qiong,YANG Yu-Xia.Journal of Analytical Science,2004,20(2):125-128黄菲,曾百肇,赵发琼,杨玉霞.分析科学学报,2004,20(2):125-128
9Liu J,Li Y,Wu X,WangW,Ye B.Sensor Lett.,2013,11(9):1579-1585
10WANG Chun-Qiong,BAIHui-Ping,CHEN Jing,CAO Qiu-E.Chinese J.Anal.Chem.,2014,42(6):842-846王春琼,白慧萍,陈瑾,曹秋娥.分析化学,2014,42(6):842-846
11GAO Yang,WANG Wei,LIU Ying-Zi,TAO Qiang,WAN Xue,ZHANG Juan-Kun.Chinese J.Anal.Chem.,2015,43(2):212-217高杨,王伟,刘英姿,陶强,万雪,张娟琨.分析化学,2015,43(2):212-217
12Behzad R,Najmeh M,Ali A.E.Anal.Method.2011,11(3):2510-2516
13Sun S,Zhang M Q,Li Y J,He XW.Sensors,2013,13(5):5493-5506
14LIU Rong,ZHONG Tong-Sheng,LONG Li-Ping,YING Zhi-Fang,CAOWei.Chinese J.Appl.Chem.,2013,30(11): 1361-1365刘蓉,钟桐生,龙立平,尹志芳,曹伟.应用化学,2013,30(11):1361-1365
15WU Zhao-Yang,LUO Fei-Fei,LUAN Cong-Lin,JIANG Xiao-Hua,MEIQiong-Zhi.Journal of Hunan University(Natural Sciences),2013,40(10):79-82吴朝阳,罗飞飞,栾崇林,蒋晓华,梅琼之.湖南大学学报(自然科学版)2013,40(10):79-82
Thiswork was supported by the National Natural Science Foundation of China(No.21545003)
Fabrication and Application of a Molecularly Imprinted Sensor for Morin Detection
LIU Rong1,2,LONG Li-Ping*1,LEICun-Xi1,Wu Zhao-Yang2,LIU Yu1,LISi-Jia1
1(College of Chemistry&Environmental Engineering,Hunan City University,Yiyang 413000,China)2(State Key Laboratory of Chemo/Biosensing and Chemometrics,Hunan University,Changsha 410082,China)
Based on the intermolecular interaction,a molecularly imprinted polymer electrochemical sensor with specific identification of cavity on gold electrode surface was proposed with o-aminophenol as functional monomers and morin as template molecule.The performance and effect of MIP were investigated by cyclic voltammetry(CV)and differential pulse voltammetry(DPV).Factors affecting the properties of sensor,such as polymeric membrane ratio,scanning cycles,elution time and adsorption time were investigated.Substances which had a similar structure tomorin was used to compared the selective response.The result showed that the sensor had a good selectivity tomorin.Under the optimized experiment conditions,the current response of the imprinted sensorwas linear to the concentration ofmorin in the range of0.05-1.7μmol/Lwith linear equation as follows:I(μA)=1.0800lg c(mol/L)+9.3599(R=0.9934),and the detection limit of 0.1μmol/L.The sensor was used to determine the contentofmorin in black tea samples,and the recoveries of standard addition were between 104.0%and 108.0%.
Molecularly imprinted;Morin;Electrochemical sensor;Electropolymerization
26 September 2015;accepted 27 November 2015)
10.11895/j.issn.0253-3820.150761
2015-09-26收稿;2015-11-27接受
本文系湖南省教育厅高校科研一般项目(No.15C0244),国家自然科学基金项目(No.21545003),湖南省自然科学基金项目(No.2015JJ2023),湖南省高校科技创新团队支持计划项目(No.2014)207号)资助
*E-mail:llping401@163.com

