产氨菌化学诱变及浸出低品位铜矿试验研究
胡凯建,吴爱祥,王洪江,王少勇
产氨菌化学诱变及浸出低品位铜矿试验研究
胡凯建,吴爱祥,王洪江,王少勇
(北京科技大学金属矿山高效开采与安全教育部重点实验室,北京,100083)
以碱性产氨菌为原始菌种,使用盐酸羟胺对其进行化学诱变,考察诱变前后细菌活性、形貌以及浸铜能力的变化。研究结果表明:盐酸羟胺的诱变作用提高细菌的活性以及浸铜能力。1.5%(质量分数)的盐酸羟胺为最佳诱变剂含量,在此条件下细菌的致死率为81.00%、正突变率为16.67%。与诱变前细菌相比,诱变后细菌生长到达稳定期时间缩短10 h,稳定期细菌浓度提高30.00%,产氨量提高17.60%,诱变后细菌尺寸与形状未发生变化,但其表面分泌物增多。使用诱变菌种浸出铜矿石,168 h后铜浸出率达58.52%,比诱变前细菌浸出率提高10.21%。浸出后矿石表面细颗粒矿物消失,矿石表面未形成结晶或沉淀,表面孔裂隙明显增多。
低品位铜矿;生物浸出;化学诱变;细菌;氨
随着铜矿资源日益紧张,低品位铜矿的开发与利用越来越受到关注,微生物浸出以其成本低、操作简单、低能耗、绿色环保等优点被广泛应用于低品位铜矿的处理过程中[1−2]。但由于脉石耗酸量大、浸出体系pH波动大不利于微生物生长、酸浸结垢阻碍浸出[3−4]等问题,使得传统嗜酸微生物处理低品位高含碱性脉石铜矿的效果不佳。利用碱性产氨菌可有效避免以上问题,其浸出环境为碱性,浸出过程中脉石不参与反应,可有效处理高含碱性脉石低品位铜矿[5]。高效碱性浸矿微生物育种的研究对于降低浸矿成本、实现绿色矿山、丰富微生物浸矿菌种具有重要意义。在浸矿育种方面,诱变育种作为一种获取高效浸出菌种的方法得到了广泛应用,其中化学诱变育种因其操作简单、易于控制、基因损伤小及突变率高等特点,成为运用最为广泛的诱变育种技术之一[6−8]。董颖博等[9]采用盐酸羟胺对T.f6菌株进行化学诱变,获得了一株高效浸铜菌种,其浸铜效果比原始菌种提高了20.70%;徐晓军等[8]使用盐酸羟胺对氧化铁硫杆菌进行化学诱变,诱变后菌种活性提高了37.40%,对黄铜矿的浸出率提高了11.50%。盐酸羟胺是具有特异诱变效应的诱变剂,通过与胞嘧啶发生反应引起细胞DNA结构发生变化,进而产生诱变效果[10]。本文作者以本实验室已筛选出的优良碱性产氨菌种为原始菌种,采用盐酸羟胺作为诱变剂对细菌进行化学诱变,分析盐酸羟胺对于细菌的诱变效果,考察诱变前后细菌生长、产氨、形态的变化,并以云南某矿的低品位高含碱性脉石氧化铜矿为浸出对象,开展细菌浸铜试验,对诱变前后细菌浸铜效果及浸出过程进行分析,同时对浸出前后矿石表面形貌变化进行测试分析。
1 试验
1.1 试验矿样
试验矿样为取自云南某矿的氧化铜矿石,其化学组成如表1所示。该矿石中主要含铜矿物为孔雀石、硅孔雀石,次有黄铜矿、辉铜矿等;脉石矿物主要以硅酸盐为主,次有碳酸盐类及氧化物类,矿石含泥量较高,为典型的难处理高碱性氧化铜矿。试验中将矿石粒度加工至74 μm以下进行浸出。

表1 矿石化学组成(质量分数)
1.2 碱性菌种
试验所使用的碱性菌种分离自内蒙古某处碱性土壤中,经16Sr DNA鉴定,此菌种属普罗威登斯菌属(),与.具有99%的同源性,将其命名为[11]。该菌种为革兰氏阴性,兼性厌氧。本试验使用尿素培养基作为的生长及浸矿的培养基,尿素培养基成分及质量浓度如表2所示,其中柠檬酸钠为细菌碳源,尿素为细菌氮源,代谢过程中细菌可将尿素分解为氨。细菌的培养条件如下:初始pH为7.0,温度为30 ℃,转速为180 r/min。

表2 培养基成分表(质量浓度)
2 试验原理和方法
2.1 细菌浸铜试验原理
碱性细菌属于异养型细菌,其浸铜的主要作用有细菌对矿石的侵蚀作用、铜氨络合反应、氧化还原作用以及细菌分泌的蛋白质和胞外多聚物的络合作用[5,12]。此菌种在浸出铜矿石时浸出液中主要发生的化学反应如下:
(4)

2.2 菌种诱变试验
恒温培养细菌至对数生长期后取培养液50 mL,置于离心机中以5 000 r/min的速度离心20 min,去除上清液后以无菌生理盐水洗涤菌体,重复操作3次,得到细菌悬浊液,利用血球计数板进行细菌计数,使用无菌生理盐水调细菌浓度调至108个/mL,作为待处理菌液。
取待处理菌液10 mL加入到90 mL含有不同质量分数的盐酸羟胺(0.50%,1.00%,1.50%,2.00%和3.00%)的尿素培养基中进行诱变培养。诱变培养4 d后对溶液中的细菌进行计数,得到诱变剂浓度与细菌致死率的关系。以传代时间和产氨量作为考察菌种正突变的指标,将不同诱变剂量下的诱变细菌稀释后接入牛肉膏蛋白胨平板培养基培养,控制菌液稀释度,以0.10 mL稀释后的菌液在平板上培养出现菌落30~50个为宜,随机挑选平板上菌落30株接入尿素培养基中,考察细菌的传代时间和产氨量确定诱变菌种的正突变率,并选出最优正突变菌种用于浸铜试验。
2.3 诱变菌种浸铜试验
设计3组浸铜试验:1) 诱变后的细菌浸铜试验;2) 诱变前的细菌浸铜试验;3) 无菌对照试验。每组做3组平行试验。取最优正突变菌落接入尿素培养基中培养至对数期,使用无菌生理盐水将其调至1×108个/mL作为浸矿菌种。将80 mL的尿素培养基加至250 mL的锥形瓶中,将浸矿菌种以20%的质量分数接种至尿素培养基中,同时以8.00%的矿浆质量分数添加铜矿粉至锥形瓶的浸出液中。置于恒温摇床内振荡培养,培养温度为30 ℃、摇床转速为180 r/min,浸出168 h并定期测定浸出液中细菌浓度、pH以及Cu2+质量分数。
2.4 试验测试与分析
溶液中细菌浓度通过血球计数板在显微镜下直接测得;溶液pH通过数显pH计测得;细菌的产氨量通过盐酸滴定法测得;浸出液中Cu2+质量分数通过原子吸收分光光度计测得;诱变前后细菌形态变化以及浸出前后矿石表面形貌变化通过扫描电镜(SEM)观察。
3 结果与讨论
3.1 盐酸羟胺诱变效果分析
盐酸羟胺是一种具有特异诱变效应的诱变剂,它几乎只和胞嘧啶发生反应,能够专一性地引起G: C→A:T转换,同时羟胺能与细胞中的一些物质反应生成过氧化氢,同样能对细胞产生诱变作用。诱变剂的浓度是决定诱变效果的重要参数,而且直接影响细菌的致死率。图1所示为不同质量分数的盐酸羟胺下细菌的致死率。由图1可知:盐酸羟胺的质量分数越高,的致死率越高,当盐酸羟胺质量分数为0.50%~1.00%时,细菌致死率为53.00%~75.00%,说明此细菌在低诱变剂时已有较高的致死率;当盐酸羟胺质量分数大于1.50%时,细菌致死率则高于80.00%,而盐酸羟胺质量分数为3.00%时,细菌几乎100.00%死亡。盐酸羟胺和胞嘧啶反应后,胞嘧啶结构发生变化并与腺嘌呤配对,引起DNA结构变化。当盐酸羟胺质量分数较高时,羟化作用增强导致细菌DNA结构变化较大;当菌体的遗传变异幅度过大时将导致细菌死亡[10]。
以传代时间和产氨量作为考察菌种正突变的指标,考察不同诱变剂质量分数对细菌突变的影响,结果如表3所示。当细菌致死率较低(小于71.00%)时,存活的细菌相对较多,但其中筛选出大幅度提高的正突变菌种较少;而当致死率较高时,细菌存活较少,但在不多的细胞中筛选到大幅度提高的正突变菌种的可能性较大[13];当诱变剂质量分数为1.50%时,致死率为81%,菌种的正突变率为16.67%。因此,选取1.50%为最佳诱变剂质量分数,使用此诱变剂质量分数下的正突变菌种进行培养与浸矿。
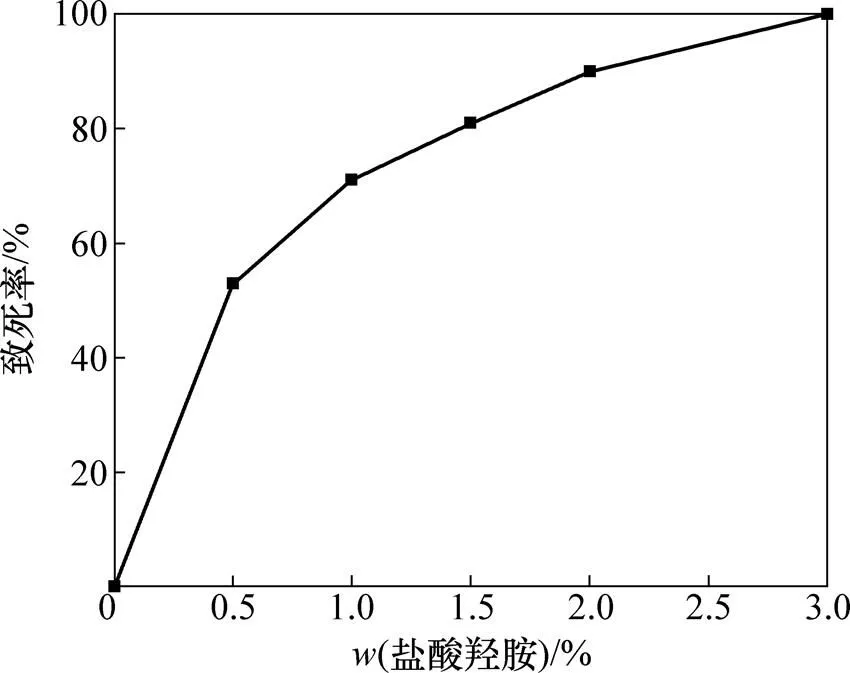
图1 盐酸羟胺质量分数对细菌致死率的影响

表3 诱变作用对Providencia Jat-1菌的影响
3.2 诱变细菌生长与形态分析
为保证突变菌种的稳定性,对1.5%诱变剂下的正突变菌落进行反复传代培养,观测其稳定性并优选出最佳正突变菌种。培养条件如下:初始pH为7.0,温度为30 ℃,转速为180 r/min。通过考察细菌的传代时间和产氨量确定正突变菌落,将最佳正突变菌种接入尿素培养基中,其生长以及产氨情况如图2和图3所示。
诱变后细菌的生长速度明显得到提高,其达到稳定期的时间为40 h,与诱变前菌种相比提前了10 h,溶液中细菌浓度最高达到7.38×108个/mL,与原菌种相比提高了30.00%。该菌以尿素为氮源,在生长过程中分解尿素产生氨,故在细菌对数期时培养液内氨浓度增长较快,在细菌达到稳定期后,溶液的氨质量浓度增长较慢并趋于平缓。70 h时诱变菌液中氨质量浓度最高可达8.21 g/L,与原菌种相比提高1.23 g/L,即诱变后细菌产氨能力提高了17.60%。

1—诱变前;2—诱变后。

图3 诱变前后细菌产氨对比
盐酸羟胺诱变作用使细菌的DNA结构发生变化,这也将导致细菌的尺寸和形状等形态变化。通过扫描电镜对诱变前后菌种的形态进行观察分析,如图4所示。诱变前细菌(图4(a))形状为杆状,菌长为1.5~3.0 μm,直径为0.2~0.4 μm,表面光滑并附着有少量分泌物,细菌聚团分布。诱变后细菌(图4(b))形状仍呈杆状,其直径也基本未发生变化。但与诱变前细菌相比,诱变后细菌表面观察到的分泌物增多,如图4(b)所示,其原因在于诱变环境中,细菌细胞分泌出一些多糖和蛋白质来适应环境变化,并达到自我保护的目的[14−15]。

(a) 诱变前;(b) 诱变后
3.3 诱变菌种浸铜效果分析
对诱变前后菌种浸铜效果进行对比研究,取对数期菌液使用无菌生理盐水将其浓度调至1×108个/mL,并以20%的接种浓度接入矿浆质量分数为8%的浸出液中,以无菌组作为对照,在温度30 ℃、摇床转速180 r/min的条件下浸出168 h,结果如图5所示。从图5可见:无菌组在浸出过程中的铜浸出率基本没有变化;细菌浸出试验中,铜浸出率随时间而不断升高,在浸出96 h后趋于稳定。浸出168 h后,在诱变后细菌作用下铜浸出率达58.52%,与诱变前细菌相比浸出率提高了10.21%。
碱性产氨菌属异养型细菌,其浸铜主要通过铜氨络合作用、细菌的侵蚀作用、氧化还原反应等作用实现,细菌的生长活性与代谢产氨能力决定了铜的浸出效果。以诱变菌浸铜体系为例,浸出体系中细菌的生长与pH变化如图6所示。细菌在浸出体系中由于受到矿浆的抑制作用,其生长迟缓期为24 h,比正常条件下延迟近8 h。在浸出24 h后,细菌生长进入对数期,此阶段铜的浸出率随细菌浓度上升而升高较快;在浸出88 h后细菌进入衰退期,随细菌的活性与数量不断下降,铜的浸出速率也不断下降,在浸出144 h后铜浸出率基本保持不变。浸出初期,碱性矿物的溶解以及细菌代谢产氨导致溶液pH不断升高,随细菌产氨量增多pH最高达9.68,浸出后期pH在这一水平基本保持不变。由此可知,pH对铜的浸出率影响较小,铜浸出效果主要受细菌浓度与活性影响,浸出后期,由于溶液中细菌赖以生长的营养物质消耗殆尽,细菌浓度与活性不断降低,铜浸出率基本保持不变。为提高铜的浸出率,在浸出后期需添加新鲜的细菌培养基,保证细菌生长代谢活性。

1—诱变前;2—诱变后;3—无菌对照。

1—细菌数量;2—pH。
3.4 浸出前后矿石表面形貌分析
通过电镜扫描对浸出前后矿石的表面形貌进行分析,如图7所示。浸出前(图7(a))矿石表面颗粒致密,颗粒均匀且孔隙较少。浸出后矿石表面(图7(b))受到明显的腐蚀,矿石表面细颗粒矿物基本消失,孔裂隙明显增多。结合表面能谱分析对矿石表面元素变化进行研究,结果如表4所示。由表4可知:浸出后,由于铜离子被浸出,矿石表面的Cu元素质量分数明显降低。Fe,Mg和Ca的质量分数在浸出后有所下降,但并未大幅减少,表明在浸出过程中脉石矿物并未参与反应。Si元素在矿石中主要以硅孔雀石、二氧化硅形态存在,在浸出后其质量分数降低,表明在细菌浸出过程中,由于细菌侵蚀以及络合作用,硅孔雀石被浸出[5]导致矿石表面Si元素质量分数降低。浸出前,矿石表面几乎未检测到C元素,而浸出后表面检测到大量C元素,O元素质量分数也大幅度增加,这是尿素分解产生的CO2与矿石中的CaO等碱性脉石发生反应生成碳酸盐所致。
之前研究表明[16]:酸浸处理高碱性氧化铜矿石时,矿石表面会出现大量的CaSO4化学沉淀,并堵塞了矿石表面的孔裂隙,阻碍浸出反应的进行。而由图7(b)可知:浸出后矿石表面孔裂隙明显增多,结合能谱分析结果可以确定,浸出后矿石表面并未形成大量的结晶或沉淀,这也说明使用碱性产氨菌处理高碱性低品位铜矿石在技术上比酸浸更加合理。

(a) 浸出前;(b) 浸出后

表4 浸出前后矿石表面能谱分析结果(质量分数)
4 结论
1) 盐酸羟胺质量分数为1.50%时对细菌的诱变作用最佳,在此条件下细菌的致死率为81.00%、正突变率为16.67%,选取此诱变剂含量下的正突变菌种进行培养与浸矿。
2) 与诱变前菌种相比,诱变后细菌生长达到稳定期的时间提前了10 h,稳定期细菌数量提高了30%,产氨能力提高了17.60%。诱变后细菌的直径与形状基本未发生变化,但细菌表面的分泌物增多,细菌以此来适应环境变化并进行自我保护。
3) 使用诱变菌种浸矿168 h后铜浸出率达58.52%,与诱变前菌种相比铜浸出率提高了10.21%。受矿浆抑制作用细菌到达对数期生长时间延迟8 h;浸出88 h后,随细菌浓度不断下降,铜的浸出速率也不断下降。为提高铜的浸出率,在浸出后期须添加新鲜细菌培养基以保证细菌生长代谢活性。
4) 浸出后矿石表面受到明显腐蚀,细颗粒矿物基本消失,矿石表面未形成结晶或沉淀,表面孔裂隙明显增多。与原矿石相比,浸出后矿石表面Cu和Si元素质量分数降低,Fe,Mg和Ca元素未大幅度变化,C和O元素质量分数增加。
参考文献:
[1] 李宏煦. 硫化铜矿的生物冶金[M]. 北京: 冶金工业出版社, 2007: 1−5. LI Hongxu. Bio-metallurgical of sulfide copper[M]. Beijing: Metallurgical Industry Press, 2007: 1−5.
[2] VAKYLABAD A B. A comparison of bioleaching ability of mesophilic and moderately thermophilic culture on copper bioleaching from flotation concentrate and smelter dust[J]. International Journal of Mineral Processing, 2011, 101(1): 94−99.
[3] 严佳龙, 王洪江, 吴爱祥, 等. 羊拉铜矿氧化铜矿柱浸扩大试验研究[J]. 矿冶工程, 2011, 31(2): 79−82. YAN Jialong, WANG Hongjiang, WU Aixiang, et al. Expanded experiment on column leaching of copper oxide ore in Yangla Copper Mine[J]. Mining and Metallurgical Engineering, 2011, 31(2): 79−82.
[4] LIU Zhixiong, YIN Zhoulan, HU Huiping, et al. Leaching kinetics of low-grade copper ore containing calcium-magnesium carbonate in ammonia-ammonium sulfate solution with persulfate[J]. Transactions of Nonferrous Metals Society of China, 2012, 22(11): 2822−2830.
[5] 王洪江, 熊有为, 吴爱祥, 等. 产氨细菌浸出碱性氧化铜矿[J]. 北京科技大学学报, 2013, 35(9): 1126−1130. WANG Hongjiang, XIONG Youwei, WU Aixiang, et al. Alkaline copper oxide ore bioleaching by ammonia-producing bacteria[J]. Journal of University of Science and Technology Beijing, 2013, 35(9): 1126−1130.
[6] XU Ailing, XIA Jinlan, ZHANG Shuai, et al. Bioleaching of chalcopyrite by UV-induced mutagenized Acidiphilium cryptum and Acidithiobacillus ferrooxidans[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(2): 315−321.
[7] 杨宇, 张帅, 徐爱玲, 等. 隐藏嗜酸菌DX1-1和氧化亚铁硫杆菌CMS的紫外诱变育种及浸矿研究[J]. 中南大学学报(自然科学版), 2010, 41(2): 393−399. YANG Yu, ZHANG Shuai, XU Ailing, et al. UV-induced mutagenesis and bioleaching of Acidiphilium cryptum and Acidithiobacillus ferrooxidans[J]. Journal of Central South University (Science and Technology), 2010, 41(2): 393−399.
[8] 徐晓军, 宫磊, 孟云生, 等. 硫杆菌的化学诱变及对低品位黄铜矿的浸出[J]. 金属矿山, 2004 (8): 42−44. XU Xiaojun, GONG Lei, MENG Yunsheng, et al. Chemical mutation of bacterium T.f and its leaching of low grade chalcopyrite ores[J]. Metal Mine, 2004(8): 42−44.
[9] 董颖博, 林海, 傅开彬, 等. 细菌化学诱变对低品位铜尾矿微生物浸出的影响[J]. 北京科技大学学报, 2011, 33(5): 532−538. DONG Yingbo, LIN Hai, FU Kaibin, et al. Effects of chemical mutation on the microbial leaching of low grade copper tailings[J]. Journal of University of Science and Technology Beijing, 2011, 33(5): 532−538.
[10] 施巧琴, 吴松钢. 工业微生物育种[M]. 福州: 福建科学技术出版社, 1991: 54−55. SHI Qiaoqin, WU Songgang. Breeding of industrial microbes[M]. Fuzhou: Fujian Science and Technology Publishing House, 1991: 54−55.
[11] 王洪江, 吴爱祥, 熊有为, 等. 一株产氨浸铜细菌的分离与鉴定[J]. 北京科技大学学报, 2014, 36(11): 1443−1447. WANG Hongjiang, WU Aixiang, XIONG Youwei, et al. Isolation and identification of an ammonia-producing copper leaching strain[J]. Journal of University of Science and Technology Beijing, 2014, 36(11): 1443−1447.
[12] JAIN N, SHARMA D K. Biohydrometallurgy for nonsulfidic minerals: a review[J]. Geomicrobiology Journal, 2004, 21(3): 135−144.
[13] DONG Y, LIN H, WANG H, et al. Effects of ultraviolet irradiation on bacteria mutation and bioleaching of low-grade copper tailings[J]. Minerals Engineering, 2011, 24(8): 870−875.
[14] WINGENDER J, NEU T R, FLEMMING H C, et al. Microbial extracellular polymeric substances: characterization, structure, and function[M]. Berlin: Springer Science and Business Media, 1999: 12−15.
[15] SAND W, GEHRKE T. Extracellular polymeric substances mediate bioleaching/biocorrosion via interfacial processes involving iron (III) ions and acidophilic bacteria[J]. Research in Microbiology, 2006, 157(1): 49−56.
[16] 吴爱祥, 王少勇, 尹升华, 等. 高碱氧化铜矿堆浸过程中的化学沉淀与调控[J]. 中南大学学报 (自然科学版), 2012, 43(5): 1851−1857. WU Aixiang, WANG Shaoyong, YIN Shenghua, et al. Chemical precipitation and control in process of heap leaching of high-alkali oxide copper ore[J]. Journal of Central South University (Science and Technology), 2012, 43(5): 1851−1857.
(编辑 杨幼平)
Experimental study on chemical mutation of ammonia-producing bacteria and bioleaching of low grade copper ore
HU Kaijian, WU Aixiang, WANG Hongjiang, WANG Shaoyong
(Key Laboratory of Ministry of Education for Efficient Mining and Safety of Metal Mines,University of Science and Technology Beijing, Beijing 100083, China)
The effects of chemical mutation by hydroxylamine hydrochloride on the activity and morphology of bacteria and its ability of copper bioleaching were investigated with the alkaline ammonia-producing bacteriaas an original strain. The results show that the activity of the bacteria and its ability of bioleaching are improved after chemical mutation by hydroxylamine hydrochloride. The best mass fraction of hydroxylamine hydrochloride for mutation is 1.5%. After being treated at this condition, the lethality rate of bacteria is 81.00% and the positive mutation rate is 16.70%. Compared to the original bacteria, the bacteria after mutation reaches stationary phase 10 h ahead of the original bacteria, the concentration of bacteria at stationary phase is improved by 30.00% and ability of producing ammonia is improved by 17.60%, the diameter, length and shape of bacteria do not change but the extracellular secretion increases. The bioleaching of copper ore using bacteria after mutation is carried out and the copper recovery is 58.52% after 168h bioleaching, which is improved by 10.21% compared to the original bacteria. When bioleaching the fine particles is absent and no crystals precipitation is formed on the surface, the pores and fractures are increased obviously.
low grade copper ore; bioleaching; chemical mutation; bacterial; ammonia
10.11817/j.issn.1672-7207.2016.10.001
TD982
A
1672−7207(2016)10−3289−06
2015−10−16;
2016−01−06
国家“十二五”科技支撑计划项目(2012BAB08B02);国家自然科学基金资助项目(51304011,51374035)(Project (2012BAB08B02) supported by the National Science and Technology Pillar Program during the 12th Five-year Plan Period; Projects(51304011, 51374035) supported by the National Natural Science Foundation of China)
王洪江,博士,教授,从事充填采矿、溶浸采矿及岩石力学研究;E-mail:wanghj1988@126.com

