人类与肠道微生物的共生关系
徐弘君王新明肖 林覃树林
(1 禹城市人民医院,禹城 251200;2 山东龙力生物科技股份有限公司,禹城 251200;3 山东省功能糖工程研究中心,禹城 251200)
人类与肠道微生物的共生关系
徐弘君1王新明2,3肖 林2覃树林2,3
(1 禹城市人民医院,禹城 251200;2 山东龙力生物科技股份有限公司,禹城 251200;3 山东省功能糖工程研究中心,禹城 251200)

徐弘君,消化内科主任医师。长期致力于肠道微生态疾病诊断和治疗的研究。主持参加国家重点课题肠道微生态制剂在消化道疾病治疗中的应用研究。
〔编者按〕
近年来的研究发现,曾经被长期忽视的人体微生物组特别是肠道菌群,与人体的多种疾病相关联,深刻影响了疾病的治疗和临床研究,包括体重、糖尿病、免疫系统、肠道疾病、代谢疾病、炎症、心脏病、大脑神经系统等等,被认为是人体的“第二基因库”,但由于大部分的肠道细菌难以在体外分离培养,对肠道菌群的进一步研究也受到了限制。随着现代分子生物技术的蓬勃发展,已解决了不可培养微生物研究的难题,使得肠道微生物的研究进入一个新的阶段。为此,我们特别邀请了禹城市人民医院、山东龙力公司等单位的专家,以连载的形式,主要从基础研究(肠道微生物的角色)、临床(肠道微生物与健康、微生物制剂与药物联用)、产业(微生态制剂的开发)等方面展开,对肠道微生态学研究及相关产业的发展进行解读。
H O O P E R L V, L I T T M A N D R,MACPHERSON A J. Interactions between the microbiotaand the immune system. Science,2012,336:1268-1273.
2 参考文献
ECKBURG P B,BIK E M,BERNSTEIN C N,et al. Diversity of the human intestinal microbial flora. Science,2005,308(5728):1635-1638.
3 参考文献
MARTENS E C,CHIANG H C,GORDON J I. Mucosal glycan foraging enhances fitness and transmission of a saccharolytic human gut bacterial symbiont. Cell Host & Microbe,2008,4(5):447-457.
4 参考文献
COMSTOCK E. Importance of glycans to the host-bacteroides mutualism in the mammalian intestine. Cell Host & Microbe, 2009, 5(6):522-526.
5 参考文献
LEY R E, PETERSON D A, Gordon J I. Ecological and evolutionary forces shaping microbial diversity in the human intestine. Cell,2006, 124(4):837-848.
6 参考文献
JOHANSSON M E, LARSSON J M,HANSSON G C. The two mucus layers of colon are organized by the MUC2 mucin, whereas the outer layer is a legislator of host-microbial interactions. Proceedings of the National Academy of Sciences,2011, 108 Suppl 1(11):4659-4665.
7 参考文献
刘少凌, 陈运彬, 杨杰. 肠道益生菌对新生儿免疫系统的影响. 中国新生儿科杂志, 2006,21(6):380-382.
1 营养代谢
人类的消化道负责从摄入的食物中获取营养,分泌消化液将食物分解为可以吸收的物质,食物由口腔经胃、小肠到达结肠时剩余一些机体不可消化吸收的非淀粉多糖,这些物质最终可以被结肠中的微生物分解代谢。拟杆菌不仅可以分解人体不能分解的植物多糖,还可以分解人体产生的黏多糖、消化酶等。结肠中的B. thetaiotaomicron VPI-5482基因组中包含88个多糖运输、降解的利用位点(PULs),利用图1所示途径,多糖最终被降解为人体可以利用的短链脂肪酸,或者合成自身需要的多糖和宿主免疫相关的糖蛋白3。
人体中的胆酸、胆固醇和一些激素需要肝脏和肠道微生物共同代谢完成,微生物可以产生大量人体不具备的酶,协助肝脏代谢这些难分解物质,肝肠协同还具有外源药物的解毒等功能4。
肠道微生物能够合成B族和K族维生素、叶酸、多种氨基酸等供给人体,还可以促进肠黏膜上皮细胞增殖,促进肠道发育,很多实验表明,无菌饲养的动物会出现肠组织发育不健全现象5。人体与肠道微生物的营养代谢关系不仅保证了食物的充分利用,而且微生物自身获得营养的同时,将原本无法降解的食物转化为对人体有益的物质。
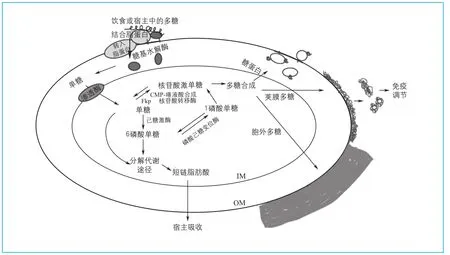
图1 肠道中脆弱拟杆菌聚糖利用合成途径
2 免疫调节
肠道中的上皮细胞外有一层黏蛋白组成的黏膜,将肠道表面封闭形成屏障,阻止细菌与上皮细胞结合进入肠道细胞,并通过肠蠕动将附着在黏膜上的细菌一同排出体外。黏膜有利于厌氧的双歧杆菌等定植、生长,这些肠道厌氧菌也有利于黏蛋白的分泌,促进黏膜生成。同时,它们还和“过路菌”竞争营养,代谢产物短链脂肪酸形成酸性环境,从而抑制外来细菌生长6。
新生儿以及无菌饲养的动物的抗体形成以及淋巴系统等免疫系统的发育会出现不良现象,新生儿成长过程中,或者将无菌动物置于正常环境中,他们的肠道内菌群量不断增多,肠道菌群作为抗原诱导肠道淋巴组织发育,体液和细胞免疫功能也会随之完善7。
肠道适应性免疫应答假说提出,肠道中含有大量的免疫球蛋白(lgA),lgA和T细胞组成的免疫屏障对共生微生物没有免疫反应,而当外源病菌突破肠道微生物黏膜和上皮细胞膜时,T细胞和lgA迅速产生免疫应答或炎症,肠道中的双歧杆菌、乳酸杆菌等可以促进lgA的产生89。
肠道共生微生物不被人体的免疫系统所排斥,一方面是因为肠道微生物与宿主的细胞表面抗原同质化,如前文提到,在营养代谢过程中,肠道微生物可以利用多糖转化合成人体所需要的糖蛋白和自身需要的多糖,两种物质具有一定的同源性,这些糖蛋白便有一部分组成肠道细胞抗原,同源的微生物细胞表面多糖使得宿主免疫系统无法识别10。另一方面,肠道微生物中的脆弱型拟杆菌产生的多糖可以刺激调节性T(Treg)细胞分化,一些梭状芽胞杆菌刺激肠上皮细胞产生的TGF-β也能诱导T细胞分化为Treg,虽然肠道菌群中的分节丝状菌会诱导T细胞产生能够介导机体炎症的辅助性T细胞(Th17),但是Treg可以有效降低Th17的效用,保证肠道菌群不诱发机体产生肠道反应11。
8 参考文献
GEUKING M B, MCCOY K D, MACPHERSON A J. The function of secretory IgA in the context of the intestinal continuum of adaptive immune responses in host-microbial mutualism. Seminars in Immunology, 2012, 24(1):36-42.
9 参考文献
KAETZEL C S. Cooperativity among secretory IgA, the polymeric immunoglobulin receptor, and the gut microbiota promotes hostmicrobial mutualism. Immunology Letters, 2014 162(2ptA):10-21.
10 参考文献
刘威, 姚文, 朱伟云. 人体与肠道微生物间的互惠共生关系. 世界华人消化杂志, 2006,14(11):1081-1088.
11 参考文献
王珊珊, 王佳堃, 刘建新. 肠道微生物对宿主免疫系统的调节及其可能机制. 动物营养学报,2015, 27(2):375-382.
12 参考文献
ARUMUGAM M, RAES J, PELLETIER E, et al. Enterotypes of the human gut microbiome. Nature, 2011, 473(7346):174-180.
13 参考文献
徐爱蕾, 黄毅, 王为. 16SrRNA基因序列分析技术在肠道菌群检测中的应用进展. 临床消化病杂志, 2015, 27(3):186-189.
14 参考文献
陈娜, 杨毅, 张澜, 等. Illumina高通量测序技术分析早产儿出生后肠道菌群变化的初步研究.中国循证儿科杂志, 2014, 9(5):359-364.
15 参考文献
许波, 杨云娟, 李俊俊. 宏基因组学在人和动物胃肠道微生物研究中的应用进展. 生物工程学报, 2013, 29(12):1721-1735.
3 基因层面
个体间肠道微生物数量和组成各不相同,并表现出一定的地域性和民族性12,目前,利用分子生物学方法对肠道微生物进行分类和鉴定,可以在基因水平了解肠道微生物的种类、功能、与宿主共生关系的机制。包括16SrRNA基因测序技术、宏基因组学技术和代谢组学技术等。
16SrRNA基因测序技术通过测定特定微生物16SrRNA中的保守区和可变区确定微生物种类13,包括采用变性梯度凝胶电泳技术(DGGE)、温度梯度凝胶电泳技术(TGGE)、单链构象多态性技术(SSCP)、荧光定量PCR技术、Illumina测序技术等。陈娜等14利用Illumina测序技术对早产儿粪便中的细菌的16SrRNAV3区进行基因测序,发现微生物丰度与日龄呈相关,表现出一定的个体差异性,抗生素暴露会影响微生物多样性,而微生物菌群中致病菌占优势可能会引发败血症。
16 参考文献
GILL S R, POP M, DEBOY R T, et al. Metagenomic analysis of the human distal gut microbiome. Science, 2006, 312(5778):1355-1359.
17 参考文献
赵立平. 食品与肠道微生物组互作对人体代谢表型组的贡献.乳酸菌与人体健康: 第十届乳酸菌与健康国际研讨会摘要汇编, 2015.
18 参考文献
刘萍, 董丽娜, 韩轶, 等. 青少年肠道菌群特点分析. 中国药物与临床. 2015(12):1685-1688.
19 参考文献
王小卉, 杨毅, 徐秀, 等. 不同喂养方式对婴儿肠道菌群的影响. 中国儿童保健杂志, 2004, 01:40-42.
20 参考文献
FINEGOLD S M, LI Z P, SUMMANEN P H,et al.Xylooligosaccharide increases bifidobacteria but not lactobacilli in human gut microbiota.Food and Function, 2014, 5:436-445.
21 参考文献
PAUN A, YAU C, DANSKA J S. Immune recognition and response to the intestinal microbiome in type 1 diabetes. Journal of Autoimmunity, 2016, 71:10-18.
22 参考文献
王文建, 郑跃杰. 肠道菌群与中枢神经系统相互作用及相关疾病. 中国微生态学杂志, 2016,02:240-245.
宏基因组学技术通过测定混合菌的总DNA序列,获取全部肠道菌群的基因组信息,来推断微生物组成与功能15。宏基因组学避开了微生物分离培养的难题,更具有广泛性和有效性。将获得的基因组信息通过功能基因组学分析,得知肠道微生物中含有多糖、氨基酸、代谢、维生素、类异戊二烯合成等相关的基因
16,补充了人体自身的不足。
代谢组学是通过获取某个区域所有的代谢物,来获取该区域物质代谢途径及所受内外因素的影响17,这比基因序列测序手段的工作量小得多,而且得到的信息更加直观准确。测定分析无菌小鼠和正常小鼠消化道、血浆、尿液中的代谢表型,会发现明显不同,表明肠道微生物与宿主之间代谢表型具有相关性。前文中提到的肠道微生物和肝脏共同代谢脂类、激素等物质也是通过分析肝组织、体液、肠道等的代谢表型确定的。
4 人体和肠道微生物互相影响
人类活动会影响肠道菌群。随年龄不同,人体肠道中微生物种类和数量显著不同。人类出生前处于无菌状态,出生后肠道微生物迅速定植,约一岁后数量达到成年人水平。随年龄增长,肠道中的双歧杆菌和乳杆菌数量减少,梭杆菌、拟杆菌数量增加18。饮食结构和含量会影响肠道微生物的种类和数量,母乳喂养的新生儿肠道中的乳酸杆菌、双歧杆菌数量明显高于人工喂养19。食物中脂肪含量过高会导致肠道中双歧杆菌数量减少,肠杆菌数量增加。口服益生菌和益生元可以有目的地改变肠道菌群结构,增殖有益菌。
肠道菌群变动也会对宿主产生影响,如前文提到肠道共生菌可以抑制肠道炎症的发生。当过量使用抗生素,致病菌入侵导致肠道菌群失衡、多样性降低,从而产生腹泻。老年人肠道中的双歧杆菌数量减少,肠道蠕动能力降低,容易导致便秘,服用能促进双歧杆菌增殖的双歧因子(如低聚木糖)则有利于缓解便秘20。有益菌产生的短链脂肪酸减少,有害菌产生的内毒素、硫化氢、甲烷增多与结肠癌、肝病有关。高脂饮食会破坏肠道平衡,肠道菌参与脂肪代谢,导致肥胖,恶性循环引发慢性炎症,2型糖尿病也与此有关。最新研究表明,肠道菌与胰腺免疫有关联,幼儿和青少年时期的肠道微生物平衡遭到破坏与1型糖尿病有一定关系21。另外,精神性疾病、特应性疾病等越来越多的疾病被发现与肠道微生物失衡有关22。
10.3969/j.issn.1674-0319.2016.05.008
人类肠道中栖息着大量微生物,包括共生菌、致病菌、中间性菌等,其中共生菌数量最大,与人类共同生活、进化至今,具有促进人体营养吸收、合成维生素、免疫调节等生理功能。人类和肠道微生物互相影响,尤其是肠道微生物平衡与人类疾病的关联引起了学者们极高的研究热情。综述了人类与肠道微生物在营养代谢、免疫调节和基因分子水平的共生关系,有助于深刻揭示人类与肠道微生物的关联,并通过利用或干预两者之间的共生关系达到维护人类健康的目的。
如今,越来越多的疾病和健康问题会与肠道微生物联系在一起,人类和其他哺乳动物的机体与环境接触,相通的肌肤、口腔、胃肠道、泌尿等处均含有大量微生物,不同处的微生物各成系统,其中胃肠道中的微生物数量最多、种类复杂、对宿主的影响最大。健康人的胃肠道中长期稳定寄居的微生物有1000多种,细胞总数约是人体细胞的10倍,以厌氧菌为主,结肠中数量最多,大多属于厚壁菌门、拟杆菌门、变形菌门和放线菌门1。肠道微生物之间以及肠道微生物与人及环境间经过几百万年的协同进化形成了一种稳定的微生态系统,参与人体营养吸收、能量代谢、免疫等2。当微生态系统被破坏时,人的营养、健康也会产生各种各样的问题。所以,人和肠道微生物之间是一种互惠共生的关系,体现在以下方面。

