挺水植物芦苇的腐解对水体水质的影响
亓鹏玉,刘金明
诸城市环境保护监测站,山东 潍坊 262200
挺水植物芦苇的腐解对水体水质的影响
亓鹏玉,刘金明
诸城市环境保护监测站,山东 潍坊 262200
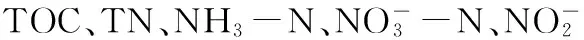
芦苇;腐解;水体水质;底泥
水生植物作为湖泊生态系统的重要组成部分,不仅是湖泊生物链中的主要生产者,而且是湖泊演化和湖泊生态平衡的重要调控者[1-2]。水生植物不仅具有非常好的观赏价值,而且能通过其生长过程中的吸收、过滤、截留等作用,主动并有效地吸收水体中的氮、磷、重金属、有机物等污染物,对污水起到一定的净化作用[3-5]。此外,生长于植物根际的微生物,亦能够在一定程度上降解水中的有机污染物[6-7]。因此,培育水生植物已经成为湖泊污染治理和生态修复的重要途径[8-10]。
水生植物的生长具有周期性,在经历生长稳定期后,逐渐进入衰亡期。水生植物在腐烂分解过程中,一方面,植物体内的氮、磷等营养盐会逐渐释放到水体中,可能导致湖泊水质的恶化,造成水体的二次污染[11-12];另一方面,其腐解过程中释放的有机质进入水体后,能够为水体及底泥中的厌氧微生物提供一定的碳源,并通过反硝化作用将水体中的硝态氮转化为氮气,在一定程度上有利于受纳水体的脱氮作用[13-14]。因此,研究水生植物腐解过程中物质的释放规律及其对水体水质的影响,对水体生态修复及污染治理具有重要的现实意义。
芦苇是种适应性广、抗逆性强、生物量高的挺水植物,由于其叶、叶鞘、茎、根状茎和不定根均具有通气组织,在净化污水中能够发挥重要作用[15]。因此,芦苇在水体生态修复及污染治理中的应用越来越受到专家和学者们的重视。笔者在试验模拟条件下,选择典型的挺水植物——芦苇作为研究对象,综合考察不同生物量密度下,芦苇残体的腐解过程及其对水体水质的影响,深入探讨芦苇残体腐解过程中养分的释放规律。以期为残体在湿地脱氮中的利用提供可靠的依据,最终为实际的湿地生态修复工程提供一定的参考。
1 材料与方法
1.1 材料的预处理
1)用高纯水漂洗收集的芦苇残体茎和叶,以去除残体表面的杂质,随后将残体置于烘箱中,于65 ℃烘干至恒重;2)将残体剪成约1 cm长的碎片,混合均匀后置于密封袋中,并置于干燥器内备用;3)收集芦苇生长区的表层底泥,将收集的底泥混合均匀,过100目网筛,去除底泥中植物残体和杂物,再加入适量的高纯水混匀,配制成底泥悬浮液备用,底泥的成分如表1所示。

表1 底泥的主要成分
1.2 试验设计
在室温(19.5~21.8 ℃)下,用尼龙网将不同质量的芦苇残体碎片包裹后,置于1 L的烧杯中进行腐解试验,试验用水为高纯水。试验分为0.1 gL残体、0.2 gL残体、0.4 gL残体、0.2 gL残体+底泥悬浮液、底泥悬浮液5个工况,每个工况设3个重复试验。整个试验在避光条件下进行,于第0、2、4、6、8、10、17、24、31、38、52和66天进行采样监测,每次取20 mL水样测定-N、TP、DO浓度以及pH和水温等,并补充适量的高纯水以保持整体水量,直至试验结束。
1.3 水质指标的测定
2 结果与分析
2.1 对水体pH和DO浓度的影响
植物残体在腐解过程中,极易对水体pH和DO浓度造成较大的影响,从而影响整个水体生态系统。水体pH随腐解时间的变化见图1。
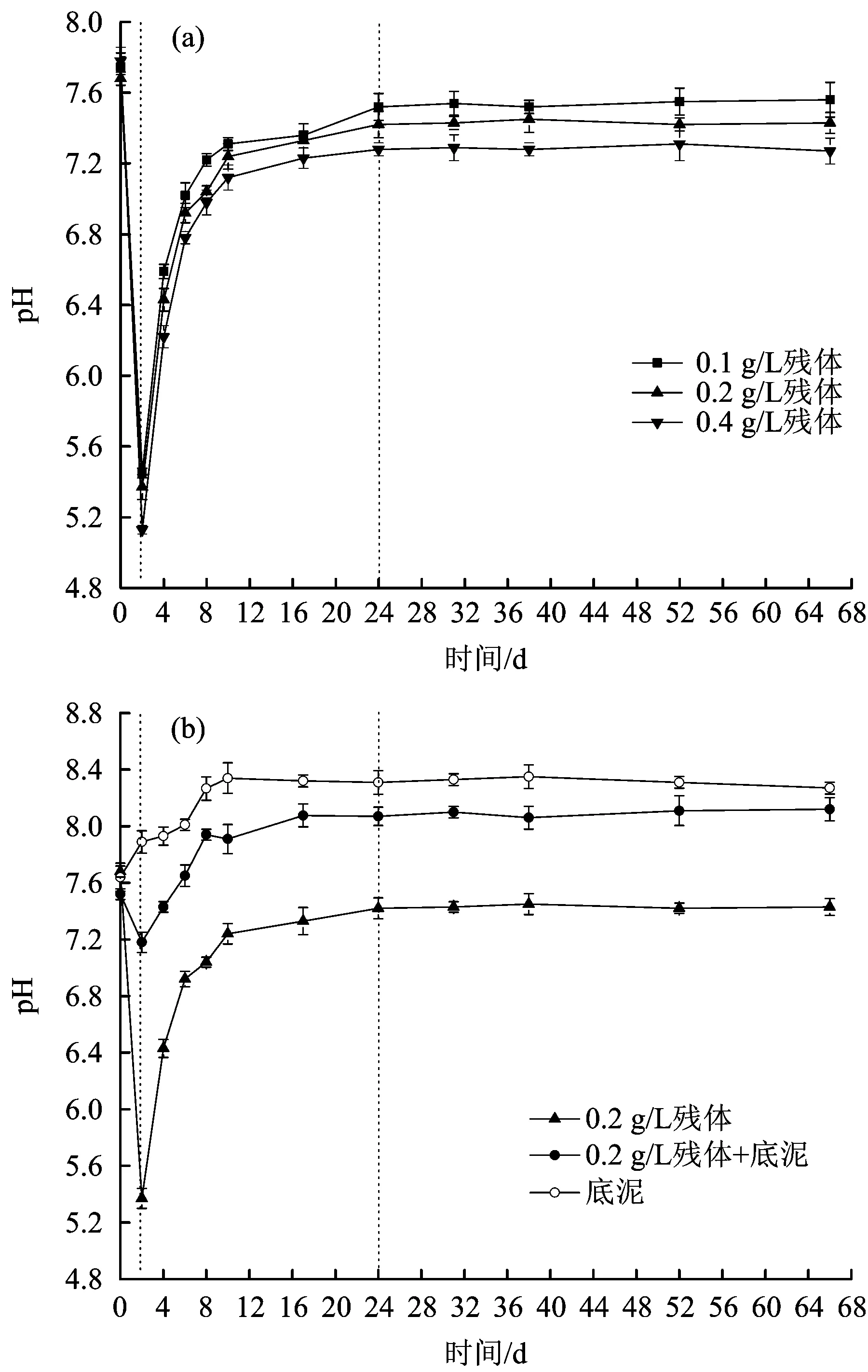
图1 水体pH随腐解时间的变化Fig.1 Variations of pH in water body with the change of decomposition time
从图1(a)可以看出,在投加量分别为0.1、0.2和0.4 gL时,水体pH表现出相似的变化趋势,即腐解第2天,水体pH出现了骤降,随后出现先急后缓的上升(第2~24天),最终趋于稳定(第24~66天)。水体pH在第2天均达到了最低值,分别为5.45、5.37和5.13,试验结束时,水体pH分别为7.56、7.43和7.27,均低于初始值(7.80)。综上,芦苇的腐解会降低水体的pH。此外,随着植物残体投加量的增加,水体pH的降幅逐渐增大。从图1(b)可以看出,当芦苇腐解过程中存在底泥时,水体pH的变化要明显小于无底泥时,并且试验结束时水体的pH(8.12)要明显高于初始值。结果表明,底泥的存在能够降低芦苇腐解对水体pH的影响。
水体DO浓度随腐解时间的变化见图2。
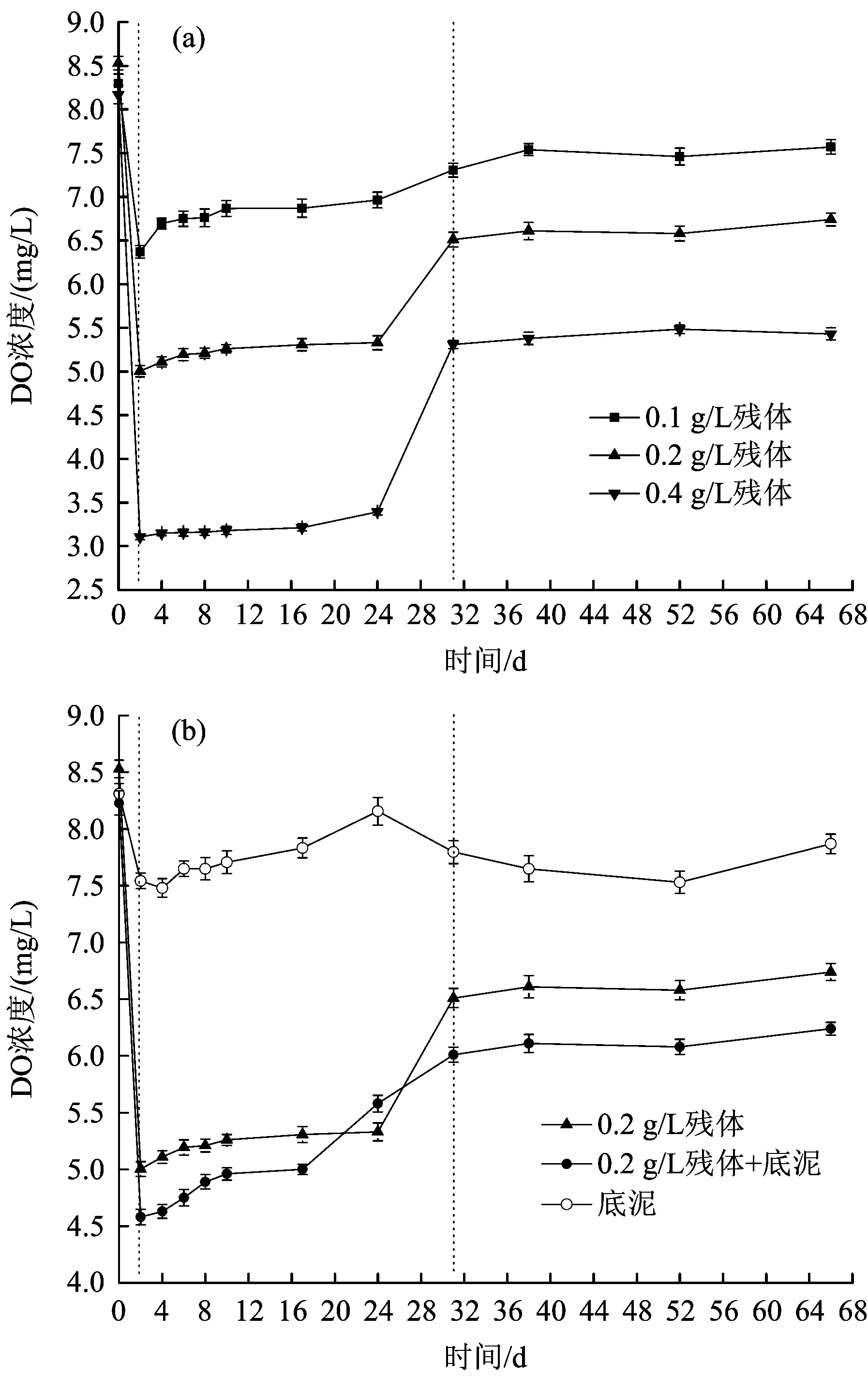
图2 水体DO浓度随腐解时间的变化Fig.2 Variations of DO in water body with the change of decomposition time
从图2(a)可以看出,投加量分别为0.1、0.2和0.4 gL时,水体DO浓度表现出相似的变化趋势。腐解第2天,DO浓度出现了骤降,随后缓慢上升(第2~31天),最终趋于稳定(第31~66天)。DO浓度在第2天达到最低值,分别为6.37、5.00和3.11 mgL,试验结束时,DO浓度分别为7.57、6.74和5.43 mgL,均低于初始浓度(8.30 mgL)。此外,随着残体投加量的增加,水体DO浓度逐渐降低。综上,芦苇腐解是消耗氧的过程,即好氧过程,因此,芦苇腐解可造成水体缺氧。从图2(b)可以看出,当腐解过程中存在底泥时,虽然水体DO浓度没有发生明显变化,但出现了一定程度的降低,即芦苇腐解过程中,底泥的存在会在一定程度上降低水体中的DO浓度。
2.2 对水体TOC浓度的影响
水体中TOC浓度是微生物及植物生长的一个重要影响因素,会影响整个水体的生态系统。水体TOC浓度随腐解时间的变化见图3。
图3 水体TOC浓度随腐解时间的变化Fig.3 Variations of TOC in water body with the change of decomposition time
从图3(a)可以看出,在残体投加量分别为0.1、0.2和0.4 gL时,水体TOC浓度表现出相似的变化趋势,即残体投加量未对水体TOC浓度的变化趋势产生明显的影响,仅对TOC浓度产生了一定的影响。腐解前期(第0~4天),水体TOC浓度出现了明显的升高(尤其是第2天),随后水体TOC浓度进入缓慢降低的阶段(第4~31天),最终进入了稳定阶段(第32~66天)。腐解第4天,水体TOC浓度均达到了最高值,分别为16.58、23.43和28.67 mgL。腐解试验结束时,水体TOC浓度分别为5.53、10.48、16.48 mgL,均高于初始浓度(0)。此外,随着芦苇残体投加量的增加,水体的TOC浓度亦逐渐升高。综上,芦苇残体的腐解可增加水体中的TOC浓度,且残体投加量越大,TOC浓度升高幅度越大。从图3(b)可以看出,芦苇腐解过程中,底泥的存在对水体中TOC浓度产生了一定的影响,在腐解前期(第0~4天),水体TOC的浓度要明显高于无底泥时(仅投加芦苇残体),而腐解中期和后期(第4~66天),水体TOC浓度要明显低于无底泥时。总体上,底泥的存在能够降低芦苇残体腐解过程对水体TOC的影响。
2.3 对水体氮浓度的影响
氮的浓度及存在形式可能对水体中的微生物群落、水体氧环境、水生生物等造成较大的影响,因此,研究水体中氮浓度及存在形式的变化至关重要。
水体TN浓度随腐解时间的变化见图4。

图4 水体TN浓度随腐解时间的变化Fig.4 Variations of TN in water body with the change of decomposition time
从图4(a)可以看出,在残体投加量分别为0.1、0.2和0.4 gL时,水体TN浓度表现出相似的变化趋势。腐解前期(第0~4天),水体TN浓度迅速增加;腐解中期(第4~31天),水体TN浓度进入先迅速降低后缓慢降低的阶段;腐解后期(第32~66天),水体TN浓度趋于稳定。在腐解第4天,水体TN浓度达到了最高值,分别为1.77、1.85和2.21 mgL。腐解试验结束时,水体TN浓度分别为0.82、0.91和0.61 mgL,均高于初始浓度(0)。虽然腐解前期,水体TN浓度随残体投加量的增加而逐渐增大,但腐解中期及后期,水体中的TN浓度与残体投加量并不呈正相关性。总之,芦苇腐解可增加水体中的TN浓度,但并不与残体投加量呈正相关性。从图4(b)可以看出,当存在底泥时,腐解过程中的TN浓度要明显低于无底泥时,说明底泥的存在能够降低芦苇残体腐解过程对水体TN浓度的影响。
水体NH3-N浓度随腐解时间的变化如图5所示。
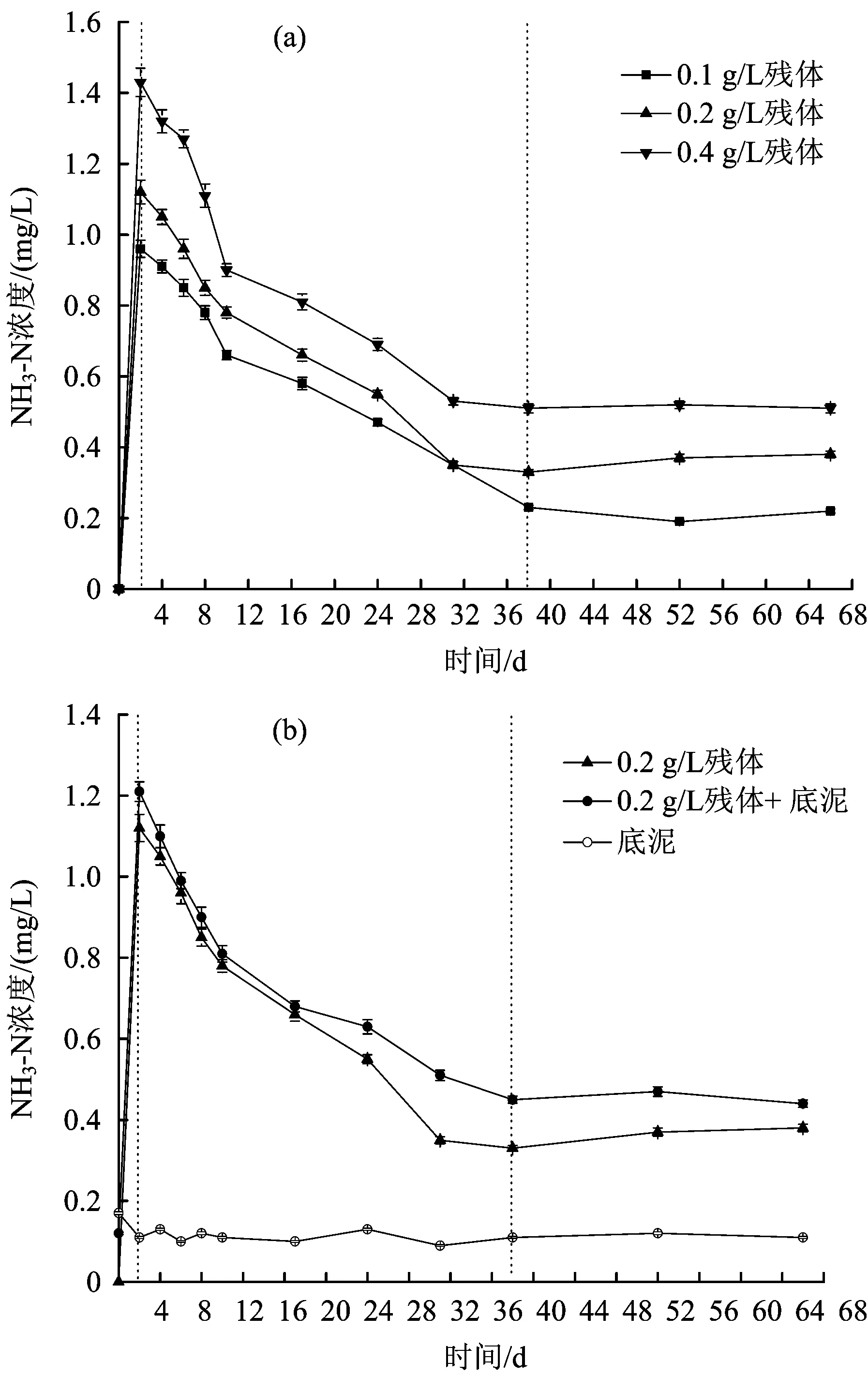
图5 水体NH3-N浓度随腐解时间的变化Fig.5 Variations of NH3-N in water body with the change of decomposition time
从图5(a)可以看出,残体投加量分别为0.1、0.2和0.4 gL时,水体NH3-N浓度呈现出相似的变化趋势,同时,水体NH3-N浓度随残体投加量的增加而升高。腐解第2天,水体NH3-N浓度出现了陡增,随后进入逐渐降低的过程(第4~38天),最终进入稳定阶段(第38~66天)。水体NH3-N在腐解第2天达到最大值,分别为0.96、1.12和1.43 mgL,腐解结束时,其浓度分别为0.22、0.38和0.51 mgL,均高于初始浓度(0)。综上,芦苇腐解过程可增加水体NH3-N的浓度,且其浓度随残体投加量的增加而升高。从图5(b)可以看出,底泥存在时,水体NH3-N浓度在整个腐解过程中均低于无底泥时,因此,底泥的存在能够降低芦苇腐解对NH3-N浓度的影响,但降低程度较小。

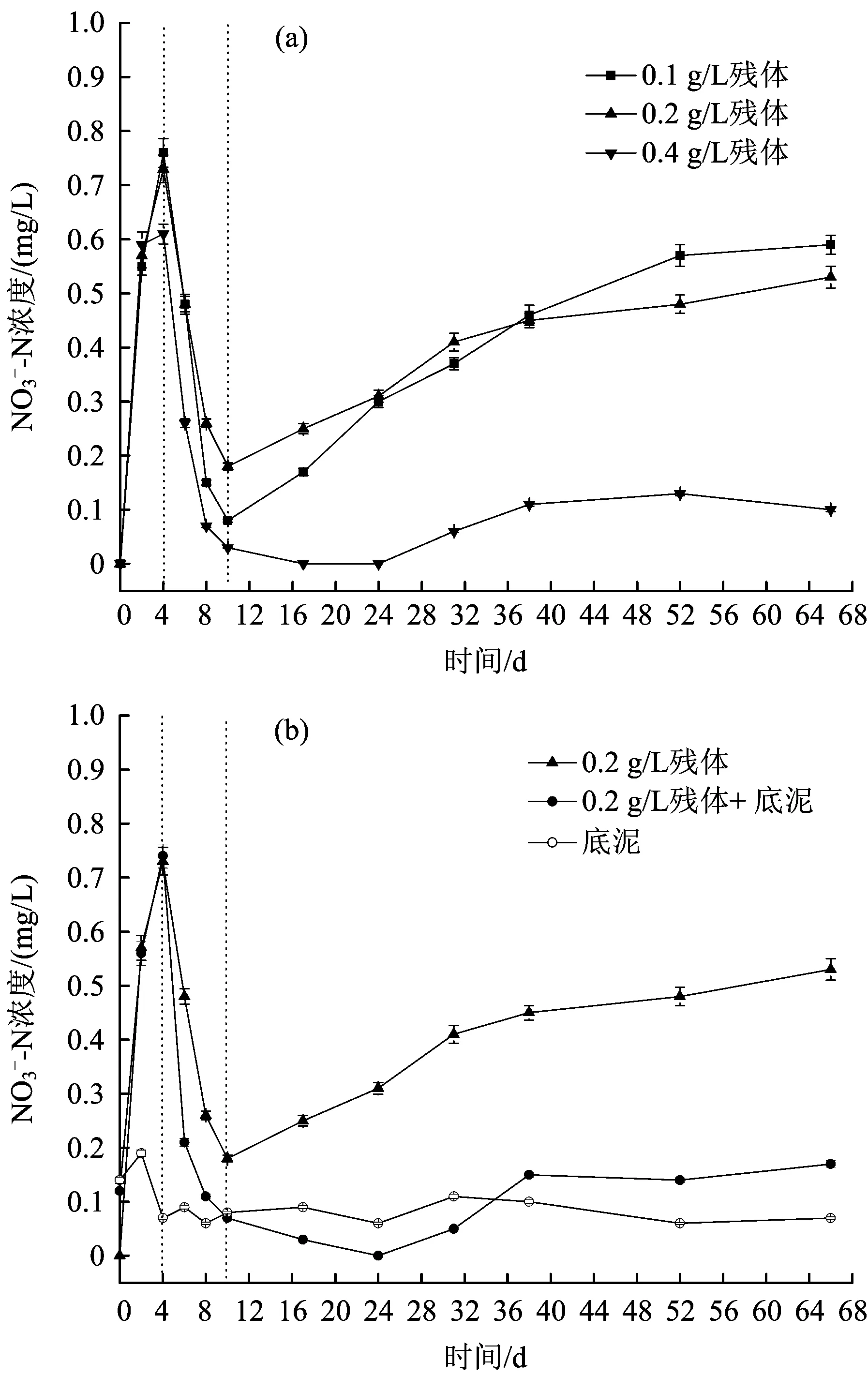
图6 水体-N浓度随腐解时间的变化Fig.with the change of decomposition time
从图6(a)可以看出,残体投加量分别为0.1、0.2和0.4 gL时,水体-N浓度呈现出相似的变化趋势,但其变化趋势明显不同于TN和NH3-N浓度。腐解前期(第0~4天),水体-N浓度出现了迅速增加;腐解中前期(第4~10天),水体-N浓度出现了迅速降低;腐解中后期(第10~31天)及后期(第31~66天),水体-N浓度又呈现出了缓慢升高的趋势。腐解第4天,水体浓度达到了最大值,分别为0.76、0.73和0.63 mgL;第10天达到了最小值,分别为0.08、0.18和0 mgL;腐解结束时,水体-N浓度分别为0.59、0.53、0.10 mgL。综上,芦苇腐解过程可增加水体的-N浓度,水体-N的增加幅度与残体投加量呈负相关性。从图6(b)可以看出,在芦苇腐解的中期及后期,底泥的存在能够明显降低水体-N浓度,即底泥的存在能够降低芦苇腐解过程对水体-N浓度的影响。

从图7(a)可以看出,投加量分别为0.1、0.2和0.4 gL时,水体-N浓度无明显的变化趋势。腐解前期(第0~4天),水体-N浓度呈迅速增加的趋势,并且于第4天达到最大值,分别为0.10、0.07和0.28 mgL;腐解中期及后期,水体-N浓度先迅速降低后缓慢降低;腐解结束时,水体-N浓度均接近于初始值(0)。综上,芦苇腐解对水体-N浓度的影响较小,而且最终的影响程度并不随投加量的变化而变化。从图7(b)可以看出,当底泥存在时,水体-N浓度要低于无底泥时,因此,底泥的存在能够降低芦苇腐解对水体-N浓度的影响。
2.4 对水体TP浓度的影响
水体TP浓度随腐解时间的变化情况见图8。
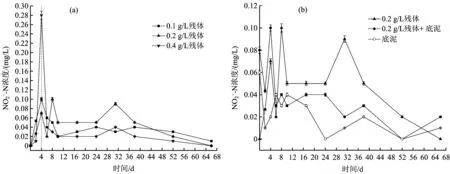
图7 水体-N浓度随腐解时间的变化Fig.7 Variations of -N in water body with the change of decomposition time
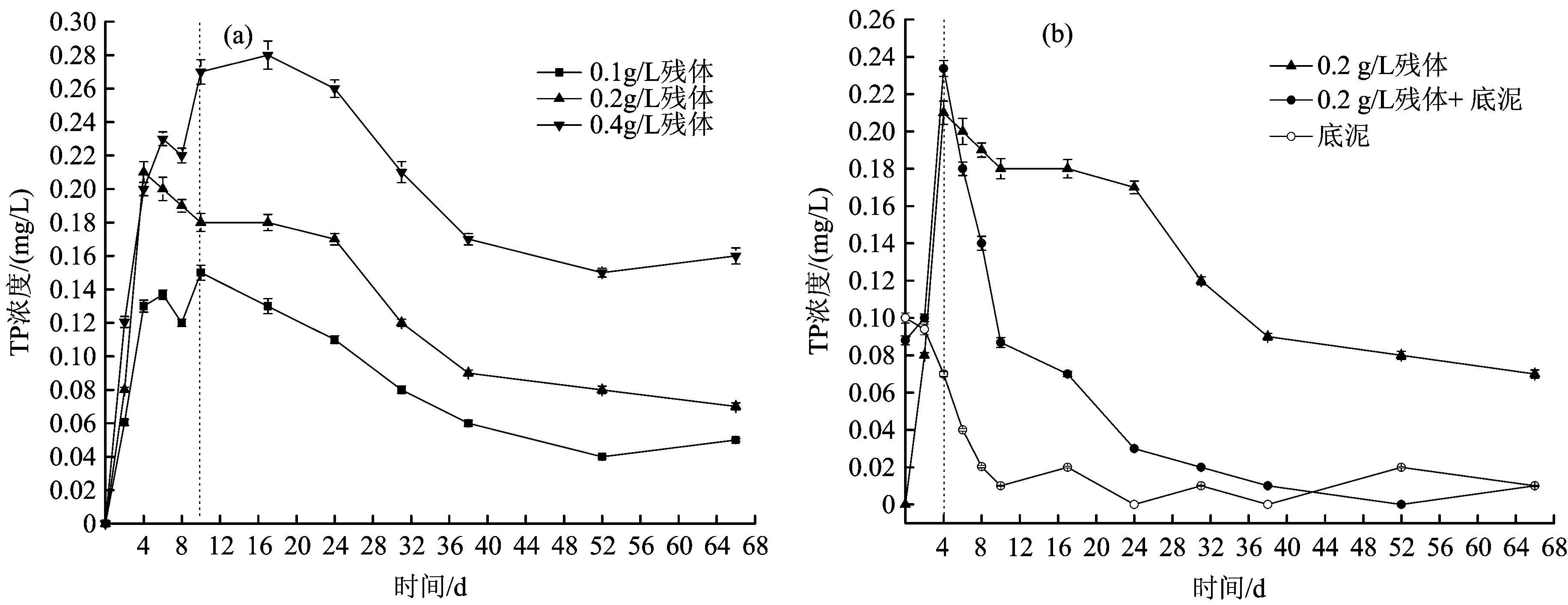
图8 水体TP浓度随腐解时间的变化Fig.8 Variations of TP in water body with the change of decomposition time
从图8(a)可以看出,植物腐解过程中,磷的释放比碳和氮的释放要缓慢一些。在投加量分别为0.1、0.2和0.4 gL时,腐解前期(第0~4天)或前期及中前期(第0~10天),水体TP浓度逐渐增加,在此期间,水体的TP浓度均达到了最高值,分别为0.15、0.21和0.28 mgL;随后水体TP浓度均进入了缓慢降低的阶段;最终,水体TP浓度分别为0.05、0.07和0.16 mgL,均高于初始值(0)。此外,随着残体投加量的增加,水体TP浓度亦相应的升高。综上,芦苇腐解可增加水体的TP浓度,且随着残体投加量的增加而升高。从图8(b)可以看出,当芦苇腐解过程中存在底泥时,水体TP浓度出现了较为明显的变化,即腐解中后期,水体TP浓度出现了较为快速的下降,明显低于无底泥时,因此,底泥能够降低芦苇腐解对水体TP浓度的影响。
3 讨论
3.1 芦苇腐解对水体pH和DO浓度的影响
腐解前期(第0~2天),水体pH出现了骤降,主要是因为芦苇在腐解初期释放出大量的有机酸[17],随着腐解过程的进行,水体中的有机酸被水体微生物吸收利用并分解。因此,植物腐解中期,水体pH逐渐增加。当水体中的大部分有机酸被消耗时,腐解进入缓慢或停滞阶段,水体pH也趋于稳定。但对比试验始末的水体pH,最终,芦苇腐解在一定程度上降低了水体的pH,而且随着残体投加量的增加,水体pH的降幅增大。此外,当水体中存在底泥时,水体pH的降幅要明显小于无底泥时,通过与底泥空白的对比,可以推断,由于底泥存在少量的碱性物质,其释放减缓了芦苇腐解对水体pH的影响。
腐解前期(第0~2天),水体DO浓度出现了骤降,主要是因为植物腐解过程属于消耗氧的过程[18],水体微生物对植物及其释放的有机物的分解同样需要消耗水体中的溶解氧。随着腐解时间的延长,腐解速度越来越慢,导致水体DO消耗速率的降低,空气中的氧气不断补充入水体中,因此腐解中后期,水体DO浓度逐渐升高并趋于稳定。对比试验始末,芦苇腐解在一定程度上降低了水体的DO浓度,而且降幅随残体投加量的增加而增大。此外,当存在底泥时,水体DO浓度要明显低于无底泥时,可能是由于底泥的介入,引入了一些底泥微生物,加快了对水体DO的消耗。
3.2 芦苇腐解对水体C、N、P浓度的影响
在植物腐解前期(第0~4天),水体TOC浓度出现了较大幅度的升高,主要来源于芦苇腐解释放出的有机物,其中,部分有机物逐渐被水中的微生物作为碳源吸收利用[19]。随着时间的延长,芦苇腐解速率逐渐减慢,因此,腐解的中期及后期,水体TOC浓度逐渐降低并趋于稳定。总之,芦苇腐解可增加水体TOC浓度,且增幅随芦苇残体投加量的增加而升高。此外,当底泥存在时,腐解前期,水体TOC浓度明显高于无底泥时,可能是由于底泥微生物的引入促进了芦苇的腐解,而微生物的增加加快了水体TOC的消耗,因此,腐解中期和后期,水体TOC浓度明显低于无底泥时。综上,底泥的存在能够促进芦苇的腐解,同时能够加快水体TOC的消耗[20-21]。
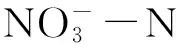
在植物腐解的前期及中前期(第0~10天),水体TP浓度呈显著的升高趋势,可能是来源于芦苇腐解的释放,腐解前期水体DO浓度的下降,也促进了TP的释放;腐解中后期,水体DO浓度逐步上升,促进了对TP的吸收[25],因此,水体TP浓度出现了降低趋势。总之,芦苇腐解在一定程度上增加了水体TP浓度,且增幅随残体投加量的增加而增大。此外,当存在底泥时,水体TP浓度明显低于无底泥时,这主要是由于底泥对水体中磷的吸收作用,使水体中的磷迁移至底泥中。
4 结论
(1)芦苇残体的腐解造成了受纳水体pH和DO浓度的明显降低,其降幅随芦苇残体投加量的增加而增大。尤其在腐解前期,受纳水体的pH和DO浓度会出现急剧下降。
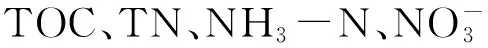
(3)若芦苇残体的腐解在底泥表层进行时,其腐解过程对水体水质的影响要明显小于无底泥时,这主要源于底泥自身的吸附作用以及底泥微生物的反硝化作用。因此,实际湿地生态修复过程中,应采取适当的方法避免植物残体漂浮于水面,不仅能避免残体覆盖造成的水体DO浓度急剧降低,而且能使残体的腐解在底泥的表层进行,降低了腐解过程对水体水质的影响。

[1] 曹培培,刘茂松,唐金艳,等.几种水生植物腐解过程的比较研究[J].生态学报,2014,34(14):3848-3858.
CAO P P,LIU M S,TANG J Y,et al.A comparative study on the decomposition processes among some aquatic plants[J].Acta Ecologica Sinica,2014,34(14):3848-3858.
[2] ENGEL S.The role and interactions of submerged macrophytes in a shallow Wisconis Lake[J].Freshwater Ecology,1998,4(3):329-341.
[3] 种云霄,胡洪营,钱易.大型水生植物在水污染治理中的应用研究进展[J].环境污染治理技术与设备,2003,4(2):36-40.
CHONG Y X,HU H Y,QIAN Y.Advances in utilization of macrophytes in water pollution control[J].Techniques and Equipment for Environmental Pollution Control,2003,4(2):36-40.
[4] 徐德福,徐建民,王华胜,等.湿地植物对富营养化水体中氮、磷吸收能力研究[J].植物营养与肥料学报,2005,11(5):597-601.
XU D F,XU J M,WANG H S,et al.Absorbability of wetland plants on N and P from eutrophic water[J].Plant Nutrition and Fertilizer Science,2005,11(5):597-601.
[5] 唐金艳,曹培培,徐驰,等.水生植物腐烂分解对水质的影响[J].应用生态学报,2013,24(1):83-89.
TANG J Y,CAO P P,XU C,et al.Effects of aquatic plants during their decay and decomposition on water quality[J].Chinese Journal of Applied Ecology,2013,24(1):83-89.
[6] 李俊,李科林.水生植物处理污染水研究现状及应用前景[J].安徽农业科学,2007,35(34):11159-11161.
LI J,LI K L.Research status and application prospect of treating polluted water with aquatic plant[J].Journal of Anhui Agricultural Sciences,2007,35(34):11159-11161.
[8] 颜昌宙,金相灿,赵景柱,等.湖滨带退化生态系统的恢复与重建[J].应用生态学报,2005,16(2):362-364.
YAN C Z,JIN X C,ZHAO J Z,et al.Ecological restoration and reconstruction of degraded lakeside zone ecosystem[J].Chinese Journal of Applied Ecology,2005,16(2):362-364.
[9] MERLIN G,PAJEAN J,LISSOLO T.Performances of constructed wetlands for municipal wastewater treatment in rural mountainous area[J].Hydrobiologia,2002,469:87-98.
[10] MASIFWA W F,OKELLO W,OCHIENG H,et al.Phosphorus release from decomposing water hyacinth and effects of decomposition on water quality[J].Uganda Journal of Agricultural Sciences,2004,9:389-395.
[11] 叶春,王博,李春华,等.沉水植物黑藻腐解过程中营养盐释放过程[J].中国环境科学,2014,34(10):2653-2659.
YE C,WANG B,LI C H,et al.Nutrient release process during decomposition of submerged macrophytes[J].China Environmental Science,2014,34(10):2653-2659.
[12] 叶碧碧,曹德菊,储昭升,等.洱海湖滨带挺水植物残体腐解特征及其环境效应初探[J].环境科学研究,2011,24(12):1364-1369.
YE B B,CAO D J,CHU Z S,et al.Decomposition characteristics of emergent aquatic plant residues from the lakeshore of Erhai Lake and their environmental effects[J].Research of Environmental Sciences,2011,24(12):1364-1369.
[13] FENNESSY M S,ROKOSCH A,MACK J J.Patterns of plant decomposition and nutrient cycling in natural and created wetlands[J].Wetlands,2008,28(2):300-310.
[14] CHIMNEY M J,PIETRO K C.Decomposition of macrophyte litter in a subtropical constructed wetland in South Florida (USA)[J].Ecological Engineering,2006(27):301-321.
[15] 王萌,王玉彬,陈章和.芦苇的种质资源及在人工湿地中的应用[J].应用与环境生物学报,2010,16(4):590-595.
WANG M,WANG Y B,CHEN Z H,et al.Germplasm resource of phragmites adans and its application in constructed wetlands[J].Chinese Journal of Applied and Environmental Biology,2010,16(4):590-595.
[16] 国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2009.
[17] 卢少勇,张彭义,余刚,等.茭草、芦苇与水葫芦的污染物释放规律[J].中国环境科学,2005,25(5):554-557.
LU S Y,ZHANG P Y,YU G,et al.The contaminants release rule ofZizaniacaduciflora,PhragmitesaustrailsandEichhorniacrassipes[J].China Environmental Science,2005,25(5):554-557.
[18] 周林飞,邹飞,李颖卓.沉水植物腐解对人工湿地水质的持续影响研究[J].水土保持学报,2013,27(6):119-123.
ZHOU L F,ZOU F,LI Y Z.Continous influence of submerged plant decomposition on water quality in constructed wetland[J].Journal of Soil and Water Conservation,2013,27(6):119-123.
[19] 王晓玥,孙波.植物残体分解过程中微生物群落变化影响因素研究进展[J].土壤,2012,44(3):353-359.
WANG X Y,SUN B.Factors affccting change of microbial community during plant residue decomposition:a review[J].Soils,2012,44(3):353-359.
[20] SONG N,JIANG H L,CAI H Y.Beyond enhancement of macrophyte litter decomposition in sediments from a terrestrializated shallow lake through bioanode employment[J].Chemical Engineering Journal,2015,279:433-441.
[21] LONGHI D,BARTOLI M,VIAROLI P.Decomposition of four macrophytes in wetland sediments-organic matter and nutrient decay and associated benthic processes[J].Aquatic Botany,2008,89:303-310.
[22] TORREMORELL A,GANTES P.Decomposition and nitrogen dynamics ofRhynchosporaasperulain floating soils of Esteros del Iberá,Argentina[J].Wetlands Ecology & Management,2010,18:191-201.
[23] XIE Y H,YU D,REN B.Effects of nitrogen and phosphorus availability on the decomposition of aquatic plants[J].Aquatic Botany,2004,80:29-37.
[24] KRISTENSEN E.Decomposition of macroalgae,vascular plants and sediment detritus in seawater:use of stepwise thermogravimetry[J].Biogeochemistry,1994,26:1-24.
[25] CHEESMAN A W,TURNER B L,INGLETT P W,et al.Phosphorus transformations during decomposition of wetland macrophytes[J].Environmental Science & Technology,2010,44:9265-9271.□
The Influence of Bulrush Litter Decomposition on Water Quality
QI Pengyu, LIU Jinming
Zhucheng Environmental Monitoring Station, Weifang 262200, China

bulrush; decomposition; water quality; sediment
2016-04-27
亓鹏玉(1986—),男,工程师,硕士,主要从事人工湿地与环境监测管理,zchbj001@163.com
X522
1674-991X(2016)06-0591-09
10.3969j.issn.1674-991X.2016.06.085
亓鹏玉,刘金明.挺水植物芦苇的腐解对水体水质的影响[J].环境工程技术学报,2016,6(6):591-599.
QI P Y, LIU J M.The influence of bulrush litter decomposition on water quality[J].Journal of Environmental Engineering Technology,2016,6(6):591-599.

