重症监护病房血流感染的临床特点和病原学分析
陈瑞娟, 芮庆林, 郭 涛, 望亭松, 李 洁, 杨之涛, 毛恩强, 陈尔真
重症监护病房血流感染的临床特点和病原学分析
陈瑞娟1, 芮庆林1, 郭 涛1, 望亭松2, 李 洁*, 杨之涛2, 毛恩强2, 陈尔真2
目的 分析重症监护病房医院获得性血流感染(NBSI)患者的临床特点、流行病学和病原菌对抗菌药物敏感性,为NBSI的预防和经验性用药提供参考。方法 回顾整理2010年1月-2013年7月在上海交通大学医学院附属瑞金医院重症监护病房被诊断为NBSI患者的临床资料和病原学结果并对其进行描述性统计分析。结果 共有239例患者发生285例次的NBSI,分离出318株病原微生物,其中复数菌感染者27例。男性158例(66.1 %),女性81例(33.9 %),平均年龄(62.5±14.8)岁。常见的基础疾病为心血管病83例(34.7 %)和肺部感染54例(22.6 %)。最常见的诱发因素为留置中心静脉导管212例(88.7 %),其次为留置导尿管187例(78.2 %),机械通气174例(72.8 %)。患者存活114例(47.7 %),死亡125例(52.3 %),其中以合并鲍曼不动杆菌的复数菌感染者的病死率最高,达85.7 %。分离得革兰阳性菌137株(43.1 %),革兰阴性菌141株(44.3 %),真菌40株(12.6 %)。5种最常见的致病菌是凝固酶阴性葡萄球菌68株(21.4 %),鲍曼不动杆菌35株(11.0 %),屎肠球菌27株(8.5 %),肺炎克雷伯菌26株(8.2 %)和金黄色葡萄球菌(金葡菌)20株(6.3 %)。凝固酶阴性葡萄球菌和金葡菌中甲氧西林耐药菌株占各自菌种的82.4 %和75.0 %。鲍曼不动杆菌耐药性严重,其对阿米卡星敏感率最高仅为22.9 %,其次为头孢哌酮-舒巴坦,敏感率20.0 %。肺炎克雷伯菌对阿米卡星、亚胺培南和美罗培南的敏感率分别为73.1 %、65.4 %和57.7 %。白念珠菌为最常见的念珠菌(14株, 4.4 %),对两性霉素B的敏感率为100 %,对伏立康唑、氟康唑和伊曲康唑的敏感率分别为92.9 %、85.7 %和71.4 %。结论 重症监护病房NBSI中革兰阴性菌的比率略高于革兰阳性菌,NBSI的病死率高,因此严格的感染控制措施非常重要。
医院获得性血流感染; 重症监护病房; 抗菌药物敏感性试验
医院获得性血流感染(nosocomial blood stream infection,NBSI)是一种全身性重症感染疾病,病死率21 %~48 %[1]。近年来,随着广谱抗生素、免疫抑制剂和抗肿瘤药物的广泛应用以及侵袭性诊疗技术的开展,NBSI在重症监护病房(ICU)的发生率逐年增高,引起血流感染的病原菌谱和耐药性也不断变化,研究血流感染的病原菌构成及耐药性可为血流感染的经验性治疗提供依据。本研究对上海交通大学医学院附属瑞金医院2010年1月-2013年7月成人ICU中确诊为NBSI的临床和病原微生物资料进行回顾性统计分析。
1 材料与方法
1.1临床资料
收集2010年1月-2013年7月上海交通大学医学院附属瑞金医院急诊科、呼吸科、外科和心胸外科ICU中发生血流感染患者的临床资料,包括基础疾病、诱发因素、疾病转归等进行回顾性调查。
1.2方法
1.2.1诊断标准 入住ICU 48 h后血培养分离出病原微生物,具有感染相应的临床表现,同时参照我国卫生部医院感染诊断标准诊断NBSI[2]。 常见皮肤定植菌需要至少2次血培养为相同菌株方诊断为阳性。
1.2.2复数菌感染 单次静脉血培养分离出≥2种细菌或连续多次培养分离出≥2种细菌或其他病原微生物的血流感染统称为复数菌感染。
1.2.3病原菌分离、培养、鉴定和药敏试验 所有血液标本按照医院常规方法进行细菌分离、鉴定,去除同一患者同一次发作的重复菌株。所用BACTECTMFX血培养仪为美国BD公司产品。VITEK 2-compact全自动细菌鉴定仪, 原装革兰阳性菌(GNI)和革兰阳性菌(GPI)鉴定卡为法国BioMérieux公司生产。药敏质控菌株为大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 27853、金黄色葡萄球菌(金葡菌)ATCC 25923、粪肠球菌ATCC 29212。VITEK 2-compact YST真菌鉴定卡为法国BioMérieux公司生产,质控菌株为白念珠菌ATCC 14053。使用ATB FUNGUS 3真菌药敏试剂盒进行药敏试验,质控菌株为近平滑念珠菌ATCC 22019和克柔念珠菌ATCC 6258。药敏结果遵循美国临床和实验室标准化协会(CLSI)规定的纸片法及当年更新的判断标准认定敏感或耐药。
2 结果
2.1临床特点
2.1.1一般情况 239例患者中,男158例(66.1 %),女81例(33.9 %),平均年龄(62.5±14.8)岁,共发生285例次NBSI,培养获得318株病原体。
2.1.2基础疾病 基础疾病中心血管疾病最常见,共83例(34.7 %,其中冠心病58例,心脏瓣膜病18例),肺部感染54例,肿瘤32例(包括实体瘤28例和血液系统恶性肿瘤4例)。其他基础疾病包括糖尿病21例(8.8 %),肾功能不全9例(3.8 %),脑血管疾病7例(2.9 %)。
2.1.3诱发因素 手术97例(40.6 %),其中胸部手术34例,腹部手术30例,胸腹部联合手术33例。留置中心静脉导管212例(88.7 %),留置导尿管187例(78.2 %),机械通气174例(72.8 %),血液透析37例(15.5 %), 使用免疫抑制剂4例(1.7 %)。
2.1.4科室分布 239例患者分布在外科ICU 71例(29.7 %),急诊ICU 57例(23.8 %),心胸外科ICU 79例(33.1 %),呼吸科ICU 32例(13.4 %)。
2.1.5病情转归 239例患者中存活114例(47.7 %),死亡125例(52.3 %)。
2.2病原学特点及分布
2.2.1病原菌检出率 期间ICU共送检血培养标本5 291份,其中阳性标本318份,血培养送检标本数逐年增加但阳性率逐年下降,见表1。
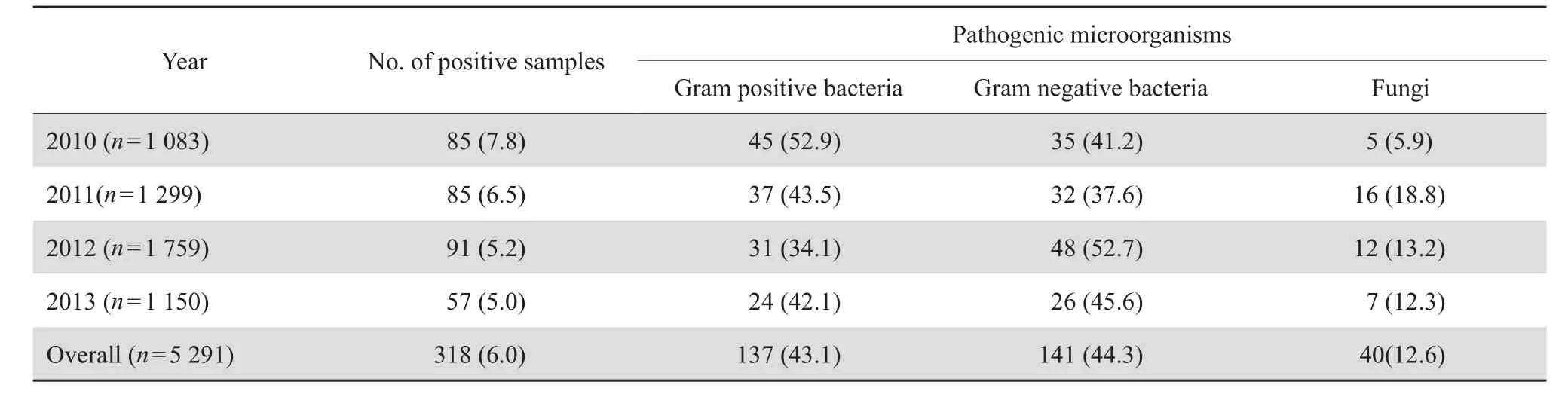
表1 血培养病原菌检出率Table 1 Prevalence of pathogens in blood samples [n( %)]
2.2.2菌株种类和构成比 在检出的318株临床分离菌中,革兰阳性菌137株(43.1 %),革兰阴性菌141株(44.3 %),真菌40株(12.6 %)。其中2010、2011年革兰阳性菌较革兰阴性比例高,而2012、2013上半年革兰阴性菌所占比例高于革兰阳性菌。
最常见的病原菌依次为凝固酶阴性葡萄球菌68株(21.4 %),包括表皮葡萄球菌31株(9.7 %)、溶血葡萄球菌19株(6.0 %),鲍曼不动杆菌35株(11.0 %),屎肠球菌27株(8.5 %),肺炎克雷伯菌26株(8.2 %),金葡菌20株(6.3 %),大肠埃希菌16株(5.0 %),白念珠菌14株(4.4 %)。各种病原菌逐年分布见表2。
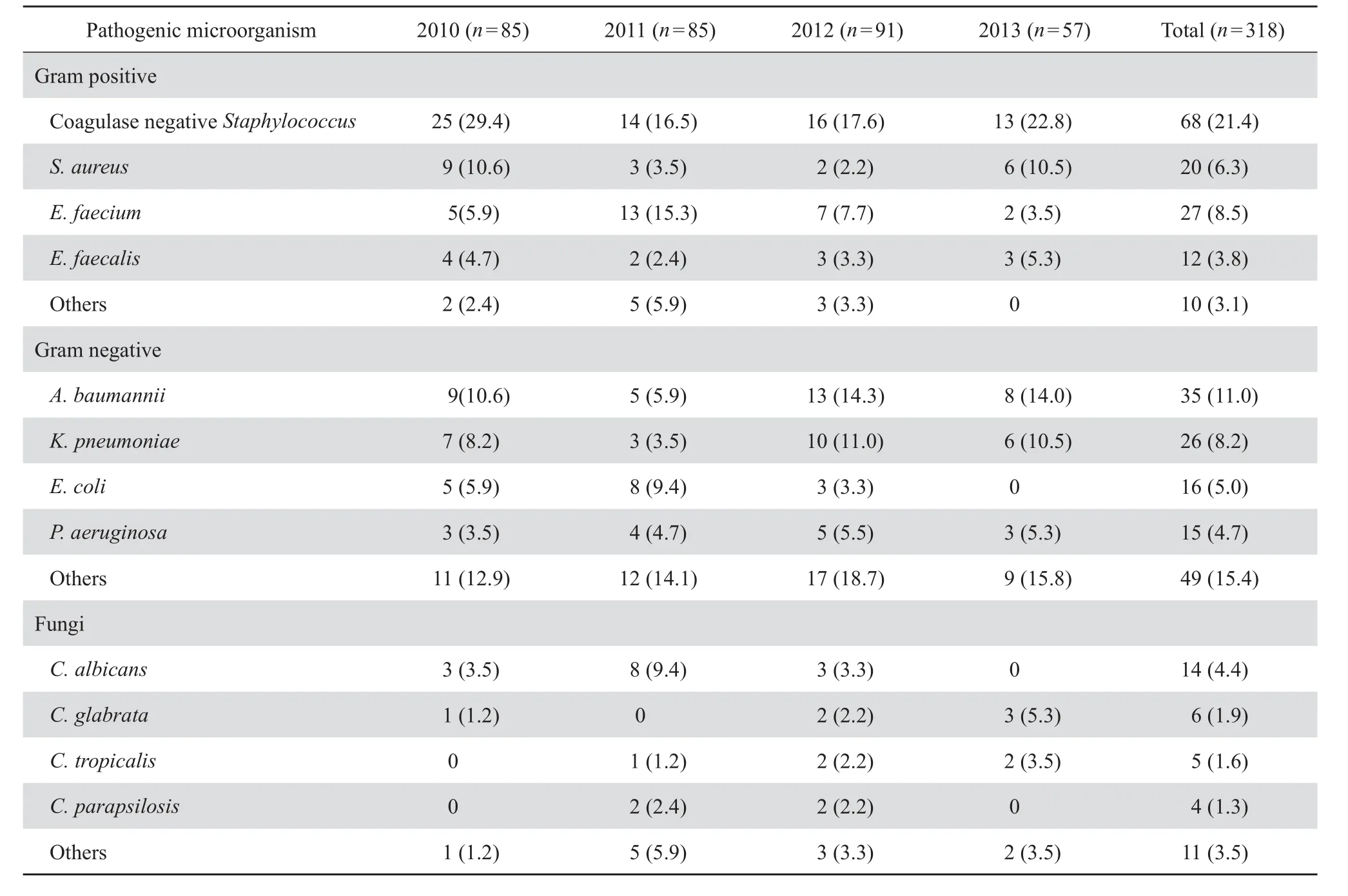
表2 2010-2013年血流感染病原菌构成Table 2 Distribution of 318 pathogenic isolates during the period of 2010 to 2013 [n( %)]
2.2.3复数菌感染比率 在285例次NBSI中,复数菌感染27例(9.5 %),其中≥2种细菌21例(7.4 %),≥2种真菌2例(0.7 %),细菌和真菌混合感染4例(1.4 %)。复数菌感染中最常出现的合并菌为鲍曼不动杆菌共7例,其中死亡6例。
2.2.4各科室主要菌株分布 呼吸科ICU中革兰阳性菌和革兰阴性菌的比例相同,为39.0 %,但构成比最高的菌为肺炎克雷伯菌(12.2 %)和白念珠菌(12.2 %);急诊ICU中革兰阳性菌、革兰阴性菌和真菌的比例分别为50.8 %、35.8 %和13.4 %,构成比最高的细菌为表皮葡萄球菌(11.9 %)和屎肠球菌(11.9 %);外科ICU中革兰阳性菌、革兰阴性菌和真菌的比例分别为44.1 %、46.1 %和9.8 %,构成比最高的细菌为鲍曼不动杆菌(17.6 %);心胸外科ICU中革兰阳性菌、革兰阴性菌和真菌的比例分别为38.9 %、50.0 %和11.1 %,构成比最高的细菌为表皮葡萄球菌(11.1 %)。
2.2.5死亡患者的病原菌分布及构成 在114例次革兰阳性菌感染中,死亡52例(45.6 %),致死病原菌最多是凝固酶阴性葡萄球菌23例,其次为屎肠球菌14例;在113例次革兰阴性菌感染中,死亡54例(47.8 %),致死病原菌最多为鲍曼不动杆菌(18例),其次为肺炎克雷伯菌14例;在31例次真菌感染中,死亡19例(61.3 %),病原菌最多为白念珠菌8例;复数菌27例次感染中,死亡13例(48.1 %)。
2.3药敏试验结果
2.3.1革兰阳性菌 凝固酶阴性葡萄球菌和金葡菌中甲氧西林耐药株分别占82.4 % 和75.0 %,甲氧西林耐药株对万古霉素和利奈唑胺的敏感率较高,甲氧西林耐药凝固酶阴性葡萄球菌(MRCNS)对利福平的敏感率较甲氧西林耐药金葡菌(MRSA)高;肠球菌属中屎肠球菌和粪肠球菌仅对万古霉素、替考拉宁和利奈唑胺的敏感率较高,见表3。
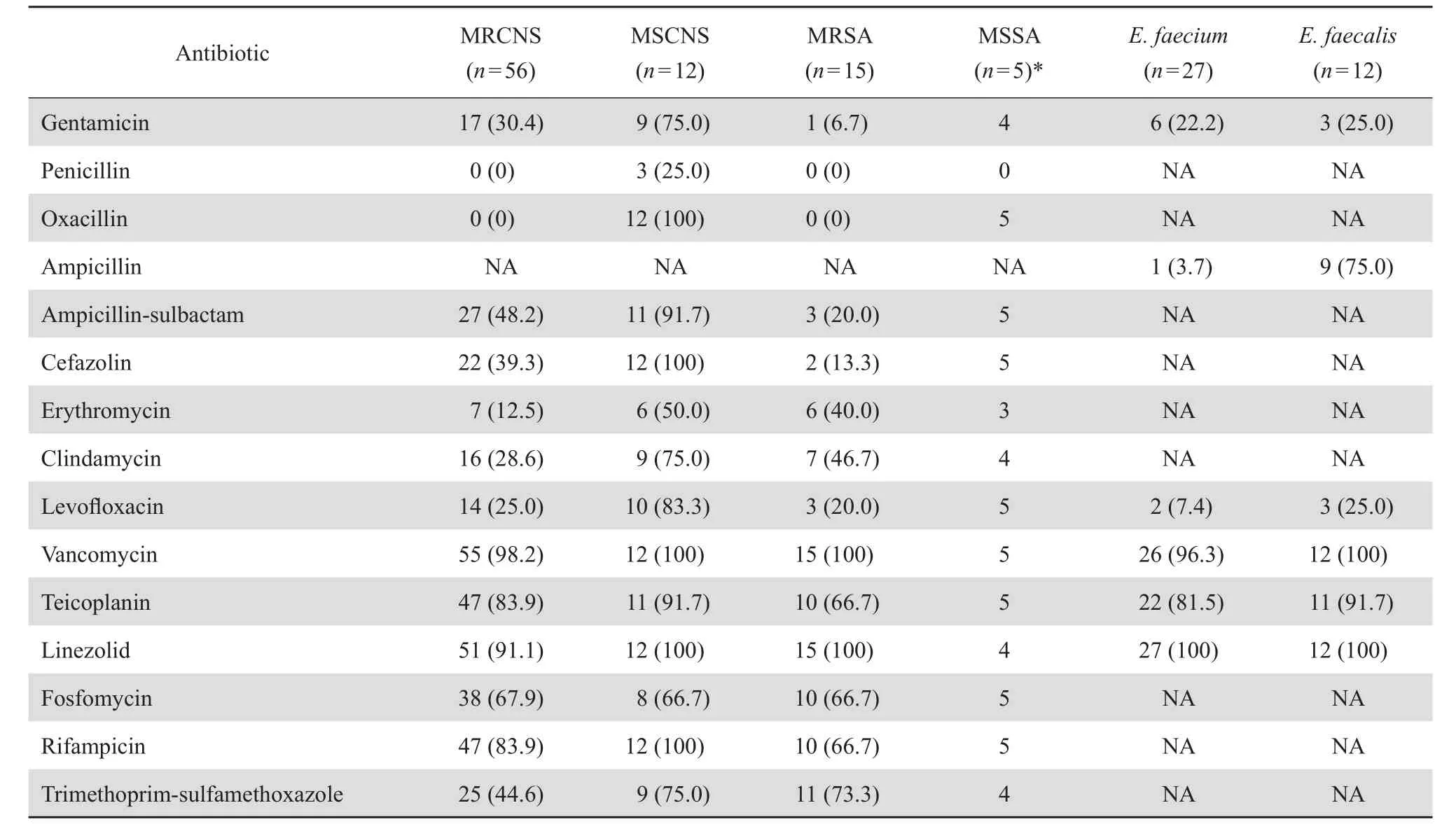
表3 革兰阳性菌对抗菌药物的敏感率Table 3 Susceptibility of gram positive organisms to antimicrobial agents [n (%)]
2.3.2革兰阴性菌 不发酵糖革兰阴性杆菌中常见的有鲍曼不动杆菌和铜绿假单胞菌。鲍曼不动杆菌耐药最为严重,对阿米卡星的敏感率最高为22.9 %,其次是头孢哌酮-舒巴坦20.0 %。铜绿假单胞菌对阿米卡星的敏感率最高为86.7 %,对哌拉西林、头孢他啶、环丙沙星和哌拉西林-他唑巴坦的敏感率皆为80.0 %。肠杆菌科细菌常见的有肺炎克雷伯菌和大肠埃希菌,药敏结果显示前者对碳青霉烯类和哌拉西林-他唑巴坦的敏感率明显低于后者。肺炎克雷伯菌对阿米卡星的敏感率最高为73.1 %,其次为亚胺培南65.4 %;大肠埃希菌对阿米卡星、哌拉西林-他唑巴坦、美罗培南的敏感率皆为93.8 %,见表4。
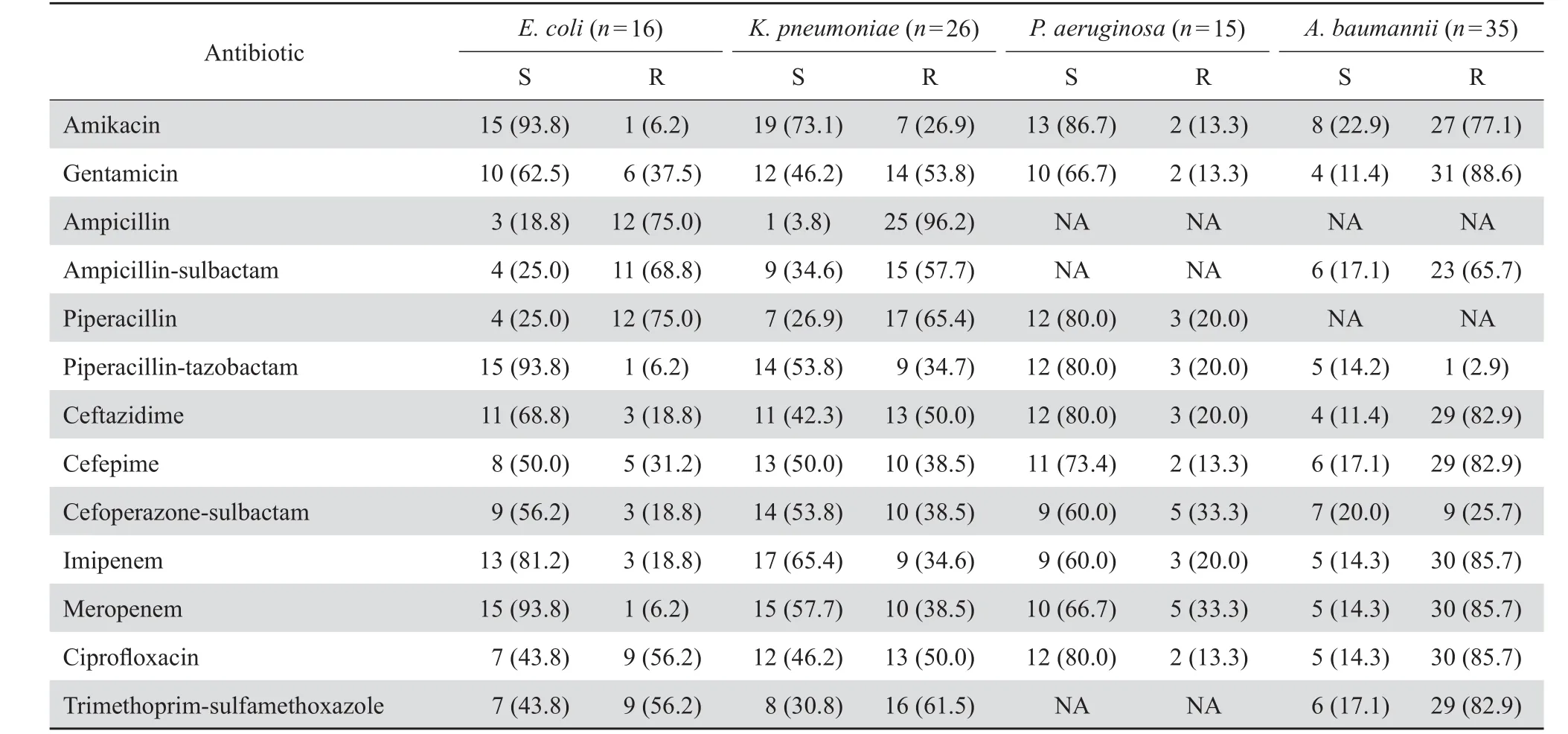
表4 革兰阴性菌对抗菌药物的敏感率Table 4 Susceptibility of gram negative organisms to antimicrobial agents [n( %)]
2.3.3真菌 真菌中念珠菌共37株(11.6 %,37/ 318),占真菌血流感染的多数,其中白念珠菌最多为14株(4.4 %),其次为光滑念珠菌6株(1.9 %),热带念珠菌5株(1.6 %),近平滑念珠菌4株(1.3 %)。常见念珠菌对5- 氟尿嘧啶和两性霉素皆敏感,白念珠菌、光滑念珠菌和热带念珠菌对伊曲康唑的敏感性一般,热带念珠菌对氟康唑敏感率最低,近平滑念珠菌对常用抗真菌药物敏感,见表5。

表5 念珠菌对抗菌药物的敏感率Table 5 Susceptibility of Candida species to antifungal agents [n( %)]
3 讨论
血流感染为全身性的重症感染,患者住院时间长,治疗费用高,严重者可导致休克、弥散性血管内凝血和多脏器功能衰竭,病死率极高。血流感染病原菌的构成比和耐药性不断发生演变,耐药菌、条件致病菌和其他少见细菌在血流感染中的分离率明显增多,病死率也不断增加,动态监测血流感染病原菌的分布和耐药性既是临床微生物学的重要课题也是进行医院感染监测、指导合理选择抗菌药物、防止细菌耐药的重要手段。
2010年1月-2013年7月上海瑞金医院ICU239例患者血培养分离的318株病原菌中,革兰阴性菌141株(44.3 %)略高于革兰阳性菌137株(43.1 %),真菌40株(12.6 %),其中2010、2011年革兰阳性菌较革兰阴性菌比例高,而2012、2013年上半年革兰阴性菌所占比例高于革兰阳性菌,提示革兰阴性菌的比例正逐年升高,这与国内外研究结果一致[3-5],也有报道NBSI以革兰阳性菌为主[6-8]。本研究结果显示在285例次NBSI中,复数菌感染27例(9.5 %),低于WISPLINGHOFF等[8]报道的13 %复数菌血流感染和SANCHO等[9]报道的ICU患者复数菌血流感染20.2 %的比例,且他们还发现复数菌感染并没有显著增加病死率只是增加了住院天数和住院费用。本研究结果同样显示复数菌感染的病死率为48.1 %,略高于革兰阴性菌的47.8 %和革兰阳性菌的45.6 %,低于真菌感染病死率(61.3 %)。
革兰阴性菌中最常见为鲍曼不动杆菌,该菌对阿米卡星敏感率最高(22.9 %),其次为头孢哌酮-舒巴坦(20.0 %),耐药颇为严重。鲍曼不动杆菌是条件致病菌,广泛分布于医院环境,易在住院患者皮肤、结膜、口腔、呼吸道、胃肠道及泌尿生殖道等部位定植[10],是年老体弱、慢性疾病和免疫功能低下患者合并感染的常见病原菌。本研究鲍曼不动杆菌感染者多数为外科术后危重患者,住院时间较长、接受过机械通气、深静脉置管、导尿等侵袭性操作多,抗生素使用比率较高均可能导致鲍曼不动杆菌感染。“中国鲍曼不动杆菌感染诊治与防控专家共识”中指出鲍曼不动杆菌感染常见于危重患者,常伴有其他细菌和/或真菌的感染,鲍曼不动杆菌感染患者病死率高[11],本研究结果显示复数菌感染中最常出现的合并细菌为鲍曼不动杆菌,合并有鲍曼不动杆菌的复数菌感染病死率达85.7 %,远高于复数菌感染的平均病死率48.1 %。
肠杆菌科细菌常见的有肺炎克雷伯菌(26株,8.2 %)和大肠埃希菌(16株,5.0 %)。肺炎克雷伯菌对阿米卡星的敏感率最高(73.1 %),其次亚胺培南(65.4 %),而其对哌拉西林-他唑巴坦、美罗培南和头孢哌酮-舒巴坦的敏感率分别为53.8 %、57.7 %和53.8 %。大肠埃希菌对阿米卡星、哌拉西林-他唑巴坦、美罗培南的敏感率皆为93.8 %,其对头孢哌酮-舒巴坦的敏感率仅为56.2 %。大肠埃希菌和肺炎克雷伯菌是引起临床感染的重要条件致病菌,其耐药机制与产质粒介导的超广谱β内酰胺酶(ESBL)和头孢菌素酶(AmpC)有关,而且细菌在产ESBL同时也可产碳青霉烯酶等,还可以伴有膜通透性改变等其他耐药机制,导致对各类抗菌药物出现不同程度的耐药[12]。本次结果显示大肠埃希菌对哌拉西林-他唑巴坦的敏感率高于头孢哌酮-舒巴坦,这与陈梅莉等[13]报道的他唑巴坦的抗菌效果优于舒巴坦一致,但具体原因仍有待进一步的研究。
凝固酶阴性葡萄球菌共计68株(21.4 %),是最多见的NBSI致病菌,包括表皮葡萄球菌31株(9.7 %),溶血葡萄球菌19株(6.0 %),与WISPLINGHOFF等[8]报道相仿。近年来凝固酶阴性葡萄球菌已成为医院感染的重要致病菌,但同时亦是最常见的污染菌,如何正确地鉴别感染菌与污染菌具有重要的临床意义。污染菌至少应具备以下一项:①无明显发热及感染征象;②抽取血培养至药敏结果回报7 d内患者体温≤38 ℃,白细胞≤10×109/L;③根据患者血培养分离菌体外药敏结果选择敏感药物治疗无效;④长时间培养或连续多次多日培养,仅1次阳性且为皮肤正常菌群;⑤1次血培养分离出多于2种皮肤正常菌群;⑥分离到皮肤正常菌群后72 h内又分离出另一种细菌或真菌;⑦双套血培养分离出不同种细菌。此外由于污染菌的菌量通常较少导致阳性检出时间较长,因此血培养阳性报警时间长则提示可能是污染菌[14-15]。本结果显示凝固酶阴性葡萄球菌为NBSI革兰阳性菌中最主要的致病菌,与金葡菌同样对万古霉素、替考拉宁的敏感率较高,在90 %以上,但对其他抗菌药物的敏感率不高。
本研究中念珠菌占NBSI的11.6 %,高于2014年CORZO-LEON等[16]报道念珠菌占血流感染的3.8 %:提示念珠菌血流感染的比例可能在上升,这与国内外的报道结果一致[17-19]。本研究以白念珠菌最常见(14株, 4.4 %), 其次为光滑念珠菌(6株,1.9 %)。不同的是ADHIKARY 等[20]报道念珠菌血症中最常见的为热带念珠菌(39.7 %)。中心静脉置管被认为是NSBI最常见的诱发因素[21],本研究中患者接受深静脉置管、侵袭性操作、高能营养物质输注等高危因素的比例较高,留置中心静脉导管者达83.1 %,故临床医师对于真菌血流感染仍应保持足够的警惕性。在我们的研究中白念珠菌对5- 氟尿嘧啶和两性霉素B 100 %敏感,对氟康唑、伊曲康唑和伏立康唑的敏感率分别为85.7 %、71.4 %和92.9 %。热带念珠菌对5- 氟尿嘧啶和两性霉素B全部敏感,对伏立康唑敏感率一般、对伊曲康唑敏感率低。ADHIKARY等[20]研究提示尽管念珠菌对两性霉素B的敏感率为92 %,但对伏立康唑敏感率为56 %,对氟康唑仅为36 %,这与本研究热带念珠菌的药敏结果较为接近。本次结果显示真菌NBSI的病死率高达61.3 %,远高于COLOMBO等[22]描述的40 %真菌血症病死率,这可能与近年来真菌耐药性增加导致病死率随之增加有关。
在NBSI患者中真菌感染的病死率最高为61.3 %,其次为革兰阴性菌(47.8 %),最常见的致死细菌为凝固酶阴性葡萄球菌,其次为屎肠球菌和鲍曼不动杆菌。这可能与①凝固酶阴性葡萄球菌较高的检出率和耐药率;②外科ICU腹部手术较多,而腹部手术中受到屎肠球菌感染的概率较高;③鲍曼不动杆菌所致感染病死率高可能与其本身为条件致病菌容易导致免疫力低下人群致病以及近年来的耐药率逐年提高,药物抗感染治疗效果差有关。
总而言之,ICU是NBSI的高发区,为减少血流感染的发生,应加强临床无菌操作理念,严格执行洗手制度,尽量减少不必要介入性操作,对于确认血流感染者应根据药敏结果选用适当的抗菌药物治疗;而且由于耐药菌的不断增加,感染控制措施的重要性将更加突出。
[1] RODRÍGUEZ-CRÉIXEMS M, ALCALÁ L, MUÑOZ P,et al. Bloodstream infections: evolution and trends in the microbiology workload, incidence, and etiology, 1985-2006[J]. Medicine(Baltimore), 2008,87(4): 234-249.
[2] 中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 现代实用医学, 2003, 15(7):460-465.
[3] 王世瑜,刘晔华,张坚磊,等. 血培养常见病原菌分布及耐药性分析[J]. 中华医院感染医学杂志, 2014, 24(1): 39-41.
[4] 张黎明,钟桥石,黄淑英,等. 重症监护室患者血流感染菌谱构成及耐药性分析[J].中国微生态学杂志,2013,25(4):430-433,436.
[5] DEMIRTURK N, DEMIRDAL T. Causative agents of nosocomial bloodstream infections and their antimicrobial susceptibility patterns[J]. Southeast Asian J Trop Med Public Health,2013,44(6):1036-1042.
[6] 王芳, 赵静雅, 涂显春, 等. 医院获得性血流感染的流行病学研究[J]. 中华医院感染学杂志,2012, 22(14):3039-3041.
[7] 刘海波, 朱光发, 王爱萍, 等. 医院获得性血流感染的临床与病原学分析[J]. 中国感染与化疗杂志,2013,13(3): 176-180.
[8] WISPLINGHOFF H, BISCHOFF T, TALLENT SM, et al. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study[J]. Clin Infect Dis,2004, 39(3):309-317.
[9] SANCHO S, ARTERO A, ZARAGOZA R, et al. Impact of nosocomial polymicrobial bloodstream infections on the outcome in critically ill patients[J]. Eur J Clin Microbiol Infect Dis,2012, 31(8):1791-1796.
[10] MUNOZ-PRICE LS,WEINSTEIN RA. Acinetobacter infection[J]. N Engl J Med, 2008, 358(12):1271-1281.
[11] 陈佰义, 何礼贤, 胡必杰,等. 中国鲍曼不动杆菌感染诊治与防控专家共识[J]. 中国医药科学,2012,2(8):3-8.
[12] 周蓉, 朱卫民, 黄文祥,等. 855株肺炎克雷伯菌感染的临床分布及耐药性分析[J].中国抗生素杂志,2013,38(5):363-369.
[13] 陈梅莉,唐志华,肖幸丰. 2009年肺炎克雷伯菌的分布及耐药性分析[J].中华医院感染学杂志,2011,21(1):152-153.
[14] 郭健莲,肖斌龙,刘惠娜, 等. 血培养报阳时间在鉴别血流感染和采血污染中的应用[J].中国感染控制杂志,2015,14(12): 803-806.
[15] 张婷菊, 刘贵建. 降低血培养污染的对策[J]. 国际检验医学杂志,2014,35(1):119-120.
[16] CORZO-LEON DE, ALVARADO-MATUTE T, COLOMBO AL, et al. Surveillance of Candida spp bloodstream infections:epidemiological trends and risk factors of death in two Mexican tertiary care hospitals[J]. PLoS One, 2014, 9(5):e97325.
[17] SAHNI V, AGARWAL SK, SINGH NP, et al. Candidemia--an under-recognized nosocomial infection in Indian hospitals[J]. J Assoc Physicians India, 2005,53:607-611.
[18] XESS I, JAIN N, HASAN F, et al. Epidemiology of Candidemia in a tertiary care center of North India: 5-year study[J]. Infection, 2007, 35(4):256-259.
[19] 李光辉. 念珠菌血症的诊断和抗真菌治疗[J]. 中国感染与化疗杂志,2011,11(2):98-100.
[20] ADHIKARY R, JOSHI S. Species distribution and anti-fungal susceptibility of Candidemia at multi super-specialtycenter in Southern India[J]. Indian J Med Microbiol, 2011, 29(3):309-311.
[21] SHIN JH, KEE SJ, SHIN MG, et al. Biofilm production by isolates of Candida species recovered from nonneutropenic patients: comparison of blood stream isolates from other sources[J]. J Clin Microbiol,2002, 40(4):1244-1248.
[22] COLOMBO AL, TOBÓN A, RESTREPO A, et al. Epidemiology of endemic system fungal infections in Latin America[J]. Med Mycol,2011, 49(8):785-798.
Clinical and microbiological features of nosocomial blood stream infections in intensive care units
CHEN Ruijuan, RUI Qinglin, GUO Tao, WANG Tingsong, LI Jie, YANG Zhitao, MAO Enqiang, CHEN Erzhen. (Department of Emergency Medicine, Affi liated Hospital of Nanjing University of Traditional Chinese Medicine, Nanjing 210029, China)
Objective To characterize the feature, prevalence and antimicrobial susceptibility of the pathogens isolated from patients with nosocomial blood stream infections (NBSIs) in intensive care units (ICUs) and provide evidence for prevention and empirical antimicrobial therapy of NBSIs. Methods Clinical and microbiological data were retrospectively collected from the ICU patients with NBSIs in Ruijin Hospital, Shanghai Jiaotong University School of Medicine from January 2010 to July 2013. The data were subjected to descriptive statistical analysis. Results Two hundred and eighty fi ve episodes of NBSIs were identifi ed in 239 patients [158 males, 81 females; mean age (62.5±14.8) years]. A total of 318 strains were isolated from blood specimens, including multiple microorganisms from 27 patients. The common underlying diseases were cardiovascular disease (83 cases, 34.7 %) and pulmonary infection (54 cases, 22.6 %). Among the potential factors predisposing patients to BSI, central venous catheter was the most frequently identified factor (212 cases, 88.7 %), followed by urinary catheter (187 cases, 78.2 %), and mechanical ventilation (174 cases, 72.8 %). Finally, 114patients (47.7 %) were cured, while 125 patients (52.3 %) died. The highest mortality rate (up to 85.7 %) was found in the multipleorganism infection patients with A. baumannii infection. Among the isolates, gram-positive bacteria represented 137 (43.1 %), gramnegative bacteria 141 (44.3 %) and fungus 40 (12.6 %). The top fi ve microorganisms were coagulase-negative Staphylococcus (21.4 %, 68/318), A. baumannii (11.0 %, 35/318), E. faecalis (8.5 %, 27/318), K. pneumoniae (8.2 %, 26/318) and S. aureus (6.3 %, 20/318). A. baumannii showed higher resistance rate to the antibiotics tested than other microorganisms. About 73.1 %, 65.4 % and 57.7 % of the K. pneumoniae isolates were susceptible to amikacin, imipenem and meropenem, respectively. Candida albicans (4.4 %, 14/318) was the predominant fungal species. Conclusions Gram-negative bacilli were more prevalent than gram-positive bacteria in the BSIs acquired in ICU. NBSIs showed high mortality. Therefore, strict infection control measures are very important.
nosocomial blood stream infection; intensive care unit; antimicrobial susceptibility testing
R515.3
A
1009-7708 ( 2016 ) 06-0673-07
10.16718/j.1009-7708.2016.06.001
1. 南京中医药大学附属医院急诊科,南京 210029;
2. 上海交通大学医学院附属瑞金医院急诊科;*微生
物科。
陈瑞娟(1979—),女,硕士研究生,副主任医师,主要从事脓毒症研究。
杨之涛,E-mail:yangzhitao@hotmail.fr。
2015-04-28
2016-05-31

