犬恶丝虫天冬氨酸转氨酶基因的原核表达及分析
刘 梅,兰景超,王 宇,林 海,张志和,王成东,罗 娌,刘 理,古小彬,汪 涛,杨光友
犬恶丝虫天冬氨酸转氨酶基因的原核表达及分析
刘 梅1,兰景超2,王 宇1,林 海1,张志和2,王成东2,罗 娌2,刘 理2,古小彬1,汪 涛1,杨光友1
目的 了解犬恶丝虫天冬氨酸转氨酶(AspAT)基因特征及其在虫体的定位,对犬恶丝虫AspAT(DiAspAT)基因进行了原核表达和免疫荧光定位分析。方法 从犬恶丝虫成虫转录组数据库中筛选到DiAspAT基因序列,通过RT-PCR方法克隆DiAspAT基因,利用相关软件进行生物信息学分析;构建原核表达载体pET32a(+)-AspAT并进行诱导表达;表达产物经Ni-NTA层析柱纯化后进行Western blotting分析;通过免疫组化技术观察DiAspAT蛋白在犬恶丝虫虫体内的定位分布。结果DiAspAT基因的ORF框长度为1 221 bp,编码406个氨基酸,理论相对分子量45.731 8 kDa,等电点为8.05,表达的重组蛋白约为64 kDa;Western blotting显示AspAT重组蛋白能被犬恶丝虫阳性血清识别;间接免疫荧光染色结果显示,DiAspAT在犬恶丝虫的侧索、皮下组织、肌细胞、假体腔壁、子宫及肠上皮、发育的胚胎中分布。结论 成功克隆和表达了DiAspAT基因,并完成DiAspAT在雌性犬恶丝虫成虫上的定位,为进一步了解犬恶丝虫的生理代谢及犬恶丝虫病的诊断和防控奠定基础。
犬恶丝虫;AspAT基因;克隆;原核表达;免疫荧光定位
犬恶丝虫(Dirofilariaimmitis)成虫主要寄生于犬科和猫科动物的右心室及肺动脉内,引起以循环障碍、呼吸困难、贫血和猝死等为特征的犬恶丝虫病,该病呈全球性分布,在热带和亚热带地区广泛流行[1],在我国北京、上海、广东、四川等27个省和直辖市均有动物感染犬恶丝虫的报道[2]。犬恶丝虫也是一种蚊媒传播的人兽共患寄生虫,人通过叮咬可被感染,虫体主要侵害肺部,引起以咳嗽、胸闷和胸疼为特征的临床症状,虫体还可在皮下、眼部、阴囊等处发现[3-6]。
天冬氨酸转氨酶(AspAT,E.C.2.6.1.1)又称谷草转氨酶(GOT),参与氨基酸合成和降解,以不同方式参与氮代谢以及碳的利用率,并作为三羧酸循环多种代谢途径中的一个重要酶。在疟疾、艾美耳球虫等研究中有过较多尝试[7-15]。
为探讨AspAT在犬恶丝虫免疫学诊断、疫苗及药物开发中的作用,本研究从犬恶丝虫成虫转录组数据库中筛选DiAspAT基因[16],通过对该基因的克隆和原核表达,使用AspAT重组蛋白(rAspAT)制备多克隆抗体,应用间接免疫荧光染色法确定AspAT在雌性犬恶丝虫成虫的分布部位,为进一步开展犬恶丝虫病的免疫诊断、疫苗和药物的研发奠定基础。
1 材料与方法
1.1 虫株、菌株、载体及实验动物 犬恶丝虫阳性血清及活虫体采自四川自然感染犬恶丝虫的阳性犬,采集的活虫用PBS清洗并经形态学鉴定后,冻于液氮中备用。雌性犬恶丝虫成虫的石蜡切片,由四川农业大学动物寄生虫病实验室提供。宿主菌大肠杆菌DH5α、大肠杆菌BL21(DE3)、pMD19-T Vector,购于宝生物工程(大连)公司;pET32a(+)载体由四川农业大学动物寄生虫病实验室提供。2只健康新西兰大白兔,雌性,1.5~2.0 kg,购于四川农业大学养兔场。
1.2 主要试剂 总RNA抽提试剂盒,购于华舜生物工程(上海)有限公司,逆转录试剂盒,购于Thermo公司;DNA Marker、Protein Marker、限制性内切酶(EcoRI、HindIII)、T4 DNA连接酶,购于宝生物工程(大连)公司;琼脂糖凝胶回收试剂盒、Ni-NTA Agarose,购于Qiagen公司;TaqPCR MasterMix、质粒小量抽提试剂盒、HRP-DAB底物显色试剂盒,购于天根生化科技(北京)有限公司;HRP-标记羊抗兔IgG、HRP-标记羊抗狗IgG,购于博士德生物工程(武汉)有限公司;弗氏完全佐剂和不完全佐剂,购于Sigma公司;FITC-标记羊抗兔IgG,购于EarthOx公司;HiTrap Protein A HP,购于Bio-Rad公司;PCR引物合成和测序由上海英俊生物工程有限公司完成;其它试剂均为国产分析纯。
1.3 DiAspAT基因的RT-PCR扩增 从液氮中取出犬恶丝虫成虫,根据总RNA抽提试剂盒提取犬恶丝虫的总RNA,按照反转录试剂盒反转录合成cDNA。从犬恶丝虫成虫转录组数据库中筛选得到的DiAspAT unigene11646(GenBank Accession No.: JR907574)序列,使用Primer premiere 5.0软件设计上、下游引物,序列如下:P1 5′-CCGGAATTCATGGCATCATTTTTCAAGAACA -3′;P2 5′- CCCAAGCTT CTATTTTAAATAGTTAATTGTTTCA -3′( 下划线序列分别含EcoR I和Hind III酶切位点),然后以cDNA为模板进行PCR扩增。扩增体系(25 μL):cDNA模板1 μL,上、下游引物各1 μL,PCR Mixture 12.5 μL,灭菌双蒸水9.5 μL。反应条件:94 ℃,5 min; 94 ℃ 60 s,54 ℃ 60 s,72 ℃ 60 s;35个循环,72 ℃延伸10 min。扩增产物经1%琼脂糖凝胶电泳检测。
1.4 DiAspAT基因的克隆及生物信息学分析 用琼脂糖凝胶回收试剂盒回收目的产物后克隆于pMD19-T载体,构建重组质粒pMD19-T-AspAT,将菌液PCR和EcoR I和Hind III双酶切鉴定为阳性的重组质粒送往英骏生物技术(上海)测序。
使用ORF Finder工具分析DiAspAT基因的ORF框(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)。通过在线软件ProtParam(http://web.expasy.org/protparam/)、SignalP(http://www.cbs.dtu.dk/services/SignalP/)、TMHMM2.0(http://www.cbs.dtu.dk/services/ TMHMM/)和BepiPred 1.0b Server(http://www.cbs.dtu.dk/services/BepiPred/)对DiAspAT基因编码的蛋白序列的基本理化性质、信号肽切割位点、跨膜区、B抗原表位进行预测分析。利用在线分析工具(http://www.predictprotein.org/)预测DiAspAT蛋白的二级结构。在NCBI中通过BlastP搜索与DiAspAT蛋白同源的其他寄生虫物种序列,运用DNAMAN软件进行序列相似性分析和MEGA5.0软件构建系统进化树(Neighbor-joining方法)。
1.5 重组表达载体的构建 对测序正确的pMD19-T-AspAT重组质粒和pET32a(+)质粒用EcoR I和Hind III双酶切后回收目的片段,用T4 DNA连接酶进行连接后转化到DH5α菌中构建pET32a(+)-AspAT重组菌,将菌液PCR和酶切鉴定正确的pET32a(+)-AspAT重组质粒和空载体pET32a(+)质粒转化到大肠杆菌BL21(DE3)中,用含0.1 mg/mL氨苄青霉素(AMP)筛选阳性单克隆,且菌液PCR鉴定为阳性的菌液送往测序。
1.6 pET32a(+)-AspAT重组蛋白的表达及纯化
将测序正确的含pET32a(+)-AspAT的重组菌和空载体pET32a(+)菌接种于用含氨苄西林的LB液体培养基,于37 ℃摇床培养6 h,从中吸取菌液加入到LB液态培养基(含AMP)中,于37 ℃摇床培养4 h,直至菌液OD值达到0.6,加入IPTG至终浓度达1 mmol/L(同时选取不加IPTG的作为对照),在37 ℃培养5 h。12 000 r/min离心10 min收集菌体,超声波裂解后,对表达菌体的上清和沉淀用12%SDS-PAGE电泳分析,确定重组蛋白的表达情况和存在形式。并优化原核表达的IPTG的诱导浓度、诱导时间和最适温度。
在最佳表达条件下大量诱导表达,rAspAT用Ni-NTA层析柱亲和纯化,其操作按照说明书进行,用核酸蛋白仪测定纯化后回收蛋白浓度。
1.7 免疫印迹(Western blotting)分析 重组蛋白经SDS-PAGE分离后的凝胶半干转移到PDVF膜上,5%脱脂奶粉室温封闭2h,血清(1∶200稀释)作为一抗4 ℃孵育过夜,TBST洗涤,HRP-标记羊抗狗IgG(1∶3 000稀释)作为二抗进行室温孵育2 h,TBST洗涤,二氨基联苯胺(DBA)显色,加纯水终止反应。
1.8 兔抗rAspAT-IgG血清的制备和纯化 参照Hu等[17]的免疫方法制备兔抗rAspAT-IgG血清。免疫程序结束后经心脏采血并分离血清。获得的血清根据HiTrap Protein A HP的使用说明纯化兔抗rAspAT-IgG,纯化后的抗体分别用SDS-PAGE和Western blotting检测其纯度和特异性。
1.9 间接免疫荧光染色 雌性犬恶丝虫成虫石蜡切片经二甲苯脱蜡,梯度酒精复水,用柠檬酸缓冲液进行抗原热修复,PBS(pH7.4)洗涤,滴加3%H2O2,室温孵育20 min,PBS洗涤,滴加5%BSA(牛白蛋白溶液)室温封闭30 min,PBS洗涤。滴加1.2.5制备的一抗,同时以免疫AspAT蛋白前的兔血清作为阴性对照(1∶100稀释),于湿盒中4 ℃孵育过夜,PBS洗涤后,滴加二抗(FITC-标记的羊抗兔IgG,用0.1%伊文氏蓝1∶100稀释),湿盒中37 ℃孵育1 h,PBS洗涤。树脂胶封片后,在荧光显微镜下观察与照像。
2 结 果
2.1 DiAspAT基因的RT-PCR扩增及克隆 DiAspAT基因的RT-PCR产物通过1%琼脂糖凝胶电泳,得到与预期结果一致的特异性条带,如图1A。重组质粒pMD19-T-AspAT经PCR鉴定为阳性的,其质粒经双酶切鉴定显示,插入片段的大小与预期结果一致(图1B),测序显示其序列与转录组数据中筛选的序列一致。

M1、M2:DNA分子质量标准;(A)DiAspAT基因的RT-PCR产物,1:PCR产物;(B)重组质粒pMD19-T-AspAT的酶切鉴定,1:双酶切产物,(C)重组质粒pET32a(+)-AspAT的酶切鉴定,1:双酶切产物M1: DL2000 DNA marker; M2 DL7000 DNA marker; (A) Products of DiAspAT gene by RT-PCR, 1: PCR products; (B) Identification of recombinant plasmid pMD19-T-AspAT by restriction endonucleases digestion, 1: products of double-enzyme digestion; (C) Identification of recombinant plasmid pET32a(+)-AspAT by restriction endonucleases digestion, 1: products of double-enzyme digestion图1 DiAspAT基因的RT-PCR产物及重组质粒的酶切鉴定Fig.1 Products of DiAspAT gene by RT-PCR and identification of recombinant plasmid by restriction endonucleases digestion
2.2 DiAspAT基因的生物信息学分析
2.2.1 DiAspAT蛋白的理化性质预测 DiAspAT的ORF框长为1 221 bp,其中A、T、C、G含量分别为31.70%、29.81%、17.04%、21.46%,G+C含量为38.49%,A+T含量为61.51%。Protparam分析结果显示,DiAspAT基因序列编码406个氨基酸,蛋白质的分子式C2067H3205N549 O580S22,原子总数为4 623,相对分子量45.731 8 kDa,等电点为8.05。带负电荷氨基酸残基总数为43,带正电荷氨基酸残基总数为45。含量最多的氨基酸分别是Ala(37/406,9.1%)和Leu(36/406,8.9%),Cys和Trp含量最少,无Pyl和Sec两种氨基酸。蛋白在280 nm的消光系数为58245 M·cm,估算半衰期大于10 h。蛋白质不稳定系数为32.26,亲水性平均数为-0.159,因此,预测DiAspAT是稳定的可溶性蛋白。
该蛋白无信号肽,整个蛋白都在膜外,蛋白抗原表位有14个,主要集中在23-30、39-46、57-60、92-100、109-113、132-135、154-157、172-176、187-200、222-230、272-275、288-296、338-346、388-392位氨基酸。DiAspAT蛋白的二级结构显示,该蛋白中α-螺旋占48.77%,β-折叠占10.84%,环状结构占40.39%。其次,预测该蛋白有4个N-糖基化位点,4个蛋白激酶C磷酸化位点,2个酪蛋白激酶Ⅱ磷酸化位点,1个酪氨酸激酶磷酸化位点,3个N-豆蔻酰化位点,1个Class I转氨酶磷酸吡哆醛PLP附着位点(aa249-262)。
2.2.2 DiAspAT蛋白的氨基酸序列同源性分析及分子进化树构建 犬恶丝虫的AspAT氨基酸序列与盘尾丝虫AspAT(Accession No.:AAY89413)、班氏丝虫(Accession No.:EJW87036)、马来丝虫(Accession No.:XP_001897604)、罗阿丝虫(Accession No.:XP_003146526)、鼠类圆线虫(Accession No.:CEF69308)的AspAT序列相似性分别为89%、86%、85%、84%和67%。从系统发育树中可以看出犬恶丝虫AspAT与盘尾丝虫的亲缘关系较近,聚为一个分支(图2)。
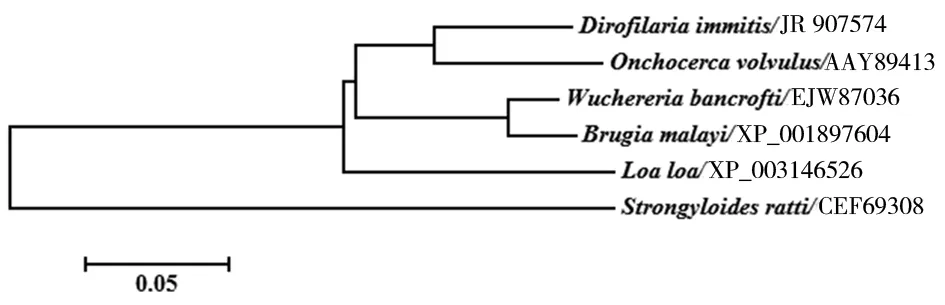
图2 DiAspAT蛋白的系统发育树(NJ树)Fig.2 Phylogenetic analysis of DiAspAT proteins (NJ tree)
2.3 重组表达载体的构建 pET32a(+)-AspAT重组质粒经PCR鉴定为阳性的,其质粒经双酶切鉴定显示,插入片段的大小与预期结果一致(图1C)。酶切鉴定正确的质粒pET32a(+)-AspAT转化到表达菌BL21中,经PCR鉴定为阳性的质粒其测序结果显示成功构建表达载体。
2.4 重组蛋白的表达、纯化及免疫印迹分析 经优化,确定原核表达最佳条件为:IPTG浓度为1.0 mmol/L,37 ℃诱导6 h。诱导表达后的pET32a(+)-AspAT重组菌,经12%SDS-PAGE电泳显示,得到约64 kDa左右的蛋白,与预期结果大小一致(图3A)。通过可溶性分析,pET32a(+)-AspAT表达的蛋白主要以上清的形式存在。pET32a(+)-AspAT表达的蛋白,经Ni-NTA亲和层析柱纯化后的蛋白经SDS-PAGE电泳显示,AspAT蛋白条带较单一,纯度较好(图3A)。免疫印迹分析,显示该重组蛋白能与感染了犬恶丝虫的犬阳性血清特异性结合,目的条带与预期结果一致(图3B)。

M:蛋白质分子质量标准;(A)rAspAT的表达,1:IPTG诱导的含pET32a(+)-AspAT的细菌;2:IPTG未诱导的含pET32a(+)-AspAT的细菌;3:IPTG未诱导的含pET32a(+)的细菌;4:IPTG诱导的含pET32a(+)细菌。(B)rAspAT的纯化和免疫印迹分析,1:纯化的重组蛋白;2:rAspAT的免疫印迹结果M: Protein marker; (A) The expression of recombinant protein AspAT, 1: pET32a(+)-AspAT induced by IPTG; 2: pET32a(+)-AspAT without IPTG induction; 3: pET32a(+) without IPTG induction; 4: pET32a(+) induced by IPTG; (B) Purification of recombinant protein AspAT and western blot analysis, 1: Purified recombinant protein; 2: Western blotting result of rAspAT图3 rAspAT的表达、纯化及免疫印迹分析Fig.3 Expression, purification and western blotting analysis of recombinant protein AspAT
2.5 DiAspAT的免疫荧光定位
间接免疫荧光染色结果显示,DiAspAT在雌性犬恶丝虫成虫的侧索、皮下组织、肌细胞、子宫及肠上皮、假体腔壁、发育中的胚胎都有表达,其中在侧索、假体腔壁、子宫及肠上皮、发育的胚胎表达水平较高,在皮下组织、肌细胞表达水平较低(图4A)。
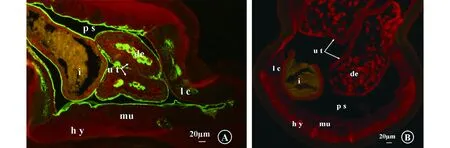
(A)纯化的兔抗重组AspAT蛋白抗体作为一抗;(B)免疫前的血清作为一抗。i:肠;ut:子宫;de:发育的胚胎;hy:皮下组织;mu:肌肉;lc:侧索;ps:假体腔;比例尺:20 μm(A) purified rabbit anti-rDiAspAT-Ig as primary antibodies; (B) pre-immune sera as primary antibodies. i: intestine; ut: uterus; de: developing embryos; hy: hypodermis; mu: muscle; chord; lc: lateral chord;ps: pseudocoelom; scale bar, 20 μm图4 雌性犬恶丝虫成虫横切面AspAT蛋白的间接免疫荧光定位Fig.4 Tissue localization of the transverse sections of adult female Dirofilaria immitis AspAT protein detected by indirect immunofluorescence
3 讨 论
3.1 天冬氨酸转氨酶(AspAT)在寄生虫氨基酸合成与代谢中发挥重要作用,已有研究发现丝虫体内的内共生菌——沃尔巴克氏体(Wolbachia)需要的氨基酸除它自己能合成的唯一氨基酸——内消旋二氨基庚二酸外,其生长所需的其它氨基酸均由丝虫提供[18]。沃尔巴克氏体是丝虫对宿主致病的原因,且可能是丝虫从胚胎形成及幼虫发育到成虫所必需的,有助于丝虫的胚胎形成、生长发育和生殖,清除沃尔巴克氏体对丝虫的发育有抑制作用,甚至使丝虫死亡,而研究发现大多数引起人类和动物疾病的丝虫(包括马来丝虫、班氏丝虫、盘尾丝虫和犬恶丝虫等)均含有沃尔巴克氏体共生菌,且沃尔巴克氏体对于研究人类和动物丝虫的致病性和丝虫病的防治均具有重要意义,针对丝虫沃尔巴克氏体为靶点的药物治疗,为人和动物丝虫病的治疗带来了新的思路[19-22]。
虽然有研究报道在盘尾丝虫中有一个编码沃尔巴克氏体AspAT的基因,但是由于沃尔巴克氏体在分类学上,属于立克次体目、立克次体科,沃尔巴克体属,且研究发现立克次氏体在细胞内的生活方式演变过程中许多基因已经丢失,只剩下6个基因参与氨基酸代谢,而独立生存的细菌比之多5倍,沃尔巴克氏体的AspAT在细胞内的生活方式演变过程中其在代谢中的功能是否仍然保留还不清楚[7,23]。本次研究发现,在侧索、皮下组织、子宫上皮以及发育的胚胎均有DiAspAT的表达,与文献中沃尔巴克氏体分布的位置一致[18, 21, 24-25]。这表明,丝虫的AspAT可能不仅对丝虫的代谢起重要作用,也可能对沃尔巴克氏体的氨基酸代谢有一定的作用,抑制丝虫AspAT酶活性可能同时抑制丝虫及其体内的沃尔巴克氏体的生长,推测DiAspAT可以作为抗犬恶丝虫的药物靶点,研发同时抑制犬恶丝虫和沃尔巴克氏的AspAT活性的药物,可起到双重杀灭作用,这样或许还可以克服药物只针对犬恶丝虫或沃尔巴克氏达不到理想的治疗效果所带来的缺点,从而为有效的治疗犬恶丝虫病及人类丝虫病提供参考。
3.2 DiAspAT在肠上皮细胞有表达,而有研究发现,嗜血性寄生虫(如犬恶丝虫)肠上皮细胞的“隐藏抗原”能被宿主的免疫应答机制识别,但是它们通常不会暴露在宿主的免疫系统下,且与分泌排泄的抗原或传统的暴露在虫体表面的抗原相比,肠上皮细胞的“隐藏抗原”更适合做寄生虫的蛋白疫苗[26],因此,DiAspAT可能是犬恶丝虫的肠上皮细胞的“隐藏抗原”,可作为一个候选疫苗抗原。同时,在免疫印迹分析中,rAspAT能被犬恶丝虫阳性血清识别,说明该血清中存在有针对rAspAT的特异性抗体,且rAspAT具有反应原性,因此,DiAspAT还可作为犬恶丝虫病免疫学诊断的候选抗原。
[1] Sassi A, Geary J, Leroux LP, et al. Identification ofDirofilariaimmitisproteins recognized by antibodies from infected dogs[J]. J Parasitol, 2014, 100(3): 364-367.DOI: 10.1645/13-437.1
[2] Huang HS, Yang GY, Wang CD, et al. Advances in pathogen biology of Heartworm disease[J]. Sichuan J Zool, 2008, 27(2): 316-319. (in Chinese)
黄红松, 杨光友, 王成东,等. 犬恶丝虫病病原生物学研究进展[J]. 四川动物, 2008, 27(2): 316-319.
[3]Foissac M, Million M, Mary C, et al. Subcutaneous infection withDirofilariaimmitisnematode in human, France[J]. Emerg Infect Dis, 2013, 19(1): 171-172.DOI: 10.3201/eid1901.120281
[4]Martínez-De La Puente J, Moreno-Indias I, Hernández-Castellano LE, et al. Host-feeding pattern ofCulextheileri(Diptera: Culicidae), potential vector ofDirofilariaimmitisin the Canary Islands, Spain[J]. J Med Entomol, 2012, 49(6): 1419-1423.DOI: 10.1603/ME12081
[5]Godel C, Kumar S, Koutsovoulos G, et al. The genome of the heartworm,Dirofilariaimmitis, reveals drug and vaccine targets[J]. FASEB J, 2012, 26(11): 4650-4661.DOI: 10.1096/fj.12-205096
[6]Bowman D, Little SE, Lorentzen L, et al. Prevalence and geographic distribution ofDirofilariaimmitis,Borreliaburgdorferi,Ehrlichiacanis, andAnaplasmaphagocytophilumin dogs in the United States: results of a national clinic-based serologic survey[J]. Vet Parasitol, 2009, 160(1/2): 138-148.DOI: 10.1016/j.vetpar.2008.10.093
[7]Fischer P, Bonow I, Büttner DW, et al. An aspartate aminotransferase ofWolbachiaendobacteria fromOnchocercavolvulusis recognized by IgG1antibodies from residents of endemic areas[J]. Parasitol Res, 2003, 90(1): 38-47.DOI: 10.1007/s00436-002-0813-2
[8]Wrenger C, Müller IB, Silber AM, et al. Aspartate aminotransferase-bridging carbohydrate and energy metabolism inPlasmodiumfalciparum[J]. Curr Drug Metab, 2012, 13(3): 332-336.DOI: 10.2174/138920012799320400
[9]Ting LM, Shi WX, Lewandowicz A, et al. Targeting a novelPlasmodiumfalciparumpurine recycling pathway with specific immucillins[J]. J Biol Chem, 2005, 280(10): 9547-9554.DOI: 10.1074/jbc.M412693200
[10] Kronenberger T, Lindner J, Meissner KA, et al. Vitamin B6-dependent enzymes in the human malaria parasitePlasmodiumfalciparum: a druggable target?[J]. Biomed Res Int, 2014, 2014: 1-11.DOI: 10.1155/2014/108516.
[11]Marciano D, Llorente C, Maugeri DA, et al. Biochemical characterization of stage-specific isoforms of aspartate aminotransferases fromTrypanosomacruziandTrypanosomabrucei[J]. Mol Biochem Parasitol, 2008, 161(1): 12-20.DOI: 10.1016/j.molbiopara.2008.05.005
[12]Thornburg JM, Nelson KK, Clem BF, et al. Targeting aspartate aminotransferase in breast cancer[J]. Breast Cancer Res Treat, 2008, 10(5): R84.DOI: 10.1186/bcr2154
[13]Wrenger C, Müller IB, Schifferdecker AJ, et al. Specific inhibition of the aspartate aminotransferase ofPlasmodiumfalciparum[J]. J Mol Biol, 2011, 405 (4): 956-71. DOI: 10.1016/j.jmb.2010.11.018
[14]Jain R, Jordanova R, Müller IB, et al. Purification, crystallization and preliminary X-ray analysis of the aspartate aminotransferase ofPlasmodiumfalciparum[J]. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2010, 66(4): 409-412.DOI: 10.1107/S1744309110003933
[15]Yolchiyev YYO, Mamedova FZG. Glutamate dehydrogenase, alanine- and aspartate aminotransferase of E.Tenella(Apicomplexa, Coccidia) oocysts and effect of amino acids' alkyl derivatives on their activities[J]. IJNES, 2007, 1(2): 23-27.
[16]Fu Y, Lan J, Zhang Z, et al. Novel insights into the transcriptome ofDirofilariaimmitis[J]. PLoS One, 2012, 7(7): e41639.DOI: 10.1371/journal.pone.0041639
[17]Hu YX, Guo JY, Shen L, et al. Get effective polyclonal antisera in one month[J]. Cell Res, 2002, 12(2): 157-160.DOI: 10.1038/sj.cr.7290122
[18]Taylor MJ, Bandi C, Hoerauf A.Wolbachiabacterial endosymbionts of filarial nematodes[J]. Adv Parasitol, 2005, 60: 245-284.DOI: 10.1016/S0065-308X(05)60004-8
[19]Bouchery T, Lefoulon E, Karadjian G, et al. The symbiotic role ofWolbachiain Onchocercidae and its impact on filariasis[J]. Clin Microbiol Infect, 2013, 19(2): 131-140.DOI: 10.1111/1469-0691.12069
[20]Slatko BE, Taylor MJ, Foster JM. TheWolbachiaendosymbiont as an anti-filarial nematode target[J]. Symbiosis, 2010, 51(1): 55-65.DOI: 10.1007/s13199-010-0067-1
[21]Taylor MJ, Voronin D, Johnston KL, et al.Wolbachiafilarial interactions[J]. Cell Microbiol, 2013, 15(4): 520-526.DOI: 10.1111/cmi.12084
[22] Liu M, Yang GY. Progress onWolbachia——symbiotic bacteria in human and animal filariae[J]. Progr Vet Med, 2015, 36(4): 87-91.(in Chinese)
刘梅, 杨光友. 人和动物丝虫共生菌——沃尔巴克氏体研究进展[J]. 动物医学进展, 2015, 36(4): 87-91.
[23]Andersson SGE, Zomorodipour A, Andersson JO, et al. The genome sequence ofRickettsiaprowazekiiand the origin of mitochondria[J]. Nature, 1998, 396(6707): 133-140.DOI: 10.1038/24094
[24]Fischer K, Beatty WL, Weil GJ, et al. High pressure freezing/freeze substitution fixation improves the ultrastructural assessment ofWolbachiaendosymbiont - filarial nematode host interaction[J]. PLoS One, 2014, 9(1): e86383.DOI: 10.1371/journal.pone.0086383
[25]Ferri E, Bain O, Barbuto M, et al. New insights into the evolution ofWolbachiainfections in filarial nematodes inferred from a large range of screened species[J]. PLoS One, 2011, 6(6): e20843.DOI: 10.1371/journal.pone.0020843
[26]Mcgonigle S, Yoho ER, James ER. Immunisation of mice with fractions derived from the intestines ofDirofilariaimmitis[J]. Int J Parasitol, 2001, 31(13): 1459-1466. DOI: 10.1016/S0020-7519(01)00272-7
Yang Guang-you,Email:guangyou1963@aliyun.com
Prokaryotic expression and analysis of aspartate aminotransferase gene fromDirofilariaimmitis
LIU Mei1, LAN Jing-chao2, WANG Yu1, LIN Hai1, ZHANG Zhi-he2,WANG Cheng-dong2,LUO Li2, LIU Li2, GU Xiao-bin1, WANG Tao1, YANG Guang-you1
(1.CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu611130,China;2.ChengduResearchBaseofGiantPandaBreeding,Chengdu610081,China)
To understand the characteristic of aspartate aminotransferase (AspAT) gene fromDirofilariaimmitis(DiAspAT) and location in the worm, the gene of DiAspAT was cloned and expressed in prokaryocyte and analysed by immunofluorescence localization. DiAspAT gene sequence was selected from transcriptome of adultD.immitisand was cloned by RT-PCR method and analysed by bioinformatic approaches. A prokaryotic expression vetor of pET32a(+)-AspAT was reconstructed and then was induced expression. The expression product was purified by Ni-NTA affinity chromatography and analysed by Western blotting. Indirect immunofluorescence assay was performed to survey the distribution of DiAspAT protein in adult femaleD.immitis. The open reading frame of DiAspAT gene was 1 221 bp and encodes 406 amino acids, and the molecular weight of DiAspAT was 45.731 8 kDa and pI=8.05.The recombinant protein was about 64 kDa. Western blotting demonstrated that the AspAT recombinant protein (rAspAT) could be recognized by dog ofDiAspATdirofilariasis positive serum. Indirect immunofluorescence localization studies illustrated the DiAspAT protein localized in the lateral chord, hypodermis, muscle, pseudocoelom wall, epithelia of uterus and intestine, developing embryos. This study first successfuly clonied and expressied the DiAspAT gene, and completed locating of DiAspAT protein in adult femaleD.immitis. The results lay the foundation for further understanding of metabolism ofD.immitisand study the diagnosis and prevention and control of dirofilariasis.
Dirofilariaimmitis; AspAT gene; clone; prokaryotic expression; immunofluorescence localization
成都大熊猫繁育研究基金项目(No.CPF2014-09)资助
杨光友,Email:guangyou1963@aliyun.com
1.四川农业大学动物医学院,成都 611130;
2.成都大熊猫繁育研究基地,成都 610081
10.3969/j.issn.1002-2694.2016.08.004
R383
A
1002-2694(2016)08-0700-06
2015-12-01;
2016-03-16
Supported by the Research Foundation of Chengdu Giant Panda Breeding (CPF-2014-09)

