3,5-二氯水杨醛缩罗丹明B酰腙的合成及对Cu2+高选择性识别
冯泳兰 方敬贤 刘超 伍徐孟 许猛 蒋伍玖 庾江喜 谭宇星 邝代治(衡阳师范学院化学与材料科学学院,功能金属有机材料湖南省普通高等学校重点实验室,衡阳4008)(湘南学院化学与生命科学系,郴州43043)
3,5-二氯水杨醛缩罗丹明B酰腙的合成及对Cu2+高选择性识别
冯泳兰*,1方敬贤1刘超1伍徐孟2许猛1蒋伍玖1庾江喜1谭宇星1邝代治1
(1衡阳师范学院化学与材料科学学院,功能金属有机材料湖南省普通高等学校重点实验室,衡阳421008)
(2湘南学院化学与生命科学系,郴州423043)
设计合成了一种可逆的Cu2+比色探针3,5-二氯水杨醛缩罗丹明B酰腙(L),采用IR、1H NMR、13C NMR、元素分析和X射线单晶衍射对其结构进行了表征。利用紫外-可见吸收光谱考察了探针对金属离子的识别性能,实验结果表明,探针L在乙腈/乌洛托品(pH 5.6)缓冲体系中,当加入Cu2+后,溶液从无色变为玫瑰红色,而加入其它金属离子,溶液颜色几乎无变化,可实现3,5-二氯水杨醛缩罗丹明B酰腙探针对Cu2+高灵敏、专一显色响应,最低检测限达到了9.30×10-8mol·L-1。
3,5-二氯水杨醛缩罗丹明B酰腙;晶体结构;铜离子;识别
铜及其化合物和合金广泛应用于工业、农业、国防和医药,铜也是人体内一种非常重要的微量元素[1-2],但生命体内超量的铜有害[3-5],影响人类的健康和动植物的繁衍生存。随着科技的进步,工业化进程的推进,铜又造成对环境严重的重金属污染,检测环境中铜离子含量已成为环境检测中的一项重要指标;因此,建立对环境中铜离子简便、快速、准确地监测方法具有十分重要的现实意义,一直也是化学工作者高度关注的领域。检测铜离子的方法主要有电化学分析法[6]、电感耦合等离子体质谱法[7]、原子吸收光谱法[8]、荧光光谱法[9]、分光光度法[10]等。在众多检测铜离子方法中,因分光光度法仪器廉价、操作简便、分析快速和成本低等特点受到分析工作者的青睐[11]。
罗丹明B衍生物具有良好的水溶性,吸收波长位于可见光区,摩尔吸光系数大,是一种良好的金属离子探针的发色团,当罗丹明衍生物中加入重金属离子时,能从闭环内酰胺状态转变为开环酰胺状态,导致溶液颜色的改变,实现对金属离子的可视检测[12-13]。表1列出了紫外可见光度法中环境保护行业标准(HJ 485-2009,HJ 486-2009)和罗丹明衍生物用于环境水中测定铜的方法。
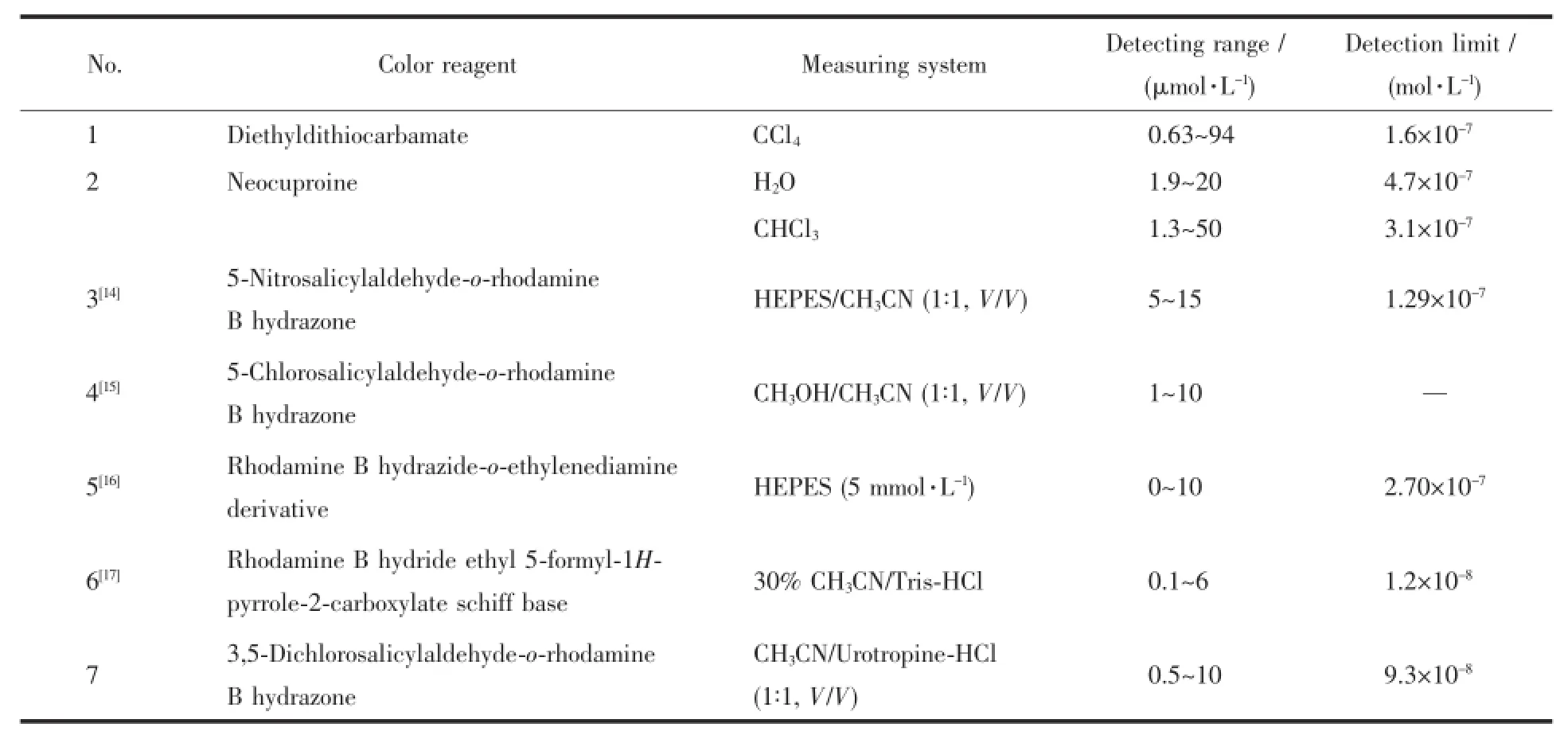
表1不同试剂用于环境水中Cu2+测定结果(紫外可见光度法)Table 1 Different reagents for the measurement results for Cu2+in environmental water(UV-Visible spectroscopy)
1实验部分
1.1仪器和试剂
IR用日本岛津Prestige-21红外光谱仪(4 000~400 cm-1,KBr压片)测定;1H和13C NMR用瑞士Bruker AVANCE-400核磁共振仪(TMS内标)测定;元素分析用美国PE-2400(Ⅱ)元素分析仪测定;晶体结构用Bruker SMART APEXⅡCCD单晶衍射仪测定;紫外-可见光谱用日本岛津UV-2550光谱仪测定;酸度用上海雷磁PHS-3C酸度计测定;熔点用北京泰克X-4双目体视显微熔点测定仪测定(温度计未经校正)。
硝酸、盐酸为优级纯,金属或金属离子试剂均为高纯试剂,乙腈为色谱纯,其他试剂为分析纯,实验用水为二次蒸馏水。
1.2合成
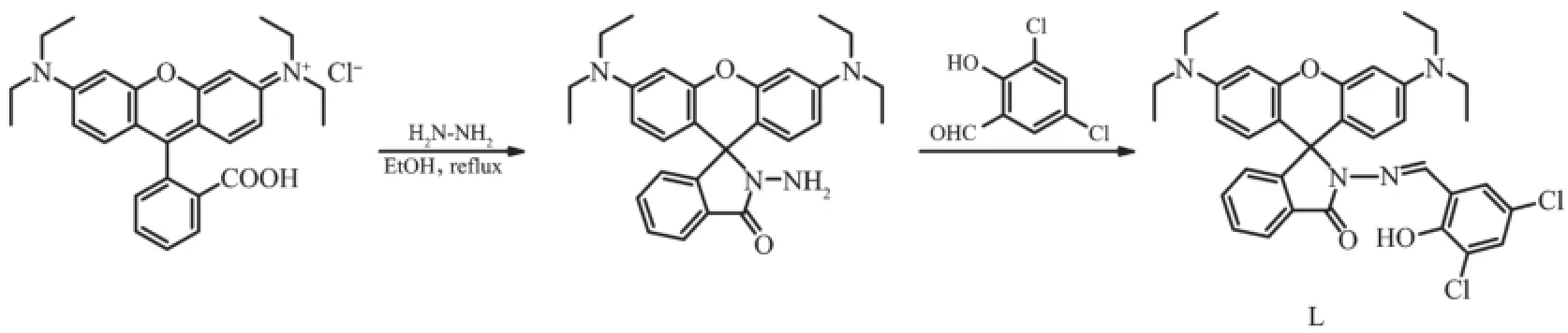
图1探针L的合成线路图Fig.1 Synthesis of Probe L
1.2.1罗丹明B酰肼的合成
[18-19]方法,在250 mL三口烧瓶中,加入9.58 g(10 mmol)罗丹明B和120 mL乙醇,混匀后,滴加24 mL一水合肼,搅拌回流2 h。反应完成后,旋转蒸发部分溶剂,用1 mol·L-1的NaOH溶液调节溶液pH值为9~10,析出红色固体,抽滤,用少量蒸馏水洗涤,干燥,得桃红色粉末6.94 g,产率76%。m.p.296~297℃(dec)。元素分析(C28H34N4O2)实测值(计算值)%:C,72.99(73.33);H,7.51(7.47);N,12.76(12.22)。IR(KBr,cm-1):2 972(w),2 365(w),1 693 (m),1 612(s),1 547(m),1 513(vs),1 467(m),1 426 (m),1 398(w),1 374(w),1 358(m),1 327(w),1 302(w),1 216(s),1 116(vs),818(m),786(m),757(m),698(m)。1H NMR(CDCl3,400 MHz):δ 7.93(m,1H,Ar-H),7.48 (m,2H,Ar-H),7.10(m,1H,Ar-H),6.45(t,J=8.4 Hz,2H,Xanthene-H),6.42(s,2H,Xanthene-H),6.30(d,J= 8.0 Hz,2H,Xanthene-H),3.61(s,2H,N H2),3.45(m,8H,N(C H2CH3)2),1.17(t,J=8.5 Hz,12H,N(CH2C H3)2)。13C NMR(CDCl3,100 MHz):δ 166.09,153.88,151.57,148.96,132.41,130.09,128.06,128.01,123.81,122.9 4,108.18,104.87,98.12,66.00,44.43,12.60。
1.2.23,5-二氯水杨醛缩罗丹明B酰肼的合成
在50 mL圆底烧瓶中,加入0.457 g(1 mmol)罗丹明B酰肼、0.191 g(1 mmol)3,5-二氯水杨醛、25 mL无水乙醇,搅拌回流8 h,待反应完成后,旋转蒸发溶剂,析出固体,用甲醇重结晶。得到淡黄色晶体0.453 g,产率72%。m.p.203~206℃。元素分析(C35H34Cl2N4O3)实测值(计算值)%:C,66.71(66.77);H,5.49(5.44);N,8.99(8.90)。IR(KBr,cm-1):3 358(m),2 965(m),2 872(m),2 358(m),1 708(m),1 651(w),1 515(w),1 429(m),1 377(m),1 238(w),1 134(s),1 091 (s),1 047(vs),995(s),880(m),808(m),661(m)。1H NMR (CDCl3,400 MHz):δ 11.47(s,1H,phen-O H),8.82(s,1H,N=C-H),7.98(d,J=7.2 Hz,1H,Ar-H),7.54~7.48 (m,2H,Ar-H),7.14(d,J=7.2 Hz,1H,Ar-H),7.24(s,1H,phen-H),6.94(s,1H,phen-H),6.47(d,J=8.4 Hz,2H,Xanthene-H),6.47(s,2H,Xanthene-H),6.26(d,J=8.8 Hz,2H,Xanthene-H),3.33(q,J=7.2 Hz,8H,-N(C H2CH3)2), 1.16(t,J=7.2 Hz,12H,-N(CH2C H3)2)。13C NMR(CDCl3, 100 MHz):δ 164.48,153.29,152.92,151.35,149.23,148.91,133.78,130.56,128.84,128.75,128.55,127.87, 124.06,123.46,123.17,122.30,120.32,108.33,104.87, 98.23,66.28,44.33,12.56。
1.3晶体结构测定
选取尺寸为0.20 mm×0.20 mm×0.18 mm的探针L晶体,在Bruker SMART APEXⅡCCD单晶衍射仪上,采用经石墨单色化的Mo Kα射线(λ= 0.071 073 nm),以φ~ω扫描方式收集衍射数据。化合物L在1.82°~25.10°范围内共收集16 347个衍射点,其中独立衍射点5 641个(Rint=0.025 2),用于结构精修的可观察衍射点4 585个(I>2σ(I))。全部数据经Lp因子和多重扫描吸收校正。晶体结构由直接法解出,全部非氢原子坐标在随后的差值傅立叶合成中陆续确定。对非氢原子坐标及其各向异性热参数用SHELXL[20]进行全矩阵最小二乘法修正至收敛。氢原子为理论加氢并采用“跨式(riding model)模型”进行修正。
CCDC:1053264,L。
1.4溶液的配制及样品的前处理
探针L储备液(1 mmol·L-1):称取0.031 5 g探针L,用DMF溶解,定容至50 mL。
乙腈-乌洛托品缓冲溶液(约0.05 mol·L-1):称取0.7 g乌洛托品,用水稀释至约50 mL,用浓盐酸调pH值至5.6,再加入50 mL乙腈混匀(该溶液现用现配)。
Cu2+标准液(1 mmol·L-1):称取0.124 8 g CuSO4· 5H2O溶解于水中,并稀释至500 mL。
其它金属离子溶液(1 mmol·L-1):Hg2+为汞单质经硝酸溶解配置,Sm3+为Sm2O3经盐酸溶解配置,Ca2+为CaCO3经盐酸溶解配置,Mn2+、Fe2+为硫酸盐配置,其余均为硝酸盐或氯化物配置。
样品处理:湘江水样品取自衡阳市湘江东洲岛段,水样经普通抽滤,再经0.45 μm水系滤膜过滤,冷藏备用;自来水样品经0.45 μm水系滤膜过滤,冷藏备用。
1.5测定方法
探针L对金属离子的识别测定:于10 mL比色管中依次加入100 μL 1 mmol·L-1探针L、100 μL 1 mmol·L-1不同金属离子标准液,用乙腈-乌洛托品缓冲溶液定容至5 mL,摇匀,放置10 min后,用1 cm石英比色皿,扫描吸收光谱(450~700 nm)。
样品测定:在10 mL比色管中依次加入50 μL 1 mmol·L-1探针L、不同浓度的样品溶液,用乙腈-乌洛托品缓冲溶液定容至5 mL,摇匀,放置10 min后,用1 cm石英比色皿,于560 nm处,测定其吸光值。
2 结果与讨论
2.1探针L的晶体结构分析
探针L的晶体学数据见表2,化合物的分子结构如图2所示,从图中可以看出C15、C13、C8、C14、N3原子组成五元杂环,说明探针L是以闭合螺环的形式存在;3,5-二氯水杨醛酚羟基氧原子O3与Schiff碱部分中C=N双键中的N4原子形成分子内氢键,形成一个由N4、C7、C1、C2、O3组成的六元环结构,此六元环与3,5-二氯水杨醛基苯环共平面,且与氧蒽杂环接近垂直。
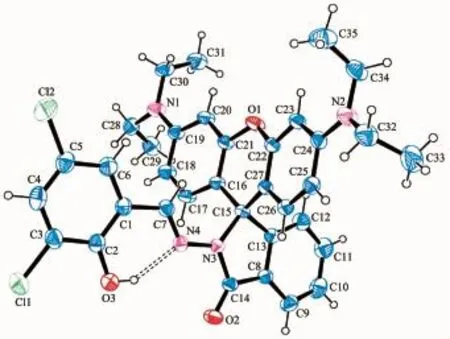
图2探针L的分子结构图(椭球率30%)Fig.2 Molecular structure of probe L with 30% probability ellipsoids
2.2紫外-可见光谱实验条件的选择
实验考察了溶剂体系、pH值及响应时间对探针L识别Cu2+的影响。在乙腈含量20%~80%(体积分数)范围内,探针L对Cu2+产生较为稳定的吸收增强响应,因此实验选择乙腈与缓冲溶液体积比为1∶1进行测试。由图3可知,在560 nm处,探针L在pH=3左右存在较弱吸收,在pH>5无明显吸收;当加入Cu2+后,探针L在560 nm处的吸收显著增强,且在pH=5~6吸收增强最大,因此选择pH 5.6(乌洛托品-盐酸缓冲体系)为最优pH值。在乙腈-乌洛托品(体积比1∶1)溶液中,测试了探针L(10 μmol·L-1)对Cu2+的响应时间,如图4所示,探针L识别Cu2+的过程在5 min后达到稳定;因此,在紫外-可见光谱法研究中,实验选择乙腈-乌洛托品(体积比1∶1)为溶剂体系,加入金属离子10 min后记录光谱数据。
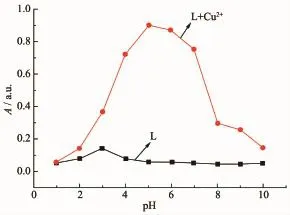
图3不同pH值下探针L对Cu2+的识别(560 nm处吸收)Fig.3 Recognition of Cu2+by L under different pH values (absorbance at 560 nm)
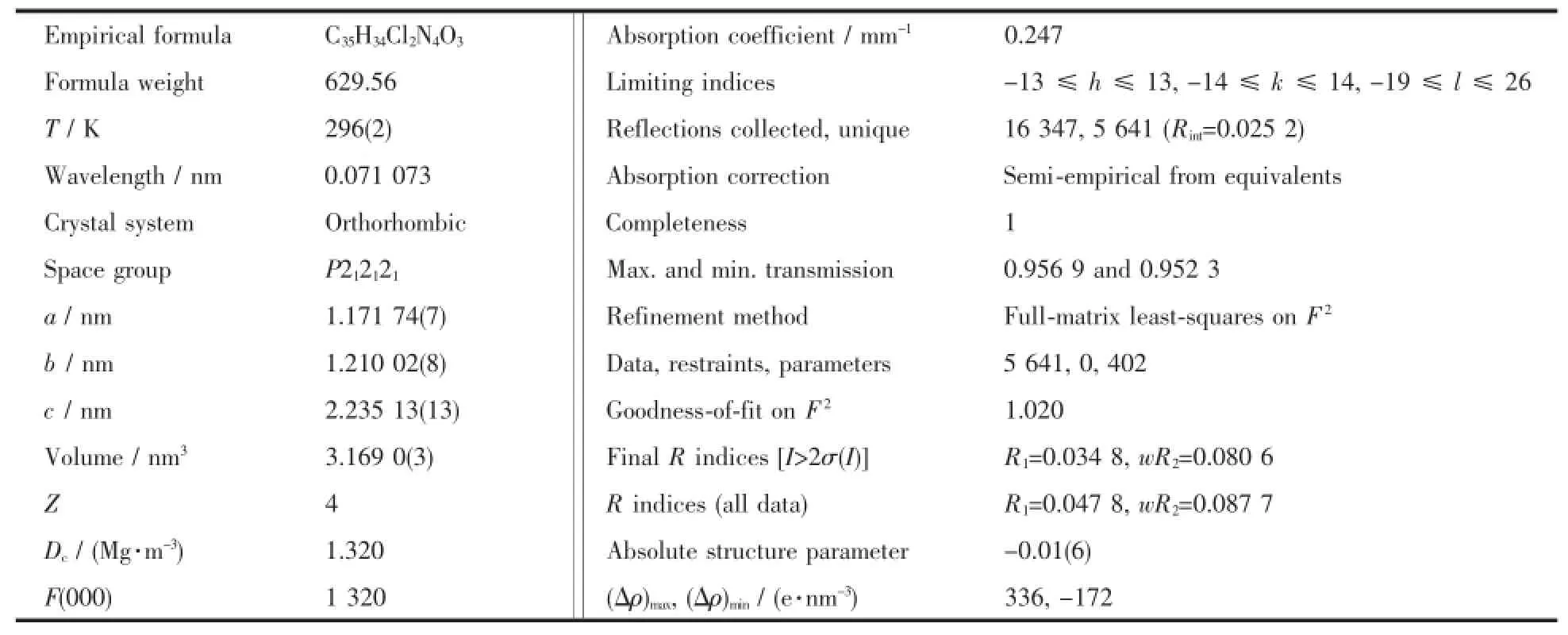
表2探针L的晶体学数据Table 2 Crystallographic data of probe L
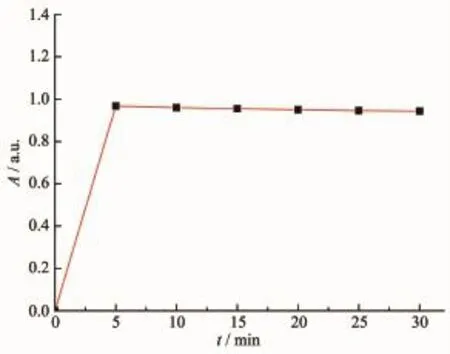
图4时间对探针L识别Cu2+的影响(560 nm处吸收)Fig.4 Time dependent absorbance changes of L with Cu2+(absorbance at 560 nm)
2.3探针L对Cu2+的选择性识别
在20 μmol·L-1探针L的乙腈-乌洛托品(体积比1∶1)溶液中分别加入20 μmol·L-1的不同金属离子,扫描其吸收光谱,结果如图5所示。结果表明:当未加金属离子时,探针L基本为无色;当加入Cu2+后,探针L显玫瑰红色,在560 nm处吸光度明显增强;当加入其他金属离子如:Na+,K+,Mg2+,Ba2+,Al3+,Ag+,Zn2+,Cd2+,Hg2+,Fe2+,Mn2+,Co2+,Ni2+,Cr3+,Pb2+,Sm3+,探针L均无明显响应。
共存离子的影响是探针识别重要性质之一,我们研究了金属离子共存下,探针L对Cu2+的识别,结果显示,当其他金属离子加入到探针L的乙腈-乌洛托品(体积比1∶1)溶液中时,不会产生明显的吸收峰及颜色变化,但是再向该体系中加入Cu2+后,在560 nm处,吸光度明显增强,溶液颜色也由无色变为玫瑰红色。这表明在共存离子干扰存在下,探针L对Cu2+的识别具有很强的抗干扰能力,是一个高选择性的Cu2+比色探针。
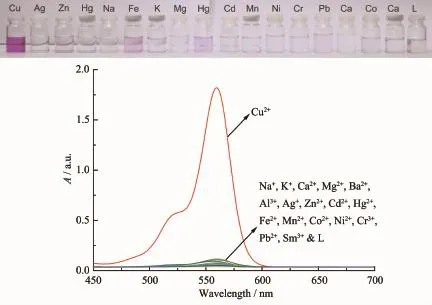
图5探针L(20 μmol·L-1)中加入不同金属离子(20 μmol·L-1)的紫外-可见吸收光谱Fig.5 Absorption spectra of probe L(20 μmol·L-1)upon addition of various metal ions(20 μmol·L-1)
2.4探针L与Cu2+的结合机理分析
Cu2+离子对探针L的紫外-可见吸收光谱滴定如图6所示。当不加Cu2+时,探针L主要以螺环形式存在,溶液无色;随着Cu2+的加入,吸光度在560 nm处逐渐增强,证明探针L分子明显发生了开环,溶液颜色也从无色变为玫瑰红色,裸眼能定性分辨出溶液中是否含有Cu2+。
由图6内插图(a)可以看出,在对探针L滴定中,Cu2+在与L等量时达到饱和吸光度,推测其配位比1∶1。为进一步确定探针L与Cu2+的结合比,进行了等物质的量连续变化(Job′s plot)法实验。如图7所示,在固定探针L与Cu2+总浓度为10 μmol·L-1条件下,测得探针L与Cu2+在物质的量之比为0.5处出现最大吸收值,表明探针L与Cu2+的结合比为1∶1,探针L与Cu2+的结合常数Ka可由Benesi-Hildebrand方程[21-22]确定:
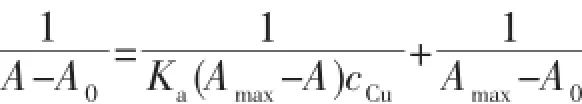
式中A0和A分别为加入Cu2+前后体系的吸光度,Amax为加入过量Cu2+时L的饱和吸光度。如图6内插图(b)所示,1/(A-A0)与1/cCu存在良好的线性关系,线性系数r=0.999 5,这进一步表明探针L与Cu2+的结合比为1∶1,由拟合曲线的截距与斜率的比值计算得出结合常数Ka=2.86×104L·mol-1。

图6乙腈-乌洛托品(1∶1,V/V)溶液中Cu2+对探针L (10 μmol·L-1)的紫外-可见光谱滴定Fig.6 UV-Vis spectra changes of probe L(10 μmol·L-1) upon the addition of different amounts of Cu2+in acetonitrile-methenam ine(1∶1,V/V)
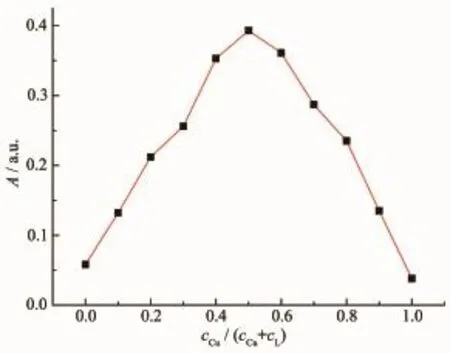
图7探针L与Cu2+作用的Job曲线(cCu+cL=10 μmol·L-1)Fig.7 Job′s plot of L with Cu2+(cCu+cL=10 μmol·L-1)
2.5探针L对Cu2+的可逆性实验
实际应用中,探针重复使用十分重要,可逆性试验是推断探针与金属离子反应模式的一种重要方法。如图8所示,在探针L(10 μmol·L-1)的乙腈-乌洛托品(体积比1∶1)溶液中加入等量Cu2+(10 μmol·L-1)后,在560 nm附近产生强的吸收谱带;当加入等量EDTA(乙二胺四乙酸二钠)后,吸收强度明显减弱;当体系中再加入等量的Cu2+时,在560 nm附近吸收谱带再次恢复,溶液又呈玫瑰红色,如此循环3次后,探针L的显色略有下降,但是灵敏度依然较高。实验研究表明,探针L对Cu2+的识别过程是一可逆过程,结合文献[12,17,23-26]的报道,推测其识别过程:探针L的羰基氧原子以及羟基与Cu2+发生配位,并诱导螺内酰胺开环,当加入EDTA后,Cu2+与EDTA配合并导致探针L螺内酰胺闭环,如图9所示。
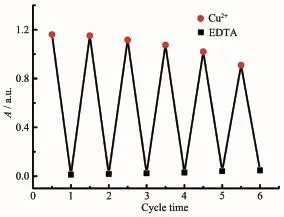
图8探针L(10 μmol·L-1)中循环加入Cu2+和EDTA的紫外-可见吸收光谱Fig.8 Absorbance spectra of probe L(10 μmol·L-1) alternating upon addition of Cu2+and EDTA cycles
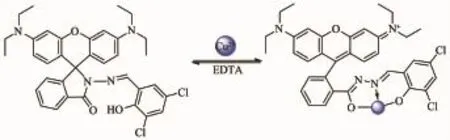
图9探针L对Cu2+的识别机理Fig.9 Mechanism of probe L recognizing Cu2+
2.6线性范围与检出限
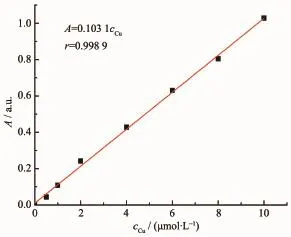
图10探针L测定Cu2+的工作曲线Fig.10 Working curve of probe L determining Cu2+
探针L测定Cu2+的工作曲线如图10所示,当Cu2+浓度在5×10-7~1×10-5mol·L-1范围时,其线性方程为A=0.103 1[cCu/(μmol·L-1)],r=0.998 9;测定11次探针空白,得标准偏差S=3.21×10-3,以3倍标准偏差计算得检出限为9.3×10-8mol·L-1。
2.7样品测定
分别取湘江水和自来水样品进行加标回收实验(n=11),平均回收率为99.5%~104.8%和100.2%,相对标准偏差(RSD)分别为1.78%~6.34%和1.30%。因此方法具有较好的准确性和精密度,可用于水体中Cu2+含量的测定。
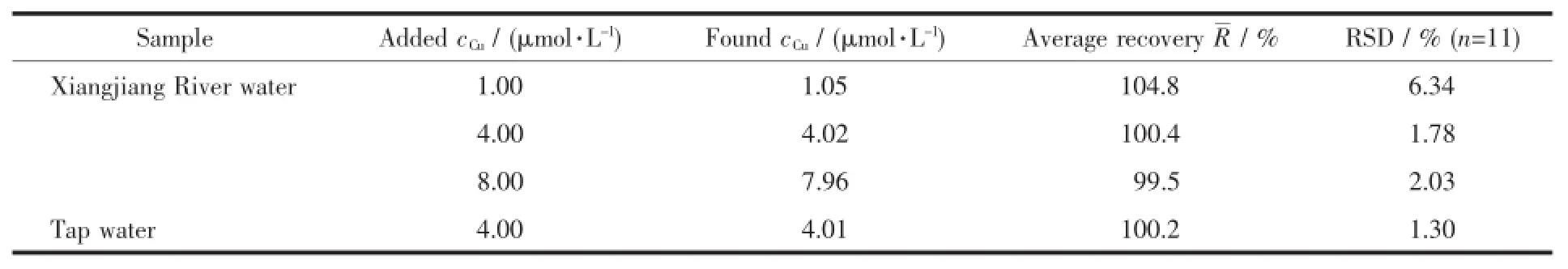
表3样品分析结果Table 3 Determ ination of Cu2+in sam ples
3 结论
合成了3,5-二氯水杨醛缩罗丹明B酰肼新探针(L),利用紫外-可见光谱法可实现对水体中Cu2+的检测。探针对Cu2+的检出限为9.3×10-8mol·L-1,当Cu2+存在时,溶液颜色从无色变为玫红色,能实现裸眼定性识别环境水样中Cu2+。本方法识别Cu2+具有高选择性,常见金属离子对检测无干扰。建立识别的新方法成功应用于湘江水及自来水中Cu2+的检测,回收率在99.5%~104.8%之间,方法简便、快捷、实用。
参考文献:
[1]Uauy R,Olivares M,Gonzalez M.Am.J.Clin.Nutr.,1998, 67:952-959
[2]Blair B G,Larson C A,Adams P L,et al.Mol.Pharmacol., 2011,79(1):157-166
[3]Muthaup G,Schlicksupp A,Hess L,et al.Science,1996, 271:1406-1409
[4]Bertinato J,ZouzoulasA.J.AOAC Int.,2009,92(5):1541-1550
[5]Dan G,Zhengping D,Chao L,et al.RSC Adv.,2014,4:5718 -5725
[6]GanjaliM R,Aghabalazadeh S,KhoobiM,etal.J.Electrochem. Sci.,2011,6(1):52-62
[7]Li Y F,Chen C Y,Li B.J.Anal.At.Spectrom.,2006,21:94-96
[8]Wu C X,Wu Q H,Wang C,et al.Chin.Chem.Let.,2011, 22:473-476
[9]Sangita A,Abhijit G,Sandip M,et al.Dalton Trans.,2014, 43:7747-7751
[10]ZHANG Hua(张华),XU Xiao-Wu(徐孝武),WU Fang-Ying (吴芳英).Chinese J.Inorg.Chem.(无机化学学报),2013,29 (11):2394-2398
[11]Wen X D,Yang Q L,Yan Z D,et al.Microchem.J.,2011, 97:249-254
[12]Ying Z,Fang W,Youngmee K,et al.Org.Lett.,2009,11 (19):4442-4445
[13]Li K,Xiang Y,Wang X,et al.J.Am.Chem.Soc.,2014,136 (4):1643-1649
[14]HU Ming-Ming(胡明明),FAN Jiang-Li(樊江莉),LI Hong-Lin(李宏林),et al.Chin.J.Anal.Chem.(分析化学),2011, 8:1195-1200
[15]Huo F,Su J,Sun Y,et al.Dyes Pigm.,2010,86(1):50-55
[16]CHEN Bin(陈斌),DONG Hui-Juan(董惠娟),DU Jian-Jun (杜健军),et al.Sci.China Chem.(中国科学:化学),2014,44 (09):1491-1498
[17]LI Zi-Fan(李紫凡),MEI Ling(梅岭),XIANG Yu(向宇), et al.Chin.J.Anal.Chem.(分析化学),2008,36(7):915-919
[18]Dujols V,Ford F,Czarnik Anthony W.J.Am.Chem.Soc., 1997,119(31):7386-7387
[19]Yang X F,Guo X Q,Zhao Y B.Talanta,2002,57(5):883-890
[20]Sheldrick G M.SHELXTL,Version 5.03,Siemens Analytical X-ray Division,Madison,WI,USA,1994.
[21]Benesi H A,Hildebrand J H.J.Am.Chem.Soc.,1949,71 (8):2703-2707
[22]Wang B D,Hai J,Liu Z C,et al.Angew.Chem.Int.Ed., 2010,49(27):4576-4579
[23]Jiang L,Wang L,Zhang B,et al.Eur.J.Inorg.Chem., 2010,2010(28):4438-4443
[24]CHEN Yi(陈义),ZHANG Yan(张艳),ZENG Xi(曾晞),et al. Chem.J.Chinese Universities(高等学校化学学报),2013, 34(7):1598-1605
[25]Xiang Y,Tong A J,Jin P Y,et al.Org.Lett.,2006,8(13): 2863-2866
[26]CHEN Jia-Xuan(陈稼轩),TIAN Yi(田怡),XIANG Qing-Xiang(向清祥),et al.Chin.J.Org.Chem.(有机化学),2012, 32(10):1930-1935
3,5-Dichlorosalicylaldehyde-o-rhodam ine B Hydrazone: Synthesis and Highly Selective Recognition for Cu2+
FENG Yong-Lan*,1FANG Jing-Xian1LIU Chao1WU Xu-Meng2XU Meng1JIANG Wu-Jiu1YU Jiang-Xi1TAN Yu-Xing1KUANG Dai-Zhi1
(1Department of Chemistry and Material Science,Key Laboratory of Functional Organometallic Materials of Hunan Provincial College;Hengyang Normal University,Hengyang,Hunan 421008,China)
(2Department of Chemistry and Life Science,Xiangnan University,Chenzhou,Hunan 423043,China)
A novel colorimetric probe,3,5-dichlorosalicylaldehyde-o-rhodamine B hydrazone(L),for Cu2+was designed,synthesized.Its structure was characterized with IR,1H NMR,13C NMR,elemental analysis and X-ray crystal diffraction.The binding property of the probe with Cu2+was examined by UV-Vis spectroscopy.The result showed in acetonitrile/methenamine(pH 5.6)buffer system,when Cu2+was added to the solution of 3,5-dichlorosalicylaldehyde-o-rhodamine B hydrazone,a dramatic color change from colorless to rose red was observed,while the other metal ions did not cause noticeable changes,which indicates that 3,5-dichlorosalicylaldehyde-orhodamine B hydrazone had a high sensitivity single selectivity colorimetric recognition for Cu2+.The detection limit for Cu2+was 9.30×10-8mol·L-1by UV-Vis spectroscopy.
3,5-dichlorosalicylaldehyde-o-rhodamine B hydrazone;crystal structure;copper ion;recognition
O614.121
A
1001-4861(2016)01-0056-07
10.11862/CJIC.2016.006
2015-06-29。收修改稿日期:2015-10-04。
湖南省自然科学基金(No.13JJ3112)、湖南省高校创新平台开放基金(No.13K105)和湖南省普通高校功能金属有机材料重点实验室开放基金(No.13K01)资助项目。
*通信联系人。E-mail:hnhyfyl@163.com

