克拉霉素缓释微丸的处方及制备工艺优化
沈静 李毅斌
(正大天晴药业集团股份有限公司,南京 210023)
克拉霉素缓释微丸的处方及制备工艺优化
沈静 李毅斌
(正大天晴药业集团股份有限公司,南京 210023)
研制克拉霉素(CLM)缓释微丸,先将其制备成速释的固体分散体,再以固体分散体为原料,加入HPMC等骨架缓释材料,挤出滚圆法制备克拉霉素缓释微丸,并通过单因素实验以溶出度为指标对处方进行了优化。得到最佳处方工艺筛选为:固体分散体时CLM与聚维酮(PVP)之比1∶2,CLM与PVP、大豆磷脂之比1∶2∶1;缓释微丸中固体分散体的量为15 %,羟丙基甲基纤维素(HPMC)用量为4.5 %。克拉霉素缓释微丸制备工艺简单易行,值得进一步的工业化生产。
克拉霉素;缓释微丸;制备工艺;释放度
克拉霉素(Clarithromycin, CLM)是大环内酯类的第三代抗生素药物,其药学和生物学特性均较优[1],对常见革兰氏阳性菌、部分革兰氏阴性菌、厌氧菌等具有良好的抗菌活性。对支原体、衣原体的独特疗效,是其他抗生素无法比及的。克拉霉素耐受性良好,不良反应发生率低[2],目前是小儿呼吸道感染的首选药。将药物开发成缓释制剂既保证药物性质稳定又便于剂量分配,且服用便易[3]。在外层进行包衣不仅使药物长效且掩盖了味道,尤为儿童使用。本文以克拉霉素为主药,先将其制备成速释的固体分散体,再以固体分散体为原料,加入HPMC等骨架缓释材料,挤出滚圆法制备克拉霉素缓释微丸,并对处方进行优化。
1 仪器与材料
ZRS-8型药物溶出仪;BAS型电子天平;岛津高效液相色谱仪LC-10A;多功能微丸机。
克拉霉素(CLM)(中国食品药品检定研究院,批号:130558—201303);羟丙基甲基纤维素(HPMC)、微晶纤维素(MCC)、大豆磷脂、聚乙烯吡咯烷酮(PVP)、乙腈(国药集团化学试剂有限公司);蒸馏水(自制);其他试剂均为分析纯。
2 方法与结果
2.1 克拉霉素缓释微丸的制备
将CLM、PVP和大豆磷脂混合,用无水乙醇溶解,于60 ℃水浴中蒸发至半干,然后转入白色搪瓷盘中,70 ℃完全挥发去溶剂,-20 ℃放置4 h,60 ℃真空干燥12 h,粉碎过80目筛,得CLM固体分散体,备用。按处方量称取CLM固体分散体、HPMC 与MCC过筛混合,制软材,挤出滚圆后成丸,50 ℃干燥,即得克拉霉素缓释微丸。
2.2 样品中克拉霉素的含量测定
2.2.1 色谱条件
Kromasil C18色谱柱(5 μm, 200×4.6 mm),乙腈-0.067 mol / L磷酸盐缓冲液(40∶60),流速为1 mL / min,检测波长为210 nm,柱温为35 ℃,进样量10 μL。
2.2.2 标准曲线与线性关系
精密称取0.0150 g CLM,先用适量乙腈溶解,再用乙腈定容至25 mL,分别精密吸取0.4、1.2、2.0、3.0、4.0 mL于10 mL容量瓶中,用乙腈定容至刻度,摇匀。取上述标准溶液10 μL进样,峰面积的平均值Y对浓度X进行线性回归,得标准曲线Y= 2 065.5 X + 613.4,r2= 0.999 7,结果表明克拉霉素在24 ~ 240 μg / mL范围内浓度和峰面积呈良好的线性关系。
2.3 溶出度测定方法[4]
采用中国药典2015年版四部0931第一法装置,
以pH 6.8 磷酸盐缓冲液(含0.1 % 十二烷基硫酸钠)溶液900 mL作为释放介质,转速100 r / min,温度37 ℃±0.5 ℃,定时取样5 mL,并及时补加等量溶液,样液经0.45 μm微孔滤膜过滤,弃去初滤液,取续滤液进样,按上述标准曲线计算药物浓度,并计算药物的累积释放率。
2.4 释放度数据分析方法[5]
释放度是评价缓控释制剂的重要数据,常用的评价方法有方差分析法、相似因子法、多变因子法、回归分析法和Spitpolt法等。美国FDA推荐使用相似因子法评价受试制剂与参比制剂的体外释放差异。相似因子(f2)用来考察两条释放曲线之间的相似度,计算公式如下:

公式中Rt与Tt分别代表参比和受试制剂第t时间点的平均累积释放度,n为测试点数。f2的值的范围在0 ~ 100,f2越大,两条曲线的相似性越高。FDA规定:若受试与参比制剂的溶出曲线间的f2值不小于50,则认为两者相似。
2.5 CLM固体分散体中各因素对药物释放的影响
2.5.1 CLM与PVP比例对主药释放的影响
固定大豆磷脂的用量,精密称取CLM 10 g,按CLM与PVP比例为1∶1、1∶2、1∶3分别称取PVP,按2.1项下的方法制备CLM固体分散体,按2.3项下的方法测定溶出度,结果见图1和表1。

图1 CLM-PVP比例对主药释放的影响Fig.1 The effect of proportions of drug-PVP on drug release

表1 微丸溶出相似性Tab.1 Analog analysis of micro-pills
图1、表1结果显示,当CLM与PVP比例为1∶2与1∶3溶出曲线较相似。由图1所示,CLM与PVP比为1∶1时, CLM的溶出相对较慢,所以选择药载比为1∶2。
2.5.2 CLM与大豆磷脂比例对主药释放的影响
CLM与PVP的用量分别为10 g、20 g,分别按CLM∶PVP∶大豆磷脂的比例为1∶2∶1、1∶2∶2、1∶2∶3称取大豆磷脂,按2.1项下的方法制备CLM固体分散体,按2.3项下的方法测定溶出度,结果见图2、表2。

图2 CLM-大豆磷脂对主药释放的影响Fig.2 The effect of proportions of CLM-soybean phospholipids on drug release

表2 微丸溶出相似性Tab.2 Analog analysis of micro-pills
图2、表2结果显示,不同处方间f2因子均大于50,溶出曲线较相似。随着大豆磷脂用量的增加,对CLM的溶出速率影响不大,所以选择CLM与PVP、大豆磷脂的比例为1∶2∶1。
2.6 CLM缓释微丸中各因素对药物释放的影响
2.6.1 CLM固体分散体的量对主药释放的影响
固定MCC、HPMC用量,考察CLM固体分散体用量占比对主药释放的影响,按2.1项下的方法制备CLM缓释微丸,按2.3项下的方法测定溶出度。结果见图3、表3。
图3、表3结果显示,不同处方间的溶出曲线相似性较高,说明CLM固体分散体的量在15 % ~ 45 %对于微丸的释放几乎没有影响,所以选择CLM固体分散体的量为15 %。

图3 CLM固体分散体用量对主药释放的影响Fig.3 The effect of the amount of CLM-solid dispersion on drug release

表3 微丸溶出相似性Tab.3 Analog analysis of micro-pills
2.6.2 HPMC对主药释放的影响
分别称取1.5 %、3.0 %、4.5 %的HPMC,15 % CLM固体分散体,其余为MCC,按2.1项的方法制备缓释微丸,按2.3项的方法测定溶出度,结果见图4、表4。
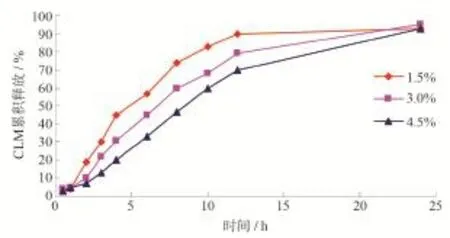
图4 HPMC用量对主药释放的影响Fig.4 The effect of different proportions of HPMC on drug release

表4 微丸溶出相似性Tab.4 Analog analysis of micro-pills
由图4和表4可知,HPMC用量对药物释放有影响,随着HPMC用量的增加,药物的缓释效果更好,所以确定HPMC用量为4.5 %。
3 讨论
目前评价溶出曲线相似性的方法有多种,自1999年美国FDA颁布f2因子比较法以来,该法已被普遍采用[5]。本试验中选用f2因子相似性评价方法是为最大程度地简化因素筛选和处方优化的过程,缩短试验所耗费的时间,因此本试验最终选用了相似性f2因子法。
本文以克拉霉素为主药,先将其制备成速释的固体分散体,再以固体分散体为原料,加入HPMC等骨架缓释材料,挤出滚圆法制备克拉霉素缓释微丸,并对处方进行优化。在固体分散体制备进行单因素考察中,以溶出度为指标,考察PVP、大豆磷脂对微丸主药释放量度的影响。CLM与PVP比为1∶1时, CLM的溶出相对较慢,所以选择药载比为1∶2。随着大豆磷脂用量的增加,对CLM的溶出速率影响不大,所以选择CLM与PVP、大豆磷脂的比例为1∶2∶1。在CLM缓释微丸制备进行单因素考察中,固体分散体的量在15 % ~ 45 %对于微丸的释放几乎没有影响,所以选择CLM固体分散体的量为15 %。缓释材料HPMC用量对药物释放有影响,随着HPMC用量的增加,药物的缓释效果更好,所以确定HPMC用量为4.5 %。
[1]Weiss LR. Open-label, randomized, comparison of the efficacy and tolerability of clarithromycin, levofloxacin, and cefuroxime axetil in the treatment of adults with acute bacterial exacerbations of chronic bronchitis. Clinical Therapeutics, 2002, 24(9):1114-1125.
[2]PROF. P. GOUMAS, S. NAXAKIS, C. BASSARIS, A. SKOUTELIS. Comparative efficacy and tolerability of clarithromycin and cefaclor in the treatment of outpatients with acute maxillary sinusitis. Clinical Drug Investigation, 1997, 13(3): 128-133.
[3]梁颖文. 浅谈儿童药物制剂的开发[J]. 儿科药学杂志, 1998, 4(1): 42-43.
[4]国家药典委员会. 中国药典·四部[M]. 北京:中国医药科技出版社,122-124.
[5]谢沐风. 溶出曲线相似性的评价方法[J]. 中国医药工业杂志,2009, 40(4): 308-310.
[6] 陆启春,刘静玲,徐亮亮,等.f2因子法评价盐酸普萘洛尔氢氯噻嗪缓释胶囊释放曲线的相似性 [J]. 中国医药工业杂志,2016, 47(2): 212-214.
Optimization of Prescription and Preparation Process of Clarithromycin Sustained-release Pellet
Shen Jing, Li Yibin
(Chia Tai Tianqing Pharmaceutical Group Co., Ltd, Nanjing 210000)
To develop the sustained-released clarithromycin pellets, immediate release solid dispersion was prepared first, and with solid dispersion as base, HPMC etc. sustained-release materials were added, sustained-released clarithromycin pellets were then prepared by using extrusion spheronization method. The prescription was optimized based on the index of resolution from single factor experiment. After screening, the optimum prescription is as the follows: in status of solid dispersion, CLM:PVP = 1:2, CLM:PVP:soybean = 1:2:1, the mass of solid dispersion in sustained-release pellets is 15%, and the mass of HPMC used is 4.5%. The process of preparing sustained-release pellets is simple and feasible, which is worthwhile to be promoted in the industry.
clarithromycin; sustained-release pellets; preparing process; dissolution
TQ 460.6
A
2095-817X(2016)05-0030-004
2016-05-06
沈静(1979—),女,工程师,主要从事制剂新剂型研究。

